Для просмотра этого контента требуется подписка на Jove Войдите в систему или начните бесплатную пробную версию.
Method Article
Раскрывающееся кальмодулина-связывающие белки
В этой статье
Резюме
Кальмодулин (CAM) выпадающее анализ является эффективным способом для исследования взаимодействия СаМ с различными белками. Этот метод использует CAM-сефарозе шарики для эффективного и конкретного анализа CAM-связывающих белков. Это является важным инструментом для изучения СаМ сигнализации в функционирование клетки.
Аннотация
Calcium (Ca2+) is an ion vital in regulating cellular function through a variety of mechanisms. Much of Ca2+ signaling is mediated through the calcium-binding protein known as calmodulin (CaM)1,2. CaM is involved at multiple levels in almost all cellular processes, including apoptosis, metabolism, smooth muscle contraction, synaptic plasticity, nerve growth, inflammation and the immune response. A number of proteins help regulate these pathways through their interaction with CaM. Many of these interactions depend on the conformation of CaM, which is distinctly different when bound to Ca2+ (Ca2+-CaM) as opposed to its Ca2+-free state (ApoCaM)3.
While most target proteins bind Ca2+-CaM, certain proteins only bind to ApoCaM. Some bind CaM through their IQ-domain, including neuromodulin4, neurogranin (Ng)5, and certain myosins6. These proteins have been shown to play important roles in presynaptic function7, postsynaptic function8, and muscle contraction9, respectively. Their ability to bind and release CaM in the absence or presence of Ca2+ is pivotal in their function. In contrast, many proteins only bind Ca2+-CaM and require this binding for their activation. Examples include myosin light chain kinase10, Ca2+/CaM-dependent kinases (CaMKs)11 and phosphatases (e.g. calcineurin)12, and spectrin kinase13, which have a variety of direct and downstream effects14.
The effects of these proteins on cellular function are often dependent on their ability to bind to CaM in a Ca2+-dependent manner. For example, we tested the relevance of Ng-CaM binding in synaptic function and how different mutations affect this binding. We generated a GFP-tagged Ng construct with specific mutations in the IQ-domain that would change the ability of Ng to bind CaM in a Ca2+-dependent manner. The study of these different mutations gave us great insight into important processes involved in synaptic function8,15. However, in such studies, it is essential to demonstrate that the mutated proteins have the expected altered binding to CaM.
Here, we present a method for testing the ability of proteins to bind to CaM in the presence or absence of Ca2+, using CaMKII and Ng as examples. This method is a form of affinity chromatography referred to as a CaM pull-down assay. It uses CaM-Sepharose beads to test proteins that bind to CaM and the influence of Ca2+ on this binding. It is considerably more time efficient and requires less protein relative to column chromatography and other assays. Altogether, this provides a valuable tool to explore Ca2+/CaM signaling and proteins that interact with CaM.
протокол
См. на рисунке 1 представлена основная схема процедуры, начиная с гомогената. Расчетное время от подготовки клеточные экстракты для вымывания CAM-связанных белков составляет около шести-семи часов.
1. Ткань подготовки
- Inject органотипической срезах гиппокампа с вирусом, содержащим плазмиду выражения рекомбинантный белок (в данном примере, зеленый флуоресцентный белок (GFP), помеченные Ng) и позволяют ткани, чтобы выразить белка в одночасье.
- Приблизительно от 12 до 18 часов после вирусной инъекции (в зависимости от вирусного время выражение), подготовить для сбора ткани. Добавить 1 мл буфера рассечение (10 мМ глюкозы, 4мм KCl, 26 мм NaHCO3, 233mM сахарозы, 5 мМ MgCl 2, 1 мМ CaCl 2 и 0,1% фенол-красный, газовые камеры с 5% CO 2 95% O 2) в чашке Петри. Передача культурной ткани / вставить в чашку Петри и добавляют 2 мл буфера для вскрытия вставить, чтобы погрузиться ткани.
- Сборт органотипической гиппокампа ткани (от 5 до 10 ломтиков), аккуратно очищая ткани без вставки мембраны с помощью скальпеля. В частности удаления конкретном регионе интерес (например, СА1) тоже вариант. Передача приостановлено ткани 1,5 мл трубки микроцентрифужных использованием перевернутой пипетки Пастера.
- Центрифуга образцов при 1500 RCF в течение 1 мин отделить ткани от вскрытия буфера. Осторожно удалите супернатант аспирацией. Убедитесь в том, чтобы не потревожить осадок.
- Для каждого среза используется, добавить от 30 до 60 мкл гомогенизации буфера (150 мМ NaCl, 20 мМ Трис рН 7,5, 1 мМ DTT, 1μg/mL leupeptin, 1μg/mL chemostatin, 1μg/mL антиболевой, 1μg/mL пепстатина, и 1% Тритон Х -100), чтобы ткани и гомогенизации полностью с пестиком.
- Для того, чтобы удалить продукты распада клеток, центрифуга оставшегося гомогената при 1100 RCF в течение 10 мин и осторожно удалите супернатант аспирацией, избегая при этом загрязнения из гранул.
- Возьмите 10% супернатант в качестве образца на входе (образец 1). Магазин оставшиеся супернатант на льду во время подготовки CAM-сефарозе шарики для использования в шаге 3.
Примечание: ткани, используемые здесь, органотипической срезах гиппокампа. Тем не менее, можно использовать диссоциированных нейронов или любой другой системы культивирования клеток. В таком случае, начнем с пункта 1.4 после сбора вашей ткани в соответствующей манере.
2. Подготовка шарики для выпадающем
При работе с бисером, очень важно, чтобы спасти бисером и максимизировать эффективность реакции, предотвращая бусы из сушки по бокам трубки. Чтобы это сделать, то лучше, чтобы повернуть трубы на их стороне, что позволяет решению на влажные бусины на стенках трубки, непосредственно перед центрифугированием.
- Для каждого выпадающего, пипетки 400 мкл взвешенных кальмодулин-сефарозой бусины в 2 мл микроцентрифужных трубка с относительно FLAт-снизу максимально площадь поверхности и взаимодействие своих решений с бисером во время инкубации.
- Центрифуга бус на 21000 RCF в течение 30 секунд и осторожно удалите супернатант аспирацией. Убедитесь в том, чтобы не потревожить бисером.
- Для мытья бисером, добавить 100 мкл соответствующего буфера гомогенизации, содержащие либо 2 мМ CaCl 2 для тех, которые используются для выпадающем Ca 2 +-СаМ связывающих белков и 2 мМ ЭДТА (известный Са 2 + хелат) для бисера снос ApoCaM связывающих белков. Слегка нажмите на трубке повторно приостанавливать бисером и центрифуге при 1500 RCF в течение 1 мин. Осторожно удалите супернатант аспирацией, убедившись, что не нарушить бисером.
Примечание: Для всех шагов стремление, то рекомендуется использовать пипетки, которая прекрасно открытия (например, советы гель загрузки), чтобы разрешить удаление решение, не снимая бусы.
3. CAM-сефарозе связывания белков
- Разделите на два супернатант условиях, содержащих равный объем. В зависимости от вашего состояния, добавить соответствующее количество CaCl 2 или ЭДТА к надосадочной до 2 мм концентрации для каждого.
- Добавить супернатант, начиная с шага 1,7 до бисер промывали в соответствующие буфера гомогенизации. Слегка нажмите на трубке, чтобы смешаться.
- Инкубируйте образцы при температуре 4 ° С в течение 3 часов на шейкере. Повторное приостановить бисером каждые 30 минут или около того, чтобы повысить эффективность связывания.
- Одноразовая пробирка с образцами и бусы в 1500 RCF в течение 3 мин.
- Возьмите 50 мкл надосадочной в качестве образца несвязанных белков (образец 2) и осторожно удалите оставшиеся супернатант аспирацией и выбросьте.
- Вымойте бусин в три раза, как описано в пункте 2.3 с 100 мкл соответствующего буфера гомогенизации.
4. Элюирование
- Добавить 50 мкл элюирующего буфера (50 мМ Трис-HCl, рН 7,5, и 150 мМ NaCl), содержащий противоположные условия (10 мМ CACL 2 или 10 мМ ЭДТА) на бусы. Например, образцы, которые были связаны гомогенизируют и в буфере, содержащем Ca 2 + вымываются в элюции буфера, содержащего ЭДТА и наоборот.
Дополнительно: Потепление элюции буфера до 37 ° С перед добавлением бисера может повысить урожайность.
- Инкубируйте решение бисером при комнатной температуре в течение 30 минут на шейкере. Смешайте бисер аккуратным постукиванием трубки примерно каждые 5 мин.
- Центрифуга бус на 1500 RCF в течение 3 мин и осторожно удалите 50 мкл надосадочной для связанного белка (образец 3) стремлением. Убедитесь в том, чтобы не потревожить бисером.
- Добавить буфера белка загрузки всех образцов (т.е. гомогената, несвязанных и связанных белков, а также тех, кто еще связан с бисером).
Примечание: Для обеспечения максимальной элюирования (особенно в случае неэффективного элюирования), добавить 50 мкл соответствующего буфера элюирования (например, добавление ЭДТА содержащих буферефер, чтобы бусины связаны в CaCl 2), чтобы бисер перед нагреванием образцов, чтобы помочь элюировать оставшиеся белком и повторить шаги, описанные в 4.3, чтобы удалить остатки связанных белков.
5. SDS-PAGE и Вестерн-блот
Поведение SDS-PAGE и анализировать использование западных пятно с помощью зондирования для белок и зонд для белок, известный связывать СаМ в противоположном состоянии, положительного контроля.
6. Представитель Результаты
Рисунок 2B показывает пример CAM-выпадающем анализа тестирования обязательные веб-камера GFP с метками Ng по сравнению с эндогенным Ng. Чтобы сделать это, GFP-Нг был избыточно экспрессируется в нашей органотипической срезах гиппокампа в ночное время и ткани гомогенизировали. Гомогенат инкубировали с CAM-сефарозе бусины в присутствии либо Ca 2 + или ЭДТА. Гомогената вход показывает, что GFP-Ng была выражена в дополнение к эндогенным Нг и Са 2 + / CAM-зависимой киназы II(CaMKII). Как и ожидалось на основе известных связывание эндогенного Нг (показано на рис. 2A), GFP с метками Ng элюировали в отсутствие Са 2 + (ЭДТА связанного белка) и несвязанного в присутствии ионов Са 2 + (рис. 2В) . В отличие от контроля, CaMKII, элюировали только в присутствии ионов Са 2 + (белком) и несвязанных в его отсутствие (ЭДТА). Это показывает, что СаМ шарики функционирует нормально, и elutions были эффективными. Самое главное, это показывает, что GFP-Ng связывается с ApoCaM в аналогии с эндогенной форме, предполагая, что теги GFP не изменило функции нашего рекомбинантного белка.
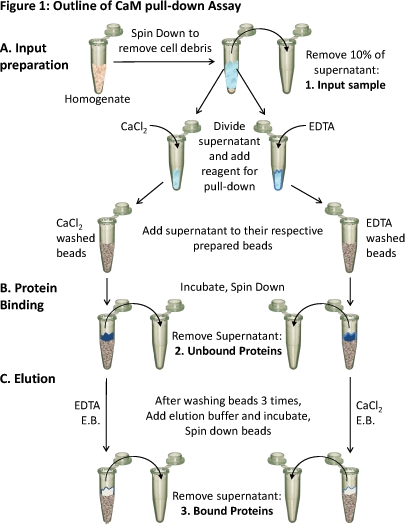
Рисунок 1. Очерк СаМ выпадающего анализа
(А) гомогената ткани вращается вниз, чтобы удалить продукты распада клеток. Около 10% надосадочной взят как образец мощность (1). Остальные супернатант делится поровну на различныхусловий и соответствующих реагентов (CaCl 2 или ЭДТА) добавляются в тест обязательным в таких условиях. Каждый супернатант (содержащие либо CaCl 2 или ЭДТА) загружается на соответственно подготовленных CAM-сефарозе бисером и (Б) инкубировали чтобы обязательными. Свободные белки удаляются (2) и (C) связанных белков (3), элюировали из бисера использованием элюирующего буфера (EB), содержащий противоположное условие, как обязательные. Белкового состава этих трех образцов белка могут быть проанализированы с помощью SDS-PAGE и Вестерн-блот анализа.
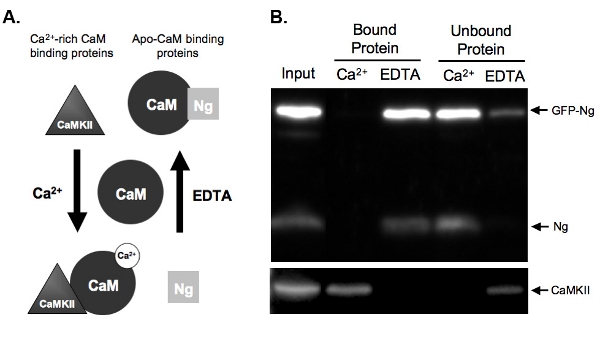
Рисунок 2. A.) Схема Ca 2 +-зависимый СаМ обязательными и элюирования в выпадающем Примеры анализа даны два типа белков, которые связываются камеры в Ca 2 +-зависимым образом. Neurogranin (Ng) представляет собой белки, которые связываются апо-CAM и CaMKII представляет белков, которые связываются с Са 2 +-богатыхCAM. СаМ показана в ее состоянием диссоциации до инкубации с гомогената белков. После инкубировали в условиях высоких Са 2 + концентраций (2 мм) или в присутствии Са 2 + хелатором, ЭДТА (2 мМ), белки связываются с СаМ соответственно. Ng связывает камеры в условиях ЭДТА как там практически нет Са 2 + подарок, и будет элюировали CAM-сефарозе бусин в присутствии ионов Са 2 +. CaMKII, однако, будет связываться с камеры в наличии большое количество Са 2 + и будет отделить один раз Са 2 + был хелатные.
Б) Результаты Например СаМ выпадающего анализа. Эта цифра демонстрирует ожидаемый конечный результат CAM-сефарозе тянуть вниз образцы исследовали на Нг и CaMKII. Оба эндогенных Нг и GFP-Ng присутствуют в полосы белки, которые связываются СаМ в присутствии ЭДТА. Нет Нг обязан, когда образцы инкубировали с камеры в присутствии ионов Са 2 +, демонстрируя, что Nг только связывает апо-CAM. Наш положительный контроль, CaMKII, с другой стороны, связывает СаМ только в присутствии ионов Са 2 +.
Обсуждение
При условии, протокол использует CAM-сефарозе бусин для расследования Ca 2 +-зависимость CAM-связывающих белков. Многие белки связываются камеры в Ca 2 +-зависимым образом. Эти взаимодействия имеют большое значение, учитывая количество CAM-связывающих белков и их важную роль во мно?...
Раскрытие информации
Нет конфликта интересов объявлены.
Благодарности
Авторы хотели бы поблагодарить Тиффани Вишня в ее помощи в оптимизации этого протокола. Эта работа финансировалась Национальным институтом старения (AG032320), а также продвижение здоровой Висконсин.
Материалы
| Продукт | Компания | Номер по каталогу | Примечания |
| Кальмодулин-сефарозой бисером | GE Healthcare | 17-0529-01 | |
| Анти-альфа CamKII | Sigma-Aldrich | C6974 | |
| Анти-neurogranin | Millipore | 07-425 | |
| Гель Советы Загрузка Пипетируйте | Рыболов | 02-707-138 | Используйте для аспирации супернатанты |
| Микроцентрифуга труб (2,0 мл) | Рыболов | 05-408-146 | Использовать для всех шагов с участием кальмодулин-сефарозой бисером |
Ссылки
- Vincenzi, F. F. Calmodulin in the regulation of intracellular calcium. Proc. West Pharmacol Soc. 22, 289-294 (1979).
- Cheung, W. Y. Calmodulin plays a pivotal role in cellular regulation. Science. 207, 19-27 (1980).
- Zhang, M., Tanaka, T., Ikura, M. Calcium-induced conformational transition revealed by the solution structure of apo calmodulin. Nat. Struct. Biol. 2, 758-767 (1995).
- Alexander, K. A., Wakim, B. T., Doyle, G. S., Walsh, K. A., Storm, D. R. Identification and characterization of the calmodulin-binding domain of neuromodulin, a neurospecific calmodulin-binding protein. J. Biol. Chem. 263, 7544-7549 (1988).
- Huang, K. P., Huang, F. L., Chen, H. C. Characterization of a 7.5-kDa protein kinase C substrate (RC3 protein, neurogranin) from rat brain. Arch. Biochem. Biophys. 305, 570-580 (1993).
- Bahler, M., Rhoads, A. Calmodulin signaling via the IQ motif. FEBS Lett. 513, 107-113 (2002).
- Routtenberg, A. Protein kinase C activation leading to protein F1 phosphorylation may regulate synaptic plasticity by presynaptic terminal growth. Behav. Neural. Biol. 44, 186-200 (1985).
- Zhong, L., Cherry, T., Bies, C. E., Florence, M. A., Gerges, N. Z. Neurogranin enhances synaptic strength through its interaction with calmodulin. EMBO J. 28, 3027-3039 (2009).
- Needham, D. M. Myosin and adenosinetriphosphate in relation to muscle contraction. Biochim. Biophys. Acta. 4, 42-49 (1950).
- Hathaway, D. R., Adelstein, R. S. Human platelet myosin light chain kinase requires the calcium-binding protein calmodulin for activity. Proc. Natl. Acad. Sci. U.S.A. 76, 1653-1657 (1979).
- Fukunaga, K., Yamamoto, H., Matsui, K., Higashi, K., Miyamoto, E. Purification and characterization of a Ca2+- and calmodulin-dependent protein kinase from rat brain. J. Neurochem. 39, 1607-1617 (1982).
- Yang, S. D., Tallant, E. A., Cheung, W. Y. Calcineurin is a calmodulin-dependent protein phosphatase. Biochem. Biophys. Res. Commun. 106, 1419-1425 (1982).
- Huestis, W. H., Nelson, M. J., Ferrell, J. E. J. Calmodulin-dependent spectrin kinase activity in human erythrocytes. Prog. Clin. Biol. Res. 56, 137-155 (1981).
- Yamniuk, A. P., Vogel, H. J. Calmodulin's flexibility allows for promiscuity in its interactions with target proteins and peptides. Mol. Biotechnol. 27, 33-57 (2004).
- Zhong, L., Kaleka, K. S., Gerges, N. Z. Neurogranin phosphorylation fine-tunes long-term potentiation. Eur. J. Neurosci. 33, 244-250 (2011).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены