JoVE 비디오를 활용하시려면 도서관을 통한 기관 구독이 필요합니다. 전체 비디오를 보시려면 로그인하거나 무료 트라이얼을 시작하세요.
Method Article
풀다운 Calmodulin 결합 단백질의
요약
Calmodulin (CAM) 풀다운 분석은 다양한 단백질과 CAM의 상호 작용을 조사하기 위해 효과적인 방법입니다. 이 방법은 캠 결합 단백질의 효과적이고 구체적인 분석을 위해 CAM - 세파 로스 구슬을 사용합니다. 이것은 세포 기능의 CAM 신호를 탐험하기위한 중요한 도구를 제공합니다.
초록
칼슘 (칼슘 2 +)은 다양한 메커니즘을 통해 세포 기능을 조절에 중요한 이온입니다. 대부분 칼슘 2는 + 신호는 calmodulin (CAM) 1,2로 알려진 칼슘 결합 단백질을 통해 중재 수 있습니다. 캠은 apoptosis, 신진 대사, 부드러운 근육 수축, 신경 소성, 신경 성장, 염증과 면역 반응을 포함한 거의 모든 세포 공정에서 여러 수준에서 참여합니다. 단백질의 숫자 카메론와의 상호 작용을 통해 이러한 경로를 조절 도움이됩니다. 이러한 상호 작용의 대부분은 칼슘으로서 칼슘 2 + 무료 상태 (ApoCaM) 3 반대 2 + (CA 2 + - CAM)에 바인딩 할 때 분명히 다릅니다 캠의 형태에 따라 달라집니다.
대부분의 대상 단백질이 칼슘 2에 바인딩하는 동안 + - 캠, 특정 단백질에만 ApoCaM에 바인딩. neuromodulin 4 neurogranin (잉) 5, 및 특정 myosins 포함한 IQ 도메인을 통해 어떤 바인딩 캠, 7, postsynaptic 기능 8, 및 근육 수축 9 중요한 역할을하기 위해 표시되었습니다. 바인딩 및 CA 2의 부재 또는 존재에 카메라를 공개 + 능력들은 함수에서 중요한 것입니다. 반대로, 많은 단백질은 칼슘 2 + 카메라를 바인딩하고 활성화에 대한 구속력이 필요합니다. 예 마이 오신 경쇄 키나제 10, 칼슘 2 + / CAM 의존 kinases (CaMKs) 11 phosphatases (예 : calcineurin) 12, 그리고 직접 및 다운 스트림 효과 14 다양한있다 spectrin 키나제 13가 포함됩니다.
세포 기능에 이러한 단백질의 효과는 종종 칼슘 2 +에 의존 방식으로 CAM에 바인딩 자신의 능력에 따라 달라집니다. 예를 들어, 우리는 다른 변이가이 바인딩을 영향을 미치는지 시냅스 기능에 잉 - CAM 바인딩의 관련성을 테스트합니다. 우리는 GFP - 태그 잉 죄수를 생성칼슘 2 +에 의존 방식으로 카메라를 바인딩하는 잉의 능력을 변경할 것입니다 IQ 도메인에서 특정 돌연변이와 구조체. 이러한 서로 다른 돌연변이 연구는 시냅스 기능 8,15에 관련된 중요한 프로세스에 우리에게 큰 통찰력을 주었다. 그러나, 이러한 연구에서, 그것은 변이된 단백질은 CAM에 대한 기대 변경된 구속력이 있는지 입증하는 것이 필수적입니다.
여기서는 예제로 CaMKII과 잉을 사용하여, CA 2 +의 존재 또는 부재에서 CAM에 바인딩하는 단백질의 기능을 테스트하기위한 방법을 제시한다. 이 방법은 캠 풀다운 분석이라고 친화도 크로마 토그래피의 한 형태입니다. 그것은 CAM과 +이 바인딩에 대한 칼슘 2의 영향에 바인딩 단백질을 테스트하기 위해 CAM - 세파 로스 구슬을 사용합니다. 그것은 효율적인 상당히 더 많은 시간을하고 칼럼 크로마 토그래피 및 기타 assays에 상대적으로 적은 단백질을 필요로합니다. 모두, 이것은 + / CAM 신호 및 단백질 거기에 칼슘 2 탐험하는 중요한 도구를 제공합니다CAM과 teract.
프로토콜
homogenate와 프로 시저 시작의 기본 도식 1 그림을 참조하십시오. 세포 추출물의 준비에서 CAM 바인딩된 단백질의 용출에 예상 시간은 약 6~7시간 있습니다.
1. 조직 준비
- 재조합 단백질의 관심 (이 예제에서는 녹색 형광 단백질 (GFP) 태그 잉)과 조직이 야간 단백질을 표현할 수있는 표현 플라스미드를 포함하는 바이러스 organotypic hippocampal 조각 주사.
- 약 12-18시간 바이러스 주사 후 (바이러스성 표현 시간에 따라), 조직을 수집 준비. 페트리 접시에 1mL 해부 버퍼를 (5 % O 2 2 95 % CO와 기름 10mM 포도당, 4mm짜리 KCl, 26mM NaHCO3, 233mM 자당, 5mM MgCl 2, 1mM CaCl 2, 페놀 - 붉은 0.1 %) 추가합니다. 페트리 접시에 교양 조직 / 삽입을 전송하고 잠수함 조직에 삽입하는 2mL 해부 버퍼를 추가합니다.
- Collec부드럽게 메스를 사용하여 삽입 막의 조직 무료로 근근이 살아가고에 의해 t organotypic hippocampal 조직 (5 사이의 10 슬라이스). 특히 관심의 특정 지역 (예 : CA1)을 제거하면 옵션입니다. 거꾸로 파스퇴르 피펫을 사용하여 1.5mL microcentrifuge 튜브에 정지 조직을 전송합니다.
- 해부 버퍼에서 조직을 별도로 1 분 1500 rcf에서 샘플을 원심 분리기. 조심스럽게 흡인하여 뜨는을 제거합니다. 펠렛을 방해하지 않도록하십시오.
- 각 슬라이스가 사용 들면, 균질화 버퍼 (150mM NaCl, 20mM 트리스 산도 7.5, 1mM DTT, 1μg/mL 류펩틴, 1μg/mL chemostatin, 1μg/mL antipain, 1μg/mL의 pepstatin,, 1 % 트리톤 X의 30-60 μL를 추가 조직 -100) 및 유봉과 함께 철저히 homogenize.
- 세포 파편을 제거하기 위해서는 10 분 1100 rcf에 남아있는 homogenate를 원심 분리기 및 펠렛의 오염을 피할하면서 조심스럽게 흡인하여 뜨는을 제거합니다.
- 입력 (예제 1) 예제로 뜨는의 10 %를 가져가라. 3 단계에 사용하기 위해 CAM - 세파 로스 구슬의 준비 기간 동안 얼음에 남아있는 뜨는을 저장합니다.
참고 : 여기에 사용되는 조직이 organotypic hippocampal 슬라이스입니다. 그러나, 하나는 dissociated 뉴런 또는 다른 세포 culturing 시스템을 사용할 수 있습니다. 이러한 경우에는 적절한 방식으로 조직을 수집 후 단계 1.4에서 시작합니다.
2. 풀다운을위한 구슬의 준비
비즈 처리에서는, 그것은 구슬을 구조하고 튜브의 측면에 건조에서 구슬을 방지하여 반응의 효율을 극대화하는 것이 중요합니다. 이렇게하려면, 그것은 바로 원심 분리하기 전에 솔루션은 튜브의 벽에 비즈를 엿먹일 수 있도록, 그들의 측면에 튜브를 회전하는 것이 좋습니다.
- 각각의 풀다운, 2 ML의 microcentrifuge 관에 정지 Calmodulin - 세파 로스 비즈의 피펫 400 μL 상대적으로 FLA로 들어T - 맨 아래에 귀하의 incubations 동안 비즈와 함께 솔루션의 표면 영역과 상호 작용을 극대화합니다.
- 30 초 동안 21000 rcf에 구슬을 원심 분리기 조심스럽게 흡인하여 뜨는을 제거합니다. 구슬을 방해하지 않도록하십시오.
- 구슬을 씻어, 풀다운 칼슘이 구슬을위한 + - CAM 바인딩 단백질과 2 MM EDTA (에틸렌 다이아 민 테트라 초산)이 (칼슘 2 알려진 + chelator) 잡아당기는하는 데 사용되는 사람들에게 CaCl 2 2 MM 중 하나를 포함하고있는 각각의 균질 버퍼 100 μL를 추가 ApoCaM 바인딩 단백질. 부드럽게 1 분 1,500 rcf에서 다시 정지 구슬과 원심 분리기에 튜브를 누릅니다. 조심스럽게 구슬을 방해하지 않도록하고, 흡인하여 뜨는을 제거합니다.
참고 : 모든 열망 단계에 대한, 그것이 구슬을 제거하지 않고 솔루션의 제거를 허용하는 훌륭한 오프닝 (예 겔로드 도움말 참조)이있는 피펫 팁을 사용하는 것이 좋습니다.
3. 단백질의 CAM - 세파 로스 바인딩
- 동일한 볼륨을 포함하는 두 가지 조건에 뜨는 분할. 당신의 상태에 따라 각각 2 MM 농도까지 여러분 뜨는에 CaCl 2 EDTA (에틸렌 다이아 민 테트라 초산)의 해당 금액을 추가합니다.
- 해당 균질화 버퍼에 쓸려 구슬 단계 1.7에서 뜨는을 추가합니다. 부드럽게 섞어 튜브를 누릅니다.
- 뿌리에서 3 시간 4 ° C에서 샘플을 품어. 바인딩의 효율성을 높이기 위해 구슬마다 30 분 정도를 다시 일시 중지합니다.
- 원심 분리기 튜브는 3 분 1500 rcf에서 샘플 및 구슬이 들어있는.
- 언바운드 단백질 (샘플 2) 샘플로 뜨는의 50μL를 가지고 신중하게 열망하고 삭제하여 나머지 뜨는을 제거합니다.
- 각각의 균질화 버퍼 100μL를 사용하여 단계 2.3에서 설명한대로 구슬 세 번 씻으십시오.
4. 용리
- 반대 조건 (10mM C를 포함하는 용출 버퍼 (50mM 트리스 - HCL 산도 7.5, 150mM NaCl과)의 50μL 추가비즈로 ACL 2 10mM EDTA (에틸렌 다이아 민 테트라 초산)). 예를 들어, CA 2가 들어있는 버퍼에 균질하고 묶여 있던 샘플 + EDTA (에틸렌 다이아 민 테트라 초산)과 반대를 포함 용출 버퍼에 eluted 있습니다.
옵션 : 구슬에 추가하면 수율을 향상시킬 수 있습니다 37 용출 버퍼를 온난화 ° C 전에.
- 흔드는 30 분 상온에서 구슬과 솔루션을 품어. 부드럽게마다 5 분에 대한 튜브를 눌러서하여 구슬을 섞는다.
- 3 분 1,500 rcf에 구슬을 원심 분리기 조심스럽게 흡인에 의해 구속 단백질 (예제 3) 뜨는의 50μL를 제거합니다. 구슬을 방해하지 않도록하십시오.
- 모든 샘플 (예 : homogenate, 언바운드 및 바운드 단백질뿐만 아니라 그 계속 비즈에 바인딩)에 단백질 로딩 버퍼를 추가합니다.
참고 : 용출을 (특히 비효율적인 용출의 경우) 극대화하려면 해당 용출 버퍼 50μL를 (예 : EDTA (에틸렌 다이아 민 테트라 초산)가 포함된 buf를 추가하는 추가남은 행 단백질과 나머지 바운드 단백질을 제거하는 4.3에서 설명한 단계를 반복을 elute 수 있도록 샘플을 가열하기 전에 비즈까지) CaCl 2 행 구슬로 그다지.
5. SDS - PAGE과 서양 얼룩
SDS - PAGE를 실시하고 긍정적인 제어로 반대 상태로 카메라를 바인딩하는 것으로 알려진 단백질에 대한 관심과 프로브의 단백질에 대해 탐색하여 서양 얼룩을 사용하여 분석할 수 있습니다.
6. 대표 결과
그림 2B는 내생 잉에 비해 GFP - 태그 잉의 캠 바인딩을 테스트 CAM - 풀다운 분석의 예를 보여줍니다. 이렇게하려면, GFP - 잉은 하룻밤 사이에 우리 organotypic hippocampal 조각에 overexpressed되었으며 조직은 균질습니다. homogenate는 칼슘 2 + 또는 EDTA (에틸렌 다이아 민 테트라 초산) 중 하나의 존재의 CAM - 세파 로스 비즈와 incubated했다. Homogenate 입력 GFP - 잉이 내생 잉 및 CA 2 + / CAM - 의존 키나제 II 이외의 표현이라고 보여줍니다(CaMKII). 마찬가지로 내생 첸 (그림. 2A의 그림)의 알려진 바인딩을 바탕으로 예상, 잉이 칼슘 2 + (EDTA (에틸렌 다이아 민 테트라 초산) 바인딩 단백질)의 부재 및 CA 2 +의 존재에 언바운드 (그림 2B)에 eluted되었습니다 GFP - 태그 . 반대로, 제어, CaMKII는 오직 칼슘 2 + (행 단백질)의 존재에 eluted되었으며 그 부재 (EDTA (에틸렌 다이아 민 테트라 초산))에 언바운드되었습니다. 이것은 CAM 비즈가 제대로 작동다고 표시되고 elutions는 효율적인되었습니다. 가장 중요한 것은, GFP - 잉은 내생 양식과 유사한 방식으로 ApoCaM에 바인딩이 보여주는 GFP 태그 우리 재조합 단백질의 기능을 변경하지 않았 것을 제안.
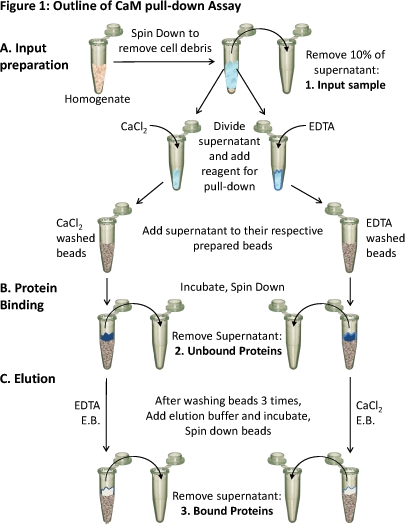
CAM 풀다운 분석의 그림 1. 개요
(A) 조직 homogenate는 세포 파편을 제거 아래로 잡아 늘인 것입니다. 뜨는의 10 % 정도는 입력 (1)의 샘플로 가져옵니다. 나머지 뜨는는 다른 동일하게 구성되어 있습니다조건 및 적절한 시약 (CaCl 2 혹은 EDTA (에틸렌 다이아 민 테트라 초산))는 이러한 조건에서 바인딩을 테스트에 추가됩니다. (CaCl 2 또는 EDTA (에틸렌 다이아 민 테트라 초산) 중 하나를 포함) 각 뜨는가 각각 준비 CAM - 세파 로스 구슬에로드되고 (B) 바인딩을 허용하는 incubated입니다. 언바운드 단백질이 제거됩니다 (2)와 (C) 행 단백질 (3)은 구속력 반대 조건을 포함한 용출 버퍼 (EB)를 사용하여 구슬에서 eluted 있습니다. 이 세 단백질 샘플의 단백질 합성이 SDS - PAGE와 서양 얼룩 분석을 사용하여 분석하실 수 있습니다.
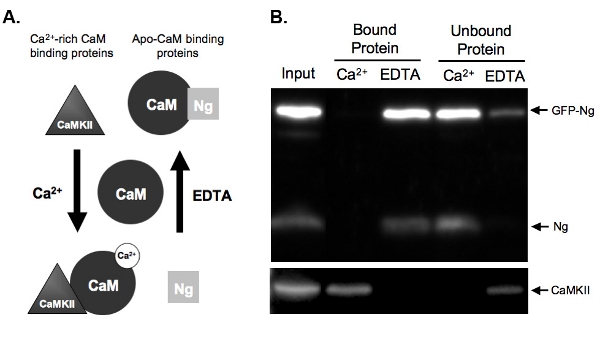
풀다운 분석 예에 칼슘 2 그림 2. A.) 도식은 + - 의존 CAM 바인딩과 용출은 단백질의 두 종류있는 칼슘 2에 구속 CAM + 종속 방식의 부여됩니다. Neurogranin (잉)은 구속 APO - CAM과 CaMKII가 + 풍부한 칼슘이에 바인딩 단백질을 나타내는 단백질을 나타냅니다캠. CAM은 homogenate 단백질과 사전 배양하기 위해 dissociated 상태로 표시됩니다. 일단 + chelator, EDTA (에틸렌 다이아 민 테트라 초산) (2 ㎜), 단백질이 적절하게 CAM에 바인딩할 것입니다 높은 칼슘 2 + 농도 (2 ㎜)의 조건이나 칼슘이의 존재에 incubated. NG없이 칼슘 2 + 현재 거의가로 EDTA (에틸렌 다이아 민 테트라 초산) 상태에서 카메라를 바인딩하고, 칼슘 2 +의 존재에있는 CAM - 세파 로스 구슬을 eluted 것입니다. CaMKII 그러나, CA이 높은 양의 앞에서 캠에 바인딩 것이 +와 칼슘 2 +가 chelated했습니다 한번 떼어 놓다 것입니다.
예를 들어 캠 풀다운 분석에서 B.) 결과. 이 수치는 CAM - 세파 로스의 예상 최종 결과는 샘플 잉과 CaMKII에 대한 탐지와 풀다운 보여줍니다. 내생 잉과 GFP - 잉 모두 EDTA (에틸렌 다이아 민 테트라 초산)의 존재에 캠에 바인딩 단백질의 차선에 존재한다. 샘플 칼슘 2 +의 존재에 CAM과 incubated 때 아무 잉가 보여주는, 구속하지 않는다는 Ng는 APO 카메라를 바인딩합니다. 우리의 긍정적인 제어, CaMKII는 반면에, 오직 칼슘 2의 존재에 캠에 바인딩 +.
토론
제공된 프로토콜은 칼슘이 캠 결합 단백질의 + - 의존도를 조사하기 위해 CAM - 세파 로스 구슬을 활용합니다. 많은 단백질은 칼슘 2 +에 의존 방식으로 카메라를 바인딩합니다. 이러한 상호 작용 카메론 바인딩 단백질과 많은 신호 경로에서 중요한 역할의 수를 주어진 매우 중요 있습니다. 이 프로토콜에서는 CAM - 세파 로스 비즈는 칼슘 2 +의 존재 또는 부재의 조직 ...
공개
관심 없음 충돌 선언하지 않습니다.
감사의 말
저자는이 프로토콜을 최적화하는 그녀의 도움 티파니 체리 감사드립니다. 이 작품은 국립 노화 연구소 (AG032320)뿐만 아니라 건강한 위스콘신를 발전하여 기금을했다.
자료
| 제품 | 회사 | 카탈로그 번호 | 노트 |
| Calmodulin - 세파 로스 비즈 | GE 헬스케어 | 17-0529-01 | |
| 안티 CamKII 알파 | 시그마 - 올드 리치 | C6974 | |
| 안티 neurogranin | Millipore | 07-425 | |
| 겔로드 Pipet 도움말 | 어부 | 02-707-138 | supernatants의 흡인에 사용 |
| Microcentrifuge 튜브 (2.0 ML) | 어부 | 05-408-146 | calmodulin - 세파 로스 비즈를 포함한 모든 단계에 사용 |
참고문헌
- Vincenzi, F. F. Calmodulin in the regulation of intracellular calcium. Proc. West Pharmacol Soc. 22, 289-294 (1979).
- Cheung, W. Y. Calmodulin plays a pivotal role in cellular regulation. Science. 207, 19-27 (1980).
- Zhang, M., Tanaka, T., Ikura, M. Calcium-induced conformational transition revealed by the solution structure of apo calmodulin. Nat. Struct. Biol. 2, 758-767 (1995).
- Alexander, K. A., Wakim, B. T., Doyle, G. S., Walsh, K. A., Storm, D. R. Identification and characterization of the calmodulin-binding domain of neuromodulin, a neurospecific calmodulin-binding protein. J. Biol. Chem. 263, 7544-7549 (1988).
- Huang, K. P., Huang, F. L., Chen, H. C. Characterization of a 7.5-kDa protein kinase C substrate (RC3 protein, neurogranin) from rat brain. Arch. Biochem. Biophys. 305, 570-580 (1993).
- Bahler, M., Rhoads, A. Calmodulin signaling via the IQ motif. FEBS Lett. 513, 107-113 (2002).
- Routtenberg, A. Protein kinase C activation leading to protein F1 phosphorylation may regulate synaptic plasticity by presynaptic terminal growth. Behav. Neural. Biol. 44, 186-200 (1985).
- Zhong, L., Cherry, T., Bies, C. E., Florence, M. A., Gerges, N. Z. Neurogranin enhances synaptic strength through its interaction with calmodulin. EMBO J. 28, 3027-3039 (2009).
- Needham, D. M. Myosin and adenosinetriphosphate in relation to muscle contraction. Biochim. Biophys. Acta. 4, 42-49 (1950).
- Hathaway, D. R., Adelstein, R. S. Human platelet myosin light chain kinase requires the calcium-binding protein calmodulin for activity. Proc. Natl. Acad. Sci. U.S.A. 76, 1653-1657 (1979).
- Fukunaga, K., Yamamoto, H., Matsui, K., Higashi, K., Miyamoto, E. Purification and characterization of a Ca2+- and calmodulin-dependent protein kinase from rat brain. J. Neurochem. 39, 1607-1617 (1982).
- Yang, S. D., Tallant, E. A., Cheung, W. Y. Calcineurin is a calmodulin-dependent protein phosphatase. Biochem. Biophys. Res. Commun. 106, 1419-1425 (1982).
- Huestis, W. H., Nelson, M. J., Ferrell, J. E. J. Calmodulin-dependent spectrin kinase activity in human erythrocytes. Prog. Clin. Biol. Res. 56, 137-155 (1981).
- Yamniuk, A. P., Vogel, H. J. Calmodulin's flexibility allows for promiscuity in its interactions with target proteins and peptides. Mol. Biotechnol. 27, 33-57 (2004).
- Zhong, L., Kaleka, K. S., Gerges, N. Z. Neurogranin phosphorylation fine-tunes long-term potentiation. Eur. J. Neurosci. 33, 244-250 (2011).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유