Un abonnement à JoVE est nécessaire pour voir ce contenu. Connectez-vous ou commencez votre essai gratuit.
Method Article
Pull-down des protéines se liant à la calmoduline
Dans cet article
Résumé
Calmoduline (CaM) pull-down test est un moyen efficace pour étudier l'interaction de la CAM avec diverses protéines. Cette méthode utilise la CaM-sépharose perles pour une analyse efficace et spécifique des protéines liant la CaM. Cela fournit un outil important d'explorer de signalisation CAM dans la fonction cellulaire.
Résumé
Le calcium (Ca 2 +) est un ion essentiel dans la régulation de la fonction cellulaire à travers une variété de mécanismes. Beaucoup de Ca 2 + de signalisation est médiée par la protéine liant le calcium connu comme la calmoduline (CaM) 1,2. Cam est impliqué à plusieurs niveaux dans presque tous les processus cellulaires, y compris l'apoptose, le métabolisme, la contraction des muscles lisses, la plasticité synaptique, la croissance des nerfs, l'inflammation et la réponse immunitaire. Un certain nombre de protéines aident à réguler ces voies grâce à leur interaction avec la CaM. Beaucoup de ces interactions dépendent de la conformation de came, qui est nettement différente lorsqu'il est lié à Ca 2 + (Ca 2 +-CaM) par opposition à sa Ca 2 + sans état (ApoCaM) 3.
Alors que la plupart des protéines cibles se lient Ca 2 +-CaM, certaines protéines ne se lient à ApoCaM. Certains CaM lient par leur QI-domaine, y compris neuromodulin 4, neurogranine (Ng) 5, et certaines myosines 7, fonction postsynaptique 8 et 9 contraction des muscles, respectivement. Leur capacité à se lier et libérer Cam en l'absence ou la présence de Ca 2 + est le pivot de leur fonction. En revanche, de nombreuses protéines ne se lient Ca 2 +-CaM et nécessitent cette liaison pour leur activation. Les exemples incluent la myosine kinase à chaîne légère 10, Ca 2 + / CaM-kinases dépendantes (CaMKs) 11 et les phosphatases (par exemple la calcineurine) 12, et la spectrine kinase 13, qui ont une variété d'effets directs et aval 14.
Les effets de ces protéines sur la fonction cellulaire sont souvent dépendants de leur capacité à se lier à Cam dans un Ca 2 +-dépendante. Par exemple, nous avons testé la pertinence de Ng-CAM obligatoire dans la fonction synaptique et la façon dont les mutations affectent différentes cette liaison. Nous avons généré une con-GFP taggés Ngstruct avec des mutations spécifiques dans le IQ-domaine qui allait changer la capacité de se lier Ng CAM dans une Ca 2 +-dépendante. L'étude de ces différentes mutations nous a donné une grande perspicacité dans les processus importants impliqués dans la fonction synaptique 8,15. Cependant, dans de telles études, il est essentiel de démontrer que les protéines mutées ont altéré la liaison prévue à Cam.
Ici, nous présentons une méthode pour tester la capacité des protéines à se lier à Cam en présence ou en absence de Ca 2 +, en utilisant CaMKII et Ng comme exemples. Cette méthode est une forme de chromatographie d'affinité appelé CaM déroulant dosage. Il utilise la CaM-Sépharose perles de tester les protéines qui se lient à came et l'influence de Ca 2 + sur cette liaison. Il est temps considérablement plus efficace et nécessite moins de protéine par rapport à la chromatographie colonne et d'autres épreuves. Au total, cela donne un outil précieux pour explorer Ca 2 + de signalisation Cam / et de protéines que dansteract avec Cam.
Protocole
Reportez-vous à la Figure 1 pour un schéma de base de la procédure depuis le broyat. Estimation du temps de la préparation d'extraits cellulaires à élution de protéines liées CaM est d'environ six à sept heures.
1. Préparation des tissus
- Injecter organotypiques coupes d'hippocampe par un virus contenant un plasmide exprimant la protéine recombinante d'intérêt (dans cet exemple, la protéine fluorescente verte (GFP)-taggés Ng) et permettent d'exprimer des protéines des tissus pendant la nuit.
- Environ 12 à 18 heures après l'injection virale (selon le temps d'expression viral), se préparent à recueillir les tissus. Ajouter 1ml de tampon de dissection (glucose 10 mM, 4mm KCl, NaHCO3 26mm, 233mm de sucrose, 5 mM MgCl 2, CaCl 2 1mM, et 0,1% de phénol-rouge, gazés avec 5% de CO 2 de 95% O 2) pour une boîte de Pétri. Transfert de cultures de tissus / insert pour boîte de Pétri et ajouter du tampon de dissection 2mL à l'insertion de submerger le tissu.
- Collect organotypiques de tissu hippocampique (entre 5 et 10 tranches) en grattant doucement le tissu libre de la membrane d'insérer à l'aide d'un scalpel. Plus précisément enlever une région d'intérêt particulier (par exemple CA1) est également une option. Transfert des tissus suspendus à un tube à centrifuger de 1,5 ml en utilisant une pipette Pasteur inversé.
- Centrifuger les échantillons à 1.500 rcf pendant 1 min pour séparer les tissus provenant de la mémoire tampon de la dissection. Retirez délicatement le surnageant par aspiration. Veillez à ne pas perturber le culot.
- Pour chaque tranche utilisée, ajouter 30 à 60 uL de tampon d'homogénéisation (150mm de NaCl, 20 mM Tris pH 7,5, 1 mM de DTT, 1μg/mL leupeptine, 1μg/mL chemostatin, 1μg/mL antidouleur, pepstatine 1μg/mL, et 1% de Triton X -100) au tissu et homogénéiser soigneusement avec un pilon.
- Afin d'éliminer les débris cellulaires, centrifuger l'homogénat restant à 1100 rcf pendant 10 min et retirez soigneusement le surnageant par aspiration, tout en évitant la contamination par le culot.
- Prenez 10% de surnageant comme un échantillon de l'entrée (échantillon 1). Stocker le surnageant restant sur la glace pendant la préparation des billes de CaM-sépharose pour une utilisation à l'étape 3.
Remarque: Le tissu utilisé ici sont organotypiques coupes d'hippocampe. Toutefois, on pourrait utiliser des neurones dissociés ou toute autre cellule du système de culture. Dans un tel cas, commencer à l'étape 1.4, après la collecte de vos tissus de la manière appropriée.
2. Préparation des billes pour les pull-down
Dans la manipulation des perles, il est important de récupérer les perles et de maximiser l'efficacité des réactions en empêchant les perles de sécher sur les parois du tube. Pour ce faire, il est préférable de faire tourner vos tubes de leur côté, permettant solution pour mouiller les perles sur les parois du tube, immédiatement avant la centrifugation.
- Pour chaque menu déroulant, une pipette 400 pi de suspension calmoduline-sépharose billes dans un microtube de 2 mL avec un fla relativementT-bas pour maximiser la surface et l'interaction de vos solutions avec les perles pendant votre incubations.
- Centrifugeuse à 21000 rcf perles pendant 30 secondes et retirer délicatement le surnageant par aspiration. Assurez-vous de ne pas déranger les perles.
- Pour laver les perles, ajouter 100 ul du tampon d'homogénéisation respectifs contenant soit 2 mM de CaCl2 à ceux qui sont utilisés pour tirer vers le bas Ca 2 +-CaM protéines de liaison et 2 mM d'EDTA (un chélateur connue Ca 2 +) pour les perles tirant vers le bas protéines ApoCaM contraignant. Tapoter légèrement le tube pour remettre en suspension des perles et centrifuger à 1500 rcf pendant 1 min. Retirez délicatement le surnageant par aspiration, en veillant à ne pas perturber les perles.
Note: Pour toutes les étapes d'aspiration, il est recommandé d'utiliser un embout de pipette qui a une ouverture fine (par exemple des conseils de chargement de gel) pour permettre le retrait de la solution sans avoir à retirer des perles.
3. CaM-sépharose liaison des protéines
- Divisez votre surnageant dans deux conditions contenant un volume égal. Selon votre condition, ajouter la quantité appropriée de CaCl 2 ou de l'EDTA à votre surnageant jusqu'à 2 mM de concentration pour chacun.
- Ajouter surnageant de l'étape de 1,7 à billes lavées en tampon d'homogénéisation correspondante. Tapoter légèrement le tube pour mélanger.
- Incuber les échantillons à 4 ° C pendant 3 heures sur un agitateur. Re-suspendre des perles toutes les 30 min environ pour accroître l'efficacité de la liaison.
- Tube à centrifuger contenant des échantillons et des perles à 1.500 rcf pendant 3 min.
- Prenez 50 pl de surnageant comme un échantillon de protéine non liée (échantillon 2) et retirer délicatement le surnageant restant par aspiration et le jeter.
- Lavez perles trois fois comme décrit dans l'étape 2.3 en utilisant 100 pi de tampon d'homogénéisation respectifs.
4. Élution
- Ajouter 50 pl de tampon d'élution (50 mM Tris-HCl pH 7,5, NaCl et 150 mm) contenant la condition opposée (10 mM CACL 2 ou 10mm EDTA) aux billes. Par exemple, les échantillons qui ont été homogénéisés et lié dans un tampon contenant Ca 2 + sont élués dans le tampon d'élution contenant de l'EDTA et vice-versa.
En option: le réchauffement du tampon d'élution à 37 ° C avant d'ajouter à billes peuvent améliorer le rendement.
- Incuber solution avec des perles à la température ambiante pendant 30 min sur un agitateur. Mélanger les perles en tapotant délicatement le tube environ toutes les 5 min.
- Centrifuger à 1500 fcr perles pendant 3 min et retirez délicatement le 50 pl de surnageant pour la protéine liée (échantillon 3) par aspiration. Assurez-vous de ne pas déranger les perles.
- Ajouter tampon de chargement de protéines pour tous les échantillons (c.-à homogénat, traitées et non traitées des protéines ainsi que ceux qui sont encore lié aux billes).
Remarque: Afin de maximiser l'élution (en particulier dans le cas d'élution inefficace), ajouter 50 pl du tampon d'élution correspondant (par exemple en ajoutant EDTA buf contenantFer à perles liés au CaCl 2) aux billes avant de chauffer les échantillons pour aider à éluer toutes les protéines restant liés et répétez les étapes décrites à la section 4.3 pour enlever les protéines liées.
5. SDS-PAGE et Western blot
Conduite SDS-PAGE et Western blot en utilisant l'analyse par sondage pour votre protéine d'intérêt et de la sonde pour une protéine connue pour se lier CAM dans la condition opposée comme un contrôle positif.
6. Les résultats représentatifs
La figure 2B représente un exemple d'un dosage de la CaM-pull-down test de la liaison de la CaM de GFP-Ng marqués par rapport à Ng endogène. Pour ce faire, GFP-Ng a été surexprimé dans notre organotypiques coupes d'hippocampe pendant la nuit et le tissu a été homogénéisé. L'homogénat a été incubé avec Cam-sépharose billes en présence soit de Ca 2 + ou de l'EDTA. Entrée homogénat montre que la GFP-Ng a été exprimé, en plus de endogènes Ng et Ca 2 + / CaM-kinase dépendante II(CaMKII). Comme attendu basé sur la liaison connue de Ng endogènes (illustré dans la Fig. 2A), la GFP-tagged Ng a été élue en l'absence de Ca 2 + (EDTA lié aux protéines) et non lié à la présence de Ca 2 + (figure 2B) . En revanche, le contrôle, CaMKII, a été élue uniquement en présence de Ca 2 + (protéines) et a été détaché dans son absence (EDTA). Cela montre que les perles étaient CaM fonctionne correctement et le élutions ont été efficaces. Plus important encore, cela montre que la GFP-Ng se lie à ApoCaM d'une façon similaire à la forme endogène, ce qui suggère que la balise GFP ne modifie pas la fonction de notre protéine recombinante.
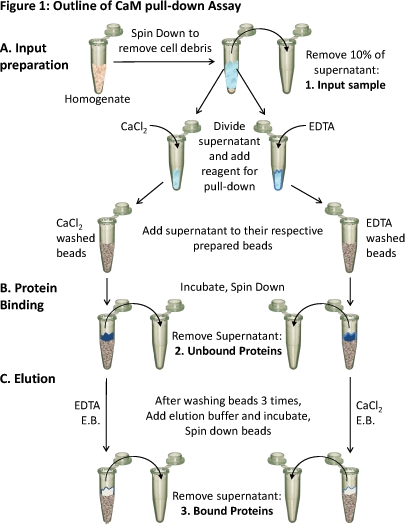
Figure 1. Schéma de la CAM pull-down assay
(A) homogénat tissulaire est centrifugé pour enlever les débris cellulaires. Environ 10% du surnageant est pris comme un échantillon de l'entrée (1). Le surnageant restant est divisé de manière égale pour les différentsconditions et les réactifs appropriés (CaCl 2 ou EDTA) sont ajoutés au test de liaison dans ces conditions. Chaque surnageant (contenant soit CaCl 2 ou EDTA) est chargé sur le prêt, respectivement CaM-sépharose perles et (B) incubée pour permettre la liaison. Les protéines non liées sont éliminées (2) et (C) les protéines liées (3) sont élués hors des perles à l'aide du tampon d'élution (EB) contenant la condition opposée comme la liaison. La composition protéique de ces trois échantillons de protéines peuvent être analysées par SDS-PAGE et Western blot.
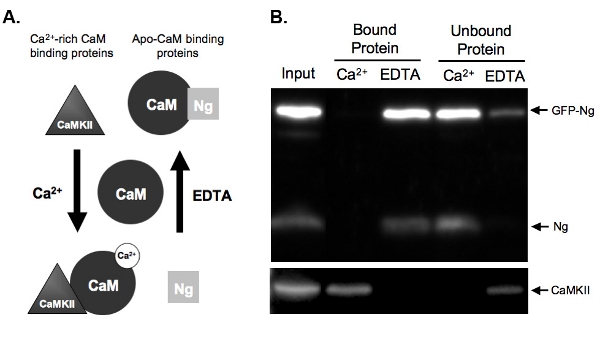
Figure 2. A.) Schéma de Ca 2 +-dépendante contraignante Cam et élution dans les exemples de dosage déroulant sont donnés des deux types de protéines qui se lient dans une CaM Ca 2 +-dépendante. Neurogranine (Ng) représente protéines qui se lient apo-Cam et CaMKII représente les protéines qui se lient à Ca 2 + richesCaM. Cam est représenté dans son état dissocié avant incubation avec les protéines d'homogénat. Une fois mis en incubation dans des conditions de haute concentration de Ca 2 + (2 mM) ou en présence d'un chélateur de Ca 2 +, l'EDTA (2 mM), les protéines se lient à la CaM conséquence. Ng lie CaM dans l'état de l'EDTA comme il ya peu ou pas de Ca 2 + présent, et serait élué hors les perles CaM-sépharose, en présence de Ca 2 +. CaMKII, cependant, se lierait à Cam, en présence de quantités élevées de Ca 2 + et serait dissocier une fois que le Ca 2 + a été chélaté.
B.) Les résultats de la CaM exemple déroulant dosage. Ce chiffre démontre le résultat final attendu d'une came-sépharose tirer vers le bas avec les échantillons sondé pour Ng et CaMKII. Tant l'Ng endogènes et GFP-Ng sont présents dans les ruelles de protéines liées à la CAM en présence d'EDTA. Pas Ng est lié lorsque les échantillons sont incubés avec Cam, en présence de Ca 2 +, ce qui démontre que Ng ne lie que l'apo-CAM. Notre contrôle positif, CaMKII, d'autre part, se lie à la CaM seulement en présence de Ca 2 +.
Discussion
Le protocole fourni utilise CaM-sépharose perles pour enquêter sur le Ca 2 +-dépendance de la CaM des protéines de liaison. De nombreuses protéines se lient dans une CaM Ca 2 +-dépendante. Ces interactions sont d'une grande importance étant donné le nombre de CaM des protéines de liaison et leur rôle crucial dans de nombreuses voies de signalisation. Dans ce protocole, Cam-sépharose perles sont utilisées pour séparer des protéines de liaison de la CaM d'homogénat de tissu en ...
Déclarations de divulgation
Pas de conflits d'intérêt déclarés.
Remerciements
Les auteurs tiennent à remercier Tiffany cerise dans son aide à l'optimisation de ce protocole. Ce travail a été financé par l'Institut national du vieillissement (AG032320) ainsi que l'avancement une meilleure santé du Wisconsin.
matériels
| Produit | Société | Numéro de catalogue | Remarques |
| La calmoduline-sépharose perles | GE Healthcare | 17-0529-01 | |
| Anti-CaMKII alpha | Sigma-Aldrich | C6974 | |
| Anti-neurogranine | Millipore | 07-425 | |
| Conseils Gel Loading Pipet | Fisher | 02-707-138 | Utilisez pour l'aspiration de surnageants |
| Tubes de centrifugation (2,0 ml) | Fisher | 05-408-146 | Utiliser pour toutes les étapes impliquant la calmoduline-sépharose perles |
Références
- Vincenzi, F. F. Calmodulin in the regulation of intracellular calcium. Proc. West Pharmacol Soc. 22, 289-294 (1979).
- Cheung, W. Y. Calmodulin plays a pivotal role in cellular regulation. Science. 207, 19-27 (1980).
- Zhang, M., Tanaka, T., Ikura, M. Calcium-induced conformational transition revealed by the solution structure of apo calmodulin. Nat. Struct. Biol. 2, 758-767 (1995).
- Alexander, K. A., Wakim, B. T., Doyle, G. S., Walsh, K. A., Storm, D. R. Identification and characterization of the calmodulin-binding domain of neuromodulin, a neurospecific calmodulin-binding protein. J. Biol. Chem. 263, 7544-7549 (1988).
- Huang, K. P., Huang, F. L., Chen, H. C. Characterization of a 7.5-kDa protein kinase C substrate (RC3 protein, neurogranin) from rat brain. Arch. Biochem. Biophys. 305, 570-580 (1993).
- Bahler, M., Rhoads, A. Calmodulin signaling via the IQ motif. FEBS Lett. 513, 107-113 (2002).
- Routtenberg, A. Protein kinase C activation leading to protein F1 phosphorylation may regulate synaptic plasticity by presynaptic terminal growth. Behav. Neural. Biol. 44, 186-200 (1985).
- Zhong, L., Cherry, T., Bies, C. E., Florence, M. A., Gerges, N. Z. Neurogranin enhances synaptic strength through its interaction with calmodulin. EMBO J. 28, 3027-3039 (2009).
- Needham, D. M. Myosin and adenosinetriphosphate in relation to muscle contraction. Biochim. Biophys. Acta. 4, 42-49 (1950).
- Hathaway, D. R., Adelstein, R. S. Human platelet myosin light chain kinase requires the calcium-binding protein calmodulin for activity. Proc. Natl. Acad. Sci. U.S.A. 76, 1653-1657 (1979).
- Fukunaga, K., Yamamoto, H., Matsui, K., Higashi, K., Miyamoto, E. Purification and characterization of a Ca2+- and calmodulin-dependent protein kinase from rat brain. J. Neurochem. 39, 1607-1617 (1982).
- Yang, S. D., Tallant, E. A., Cheung, W. Y. Calcineurin is a calmodulin-dependent protein phosphatase. Biochem. Biophys. Res. Commun. 106, 1419-1425 (1982).
- Huestis, W. H., Nelson, M. J., Ferrell, J. E. J. Calmodulin-dependent spectrin kinase activity in human erythrocytes. Prog. Clin. Biol. Res. 56, 137-155 (1981).
- Yamniuk, A. P., Vogel, H. J. Calmodulin's flexibility allows for promiscuity in its interactions with target proteins and peptides. Mol. Biotechnol. 27, 33-57 (2004).
- Zhong, L., Kaleka, K. S., Gerges, N. Z. Neurogranin phosphorylation fine-tunes long-term potentiation. Eur. J. Neurosci. 33, 244-250 (2011).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon