É necessária uma assinatura da JoVE para visualizar este conteúdo. Faça login ou comece sua avaliação gratuita.
Method Article
Pull-down da Calmodulina Proteínas de Ligação
Neste Artigo
Resumo
Calmodulina (CaM) ensaio de pull-down é uma maneira eficaz para investigar a interação de CaM com várias proteínas. Este método usa CaM-sepharose contas para análise eficiente e específica do CaM proteínas de ligação. Isto proporciona uma importante ferramenta para explorar sinalização CaM em função celular.
Resumo
Cálcio (Ca 2 +) é um íon vital na regulação da função celular através de uma variedade de mecanismos. Muito do Ca 2 + de sinalização é mediada através da proteína de ligação de cálcio conhecido como calmodulina 1,2 (CaM). CaM está envolvido em vários níveis em quase todos os processos celulares, incluindo apoptose, o metabolismo, a contração do músculo liso, plasticidade sináptica, o crescimento do nervo, inflamação e da resposta imune. Uma série de proteínas ajudam a regular essas vias através de sua interação com CaM. Muitas dessas interações dependem da conformação da CAM, que é distintamente diferente quando ligado a Ca 2 + (Ca 2 +-CAM) em oposição à sua Ca 2 + estado livre (ApoCaM) 3.
Enquanto a maioria das proteínas-alvo bind Ca 2 +-CaM, algumas proteínas só se ligam a ApoCaM. Alguns ligam-se através CaM seu QI de domínio, incluindo neuromodulin 4, neurogranin (Ng) 5, e miosinas certos 7, função pós-sinápticos 8, e 9 a contração muscular, respectivamente. Sua capacidade de ligar e liberar CaM na ausência ou presença de Ca 2 + é central na sua função. Em contraste, muitas proteínas se ligam apenas Ca 2 +-CaM e exigem esta ligação para sua ativação. Exemplos incluem a quinase da cadeia leve da miosina 10, Ca 2 + / CaM quinases dependentes (CaMKs) 11 e fosfatases (por exemplo, da calcineurina) 12, e espectrina quinase 13, que tem uma variedade de efeitos diretos e jusante 14.
Os efeitos destas proteínas em função celular são muitas vezes dependentes de sua capacidade de se ligar a CaM em Ca 2 + forma-dependente. Por exemplo, testamos a relevância da Ng-CaM obrigatório em função sináptica e como diferentes mutações afetam essa ligação. Geramos uma GFP-tagged con Ngstruct com mutações específicas no IQ-domínio que iria mudar a capacidade de Ng para ligar CaM em Ca 2 + forma-dependente. O estudo destas mutações diferentes nos deu grande insight sobre processos importantes envolvidos na função sináptica 8,15. No entanto, em tais estudos, é essencial para demonstrar que as proteínas mutantes têm a ligação esperada alterado para CaM.
Aqui, apresentamos um método para testar a capacidade de se ligar a proteínas CaM na presença ou ausência de Ca 2 +, usando CaMKII e Ng como exemplos. Este método é uma forma de cromatografia de afinidade referido como um ensaio CaM pull-down. Ele usa CaM-Sepharose contas para testar as proteínas que se ligam ao CaM e à influência de Ca 2 + em essa ligação. É tempo consideravelmente mais eficiente e requer menos proteínas em relação a cromatografia de coluna e outros ensaios. Ao todo, este fornece uma valiosa ferramenta para explorar Ca 2 + / CaM sinalização e proteínas que, emteract com CaM.
Protocolo
Consulte a Figura 1 para um esquema básico do início procedimento com o homogeneizado. Tempo estimado desde a preparação de extratos celulares para eluição de Cam-bound proteínas é de cerca de 6-7 horas.
1. Preparação dos tecidos
- Injetar organotípicas fatias do hipocampo com um vírus que contém um plasmídeo expressando a proteína recombinante de interesse (neste exemplo, proteína fluorescente verde (GFP) marcadas Ng) e permitir que o tecido que expressam a proteína durante a noite.
- Cerca de 12 a 18 horas após a injeção viral (dependendo da época expressão viral), prepare-se para coletar o tecido. Adicionar tampão dissecção 1mL (glicose 10mM, KCl 4 mM, NaHCO3 26mm, sacarose 233mM, MgCl 5mM 2, 1 mM CaCl 2, e 0,1% de fenol-vermelho, gaseados com 5% de CO 2 95% O 2) a uma placa de Petri. Transferência de tecido cultivado / inserir a placa de Petri e adicionar 2 ml de buffer dissecção para a inserção de submergir o tecido.
- Coletat organotípicas tecido do hipocampo (entre 5 e 10 fatias) delicadamente raspando o tecido livre da membrana inserção utilizando um bisturi. Especificamente a remoção de uma determinada região de interesse (por exemplo, CA1) também é uma opção. Transferência de suspensão do tecido para um tubo de microcentrífuga 1,5 ml usando uma pipeta Pasteur invertida.
- Centrifugar amostras em 1500 rcf para 1 min para separar tecido do tampão dissecção. Remova cuidadosamente o sobrenadante por aspiração. Certifique-se de não perturbar o sedimento.
- Para cada fatia usada, adicione 30-60 mL de tampão de homogeneização (150mm NaCl, 20mM Tris pH 7.5, 1mM DTT, 1μg/mL leupeptin, 1μg/mL chemostatin, 1μg/mL Antipaína, pepstatin 1μg/mL, e 1% Triton X -100) para o tecido e homogeneizar cuidadosamente com o pilão.
- , A fim de remover os restos celulares, centrifugar o homogeneizado restante em 1100 rcf durante 10 minutos e remova cuidadosamente o sobrenadante por aspiração, evitando a contaminação do sedimento.
- Ter 10% do sobrenadante como amostra da entrada (amostra 1). Guarde o sobrenadante restante no gelo durante a preparação das contas CaM-sepharose para uso no passo 3.
Nota: O tecido utilizado aqui estão organotípicas fatias do hipocampo. No entanto, pode-se usar os neurônios dissociados ou qualquer sistema de cultura de outras células. Nesse caso, comece com a etapa 1,4 depois de coletar o tecido de maneira apropriada.
2. Preparação de grânulos de pull-down
No manuseio das contas, é importante para salvar as contas e maximizar a eficiência das reações, impedindo as contas de secagem sobre os lados do tubo. Para isso, é melhor para rodar seus tubos do lado deles, permitindo que solução para molhar as contas nas paredes do tubo, imediatamente antes da centrifugação.
- Para cada pull-down, pipeta de 400 mL suspensão Calmodulina Sepharose-beads em um tubo de microcentrífuga 2 mL com um fla relativamentet-bottom para maximizar a área de superfície e interação de suas soluções com as contas durante a sua incubação.
- Centrífuga contas a 21.000 rcf durante 30 segundos e remova cuidadosamente o sobrenadante por aspiração. Certifique-se de não perturbar as contas.
- Para lavar as contas, adicionar 100 mL do tampão de homogeneização respectivos contendo um ou dois mM CaCl 2 para aqueles que estão sendo usados para puxar para baixo Ca 2 +-CaM proteínas de ligação e 2 mM EDTA (um conhecido Ca 2 + quelante) para contas puxando para baixo ApoCaM proteínas de ligação. Bata suavemente o tubo para re-suspender contas e centrifugar a 1500 rcf para 1 min. Remova cuidadosamente o sobrenadante por aspiração, certificando-se para não perturbar as contas.
Nota: Para todos os passos de aspiração, é recomendado o uso de uma ponteira que tem uma abertura fina (por exemplo, dicas de carga gel) para permitir a remoção da solução sem remover contas.
3. CaM-sepharose ligação de proteínas
- Dividir o seu sobrenadante em duas condições que contenham um volume igual. Dependendo da sua condição, adicionar a quantidade apropriada de CaCl 2 ou EDTA para o sobrenadante até 2 mM para cada concentração.
- Adicionar sobrenadante do passo de 1,7 a contas lavados em tampão de homogeneização correspondente. Bata suavemente o tubo para misturar.
- Incubar as amostras a 4 ° C por 3 horas em uma coqueteleira. Re-suspender contas a cada 30 minutos ou mais para aumentar a eficiência da ligação.
- Tubo de centrífuga contendo amostras e contas de 1500 rcf durante 3 min.
- Tome 50μL do sobrenadante como amostra de proteína unbound (amostra 2) e remova cuidadosamente o sobrenadante por aspiração e restantes descartar.
- Lavar contas três vezes como descrito no passo 2,3 utilizando 100μL de tampão de homogeneização respectivos.
4. Eluição
- Adicionar 50μL de tampão de eluição (50 mM Tris-HCl pH 7.5, NaCl e 150 mm), contendo a condição oposta (10mM CaCl 2 ou 10mM EDTA) para as contas. Por exemplo, as amostras que foram homogeneizadas e ligado em tampão contendo Ca 2 + são eluídos em tampão de eluição contendo EDTA e vice-versa.
Opcional: O aquecimento do tampão de eluição a 37 ° C antes de adicionar contas pode aumentar o rendimento.
- Incubar solução com contas em temperatura ambiente por 30 min em um agitador. Misture as contas batendo o tubo a cada 5 min.
- Centrífuga contas em 1500 rcf por 3 min e remova cuidadosamente a 50μL do sobrenadante para a ligação às proteínas (amostra 3) por aspiração. Certifique-se de não perturbar as contas.
- Adicionar tampão de carregamento de proteína para todas as amostras (ou seja, proteínas unbound homogeneizado, e amarrou bem como aqueles que ainda estão vinculados às esferas).
Nota: Para maximizar a eluição (especialmente no caso de eluição ineficiente), adicionar 50μL do tampão de eluição correspondentes (por exemplo, a adição de EDTA buf contendofer de contas vinculadas em CaCl 2) para as contas antes de aquecer as amostras para ajudar a eluir qualquer proteína ligada restantes e repita os passos descritos no item 4.3 para remover proteínas restantes vinculados.
5. SDS-PAGE e western blot
Conduta SDS-PAGE e analisar usando western blot sondando para a sua proteína de interesse e sonda para uma proteína conhecida por se ligar CaM na condição oposta como controle positivo.
6. Resultados representante
Figura 2B mostra um exemplo de um ensaio de CaM-pull-down testar a ligação da CaM GFP-tagged Ng comparação com Ng endógena. Para isso, GFP-Ng foi overexpressed em nosso organotípicas fatias do hipocampo durante a noite e o tecido foi homogeneizado. O homogenato foi incubado com CaM-sepharose contas na presença de um Ca 2 + ou EDTA. Homogenato de entrada mostra que a GFP-Ng foi expressa, além de Ng endógenos e Ca 2 + / CaM quinase II dependente de(CaMKII). Como era esperado com base na ligação conhecida de Ng endógena (ilustrado na figura. 2A), GFP-tagged Ng foi eluída na ausência de Ca 2 + (EDTA ligação às proteínas) e não ligado, na presença de Ca 2 + (Fig. 2B) . Em contraste, o controle, CaMKII, foi eluído apenas na presença de Ca 2 + (proteínas) e foi unbound na sua ausência (EDTA). Isso mostra que as contas foram CaM funcionando corretamente eo elutions foram eficientes. Mais importante, isso mostra que GFP-Ng se liga a ApoCaM de forma semelhante à forma endógena, sugerindo que a tag GFP não alterou a função da nossa proteína recombinante.
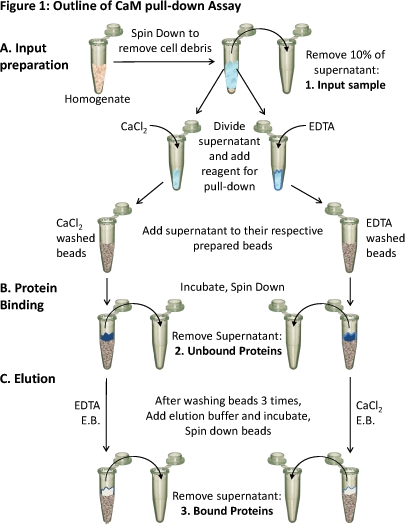
Esboço figura 1. CaM do ensaio de pull-down
(A) homogeneizado de tecido é girado para baixo para remover os restos celulares. Cerca de 10% do sobrenadante é tida como uma amostra da entrada (1). O sobrenadante restante é dividido igualmente para os diferentescondições e os reagentes apropriados (CaCl 2 ou EDTA) são adicionados ao teste obrigatório em tais condições. Cada sobrenadante (contendo um ou outro CaCl 2 ou EDTA) é carregado no respectivamente preparado CaM-sepharose contas e (B) incubado para permitir a ligação. Proteínas não ligados são removidos (2) e (C) as proteínas ligados (3) são eluídos fora das esferas usando tampão de eluição (EB), contendo a condição oposta, como a ligação. A composição das proteínas dessas três amostras de proteínas podem ser analisadas utilizando SDS-PAGE e western blot.
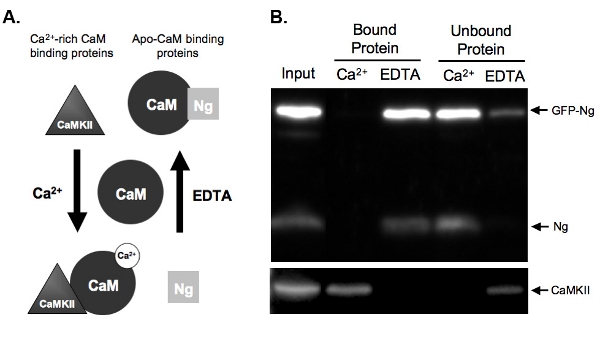
Figura 2. A. esquemática) de Ca 2 + dependentes de ligação CaM e eluição em Exemplos de pull-down ensaio são dadas de dois tipos de proteínas que se ligam CaM em Ca 2 + forma-dependente. Neurogranin (Ng) representa proteínas que se ligam apo-CaM e CaMKII representa proteínas que se ligam ao Ca 2 + ricosCaM. CaM é mostrada em seu estado dissociado antes da incubação com as proteínas homogeneizado. Uma vez incubados sob condições de altas concentrações de Ca 2 + (2 mM) ou na presença de um quelante de Ca 2 +, EDTA (2 mM), as proteínas se ligam a CaM em conformidade. Ng liga CaM na condição de EDTA como há pouca ou nenhuma Ca 2 + presente, e seria eluído fora as contas CaM-sepharose na presença de Ca 2 +. CaMKII, porém, se ligariam a CaM na presença de quantidades elevadas de Ca 2 + e que dissociar uma vez que o Ca 2 + foi quelatado.
B.) Os resultados de CaM exemplo pull-down ensaio. Este número demonstra o resultado final esperado de um CaM-sepharose puxar para baixo com as amostras sondado por Ng e CaMKII. Ambos Ng endógeno e GFP-Ng estão presentes nas pistas de proteínas ligados a CaM na presença de EDTA. Ng não é obrigado quando as amostras são incubadas com CaM na presença de Ca 2 +, demonstrando que Ng só liga apo-CaM. Nosso controle positivo, CaMKII, por outro lado, liga-se a CaM apenas na presença de Ca 2 +.
Discussão
O protocolo fornecido utiliza CaM-sepharose contas para investigar o Ca 2 + dependência da CaM proteínas de ligação. Muitas proteínas se ligam CaM em uma Ca 2 + forma-dependente. Essas interações são de grande importância dado o número de CaM proteínas de ligação e seu papel crítico em muitas vias de sinalização. Neste protocolo, CaM-sepharose contas são usadas para separar CaM proteínas de ligação a partir de homogeneizado de tecido na presença ou ausência de Ca 2 +.
Divulgações
Não há conflitos de interesse declarados.
Agradecimentos
Os autores gostariam de agradecer a Tiffany Cereja em sua ajuda na otimização deste protocolo. Este trabalho foi financiado pelo National Institute of Aging (AG032320), bem como Avançando um Wisconsin saudável.
Materiais
| Produto | Companhia | Número de catálogo | Notas |
| Calmodulina-Sepharose contas | GE Healthcare | 17-0529-01 | |
| Anti-CamKII alpha | Sigma-Aldrich | C6974 | |
| Anti-neurogranin | Millipore | 07-425 | |
| Gel Dicas Pipetar Loading | Pescador | 02-707-138 | Use para aspiração de sobrenadantes |
| Tubos de microcentrífuga (2,0 mL) | Pescador | 05-408-146 | Use para todas as etapas que envolvem a calmodulina-sepharose contas |
Referências
- Vincenzi, F. F. Calmodulin in the regulation of intracellular calcium. Proc. West Pharmacol Soc. 22, 289-294 (1979).
- Cheung, W. Y. Calmodulin plays a pivotal role in cellular regulation. Science. 207, 19-27 (1980).
- Zhang, M., Tanaka, T., Ikura, M. Calcium-induced conformational transition revealed by the solution structure of apo calmodulin. Nat. Struct. Biol. 2, 758-767 (1995).
- Alexander, K. A., Wakim, B. T., Doyle, G. S., Walsh, K. A., Storm, D. R. Identification and characterization of the calmodulin-binding domain of neuromodulin, a neurospecific calmodulin-binding protein. J. Biol. Chem. 263, 7544-7549 (1988).
- Huang, K. P., Huang, F. L., Chen, H. C. Characterization of a 7.5-kDa protein kinase C substrate (RC3 protein, neurogranin) from rat brain. Arch. Biochem. Biophys. 305, 570-580 (1993).
- Bahler, M., Rhoads, A. Calmodulin signaling via the IQ motif. FEBS Lett. 513, 107-113 (2002).
- Routtenberg, A. Protein kinase C activation leading to protein F1 phosphorylation may regulate synaptic plasticity by presynaptic terminal growth. Behav. Neural. Biol. 44, 186-200 (1985).
- Zhong, L., Cherry, T., Bies, C. E., Florence, M. A., Gerges, N. Z. Neurogranin enhances synaptic strength through its interaction with calmodulin. EMBO J. 28, 3027-3039 (2009).
- Needham, D. M. Myosin and adenosinetriphosphate in relation to muscle contraction. Biochim. Biophys. Acta. 4, 42-49 (1950).
- Hathaway, D. R., Adelstein, R. S. Human platelet myosin light chain kinase requires the calcium-binding protein calmodulin for activity. Proc. Natl. Acad. Sci. U.S.A. 76, 1653-1657 (1979).
- Fukunaga, K., Yamamoto, H., Matsui, K., Higashi, K., Miyamoto, E. Purification and characterization of a Ca2+- and calmodulin-dependent protein kinase from rat brain. J. Neurochem. 39, 1607-1617 (1982).
- Yang, S. D., Tallant, E. A., Cheung, W. Y. Calcineurin is a calmodulin-dependent protein phosphatase. Biochem. Biophys. Res. Commun. 106, 1419-1425 (1982).
- Huestis, W. H., Nelson, M. J., Ferrell, J. E. J. Calmodulin-dependent spectrin kinase activity in human erythrocytes. Prog. Clin. Biol. Res. 56, 137-155 (1981).
- Yamniuk, A. P., Vogel, H. J. Calmodulin's flexibility allows for promiscuity in its interactions with target proteins and peptides. Mol. Biotechnol. 27, 33-57 (2004).
- Zhong, L., Kaleka, K. S., Gerges, N. Z. Neurogranin phosphorylation fine-tunes long-term potentiation. Eur. J. Neurosci. 33, 244-250 (2011).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados