A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
הנפתח של calmodulin מחייב חלבונים
In This Article
Summary
Calmodulin (רמ"א) הנפתח assay היא דרך יעילה לחקור את האינטראקציה של CAM עם חלבונים שונים. שיטה זו משתמשת Cam-sepharose חרוזים לצורך ניתוח יעיל ספציפי של Cam-binding חלבונים. זה מספק כלי חשוב לחקור איתות קאם פונקציה הסלולר.
Abstract
סידן (Ca 2 +) הוא יון חיוני בוויסות תפקוד הסלולר באמצעות מגוון של מנגנונים. הרבה Ca 2 + איתות מתווכת באמצעות חלבון וסידן מחייב המכונה 1,2 (רמ"א) calmodulin. CAM הוא מעורב במספר רמות כמעט בכל תהליכים תאיים, כולל אפופטוזיס, חילוף החומרים, התכווצות שרירים חלקים, הפלסטיות הסינפטית, צמיחה עצב, דלקת את התגובה החיסונית. מספר חלבונים מסייעים לווסת מסלולים אלו באמצעות האינטראקציה שלהם עם קאם. רבים אינטראקציות אלה תלויים קונפורמציה של CAM, השונה במובהק כאשר חייב Ca 2 + (Ca 2 +-CAM) בניגוד למצב Ca 2 +-free שלה (ApoCaM) 3.
בעוד שרוב החלבונים היעד לאגד Ca 2 +-CAM, חלבונים מסוימים רק לאגד ApoCaM. חלק CAM לאגד דרך תחום IQ שלהם, כולל 4 neuromodulin, neurogranin (נג) 5, ו myosins מסוימים 7, פונקציה postsynaptic 8, 9 ו - התכווצות שרירים, בהתאמה. יכולתם לקשור ולשחרר CAM בהעדר או נוכחות של Ca 2 + הוא מכריע את תפקידם. לעומת זאת, חלבונים רבים רק לאגד Ca 2 +-CAM ודורשים זה מחייב הפעלה שלהם. דוגמאות כוללות שרירן קינאז שרשרת אור 10, Ca 2 + / CAM תלויי קינאז (CaMKs) 11 ו phosphatases (למשל calcineurin) 12, 13 ו spectrin קינאז, אשר יש מגוון של השפעות ישירות או במורד 14.
ההשפעות של חלבונים אלה על תפקוד הסלולר הם בדרך כלל תלויה ביכולתם להיקשר CAM באופן + תלויות Ca 2. לדוגמה, בדקנו את הרלוונטיות של הכריכה NG-CAM בתפקוד סינפטי וכיצד מוטציות שונות משפיעות זו מחייבת. אנחנו שנוצר קון GFP-tagged נגstruct עם מוטציות ספציפיות בתחום-IQ כי תשנה את יכולתו של נג להיקשר CAM באופן + תלויות Ca 2. המחקר של אלה מוטציות שונות נתנו לנו לרדת לעומקה של תהליכים חשובים מעורב בתפקוד סינפטי 8,15. עם זאת, מחקרים כאלה, חיוני להוכיח כי החלבונים מוטציה יש מחייב שינוי צפוי CAM.
כאן, אנו מציגים שיטה לבדיקת יכולתה של חלבונים להיקשר קאם נוכחות או היעדר של Ca 2 +, באמצעות CaMKII ו נג כדוגמאות. שיטה זו היא סוג של זיקה כרומטוגרפיה המכונה assay CAM הנפתח. היא משתמשת Cam-Sepharose חרוזים לבדוק חלבונים הנקשרים CAM ואת ההשפעה של Ca 2 + על זה מחייב. זה הזמן הרבה יותר יעיל דורש פחות חלבון ביחס כרומטוגרפיה בעמודה מבחני אחרות. בסך הכל, זה מספק כלי רב ערך כדי לחקור Ca 2 + / CAM איתות וחלבונים כיteract עם קאם.
Protocol
עיין באיור 1 עבור סכמטית בסיסית של תחילת ההליך עם homogenate. זמן משוער של הכנת תמציות הסלולר elution של רמ"א הנכנס חלבונים הוא כ 6-7 שעות.
1. רקמות הכנה
- הזרק פרוסות בהיפוקמפוס organotypic בווירוס המכיל פלסמיד ביטוי חלבון רקומביננטי של עניין (בדוגמה זו, ירוק ניאון (GFP), מתויג חלבון נג) ולאפשר רקמות לבטא חלבון לילה.
- כ 12 עד 18 שעות לאחר ההזרקה ויראלי (תלוי בזמן ביטוי ויראלי), להכין לאסוף את הרקמה. הוסף חוצץ לנתיחה 1mL (גלוקוז 10 מ"מ, 4 מ"מ KCl, NaHCO3 26mM, סוכרוז 233mM, MgCl 5mm 2, 1mm CaCl 2, ו - 0.1% פנול אדום, בגז עם 5% CO 2 95% O 2) על צלחת פטרי. העברת רקמה להכניס תרבותי / צלחת פטרי ולהוסיף למאגר לנתיחה 2ml להכניס את להטביע את הרקמה.
- הקולקטיביתלא רקמה בהיפוקמפוס organotypic (בין 5 ל 10 פרוסות) על ידי מגרד בעדינות ברקמה חופשית של הממברנה להכניס באמצעות אזמל. באופן ספציפי בהסרת אזור מסוים של עניין (למשל CA1) היא גם אופציה. העברת רקמה מושעה לצינור microcentrifuge 1.5mL באמצעות הפוכה פיפטה פסטר.
- צנטריפוגה דגימות RCF 1500 דקות 1 להפריד רקמה למאגר לנתיחה. הסר בזהירות את supernatant על ידי שאיפה. הקפד לא להפריע גלולה.
- במשך כל פרוסה בשימוש, להוסיף 30-60 μL של חיץ homogenization (NaCl 150mm, 20mm טריס pH 7.5, 1mm DTT, 1μg/mL leupeptin, 1μg/mL chemostatin, 1μg/mL antipain, pepstatin 1μg/mL, ו -1% טריטון X -100) לרקמות ו homogenize ביסודיות עם העלי.
- על מנת להסיר שאריות הסלולר, בצנטריפוגה homogenate הנותרים בבית RCF 1100 עבור 10 דקות ובזהירות להסיר את supernatant על ידי שאיפה, תוך הימנעות מזיהום של גלולה.
- קחו 10% supernatant כפי מדגם של הקלט (לדוגמה 1). חנות supernatant הנותרים על הקרח במהלך תקופת ההכנה של Cam-sepharose חרוזים לשימוש בשלב 3.
הערה: רקמה משמש כאן פרוסות בהיפוקמפוס organotypic. עם זאת, אפשר להשתמש בנוירונים ניתק או כל מערכת אחרת culturing התא. במקרה כזה, להתחיל בשלב 1.4 לאחר איסוף רקמת שלך באופן הולם.
2. הכנת חרוזי עבור הנפתח
בטיפול חרוזים, חשוב להציל את החרוזים למקסם את היעילות של התגובות ידי מניעת חרוזים מהתייבשות על דפנות הצינור. כדי לעשות זאת, עדיף לסובב הצינורות שלך בצד שלהם, מה שמאפשר פתרון להרטיב את החרוזים על קירות של הצינור, מיד לפני צנטריפוגה.
- עבור כל הנפתח, פיפטה 400 μL של calmodulin-Sepharose חרוזים מושעה לתוך צינור microcentrifuge 2 מ"ל עם יחסית flat-התחתונה על מנת למקסם את שטח הפנים ואת האינטראקציה של פתרונות שלך עם חרוזים במהלך incubations שלך.
- צנטריפוגה חרוזים ב RCF 21,000 למשך 30 שניות ובזהירות להסיר את supernatant על ידי שאיפה. הקפד לא להפריע חרוזים.
- כדי לשטוף את חרוזים, להוסיף 100 μL של למאגר homogenization בהתאמה המכיל גם 2 מ"מ CaCl 2 לאלה בשימוש הנפתח Ca 2 +-CAM חלבונים מחייב 2 mM EDTA (א chelator ידוע Ca 2 +) עבור חרוזים והורידה ApoCaM חלבונים מחייב. לטפוח בעדינות את הצינור מחדש להשעות חרוזים צנטריפוגות ב RCF 1500 דקות 1. הסר בזהירות את supernatant על ידי שאיפה, מוודא שלא להפריע את החרוזים.
הערה: כל השלבים השאיפה, מומלץ להשתמש קצה פיפטה שיש לו פתיחה נאה (למשל טעינת טיפים ג'ל) כדי לאפשר הסרה של פתרון מבלי להסיר חרוזים.
3. Cam-sepharose מחייב של חלבונים
- פיצול supernatant שלך לתוך שני תנאים המכיל נפח שווה. בהתאם למצבך, להוסיף את הכמות המתאימה של CaCl 2 או EDTA עד כדי supernatant שלך ריכוז 2 מ"מ כל אחד.
- הוסף supernatant משלב 1.7 כדי לרחוץ במאגר חרוזים homogenization המקביל. לטפוח בעדינות את הצינור לערבב.
- דגירה דגימות 4 מעלות צלזיוס במשך 3 שעות על שייקר. Re-להשעות חרוזים כל 30 דקות בערך כדי להגביר את היעילות של הכריכה.
- צינור צנטריפוגה המכילה דגימות וחרוזים ב RCF 1500 דקות 3.
- קח 50μL של supernatant כמדגם של חלבון מאוגד (מדגם 2) ו בזהירות להסיר את supernatant הנותרים על ידי שאיפה וזורקים.
- לשטוף חרוזים שלוש פעמים כמתואר צעד 2.3 באמצעות 100μL של חיץ homogenization בהתאמה.
4. Elution
- הוסף 50μL של חיץ elution (50mm טריס-HCl pH 7.5, ו 150mm NaCl) המכיל את המצב ההפוך (10mm CACL 2 או 10mm EDTA) על חרוזים. לדוגמה, דגימות שהיו הומוגני וכרוך במאגר המכיל Ca 2 + הם eluted במאגר elution המכיל EDTA ולהיפך.
אופציונלי: התחממות החיץ elution עד 37 ° C לפני הוספת חרוזים עשוי לשפר את התשואה.
- דגירה פתרון עם חרוזים בטמפרטורת החדר למשך 30 דקות על שייקר. מערבבים בעדינות את החרוזים על ידי הקשה על הצינור על כל 5 דקות.
- צנטריפוגה חרוזים ב RCF 1500 דקות 3 ובזהירות להסיר את 50μL של supernatant לחלבון כבול (מדגם 3) על ידי שאיפה. הקפד לא להפריע חרוזים.
- הוסף חוצץ טעינת חלבון לכל דגימות (כלומר, homogenate מאוגד וכרוך חלבון, כמו גם אלה עדיין קשורות עם חרוזים).
הערה: כדי למקסם את elution (במיוחד במקרה של elution לא יעיל), להוסיף 50μL של למאגר elution המתאים (למשל הוספת buf המכיל EDTAfer כדי חרוזים כבול CaCl 2) על חרוזים לפני החימום דגימות כדי לסייע elute כל חלבון חייב הנותרים וחזור על שלבים המתוארים 4.3 להסיר חלבונים מחויב הנותרים.
5. SDS-PAGE ומערב כתם
התנהגות SDS-PAGE ולנתח באמצעות כתם המערבי על ידי חיטוט לחלבון שלך עניין בדיקה של חלבון ידוע להיקשר CAM במצב ההפוך כביקורת חיובית.
6. נציג תוצאות
איור 2B מראה דוגמה של assay-CAM הנפתח בדיקה מחייב CAM של NG-GFP מתויג לעומת נג אנדוגני. כדי לעשות זאת, GFP-נג היה ביטוי יתר של פרוסות בהיפוקמפוס organotypic שלנו לילה ואת רקמת היה הומוגני. Homogenate הודגר עם קאם-sepharose חרוזים בנוכחות או Ca 2 + או EDTA. הקלט Homogenate מראה כי ה-GFP-נג התבטא בנוסף נג אנדוגני Ca 2 + / CAM תלויי קינאז II(CaMKII). כצפוי מבוסס על הכריכה הידועה של נג אנדוגני (מאויר איור 2A)., GFP-tagged נג היה eluted בהעדר Ca 2 + (חלבון EDTA כבול) ו מאוגד בנוכחות Ca 2 + (איור 2B) . לעומת זאת, השליטה, CaMKII, היה eluted רק בנוכחות Ca 2 + (חלבון קשור) היה מאוגד בהעדרה (EDTA). זה מראה את החרוזים CAM תיפקדו כראוי elutions היו יעילים. והכי חשוב, זה מראה כי ה-GFP-נג נקשר ApoCaM באופן דומה לטופס אנדוגני, טוען כי את תג ה-GFP לא לשנות את הפונקציה של חלבון רקומביננטי שלנו.
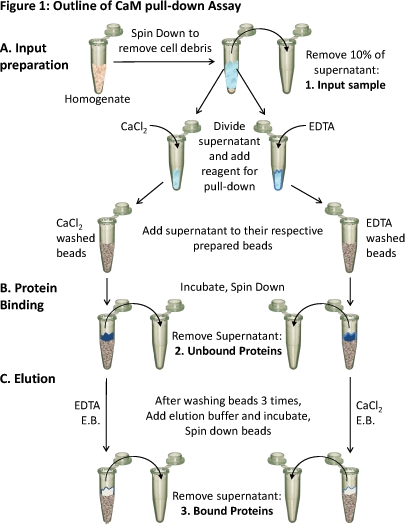
1. באיור המתאר של CAM הנפתח assay
(א) homogenate רקמות הוא הסתובב כלפי מטה כדי להסיר הפסולת התאית. כ -10% supernatant הוא נלקח מדגם של הקלט (1). Supernatant הנותר מתחלק שווה בשווה עבור שונההתנאים ואת ריאגנטים המתאימים (CaCl 2 או EDTA) מתווספים מבחן מחייב בתנאים אלה. כל supernatant (המכיל גם CaCl 2 או EDTA) נטען על גבי Cam-sepharose חרוזים מוכן בהתאמה ו (ב) מודגרות לאפשר מחייב. חלבונים מאוגד מוסרים (2) ו - (ג) את החלבונים כבול (3) הם eluted off של חרוזים באמצעות חיץ elution (EB) המכיל את המצב ההפוך כאשר מחייב. הרכב החלבונים של שלושת דגימות חלבון ניתן לנתח באמצעות SDS-PAGE וניתוח המערבי כתם.
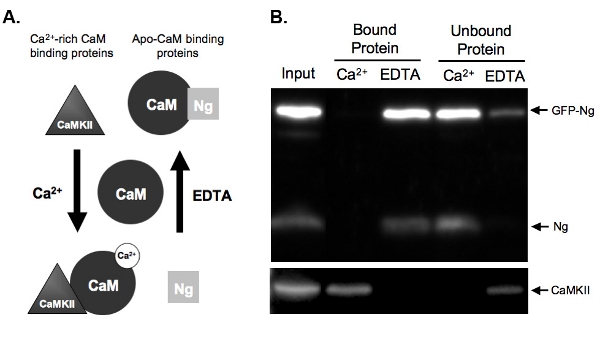
2. איור א ') סכמטי של Ca 2 + תלויות מחייב CAM ו elution ב הנפתח דוגמאות assay מקבלים שני סוגי חלבון אשר נקלטות קאם Ca 2 + תלויות בדרך. Neurogranin (נג) מייצג חלבונים הנקשרים apo-CAM ו CaMKII מייצג חלבונים אשר נקלטות על ידי Ca 2 + עשירCAM. CAM מוצג במצב שלה ניתק לפני הדגירה עם חלבונים homogenate. מודגרות לאחר בתנאי גבוה Ca 2 + ריכוזים (2 מ"מ) או בנוכחות Ca 2 + chelator, EDTA (2 מ"מ), חלבונים יהיה לאגד CAM בהתאם. נג נקשר CAM במצב EDTA כפי שיש לא מעט Ca 2 + בהווה, יהיה eluted את Cam-sepharose חרוזים בנוכחות Ca 2 +. CaMKII, לעומת זאת, היה לאגד CAM בנוכחות כמויות גבוהות של Ca 2 + והיה לנתק פעם + 2 Ca היה chelated.
ב) תוצאות של CAM למשל הנפתח assay. נתון זה מדגים את התוצאה הסופית הצפויה של Cam-sepharose לנתץ עם דגימות נחקר במשך נג ו CaMKII. הן נג אנדוגני ו-GFP נג נמצאים בסמטאות של חלבונים חייב CAM בנוכחות EDTA. נג לא קשור כאשר דגימות מודגרת עם קאם בנוכחות Ca 2 +, הוכחת כי Nגרם בלבד נקשר apo-CAM. בקרה חיובית שלנו, CaMKII, מצד שני, נקשר CAM רק בנוכחות Ca 2 +.
Discussion
פרוטוקול בתנאי מנצל Cam-sepharose חרוזים לחקור את Ca 2 +-התלות של Cam-binding חלבונים. חלבונים רבים לאגד CAM באופן + תלויות Ca 2. אינטראקציות אלה הם בעלי חשיבות רבה בהתחשב במספר CAM מחייב חלבונים תפקיד קריטי שלהם מסלולי איתות רבים. בפרוטוקול זה, Cam-sepharose חרוזים משמשים נפ...
Disclosures
אין ניגודי אינטרסים הכריז.
Acknowledgements
המחברים מבקשים להודות טיפאני שרי עזרתה אופטימיזציה בפרוטוקול זה. עבודה זו מומנה על ידי המכון הלאומי להזדקנות (AG032320), כמו גם קידום ויסקונסין בריא.
Materials
| מוצר | חברה | מספר קטלוגי | הערות |
| Calmodulin-Sepharose חרוזים | GE Healthcare | 17-0529-01 | |
| Anti-CamKII אלפא | Sigma-Aldrich | C6974 | |
| Anti-neurogranin | Millipore | 07-425 | |
| טוען ג'ל Pipet טיפים | דיג | 02-707-138 | השתמש השאיפה של supernatants |
| Microcentrifuge צינורות (2.0 מ"ל) | דיג | 05-408-146 | השתמש עבור כל השלבים הכרוכים calmodulin-sepharose חרוזים |
References
- Vincenzi, F. F. Calmodulin in the regulation of intracellular calcium. Proc. West Pharmacol Soc. 22, 289-294 (1979).
- Cheung, W. Y. Calmodulin plays a pivotal role in cellular regulation. Science. 207, 19-27 (1980).
- Zhang, M., Tanaka, T., Ikura, M. Calcium-induced conformational transition revealed by the solution structure of apo calmodulin. Nat. Struct. Biol. 2, 758-767 (1995).
- Alexander, K. A., Wakim, B. T., Doyle, G. S., Walsh, K. A., Storm, D. R. Identification and characterization of the calmodulin-binding domain of neuromodulin, a neurospecific calmodulin-binding protein. J. Biol. Chem. 263, 7544-7549 (1988).
- Huang, K. P., Huang, F. L., Chen, H. C. Characterization of a 7.5-kDa protein kinase C substrate (RC3 protein, neurogranin) from rat brain. Arch. Biochem. Biophys. 305, 570-580 (1993).
- Bahler, M., Rhoads, A. Calmodulin signaling via the IQ motif. FEBS Lett. 513, 107-113 (2002).
- Routtenberg, A. Protein kinase C activation leading to protein F1 phosphorylation may regulate synaptic plasticity by presynaptic terminal growth. Behav. Neural. Biol. 44, 186-200 (1985).
- Zhong, L., Cherry, T., Bies, C. E., Florence, M. A., Gerges, N. Z. Neurogranin enhances synaptic strength through its interaction with calmodulin. EMBO J. 28, 3027-3039 (2009).
- Needham, D. M. Myosin and adenosinetriphosphate in relation to muscle contraction. Biochim. Biophys. Acta. 4, 42-49 (1950).
- Hathaway, D. R., Adelstein, R. S. Human platelet myosin light chain kinase requires the calcium-binding protein calmodulin for activity. Proc. Natl. Acad. Sci. U.S.A. 76, 1653-1657 (1979).
- Fukunaga, K., Yamamoto, H., Matsui, K., Higashi, K., Miyamoto, E. Purification and characterization of a Ca2+- and calmodulin-dependent protein kinase from rat brain. J. Neurochem. 39, 1607-1617 (1982).
- Yang, S. D., Tallant, E. A., Cheung, W. Y. Calcineurin is a calmodulin-dependent protein phosphatase. Biochem. Biophys. Res. Commun. 106, 1419-1425 (1982).
- Huestis, W. H., Nelson, M. J., Ferrell, J. E. J. Calmodulin-dependent spectrin kinase activity in human erythrocytes. Prog. Clin. Biol. Res. 56, 137-155 (1981).
- Yamniuk, A. P., Vogel, H. J. Calmodulin's flexibility allows for promiscuity in its interactions with target proteins and peptides. Mol. Biotechnol. 27, 33-57 (2004).
- Zhong, L., Kaleka, K. S., Gerges, N. Z. Neurogranin phosphorylation fine-tunes long-term potentiation. Eur. J. Neurosci. 33, 244-250 (2011).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved