このコンテンツを視聴するには、JoVE 購読が必要です。 サインイン又は無料トライアルを申し込む。
Method Article
プルダウンカルモジュリン結合タンパク質の
要約
カルモジュリン(CaM)プルダウンアッセイは、様々なタンパク質とカルモジュリンの相互作用を調査するために効果的な方法です。このメソッドは、CAM -結合タンパク質の効率的かつ特定の分析のためのCaM -セファロースビーズを使用しています。これは、細胞機能のCAM信号を探索するための重要なツールが用意されています。
要約
カルシウム(Ca 2 +)は、さまざまなメカニズムを通じて細胞機能の調節に重要なイオンで す。多くのCa 2 +のシグナリングは、カルモジュリン(CaM)1,2として知られているカルシウム結合タンパク質によって媒介される。 CAMは、アポトーシス、代謝、平滑筋収縮、シナプス可塑性、神経の成長、炎症と免疫応答を含むほぼすべての細胞プロセス、内の複数のレベルで関与している。タンパク質の数は、CAMとの相互作用を介してこれらの経路を調節するのに役立ちます。これらの相互作用の多くは、Ca 2にバインドされたときに明らかに異なっているCAMのコンフォメーション、+(のCa 2 + - CaMの)としてのCa 2 + -フリー状態(ApoCaM)3とは対照的に依存する。
ほとんどの標的タンパク質は、Ca 2 + - CaMのをバインドしながら、特定のタンパク質だけApoCaMに結合する。ニューロ4、ニューログラニン(呉)5、および特定のミオシンを含む彼らのIQ -ドメインを介して、いくつかのバインドCAM、 7、シナプス機能8、および筋収縮9の重要な役割を果たすことが示されている。結合し、Ca 2 +の存在下または存在下でCAMをリリースする+能力は、それらの機能に極めて重要である。対照的に、多くのタンパク質は唯一のCa 2 + - CaMの結合し、それらの活性化のため、このバインディングを必要とする。例としては、ミオシン軽鎖キナーゼ10のCa 2 + /カルモジュリン依存性キナーゼ(CaMKs)11とホスファターゼ(例えばカルシニューリン)12、及び直接的および下流効果14のバリエーションがスペクトリンキナーゼ13を 、含まれています。
細胞機能に対するこれらのタンパク質の効果は、通常のCa 2 +依存的にCAMに結合する能力に依存しています。例えば、我々は、シナプス機能とどのように異なる突然変異は、この結合に影響を与えるのNG - CaMの結合の妥当性をテストした。我々は、GFPタグ付き伍CONを生成のCa 2 +依存的にCAMをバインドするために呉の能力を変更するようなIQ -ドメイン内の特定の変異を持つ構造体。これらの異なる突然変異の研究は、シナプス機能8,15に関与する重要なプロセスに私たちに偉大な洞察力を与えた。しかし、このような研究で、それは変異タンパク質が予想されるのCaMへの結合を変更していることを証明するために不可欠です。
ここで、我々は、例としてCaMKIIとngを使用して、Ca 2 +の存在下または非存在下でCAMに結合するタンパク質の能力をテストするための手法を提案する。このメソッドは、CaMとプルダウンアッセイと呼ばれるアフィニティークロマトグラフィーの形です。それは、CaMと+この結合に対するCa 2 +の影響に結合するタンパク質をテストするためのCaM -セファロースビーズを使用しています。それは、効率的なかなり多くの時間であり、カラムクロマトグラフィーおよび他のアッセイの相対少ない蛋白質を必要とします。完全に、これはでているのCa 2 + /カルモジュリンのシグナル伝達やタンパク質を探索するために貴重なツールを提供します。CAMとteract。
プロトコル
ホモジネートで始まる手続きの基本的な回路図は図1を参照してください。細胞抽出物の作成からCAM -結合タンパク質の溶出に要する時間は約6〜7時間です。
1。組織の準備
- 目的の組換えタンパク質を発現するプラスミドを含有するウイルスと器官型海馬スライス(この例では、緑色蛍光タンパク質(GFP)タグ付きng)を注入し、組織が一晩タンパク質を発現することができます。
- ウイルス注射後約12〜18時間(ウイルス発現時間に応じて)、組織を収集するための準備。ペトリ皿に1mLの解剖バッファー(10mMのグルコース、4mmのKClを、26ミリメートルNaHCO3水溶液、233mMスクロース、5%CO 2 95%O 2でガス処刑さ5mMのMgCl 2を 、1mMのCaCl 2で 、0.1%フェノールレッドを、)を追加します。ペトリ皿に培養組織/インサートを移し、水没に挿入組織に2mLの解剖のバッファを追加します。
- Collec軽くメスを用いてインサート膜の自由な組織を掻きによるT器官型海馬組織(5〜10スライス)。特に関心のある特定の地域(例:CA1)を削除することもオプションです。反転パスツールピペットを用いて1.5ml微量遠心チューブに中断組織を転送する。
- 解剖のバッファから別の組織への1分間に1,500 rcfで、サンプルを遠心分離します。慎重に吸引して上清を取り除く。ペレットを妨害しないことを確認してください。
- 使用するスライスごとに、均質化緩衝液(150MMのNaCl、20mMのトリスpH7.5、1mMのDTT、1μg/mlのロイペプチン、1μg/mlのchemostatin、1μg/mlのアンチパイン、1μg/mlのペプスタチン、および1%トリトンXの30〜60μLの組織-100)とは、乳棒で十分にホモジナイズする。
- 細胞残渣を除去するためには、10分1,100 rcfで、残りのホモジネートを遠心し、ペレットからの汚染を回避しながら慎重に吸引して上清を取り除く。
- 入力のサンプル(サンプル1)として、上清の10%を取る。ステップ3で使用するためのCAM -セファロースビーズの調製中に氷の上の残りの上清を保存する。
注:ここで使用される組織は器官型海馬スライスです。ただし、1つ解離神経細胞やその他の細胞培養システムを使用することができます。このような場合には、適切な方法であなたの組織を収集した後、ステップ1.4から始まります。
2。プルダウン用のビーズの調製
ビーズを扱うには、ビーズをサルベージし、チューブの両側に乾燥からビーズを防ぐことによって、反応の効率を最大化するために重要です。そのためには、それは解決策がすぐに遠心分離する前に、チューブの壁にビーズを湿らせることができます、彼らの側にしてチューブを回転させることが最善です。
- 各プルダウンのため、相対的にFLAで2 mlのマイクロチューブに懸濁カルモジュリン-セファロースビーズのピペット400μLあなたのインキュベーションの間のビーズを使用してソリューションの表面積との相互作用を最大化するためにT -底。
- 30秒21,000 RCFでビーズを遠心し、慎重に吸引して上清を取り除く。ビーズを邪魔しないようにしてください。
- ビーズを洗浄するためには、Ca 2プルダウンビーズ用+ - CaMの結合タンパク質および2mM EDTAを(既知のCa 2 +キレート剤)プルダウンするために使用されているものに2mMのCaCl 2のいずれかを含むそれぞれの均質化緩衝液100μLを加えるApoCaM結合タンパク質。ゆっくりと1分間に1,500 rcfで再びサスペンドビーズや遠心するチューブをタップします。慎重にビーズを邪魔しないことを確認し、吸引して上清を取り除く。
注:すべての吸引の手順については、それがビーズを除去することなく、溶液の除去を可能にするために微細な開口部を(例えば、ゲルローディングチップ)を持つピペットチップを使用することをお勧めします。
3。タンパク質のCAM -セファロース結合
- 等量を含む二つの条件にして上清を分割する。あなたの条件に応じて、各2 mMの濃度にして上清にCaCl 2またはEDTAの適切な量を追加します。
- ステップ1.7から対応する均質化緩衝液で洗浄したビーズに上清を追加。穏やかに混合するためにチューブをタップします。
- シェーカーで3時間4℃でサンプルをインキュベートする。結合の効率性を高めるために毎30分ほどビーズを再懸濁する。
- 3分1,500 rcfで、サンプルとビーズを含むチューブを遠心する。
- 非結合タンパク質のサンプル(サンプル2)として、上清の50μLを取り、慎重に吸引し、廃棄によって、残りの上清を取り除く。
- それぞれの均質化緩衝液の100μLを用いて、ステップ2.3で説明したようにビーズを3回洗浄する。
4。溶出
- 反対の条件(10mMのCを含む溶出バッファー(50mMトリス - 塩酸pH7.5の、および150mmのNaCl)の50μLを追加ビーズにACL 2または10mMのEDTA)。例えば、 カルシウムを含む緩衝液中でホモジナイズし、バインドされていたサンプルは+ EDTAおよびその逆を含む溶出バッファーで溶出されています。
オプション:° Cビーズに添加する前に37に溶出バッファーのウォーミングは、歩留まりを高めることができる。
- シェーカーで30分間室温でビーズを備えたソリューションをインキュベートする。静かに5分ごとに約チューブをタップしてビーズを混ぜる。
- 3分1,500 rcfでビーズを遠心し、慎重に吸引によって結合タンパク質(サンプル3)のために上清の50μLを削除します。ビーズを邪魔しないようにしてください。
- すべてのサンプル(すなわちホモジネート、非結合および結合蛋白質だけでなく、それらはまだビーズに結合)するタンパク質のローディングバッファーを追加。
注:、(特に非効率的な溶出の場合)溶出を最大限に対応する溶出バッファー(EDTAを含む、bufを追加するなどの50μLを追加する残りの結合蛋白質と、残りの結合タンパク質を除去するために4.3で説明した手順を繰り返しますを溶出するためのサンプルを加熱する前に、ビーズに)のCaCl 2にバインドされているビーズのFER。
5。 SDS - PAGEおよびウェスタンブロット
SDS - PAGEを行い、陽性対照として、反対の条件でCAMを結合することが知られているタンパク質の関心とプローブのタンパク質に対するプロービングによるウェスタンブロットを用いて分析する。
6。代表的な結果
図2Bは、内因性の呉に比べてGFP -タグ付き呉のCAMの結合をテストするのCaM -プルダウンアッセイの例を示しています。そのためには、GFP - NGは一晩私たちの器官型海馬切片において過剰発現され、組織をホモジナイズした。ホモジネートを、Ca 2 +またはEDTAのいずれかの存在下でカルモジュリン-セファロースビーズとインキュベートした。ホモジネート入力は、GFP - NGは、内因性NgとのCa 2 + /カルモジュリン依存性キナーゼIIに加えて、発現していることを示しています。(CaMKII)。として内因性NG(図2Aに示す)の既知の結合に基づいて予想される、呉はCa 2 +(EDTA結合タンパク質)の有無およびCa 2 +の存在下で結合していない(図2B)で溶出されたGFPタグ。対照的に、制御、CaMKIIは、唯一のCa 2 +(結合タンパク質)の存在下で溶出され、その不在(EDTA)にバインドされていないていた。これは、CAMのビーズが正しく機能していたと溶出が効率的であったことを示しています。最も重要なことは、GFP - ngは内因性のフォームに類似した方法でApoCaMに結合することをこのショーは、GFPタグが私たちの組換えタンパク質の機能を変化させなかったことを示唆している。
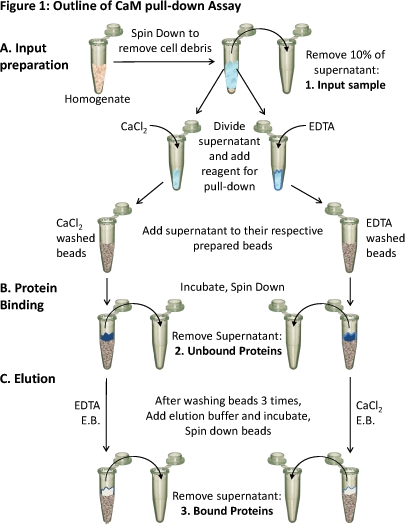
CaMとプルダウンアッセイの図1。概要
(A)組織ホモジネートは、細胞残渣を除去するためにスピンダウンされています。上清の約10%は、入力のサンプル(1)として取られます。残りの上清を別のために均等に分割されます条件と適切な試薬(CaCl 2またはEDTA)は、これらの条件で結合テストするために追加されます。 (CaCl 2またはEDTAのいずれかを含む)それぞれの上清には、それぞれ準備のCaM -セファロースビーズにロードされ、(B)結合できるようにインキュベートされる。未結合のタンパク質は削除されます(2)及び(C)結合蛋白質(3)結合として反対の条件を含む溶出バッファー(EB)を使用してビーズのオフ溶出される。これら3つのタンパク質試料のタンパク質組成はSDS - PAGEおよびウェスタンブロット分析を用いて分析することができます。
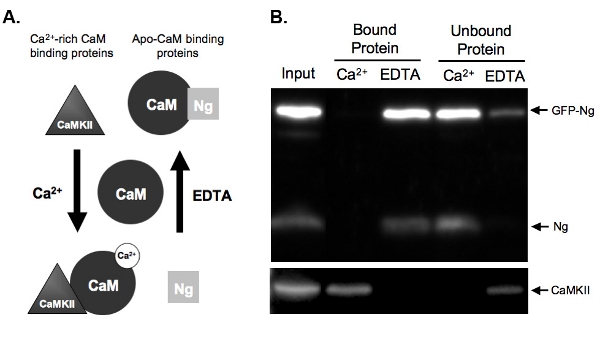
図2 A.)プルダウンアッセイの例ではCa 2 +依存性のCaMの結合と溶出の回路図は、Ca 2 +依存的にタンパク質の2種類のそのバインドCAMの与えられている。ニューログラニン(Ngは)バインドAPO - CaMとCaMKIIは、Ca 2 + -リッチに結合するタンパク質を表しているタンパク質を表しますカルモジュリン。 CAMは、ホモジネートのタンパク質とのインキュベーションに先立って、その解離状態で表示されます。一度高いCa 2 +濃度(2mM)をの条件下でインキュベートまたはCa 2 +キレート剤、EDTA(2mMの)の存在下で、タンパク質は、それに応じてCAMにバインドします。 NgはないのCa 2 +現在はほとんどがあるとしてEDTAの条件でCAMを結合し、Ca 2 +の存在下でのCaM -セファロースビーズから溶出される。 CaMKIIは、しかし、 カルシウムの多量の存在下でCAMにバインドします+とCa 2 +をキレート化された後に解離するでしょう。
B.)例CaMとプルダウンアッセイの結果。この図は、CAM -セファロースの予想される最終結果サンプルNgとCaMKII用プローブでプルダウンを示しています。内因性NgとGFP - NGの両方は、EDTAの存在下でCAMに結合したタンパク質のレーンに存在する。サンプルはそのNを示す、Ca 2 +の存在下でカルモジュリンとインキュベートしているときにンがバインドされgは唯一のアポ- CAMをバインドします。私たちのポジティブコントロール、CaMKIIは、その一方で、唯一のCa 2 +の存在下でカルモジュリンと結合する。
ディスカッション
提供するプロトコルは、CAM -結合蛋白質のCa 2 + -依存性を調査するようにCAM -セファロースビーズを利用しています。多くのタンパク質は、Ca 2 +依存的にカルモジュリンを結合する。これらの相互作用は、多くのシグナル伝達経路におけるカルモジュリン結合タンパク質およびそれらの重要な役割の数は与えられた非常に重要です。このプロトコルでは、CAM -セファロースビー?...
開示事項
利害の衝突は宣言されません。
謝辞
著者は、このプロトコルを最適化する上で彼女の助けでティファニーチェリーに感謝したいと思います。この作品は、国立老化研究所(AG032320)だけでなく、健康なウィスコンシン州を進めることによって資金を供給された。
資料
| 製品 | 会社 | カタログ番号 | ノート |
| カルモジュリンセファロースビーズ | GEヘルスケア | 17-0529-01 | |
| アンチCamKIIアルファ | シグマアルドリッチ | C6974 | |
| 抗ニューログラニン | ミリポア | 07から425 | |
| ゲルローディングピペットチップ | フィッシャー | 02-707-138 | 上清の吸引のために使用します。 |
| マイクロ遠心チューブ(2.0 mL)を | フィッシャー | 05-408-146 | カルモジュリン-セファロースビーズを含むすべてのステップのために使用します。 |
参考文献
- Vincenzi, F. F. Calmodulin in the regulation of intracellular calcium. Proc. West Pharmacol Soc. 22, 289-294 (1979).
- Cheung, W. Y. Calmodulin plays a pivotal role in cellular regulation. Science. 207, 19-27 (1980).
- Zhang, M., Tanaka, T., Ikura, M. Calcium-induced conformational transition revealed by the solution structure of apo calmodulin. Nat. Struct. Biol. 2, 758-767 (1995).
- Alexander, K. A., Wakim, B. T., Doyle, G. S., Walsh, K. A., Storm, D. R. Identification and characterization of the calmodulin-binding domain of neuromodulin, a neurospecific calmodulin-binding protein. J. Biol. Chem. 263, 7544-7549 (1988).
- Huang, K. P., Huang, F. L., Chen, H. C. Characterization of a 7.5-kDa protein kinase C substrate (RC3 protein, neurogranin) from rat brain. Arch. Biochem. Biophys. 305, 570-580 (1993).
- Bahler, M., Rhoads, A. Calmodulin signaling via the IQ motif. FEBS Lett. 513, 107-113 (2002).
- Routtenberg, A. Protein kinase C activation leading to protein F1 phosphorylation may regulate synaptic plasticity by presynaptic terminal growth. Behav. Neural. Biol. 44, 186-200 (1985).
- Zhong, L., Cherry, T., Bies, C. E., Florence, M. A., Gerges, N. Z. Neurogranin enhances synaptic strength through its interaction with calmodulin. EMBO J. 28, 3027-3039 (2009).
- Needham, D. M. Myosin and adenosinetriphosphate in relation to muscle contraction. Biochim. Biophys. Acta. 4, 42-49 (1950).
- Hathaway, D. R., Adelstein, R. S. Human platelet myosin light chain kinase requires the calcium-binding protein calmodulin for activity. Proc. Natl. Acad. Sci. U.S.A. 76, 1653-1657 (1979).
- Fukunaga, K., Yamamoto, H., Matsui, K., Higashi, K., Miyamoto, E. Purification and characterization of a Ca2+- and calmodulin-dependent protein kinase from rat brain. J. Neurochem. 39, 1607-1617 (1982).
- Yang, S. D., Tallant, E. A., Cheung, W. Y. Calcineurin is a calmodulin-dependent protein phosphatase. Biochem. Biophys. Res. Commun. 106, 1419-1425 (1982).
- Huestis, W. H., Nelson, M. J., Ferrell, J. E. J. Calmodulin-dependent spectrin kinase activity in human erythrocytes. Prog. Clin. Biol. Res. 56, 137-155 (1981).
- Yamniuk, A. P., Vogel, H. J. Calmodulin's flexibility allows for promiscuity in its interactions with target proteins and peptides. Mol. Biotechnol. 27, 33-57 (2004).
- Zhong, L., Kaleka, K. S., Gerges, N. Z. Neurogranin phosphorylation fine-tunes long-term potentiation. Eur. J. Neurosci. 33, 244-250 (2011).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved