需要订阅 JoVE 才能查看此. 登录或开始免费试用。
Method Article
测量中晚期胚胎和新生小鼠左心室压力
摘要
测量左室压力在胚胎和新生小鼠(LV)的描述。压力测量插入到LV连接到一个充满液体的传感器,超声引导下针。必须小心维持正常的心脏功能,在实验协议。
摘要
血压显着增加脊椎动物在胚胎和出生后的发展。在小鼠,血流量首先是围绕胚胎一天(五)8.5 1检测。收缩期左心室(LV)压力是E9.5在2毫米汞柱和11毫米汞柱在E14.5 2。在这些中期萌芽阶段,LV是清晰可见,通过创血压测量胸壁肋骨和皮肤,因为没有得到充分的开发。在E14.5和出生(约E21号)的成像方法必须使用查看LV。出生后,平均动脉压力增大30 - 35 3 - 70毫米汞柱从产后天(P)2。超越P20的,可以测量血压与固态导管(即米勒或Scisense)。 P20的之前,这些导管有太大发展小鼠动脉和动脉血压测量必须用自定义拉塑料导管连接到充液压力传感器或玻璃micropipettes ATT痛伺服空压力传感器4。
我们最近的工作表明,血压增幅最大的中后期早在产后5-7小鼠胚胎发生。这种血压的大量增加,可能会影响发展的动脉平滑肌细胞(SMC)的表型和触发重要的机械传导事件。在人类疾病,地方发展动脉的性能是在细胞外基质蛋白(即马凡氏的综合症8和主动脉瓣上狭窄9)的缺陷损害血压,在此期间迅速变化可能有助于疾病的表型和严重程度通过在机械传导的改变信号。因此,重要的是要能够测量血压的变化,人类疾病的小鼠模型中后期胚胎和新生儿时期。
我们描述了在后期测量左室压力的方法胚胎(E18)和产后早期(小 - 20)小鼠。超声引导下,一个充满液体的压力传感器连接到一个针插入的LV。护理是采取维持正常的心脏功能,尤其是在实验协议的小鼠胚胎。有代表性的数据提出并讨论了该协议的限制。
研究方案
1。超声和压力系统
- 根据制造商的说明(VEVO 770,Visualsonics)的启动超声系统。填写适当的探针(年龄E18 - P7的= 708,年龄> P7的模型707B模型),用蒸馏水和连接的超声系统。探头放置在可调底座的大致方位,要获得一个LV长轴成像平台上安装鼠标,使LV尖向注射胳膊指出。
- 压力系统由一个充满液体的压力传感器,桥式放大器,数据采集系统和数据记录软件(LabChart)。三通旋塞,油管,鲁尔锁和软管倒钩连接组成。 20 ml注射器充满10%的肝素生理盐水冲洗一端。另一端连接到一根针和3毫升注射器的身体保持在针管注射的手臂(图1)作为外壳使用的修改。 校准与压力表压力传感器系统。
- 安装在超声系统注入手臂的针管和套管。中环站钳压力传感器,在成像平台的近似高度。将鼠标的年龄(年龄E18 - P3 = 30G,年龄> P3的= 25G)适当的针管一针。较小的针头得到更容易堵塞,更难以通过胸壁推进,有一个较慢的响应时间。因此,最大的针头大小,适合在LV腔用于各年龄段。
- 超声凝胶成像平台上放置一个土堆,仔细排队探头针,这样可以提前进入凝胶直接下的成像探针中心(图2)使用可调底座。针必须足够远低于探头穿刺探头盖,但足够接近内探测震源深度。如果有必要,可弯针,手工,所以它仍然在日Ë正确的飞机在其整个旅行。
- 保持对齐,收回针,并提高了成像探测成像平台上放置一个鼠标。冲洗针,以消除任何可能已进入尖端的凝胶。
2。鼠标准备
- 制度的动物护理和使用委员会已批准在本协议中的所有方法。定时怀孕的母亲(E18)或新生鼠(P1 - 20)持续吸入1.5%异氟醚麻醉。管道可以插入到一个标准的鼻锥,早日新生鼠(P1 - 15),以适应小头。
- 确保鼠标在背LV尖对注射手臂指向卧位超声系统成像平台。对于孕妇,应用超声的凝胶监测与心率附加心电图探测器的插入直肠温度计体温反馈控制。新生鼠过小F这些探测器,使心率监测在压力测量体温保持与外部的热灯。
- 从对孕妇的腹部或胸部的小老鼠用脱毛霜的头发。新生鼠(P1 - 10)不需要任何脱毛。
- 对于孕妇,剖开腹部,用解剖剪刀,弯钳。外部一个子宫角和地方纱布蘸温盐水。仔细地操纵胚胎,到适当的位置,获得的LV 1胸骨旁长轴观,用超声探头。这一边测量外其他子宫角前,在所有胚胎的压力。保留所有胚胎和定期此外温生理盐水湿润的母亲的腹部。
3。压力测量
- 地方预热,脱气超声凝胶,对胚胎或新生鼠。新生小鼠仍未ðepilated应该有少量的超声凝胶擦到自己的胸部前余下的超声凝胶应用,以提高耦合。降低成像探针和成像平台的角度调整,以获得最佳的胸骨旁左室长轴。不调整探头的角度,都将丢失,因为针对齐。
- 同时监测超声屏幕上LV的形象,慢慢推进针,直到它是探头的底部附近。调整针和探头的位置,如有必要,纠正对齐转变。轻轻用生理盐水冲洗针。开始录制压力数据和为零的与LabChart软件的压力传感器。传感器的漂移,温度和位置,所以重要的是它只是之前测量每个鼠标的压力为零。
- 慢慢地前进针,直到它可以在超声图像边缘,但不是在LV尚未。调整针的位置,如有必要,在进入的LV顶点。调整探头位置,如有必要,保持针的清晰图像。推进到LV流明(图3)针,而压力数据记录和监控的超声图像上的针位置。从压力传感器开始搏动录音证实管腔内的LV(图4)的位置。
- 如果针出现在LV腔,但不脉动压力的录音,用注射器的柱塞上的光自来水冲洗,直到压力增加(约5 - 10μL的体积)检测。这应该清除任何阻塞,可能会阻止一个准确的读数。如果压力读数仍然没有搏动,针头可能高于或低于正确的平面和不被插入到LV腔。缩回针头,用生理盐水,并提前再次刷新。如果搏动的读数仍然没有得到,移动到下一个鼠标。每个鼠标使用一种新的针。
- 成功的压力读数可从75%胚胎和新生小鼠的企图。读数应采取5 - 10分钟和鼠标的压力数据不应包括心跳率比预期有显着不同(图5A)。心率有显着影响心血管措施和心跳率的改变指示心脏窘迫的。胚胎窘迫通常发生在1 - 1.5小时后,第一个外在的子宫,所以速度是重要的,用于测量压力,在整个产仔。
4。代表结果
结果表明C57BL6J小鼠。在LV流明的图像如图3所示的P1鼠标针。针是必要的胸壁穿刺和获得LV的小管腔,但它显着增加的压力系统的响应时间。当近似压力逐步增加手动应用到系统中,时间达到67%的最大压力是0.067 SEc配合油管(最有可能的实时应用的压力步骤指示),0.105秒与25的的Ğ针和0.529秒与30克针。完整的描图4A和4C所示,可以看出在延迟达到最大压力。虽然响应时间慢的30G针,更好地捕获波形在胚胎和新生儿早期阶段,因为心率增加小鼠5岁。尽管这个限制,收缩压可以计算假设,真正的舒张(最小)的压力是零,和收缩压(最高)低压压力是两次平均LV压力,处于稳定状态的读数(图4B和4D确定)6。人们普遍认为,收缩期LV和动脉压力是相等的。如图5所示测量心率,并计算LV的E18和P14之间的不同年龄段的压力。

图1。连接三通旋塞,男(M)和女性(F)的鲁尔锁连接,软管倒钩,油管,注射器和针头的压力传感器的图像。

图2图像的设立成像探测(一)配合针。成像平台是LV尖,使鼠标正面临着注射手臂的旋转。探头安装在可调的立场,在必要的大致方向,以获得一个LV长轴图像。针管套管安装在注射的手臂。针推进到一个超声波凝胶丘上的成像平台,以确定适当的角度,以尊重成像探测(二)垂直和水平位置。
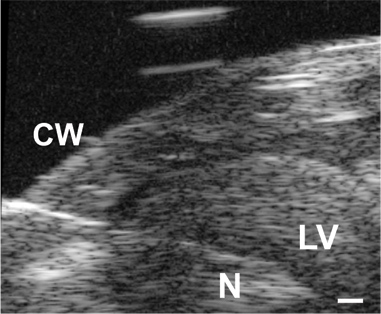
图3。针(N)的图像通过先进的胸壁(连续)到LV在P1鼠标流明。比例尺= 0.1毫米。
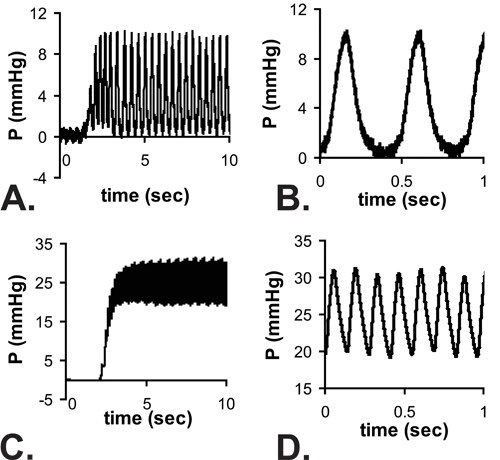
图4。范例脉动压力读数针进入LV的E18(一)和P14(三)鼠标。有一个在达到一个稳定的状态,由于针连接系统的响应时间延迟。在稳定状态的读数放大视图显示在B和D注最低E18低压压力接近零,但完整的波形从零到最大压力不能被记录在P14的小鼠的心跳率较高。平均压力测量稳态读数,假设LV收缩压= 2×平均压力。
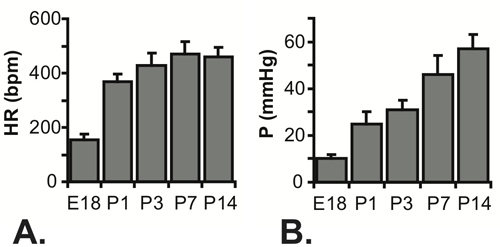
图5测量心跳率(A)和计算收缩期左室压力(B)为E18 - P14的小鼠。 n = P3的,E18,P1,22 5 7 23 P7和P14的16 5-7。
讨论
这里介绍的协议提供了一个LV的压力,在后期的胚胎和新生儿早期小鼠的测量方法。该协议的主要限制是压力系统的时间分辨率。压力信号衰减,因为它从LV旅行通过针传感器,不仅意味着可以记录压力值。最小的阻尼可以通过使用尽可能最大的针,但针必须在LV流明,适合不同年龄的小鼠。因为舒张压可近似为零,LV因此动脉收缩压,可以计算平均LV压力测量。虽然额外动脉变量将是理想的(...
披露声明
没有利益冲突的声明。
致谢
资助,这项工作的一部分,由NIH资助HL087653和HL105314。在博士罗伯特Mecham的实验室在华盛顿大学医学院的一些方法。
材料
| Name | Company | Catalog Number | Comments |
| 试剂/设备名称 | 公司 | 目录编号 | 评论 |
| 高分辨率超声系统 | visualsonics | VEVO 770 | 或其他适当的超声系统 |
| 高频超声探头 | visualsonics | 708和707B | |
| 成像平台和注射手臂 | visualsonics | 成像站2 | 心电图和温度反馈控制平台 |
| 压力传感器 | 公元仪器 | MLT 844 | |
| 桥式放大器 | 公元仪器 | ML221 | |
| 数据采集系统 | 公元仪器 | ML866 | |
| 数据记录软件 | 公元仪器 | LabChart | |
| 环站和钳 | 各供应商 | 在测量过程中要保持压力传感器 | |
| 三路活塞,带Luer连接,男性锁 | 科尔帕默 | 30600-02 | |
| 1/16“编号聚乙烯管材 | 科尔帕默 | 06408 | |
| 男性和女性luers W / 1/16“软管倒刺 | 科尔帕默 | 45510-50 45510-00 | |
| 24“在每年年底与男性和女性的鲁尔油管 | 科尔帕默 | 30600-60 | |
| 3日和10毫升的注射器 | BD公司 | ||
| 30和25G的针头 | BD公司 | 1.5英寸长 | |
| 大本钟压力计 | 里斯特 | 1456-100 | |
| 盐水 | 各供应商 | ||
| 肝素 | 各供应商 | ||
| 超声凝胶 | 帕克 | aquasonic 100 | |
| 头发卸妆乳液 | 奈尔 |
参考文献
- Ji, R. P. Onset of cardiac function during early mouse embryogenesis coincides with entry of primitive erythroblasts into the embryo proper. Circ. Res. 92 (2), 133-135 (2003).
- Ishiwata, T., Nakazawa, M., Pu, W. T., Tevosian, S. G., Izumo, S. Developmental changes in ventricular diastolic function correlate with changes in ventricular myoarchitecture in normal mouse embryos. Circ. Res. 93 (9), 857-865 (2003).
- Huang, Y., Guo, X., Kassab, G. S. Axial nonuniformity of geometric and mechanical properties of mouse aorta is increased during postnatal growth. Am. J. Physiol. Heart Circ. Physiol. 290 (2), H657-H664 (2006).
- Ishii, T., Kuwaki, T., Masuda, Y., Fukuda, Y. Postnatal development of blood pressure and baroreflex in mice. Auton. Neurosci. 94 (1-2), 34-41 (2001).
- Le, V. P., Knutsen, R. H., Mecham, R. P., Wagenseil, J. E. Decreased aortic diameter and compliance precedes blood pressure increases in postnatal development of elastin-insufficient mice. Am. J. Physiol. Heart Circ. Physiol. , (2011).
- Wagenseil, J. E. Reduced vessel elasticity alters cardiovascular structure and function in newborn mice. Circ. Res. 104 (10), 1217-1224 (2009).
- Wagenseil, J. E. The importance of elastin to aortic development in mice. Am. J. Physiol. Heart Circ. Physiol. 299 (2), H257-H264 (2010).
- Ramirez, F., Sakai, L. Y., Rifkin, D. B., Dietz, H. C. Extracellular microfibrils in development and disease. Cell. Mol. Life Sci. 64 (18), 2437-2446 (2007).
- Li, D. Y. Elastin point mutations cause an obstructive vascular disease, supravalvular aortic stenosis. Hum. Mol. Genet. 6 (7), 1021-1028 (1997).
- Roth, D. M., Swaney, J. S., Dalton, N. D., Gilpin, E. A., Ross, J. Impact of anesthesia on cardiac function during echocardiography in mice. Am. J. Physiol. Heart Circ. Physiol. 282 (6), H2134-H2140 (2002).
- Phoon, C. K. Imaging tools for the developmental biologist: ultrasound biomicroscopy of mouse embryonic development. Pediatr. Res. 60 (1), 14-21 (2006).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。