Un abonnement à JoVE est nécessaire pour voir ce contenu. Connectez-vous ou commencez votre essai gratuit.
Method Article
Mesure de la pression ventriculaire gauche à la fin de souris embryonnaires et néonatale
Dans cet article
Résumé
Mesure de la pression ventriculaire gauche (VG) chez la souris embryonnaires et néonatale est décrite. La pression est mesurée par l'insertion d'une aiguille reliée à un transducteur à remplissage de fluide dans le BT sous échographie. Des précautions doivent être prises pour maintenir une fonction cardiaque normale au cours du protocole expérimental.
Résumé
La pression artérielle augmente de façon significative au cours du développement embryonnaire et postnatal chez les animaux vertébrés. Chez la souris, le débit sanguin est le premier détectable autour du jour embryonnaire (E) 8.5 1. Systolique ventriculaire gauche (VG) la pression est de 2 mmHg à 11 mmHg et E9.5 à E14.5 2. A ces stades la mi-embryonnaires, le LV est clairement visible à travers la paroi thoracique pour les mesures de pression invasive parce que les nervures et la peau ne sont pas pleinement développés. Entre E14.5 et la naissance (environ E21) des méthodes d'imagerie doit être utilisée pour afficher le LV. Après la naissance, des augmentations moyennes de pression artérielle de 30 à 70 mmHg au jour postnatal (P) 2 - 35 3. Au-delà de P20, la pression artérielle peut être mesurée avec l'état solide (c.-à-cathéters Millar ou SCISENSE). Avant P20, ces cathéters sont trop gros pour développer les artères de souris et de la pression artérielle doit être mesurée à l'aide personnalisée tiré cathéters en plastique attachés à des transducteurs de pression remplis de liquide ou de verre 3 micropipettes attsouffrait d'asservissement des transducteurs de pression nulles 4.
Nos travaux récents ont montré que la plus forte augmentation de la pression artérielle se produit pendant les embryonnaire fin à la période postnatale précoce chez la souris 5-7. Cette forte augmentation de la pression artérielle peuvent influer sur des cellules musculaires lisses (SMC) phénotype dans les artères en développement et déclencher des événements importants mécanotransduction. Dans la maladie humaine, où les propriétés mécaniques des artères en voie de développement sont compromis par des défauts dans les protéines de la matrice extracellulaire (syndrome c.-à-Marfan 8 et une sténose aortique supravalvulaire 9) les changements rapides de la pression artérielle au cours de cette période peut contribuer à phénotype de la maladie et la gravité par des altérations dans la mécanotransduction signaux. Par conséquent, il est important de pouvoir mesurer les changements de pression artérielle au cours de la fin embryonnaire et la période néonatale dans des modèles murins de maladies humaines.
Nous décrivons une méthode pour mesurer la pression à la fin de LVembryonnaire (E18) et au début du post-natal (P1 - 20) chez la souris. Une aiguille attachée à un transducteur de pression remplie de fluide est insérée dans le LV sous échographie. On prend soin de maintenir une fonction cardiaque normale au cours du protocole expérimental, en particulier pour les souris embryonnaires. Les données représentatives sont présentées et les limites du protocole sont discutés.
Protocole
1. L'échographie et la pression du système
- Démarrez le système à ultrasons selon les instructions du fabricant (Vevo 770, Visualsonics). Remplir la sonde appropriée (âge E18 - P7 = modèle 708, l'âge> = P7 modèle 707B) avec de l'eau distillée et se connecter au système à ultrasons. Placez la sonde dans le support réglable à l'orientation approximative nécessaire pour obtenir une LV grand axe d'une souris monté sur la plate-forme d'imagerie de sorte que le sommet LV est pointé vers le bras d'injection.
- Le système de la pression se compose d'un transducteur de pression remplie de fluide, l'amplificateur de pont, le système d'acquisition de données et des logiciels d'enregistrement de données (LabChart). Les connexions se composent de trois voies robinets, tuyaux, seringues Luer et raccords cannelés. Seringue 20 ml est rempli avec une solution saline hépariné 10% pour le rinçage à une extrémité. L'autre extrémité se connecte à une aiguille et un corps de seringue 3 ml est modifiée pour une utilisation comme boîtier pour maintenir le tube d'aiguille dans le bras d'injection (figure 1).
- Calibrer le système transducteur de pression avec un manomètre.
- Monter le tube d'aiguille et le tubage dans le bras d'injection du système à ultrasons. Serrer le capteur de pression dans un support annulaire à la hauteur approximative de la plate-forme d'imagerie. Fixer une aiguille adaptée à l'âge de la souris (à l'âge E18 - P3 = 30G, l'âge> P3 = 25G) à la tubulure de l'aiguille. Les petites aiguilles obtenir bouché plus facile, il est plus difficile d'avancer à travers la paroi thoracique, et avoir un temps de réponse plus lent. Par conséquent, la plus grande taille qui correspond à l'aiguille dans la lumière BT est utilisé pour chaque âge.
- Placer un monticule de gel pour ultrasons sur la plate-forme d'imagerie et soigneusement aligner la sonde en utilisant la position réglable de sorte que l'aiguille peut être avancé dans le gel directement sous le centre de la sonde d'imagerie (figure 2). L'aiguille doit être assez loin en dessous de la sonde pour ne pas percer le couvercle de la sonde, mais assez proche pour être au sein de la profondeur de la sonde focale. Si nécessaire, l'aiguille peut être plié à la main de sorte qu'il demeure en ee bon plan tout au long de sa course.
- Maintenir l'alignement, rétracter l'aiguille et augmenter la sonde d'imagerie à placer une souris sur la plate-forme d'imagerie. Rincer l'aiguille afin d'éliminer tout gel qui peut avoir pénétré la pointe.
2. La préparation de la souris
- Toutes les méthodes indiquées dans le présent protocole ont été approuvés par le soin des animaux et du Comité institutionnel utilisation. Anesthésier une mère enceinte chronométré (E18) ou de la souris néonatale (P1 - 20) par inhalation continue de 1,5% d'isoflurane. Tube peut être inséré dans un cône de nez standard pour accueillir la tête d'un petit souris néonatale (P1 - 15).
- Fixez la souris pour la plate-forme d'imagerie du système à ultrasons dans une position décubitus dorsal avec le sommet LV pointant vers le bras d'injection. Pour les mères enceintes, appliquer échographie gel pour surveiller le rythme cardiaque avec le détecteur de joint ECG et insérez le thermomètre rectal pour un asservissement de la température du corps. Souriceaux nouveau-nés sont f trop petitou ces détecteurs, afin de fréquence cardiaque est surveillée pendant les mesures de pression et la température du corps est maintenue avec une lampe de chaleur externe.
- Enlever les poils de l'abdomen de la femme enceinte ou de la poitrine de la jeune souris avec une crème dépilatoire. Souriceaux nouveau-nés (P1 - 10) ne nécessitent pas de l'épilation.
- Pour les mères enceintes, ouvrir l'abdomen avec des ciseaux et des pinces à dissection courbes. Externaliser une corne utérine et le placer sur une gaze humidifiée avec une solution saline chaude. Soigneusement manipuler un embryon dans la bonne position pour obtenir une vue parasternale axe long de la LV en utilisant la sonde d'échographie. Mesurer la pression dans tous les embryons de ce côté avant l'externalisation de la corne utérine autre. Gardez tous les embryons et l'abdomen de la mère humide avec addition périodique de sérum physiologique chaud.
3. Mesure de la pression
- Lieu préchauffé, gel pour ultrasons dégazé sur la souris embryonnaire ou néonatale. Souriceaux nouveau-nés qui n'ont pas été dépilée devrait avoir une petite quantité de gel pour ultrasons frotté sur la poitrine avant que le gel reste ultrasons est appliqué pour améliorer couplage. Abaisser la sonde d'imagerie et ajuster l'angle de la plate-forme d'imagerie pour obtenir une vue optimale parasternale LV axe long. Ne pas régler l'angle de la sonde car l'alignement aiguille sera perdu.
- Tout en surveillant l'image sur l'écran LV ultrasons, lentement avancer l'aiguille jusqu'à ce qu'il soit à proximité du fond de la sonde. Ajustez la position de l'aiguille et la sonde, si nécessaire, pour corriger des changements d'alignement. Rincez délicatement l'aiguille avec une solution saline. Début des données de pression d'enregistrement et de mettre à zéro le transducteur de pression avec le logiciel LabChart. Le transducteur dérive avec la température et la position, il est donc important pour le zéro juste avant la mesure de pression dans chaque souris.
- Avancer lentement l'aiguille jusqu'à ce qu'il puisse être vu au bord de l'image échographique, mais pas encore dans le VG. Ajustez la position de l'aiguille, si nécessaire, pour entrer dans le LV à laapex. Ajustez la position de la sonde, si nécessaire, pour maintenir une image claire de l'aiguille. Faire avancer l'aiguille dans la lumière VL (figure 3), tout en enregistrant des données de pression et de suivi de l'emplacement d'aiguille sur l'image d'ultrasons. Le début d'enregistrements pulsatile du transducteur de pression confirme l'emplacement à l'intérieur du lumen VL (figure 4).
- Si l'aiguille semble être dans la lumière LV, mais ne sont pas des enregistrements de pression pulsatile, de niveau avec un robinet de lumière sur le piston de seringue, jusqu'à ce que une augmentation de pression est détectée (environ 5 à 10 volumes pl). Cela devrait éliminer toute obstruction qui peut empêcher d'obtenir une lecture précise. Si les lectures de pression ne sont pas encore pulsatile, l'aiguille peut être au-dessus ou au-dessous le bon plan et ne pas être inséré dans la lumière LV. Retrait de l'aiguille, rincer avec une solution saline, et avance à nouveau. Si les lectures sont pulsatiles toujours pas obtenu, passer à la souris à côté. Utilisez une nouvelle aiguille pour chaque souris.
- Des lectures de pression qui réussissent peuvent être obtenus à partir de 75% desles souris embryonnaires et néonatale tenté. Lectures devrait prendre 5 - 10 minutes chacune et les données de pression pour une souris ne devrait pas être inclus si les fréquences cardiaques sont nettement différent de celui attendu (figure 5A). La fréquence cardiaque a un effet significatif sur les mesures cardiovasculaires et les rythmes cardiaques altérés sont révélateurs de la détresse cardiaque. Détresse embryonnaire se produit habituellement 1 - 1,5 heures après l'externalisation d'abord l'utérus, si la vitesse est importante pour mesurer la pression dans une portée entière.
4. Les résultats représentatifs
Tous les résultats sont présentés pour les souris C57BL6J. Une image de l'aiguille dans la lumière BT pour une souris P1 dans la figure 3. L'aiguille est nécessaire à la perforation de la paroi thoracique et d'accéder à la petite lumière LV, mais il augmente de façon significative le temps de réponse du système de pression. Quand une augmentation de la pression approximative étape est appliquée manuellement au système, le temps pour atteindre 67% de la pression maximale est 0,067 soic avec la tubulure que (le plus probable indicatif du temps réel pour appliquer l'étape de pression), 0,105 sec avec une aiguille G 25 et 0.529 sec avec une aiguille G 30. Le retard dans la réalisation de pression maximale peut être vu dans les tracés complets présentés dans la figure 4A et 4C. Bien que le temps de réponse est plus lente avec l'aiguille 30G, la forme d'onde est mieux saisi les stades embryonnaires et néonatale précoce, car la fréquence cardiaque augmente avec l'âge chez la souris 5. Malgré cette limitation, la pression systolique peut être calculé en supposant que le LV vrai diastolique (minimale) de pression est nulle, et la pression systolique (maximale) de pression LV est de deux fois la pression moyenne LV à partir des valeurs à l'équilibre (figure 4B et 4D ) 6. Il est généralement admis que la systolique du ventricule gauche et les pressions artérielles sont égaux. Les pressions mesurées rythme cardiaque et calcule BT pour différents âges entre E18 et P14 sont présentés dans la figure 5.

Figure 1. Image du transducteur de pression avec joints à trois voies robinets, de sexe masculin (M) et femelles (F) des connexions de type luer lock, des barbes de tuyaux, tubes, seringues et aiguilles.

Figure 2. Image de l'. Mis en place pour aligner l'aiguille avec la sonde d'imagerie (A) La plate-forme d'imagerie est tourné de telle sorte que le sommet LV de la souris est confronté le bras d'injection. La sonde est montée dans le support réglable à l'orientation approximative nécessaire pour obtenir une LV long axe de l'image. Le boîtier tube aiguille est montée dans le bras d'injection. L'aiguille est avancé dans un monticule de gel pour ultrasons sur la plate-forme d'imagerie pour déterminer l'angle et la position verticale et horizontale par rapport à la sonde d'imagerie (B).
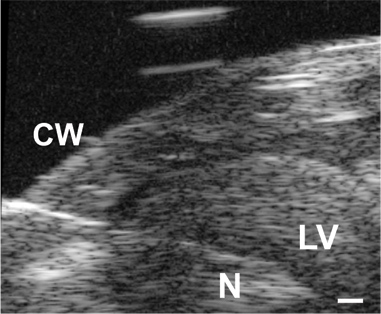
Figure 3. Image de l'aiguille (N) avancé à travers la paroi thoracique (CW) etdans la lumière LV dans une souris P1. La barre d'échelle = 0,1 mm.
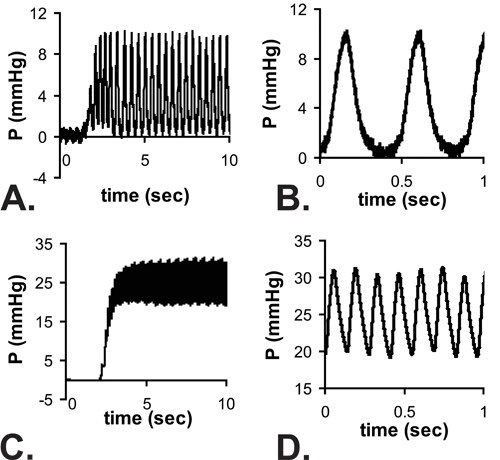
Figure 4. Exemple lectures pulsatiles de pression que l'aiguille pénètre dans le LV d'un E18 (A) et P14 (C) de la souris. Il ya un délai pour parvenir à un état d'équilibre en raison du temps de réponse du système avec l'aiguille fixée. Zoom vue de les lectures à l'état d'équilibre sont présentés dans la note B et D. que les pressions minimales E18 BT sont proches de zéro, mais la forme d'onde complète à partir de zéro à la pression maximale ne peut pas être enregistré au rythme cardiaque plus élevé de P14 chez la souris. Les pressions moyennes sont calculées à partir des lectures état d'équilibre et il est supposé que la pression systolique LV = 2 x mesurée de la pression moyenne.
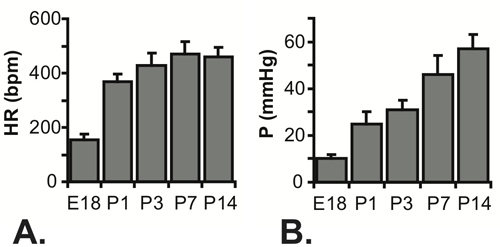
Figure 5 fréquences cardiaques mesurées (a) et calculées systolique pressions BT (B) pour E18 -. P14 souris. N = 7 pour E18, 5 pour la P1, P3 22 pour, 23 pour la P7 et 16 pour P14 5-7.
Discussion
Le protocole présenté ici fournit une méthode pour mesurer la pression dans le LV embryonnaire fin et au début des souriceaux nouveau-nés. La principale limitation de ce protocole est la résolution temporelle de la pression du système. Le signal de pression est amorti lorsqu'il se déplace de la LV à travers l'aiguille au transducteur, et que les valeurs moyennes de pression peut être enregistrée. L'amortissement peut être minimisé en utilisant la plus grande aiguille possible, mais l'aiguill...
Déclarations de divulgation
Pas de conflits d'intérêt déclarés.
Remerciements
Ce travail a été financé, en partie, par des subventions du NIH et HL087653 HL105314. Certaines de ces méthodes ont été développées dans le laboratoire du Dr Robert Mecham à l'École de médecine de l'Université de Washington.
matériels
| Name | Company | Catalog Number | Comments |
| Nom du réactif / équipements | Entreprise | Numéro de catalogue | Commentaires |
| Haute résolution système à ultrasons | Visualsonics | Vevo 770 | Ou un autre système à ultrasons appropriée |
| Hautes sondes à ultrasons de fréquence | Visualsonics | 708 et 707B | |
| Plate-forme d'imagerie et de bras d'injection | Visualsonics | Imaging Station 2 | Avec l'ECG et le contrôle suivi de la température de la plate-forme |
| Capteur de pression | Instruments AD | MLT 844 | |
| Amplificateur en pont | Instruments AD | ML221 | |
| Système d'acquisition de données | Instruments AD | ML866 | |
| Logiciel d'enregistrement de données | Instruments AD | LabChart | |
| Anneau se lever et serrer | Divers fournisseurs | Pour tenir transducteur de pression lors des mesures | |
| 3-way robinets avec les connexions Luer lock mâle | Cole Parmer | 30600-02 | |
| 1/16 "tubes Tygon ID | Cole Parmer | 06408 | |
| Luers mâles et femelles w cannelés / 1/16 le tuyau " | Cole Parmer | 45510-50 45510-00 | |
| 24 "tube avec Luer mâle et femelle à chaque extrémité | Cole Parmer | 30600-60 | |
| 3 et 10 seringues mL | BD Biosciences | ||
| 30 et 25G aiguilles | BD Biosciences | 1,5 pouces de longueur | |
| Big Ben manomètre | Riester | 1456-100 | |
| Saline | Divers fournisseurs | ||
| Héparine | Divers fournisseurs | ||
| Gel pour ultrasons | Parker | Aquasonic 100 | |
| Lotion démaquillante cheveux | Nair |
Références
- Ji, R. P. Onset of cardiac function during early mouse embryogenesis coincides with entry of primitive erythroblasts into the embryo proper. Circ. Res. 92 (2), 133-135 (2003).
- Ishiwata, T., Nakazawa, M., Pu, W. T., Tevosian, S. G., Izumo, S. Developmental changes in ventricular diastolic function correlate with changes in ventricular myoarchitecture in normal mouse embryos. Circ. Res. 93 (9), 857-865 (2003).
- Huang, Y., Guo, X., Kassab, G. S. Axial nonuniformity of geometric and mechanical properties of mouse aorta is increased during postnatal growth. Am. J. Physiol. Heart Circ. Physiol. 290 (2), H657-H664 (2006).
- Ishii, T., Kuwaki, T., Masuda, Y., Fukuda, Y. Postnatal development of blood pressure and baroreflex in mice. Auton. Neurosci. 94 (1-2), 34-41 (2001).
- Le, V. P., Knutsen, R. H., Mecham, R. P., Wagenseil, J. E. Decreased aortic diameter and compliance precedes blood pressure increases in postnatal development of elastin-insufficient mice. Am. J. Physiol. Heart Circ. Physiol. , (2011).
- Wagenseil, J. E. Reduced vessel elasticity alters cardiovascular structure and function in newborn mice. Circ. Res. 104 (10), 1217-1224 (2009).
- Wagenseil, J. E. The importance of elastin to aortic development in mice. Am. J. Physiol. Heart Circ. Physiol. 299 (2), H257-H264 (2010).
- Ramirez, F., Sakai, L. Y., Rifkin, D. B., Dietz, H. C. Extracellular microfibrils in development and disease. Cell. Mol. Life Sci. 64 (18), 2437-2446 (2007).
- Li, D. Y. Elastin point mutations cause an obstructive vascular disease, supravalvular aortic stenosis. Hum. Mol. Genet. 6 (7), 1021-1028 (1997).
- Roth, D. M., Swaney, J. S., Dalton, N. D., Gilpin, E. A., Ross, J. Impact of anesthesia on cardiac function during echocardiography in mice. Am. J. Physiol. Heart Circ. Physiol. 282 (6), H2134-H2140 (2002).
- Phoon, C. K. Imaging tools for the developmental biologist: ultrasound biomicroscopy of mouse embryonic development. Pediatr. Res. 60 (1), 14-21 (2006).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationExplorer plus d’articles
This article has been published
Video Coming Soon