JoVE 비디오를 활용하시려면 도서관을 통한 기관 구독이 필요합니다. 전체 비디오를 보시려면 로그인하거나 무료 트라이얼을 시작하세요.
Method Article
늦은 배아 및 신생아 쥐의 측정 왼쪽 심실 압력
요약
태아 및 신생아 생쥐의 측정 왼쪽 심실 압력 (LV)이 설명되어 있습니다. 압력은 초음파지도하에 LV로 유체 가득한 변환기에 연결된 바늘을 삽입하여 측정됩니다. 케어는 실험 프로토콜 동안 정상적인 심장 기능을 유지하기 위해 이동해야합니다.
초록
혈압은 척추 동물의 배아 및 출생 후의 발달 동안 대폭 증가합니다. 마우스에서 피가 흘러 배아 일 (E) 8.5 1 시경 첫번째 감지입니다. 수축기 왼쪽 심실 (LV) 압력 E9.5에서 2 mmHg와 E14.5 2시 11 mmHg이다. 갈비와 피부가 완전히 발달하지 않기 때문에 이러한 중간 배아 단계에서, LV는 침략 압력 측정을위한 가슴 벽을 통해 명확하게 볼 수 있습니다. E14.5과 출산 (약 E21) 사이 이미징 방법은 LV를 보려면 사용해야합니다. 35 3 - 출생 후의 날 (P) 2 70 mmHg - 출생 후 30 일부터 동맥 압력 증가를 의미. P20 이외에도, 동맥 압력은 고체 카테터 (예 : 밀라 나 Scisense)로 측정할 수 있습니다. 사용자는 유체 가득한 압력 트랜스 듀서 3 또는 유리 micropipettes AT & T에 부착된 플라스틱 카테터를 뽑아와 P20 전에 이러한 카테터는 마우스 동맥과 동맥 압력을 개발하기에는 너무 크다는 측정되어야합니다서보 NULL 압력 트랜스 듀서에 4 ached.
우리의 최근 작품은 혈압의 가장 큰 증가 5-7 생쥐 초기 출생 후의 기간 후반 배아 동안 발생하는 것으로 나타났습니다. 혈압이 크게 증가 개발 동맥의 평활근 세포 (SMC) 표현형 영향을 미치는 중요한 mechanotransduction 이벤트를 트리 거할 수 있습니다. 개발 동맥의 기계적 성질이 세포외 기질 단백질 (즉, Marfan 증후군 8 Supravalvular 대동맥 협착증 9) 결함에 의해 훼손되는 인간의 질병에서,이 기간 동안 혈압의 급속한 변화 mechanotransduction의 변경을 통해 질병 표현형 및 심각도에 기여할 수있다 신호. 따라서 그것은 인간 질병의 생쥐 모델에서 후반 배아와 신생아 기간 동안의 혈압 변화를 측정할 수있을 것이 중요합니다.
우리는 후반에 측정 LV 압력에 대한 방법을 설명배아 (E18)와 초기 출생 후의 (P1 - 20) 생쥐. 유체 가득한 압력 변환기에 부착된 주사 바늘을 초음파지도하에 LV에 삽입됩니다. 케어는 특히 배아 쥐를 위해 실험 프로토콜 동안 정상적인 심장 기능을 유지하기 위해 가져옵니다. 대표적인 데이터가 제시되고 프로토콜의 제한 사항이 논의된다.
프로토콜
1. 초음파와 압력 시스템
- 제조 업체 지침 (Vevo 770, Visualsonics)에 따라 초음파 시스템을 시작합니다. 증류수와 함께 초음파 시스템에 연결 - 적절한 프로브 (P7 = 모델 708, 연령> P7 = 모델 707B 연령 E18)를 입력합니다. LV 꼭대기가 분사 암으로 지적되고 있도록 이미징 플랫폼에 탑재된 마우스 LV 긴 축보기를 취득하는 데 필요한 대략적인 방향에서 조절 가능한 스탠드에 프로브를 배치합니다.
- 압력 시스템은 유체 가득한 압력 변환기, 브리지 증폭기, 데이터 수집 시스템 및 데이터 레코딩 소프트웨어 (LabChart)으로 구성되어 있습니다. 연결은 세 방향 stopcocks, 튜브, luer 잠금 및 호스 barbs 구성되어 있습니다. 20 ML의 주사기는 한쪽 끝에 홍조 10 % heparinized 염분으로 가득합니다. 다른 한쪽은 바늘에 연결하고 3 ML의 주사기 본체는 사출 팔 (그림 1)에 바늘 튜브를 개최하는 케이스로서 사용할 수 있도록 수정됩니다.
- 는 혈압계와 압력 변환기 시스템을 보정.
- 초음파 시스템의 분사 팔에 바늘 튜브와 케이스를 탑재합니다. 이미징 플랫폼의 대략적인 높이에서 링 스탠드에서 압력 변환기를 고정. 바늘 튜브로 - 마우스의 시대 (P3 = 30G, 연령> P3 = 25G 세 E18)에 적합한 바늘을 첨부합니다. 작은 바늘은 쉽게, 가슴 벽을 통해 진행하고, 느린 응답 시간이 더 어렵습니다 막힌 얻을. 따라서 LV 루멘에 맞는 가장 큰 바늘 크기는 각각의 연령에 사용됩니다.
- 이미징 플랫폼에서 초음파 젤의 마운드를 놓고 조심스럽게 바늘이 이미징 프로브 (그림 2)의 중심이 아래 겔에 직접 진출 할 수 있도록 조절 가능한 스탠드를 사용하여 프로브를 줄입니다. 바늘은 지금까지 충분히 프로브 이하이어야하지 펑크 프로브 커버하지만, 프로브 초점 심도 내에있을만큼 가까운 곳에 있습니다. 필요하다면 그것이 일에 남아 있도록, 주사 바늘을 손으로 구부 러 수그 여행 내내 전자 정확한 비행기.
- 정렬을 유지하는 것은, 바늘을 접어야 및 이미징 플랫폼에 마우스를 배치 이미징 프로브를 올립니다. 제보를 입력 수있는 젤을 제거하기 위해 바늘을 플러시.
2. 마우스 준비
- 이 프로토콜에 표시된 모든 메서드 기관 동물 케어 및 사용위원회에 의해 승인되었습니다. 1.5 % isoflurane의 지속적인 흡입에 의해 - 시간 초과 임신 어머니 (E18) 또는 신생아 마우스를 (20 P1) 마취. 튜브는 초기 신생아 마우스 (- 15 P1)의 작은 머리를 수용하기 위해 표준 코 콘에 삽입하실 수 있습니다.
- LV 꼭대기는 사출 팔을 향해 가리키고있는 지느러미 decubitus 위치에 초음파 시스템의 이미징 플랫폼에 마우스를 고정합니다. 임신한 어머니의 경우 첨부된 ECG 검출기와 심장 박동을 모니터하고 체온의 피드백 제어를 위해 직장 온도계를 삽입하는 초음파 젤를 적용합니다. 신생아 생쥐는 너무 작아서 F입니다또는 이러한 감지기, 그래서 심장 박동 압력을 측정하는 동안 감시하고 있으며 체온은 외부 가열 램프로 유지됩니다.
- depilatory 크림과 함께 젊은 마우스의 임신 어머니 가슴 복부에서 머리카락을 제거합니다. 신생아 생쥐 (P1 - 10)에 머리 제거를 요구하지 않습니다.
- 임신 어머니, 해부 가위과 곡선 집게를 사용하여 복부를 엽니다 했네요. 거즈 한 자궁 나팔과 장소는 따뜻한 생리 식염수로 moistened 외면 화하다. 조심스럽게 초음파 프로브를 사용하여 LV의 parasternal 긴 축보기를 얻을 수있는 적절한 위치로 배아를 조작. 다른 자궁 경적을 externalizing 전에이 쪽에서 모든 배아의 압력을 측정합니다. 모든 배아 따뜻한 식염수의 정기 더불어 함께 촉촉한 엄마의 복부를 유지.
3. 압력 측정
- 장소는 배아 또는 신생아 마우스, degassed 초음파 젤 prewarmed. D 적이 없어 신생아 쥐epilated 남은 초음파 젤이 커플링을 향상시키기 위해 적용되기 전에 자신의 가슴에 문질러 초음파 젤의 소량이 있어야합니다. 이미징 프로브를 낮추고 최적의 parasternal LV 긴 축보기를 얻기 위해 이미징 플랫폼의 각도를 조정합니다. 바늘 정렬이 손실되기 때문에 프로브의 각도를 조정하지 마십시오.
- 초음파 화면에 LV 이미지를 모니터링하면서 그것이 프로브의 바닥 가까이 때까지 천천히 바늘을 전진. 정렬 교대를 해결하기 위해, 필요한 경우 바늘과 프로브 위치를 조정합니다. 부드럽게 식염수 주사를 플러시. 녹화 압력 데이터를 시작하고 LabChart 소프트웨어와 압력 변환기를 제로. 변환기는 온도와 위치와 드리프트 때문에 각 마우스의 압력을 측정하기 전에 그것을 비우는 것이 중요합니다.
- 천천히가 초음파 이미지의 가장자리에 볼 수있을 때까지 바늘을 진행했지만 아직 LV 인치 바늘 위치를 조정, 필요한 경우에 LV를 입력하는 방법꼭대기. 바늘의 깨끗한 이미지를 유지하기위한 프로브 위치를 필요한 경우 조정합니다. 압력 데이터를 기록 및 초음파 이미지의 바늘 위치를 모니터링하면서 LV 루멘 (그림 3)에 바늘을 전진. 압력 변환기의 타악기 녹음의 시작 LV 루멘 (그림 4) 내부의 위치를 확인.
- 바늘은 LV 루멘 것으로 나타나지만, 압력 증가 (약 5-10 μL 볼륨) 발견하기 전에는 압력 녹음, 주사기 플런저에 가벼운 수돗물과 수세식 타악기가 아닌 경우. 이것은 정확한 결과를 방해할 수있는 나막신을 선택 취소해야합니다. 압력 수치가 여전히 타악기가 아닌 경우 바늘이 정확한 평면 위나 아래에있을 수도 있고 LV 루멘에 삽입되지 않습니다. 다시 식염수, 그리고 사전을 잔뜩 가지고, 바늘을 접어야합니다. 타악기 판독이 아직 취득하고 있지 않은 경우 다음 마우스로 이동합니다. 각각의 마우스에 대한 새 바늘을 사용합니다.
- 성공적인 압력 판독 값은 75 %에서 구할 수 있습니다태아 및 신생아 마우스하려했습니다. 신호는 5 소요됩니다 - 심장 요금은 예상보다 훨씬 다를 경우 십분 각각의 마우스에 대한 압력 데이터는 포함하지 않아야합니다 (그림 5A). 심박 수는 심장 혈관 대책에 큰 효과를 가지고 있으며, 변경된 심장 요금은 심장 조난 지표입니다. 배아 고통은 보통 1 발생 - 1.5 시간 자궁 첫 externalization 후하므로 속도가 전체 쓰레기의 압력을 측정하는 것이 중요합니다.
4. 대표 결과
표시된 모든 결과 C57BL6J 마우스위한 것입니다. 그림 3에서 P1 마우스에 대한 LV 루멘의 바늘의 이미지입니다. 바늘이 찔린 가슴 벽에 필요하고 작은 LV 루멘에 액세스할 수 있지만 그것은 크게 압력 시스템의 응답 시간을 증가시킵니다. 압력의 대략적인 단계 증가를 수동으로 시스템에 적용되면, 최대 압력의 67 %에 도달하는 시간은 0.067 SE입니다전용 (압력 단계를 적용하는 실시간 가능성이 높습니다 나타내는) 튜브와 C, 30 G 바늘로 25 G 바늘과 0.529 초와 0.105 초. 최대 압력에 도달의 지연은 그림 4A와 4C에 표시된 전체 tracings에서 볼 수 있습니다. 응답 시간은 30G 바늘로 느려질 수 있지만 심장 박동이 쥐를 5의 연령과 함께 증가하기 때문에 파형은 더, 배아 및 초기 신생아 단계에서 캡처됩니다. 이러한 제한에도 불구하고, 수축기 압력은 진정한 LV diastolic (최소) 압력이 제로임을 가정하고 계산하고, 수축기 (최고) LV 압력은 두 번 정상 상태에서의 수치 (그림 4B와 4D에서 결정된 평균 LV 압력은 수 ) 6. 이것은 일반적으로 수축기 LV과 동맥 압력이 동일하다고 가정합니다. E18과 P14 사이에 다양한 연령대의 심장 속도를 측정하고 계산 LV 압력은 그림 5에 표시됩니다.

그림 1. 첨부된 세 방향 stopcocks, 남성 (M)과 여성 (F) luer 잠금 장치 연결, 호스 barbs, 튜브, 주사기와 바늘로 압력 변환기의 이미지.

그림 2. 이미지 이미징 프로브 (A)로 바늘을 정렬하도록 설정합니다. 영상 플랫폼은 마우스의 LV 꼭대기는 사출 팔을 마주되도록 회전이다. 프로브 LV 긴 축 이미지를 얻기 위해 필요한 대략적인 방향으로 조절 가능한 스탠드에 마운트됩니다. 바늘 튜브 케이스가 사출 팔에 장착하고 있습니다. 바늘은 이미징 프로브 (B)와 관련하여 적절한 각도와 수직 및 수평 위치를 결정하기 위해 이미징 플랫폼에 초음파 젤의 마운드에 진출한다.
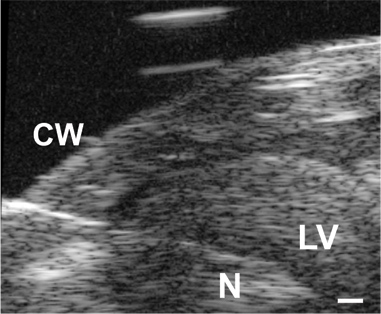
그림 3. 바늘 (N)의 이미지는 가슴 벽 (CW)를 통해 진출하고P1 마우스의 LV 루멘으로. 스케일 바는 = 0.1 mm.
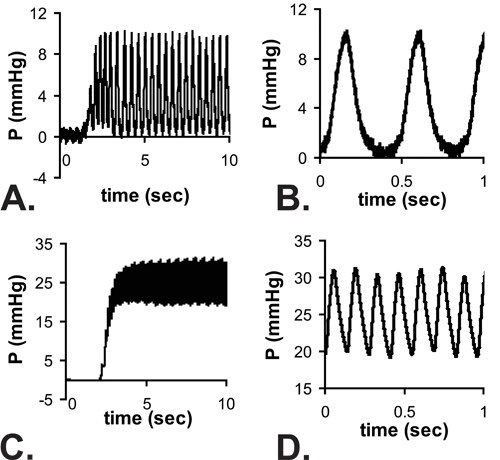
그림 4. 바늘이 E18 ()과 P14 (C) 마우스의 LV에 들어가면서 예제 타악기 압력 판독 값. 바늘이 부착되어있는 시스템의 응답 시간에 따라 일정한 상태에 도달의 지연이있다. 안정된 상태에서 신호 줌 전망은 B와 최소 E18 LV 압력이 제로 근처에있는 것으로 D. 참고로 표시되지만, 제로에서 최대 압력의 전체 파형은 P14 생쥐의 높은 심장 속도로 기록되지 않을 수 있습니다. 평균 압력이 일정한 상태를 수치로 측정되고 그것은 LV 수축기 혈압 = 2는 x 측정된 압력을 의미하는 것으로 간주됩니다.
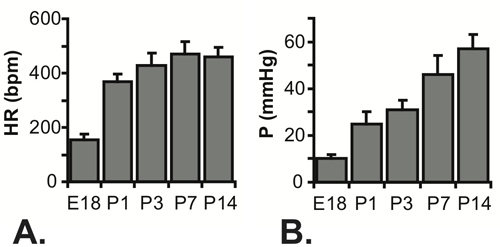
그림 5 측정 심장 속도 ()와 (B) E18에 대한 계산 수축기 LV 압력 -. P14 마우스. N P3에 대한 P1, 22를위한 E18, 5 = 7, P14을위한 P7 23 및 16 5-7.
토론
여기에 제시된 프로토콜은 후반 배아와 초기 신생아 생쥐의 LV 압력을 측정하는 방법을 제공합니다. 이 프로토콜의 주요 한계는 압력 시스템의 시간적 해상도입니다. 그것이 변환기에 바늘을 통해 LV에서 여행, 오로지 압력 값이 기록될 수 의미로 압력 신호가 감쇠됩니다. 댐핑은 가능한 큰 바늘을 사용하여 최소화 할 수 있지만, 바늘은 다른 노인 생쥐에 대한 LV 루멘에 부합해야합니다. diastolic 압...
공개
관심의 어떠한 충돌 선언 없습니다.
감사의 말
이 작품은 NIH 보조금 HL087653 및 HL105314에 의해, 부분적으로 재정 지원되었다. 방법 중 일부는 의학의 워싱턴 대학 대학원에서 박사 로버트 Mecham의 연구실에서 개발되었습니다.
자료
| Name | Company | Catalog Number | Comments |
| 시약 / 장비의 명칭 | 회사 | 카탈로그 번호 | 댓글 |
| 고해상도의 초음파 시스템 | Visualsonics | Vevo 770 | 또는 기타 적합한 초음파 시스템 |
| 고주파 초음파 프로브 | Visualsonics | 708과 707B | |
| 이미징 플랫폼과 분사 암 | Visualsonics | 이미징 역이 | ECG와 플랫폼의 온도 피드백 제어로 |
| 압력 변환기 | 광고 인 스트 루먼트 | MLT 844 | |
| 브리지 증폭기 | 광고 인 스트 루먼트 | ML221 | |
| 데이터 수집 시스템 | 광고 인 스트 루먼트 | ML866 | |
| 데이터 레코딩 소프트웨어 | 광고 인 스트 루먼트 | LabChart | |
| 반지는 서서 클램프 | 다양한 공급 업체 | 측정하는 동안 압력 변환기를 개최하려면 | |
| luer 연결과 3 방향 stopcocks, 남성 잠금 | 콜 Parmer | 30600-02 | |
| 16분의 1 "아이디 Tygon 튜빙 | 콜 Parmer | 06,408 | |
| 남성과 여성 luers W / 16분의 1 "호스 미늘 | 콜 Parmer | 45510-50 45510-00 | |
| 각 끝에 남성과 여성 luer 24 "튜빙 | 콜 Parmer | 30600-60 | |
| 세 및 10 ML의 주사기 | BD Biosciences | ||
| 30 25G 바늘 | BD Biosciences | 길이 1.5 인치 | |
| 빅 벤 압력계 | Riester | 1456-100 | |
| 식염 | 다양한 공급 업체 | ||
| 헤파린 | 다양한 공급 업체 | ||
| 초음파 젤 | 파커 | Aquasonic 100 | |
| 헤어 리무버 로션 | 나이르 |
참고문헌
- Ji, R. P. Onset of cardiac function during early mouse embryogenesis coincides with entry of primitive erythroblasts into the embryo proper. Circ. Res. 92 (2), 133-135 (2003).
- Ishiwata, T., Nakazawa, M., Pu, W. T., Tevosian, S. G., Izumo, S. Developmental changes in ventricular diastolic function correlate with changes in ventricular myoarchitecture in normal mouse embryos. Circ. Res. 93 (9), 857-865 (2003).
- Huang, Y., Guo, X., Kassab, G. S. Axial nonuniformity of geometric and mechanical properties of mouse aorta is increased during postnatal growth. Am. J. Physiol. Heart Circ. Physiol. 290 (2), H657-H664 (2006).
- Ishii, T., Kuwaki, T., Masuda, Y., Fukuda, Y. Postnatal development of blood pressure and baroreflex in mice. Auton. Neurosci. 94 (1-2), 34-41 (2001).
- Le, V. P., Knutsen, R. H., Mecham, R. P., Wagenseil, J. E. Decreased aortic diameter and compliance precedes blood pressure increases in postnatal development of elastin-insufficient mice. Am. J. Physiol. Heart Circ. Physiol. , (2011).
- Wagenseil, J. E. Reduced vessel elasticity alters cardiovascular structure and function in newborn mice. Circ. Res. 104 (10), 1217-1224 (2009).
- Wagenseil, J. E. The importance of elastin to aortic development in mice. Am. J. Physiol. Heart Circ. Physiol. 299 (2), H257-H264 (2010).
- Ramirez, F., Sakai, L. Y., Rifkin, D. B., Dietz, H. C. Extracellular microfibrils in development and disease. Cell. Mol. Life Sci. 64 (18), 2437-2446 (2007).
- Li, D. Y. Elastin point mutations cause an obstructive vascular disease, supravalvular aortic stenosis. Hum. Mol. Genet. 6 (7), 1021-1028 (1997).
- Roth, D. M., Swaney, J. S., Dalton, N. D., Gilpin, E. A., Ross, J. Impact of anesthesia on cardiac function during echocardiography in mice. Am. J. Physiol. Heart Circ. Physiol. 282 (6), H2134-H2140 (2002).
- Phoon, C. K. Imaging tools for the developmental biologist: ultrasound biomicroscopy of mouse embryonic development. Pediatr. Res. 60 (1), 14-21 (2006).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유