É necessária uma assinatura da JoVE para visualizar este conteúdo. Faça login ou comece sua avaliação gratuita.
Method Article
Pressão Ventricular Esquerda de medição no final de Ratos embrionárias e Neonatal
Neste Artigo
Resumo
Medindo a pressão ventricular esquerda (LV) em ratinhos embrionárias e neonatal é descrito. A pressão é medida através da inserção de uma agulha ligada a um transdutor cheio de fluido para o VE sob a orientação de ultra-som. Cuidados devem ser tomados para manter a função cardíaca normal durante o protocolo experimental.
Resumo
A pressão arterial aumenta significativamente durante o desenvolvimento embrionário e pós-natal em animais vertebrados. No rato, o fluxo sanguíneo é primeiro detectável por volta do dia embrionário (E) 8,5 1. Pressão sistólica do ventrículo esquerdo (LV) é de 2 mmHg em E9.5 e 11 mmHg na E14.5 2. Nessas fases mid-embrionárias, a LV é claramente visível através da parede torácica para medições de pressão invasiva, pois as costelas ea pele não estão totalmente desenvolvidos. Entre E14.5 e nascimento (aproximadamente E21) métodos de imagem deve ser usado para visualizar o LV. Após o nascimento, a média aumenta a pressão arterial de 30 a 70 mmHg desde o primeiro dia pós-natal (P) 2 - 35 3. Para além P20, a pressão arterial pode ser medida com cateteres de estado sólido (isto é, Millar ou Scisense). Antes de P20, estes cateteres são grandes demais para o desenvolvimento de artérias de rato e de pressão arterial deve ser medida com o costume puxado cateteres de plástico ligados a transdutores cheias de líquido de pressão ou 3 micropipetas de vidro attdoíam a servo-transdutores de pressão nulos 4.
O nosso trabalho recente demonstrou que o maior aumento na pressão sanguínea ocorre durante os embrionário tardios para período pós-natal precoce em ratinhos 5-7. Este grande aumento na pressão sanguínea pode influenciar o fenótipo da célula de músculo liso (SMC) em artérias em desenvolvimento e desencadear eventos mecanotransdução importantes. Na doença humana, onde as propriedades mecânicas das artérias desenvolvimento estão comprometidos por defeitos de proteínas da matriz extracelular (Síndrome ie Marfan 8 e estenose aórtica supravalvar 9) as mudanças rápidas na pressão sanguínea durante este período pode contribuir para o fenótipo e gravidade da doença através de alterações na mecanotransdução sinais. Portanto, é importante ser capaz de medir as alterações da pressão arterial durante embrionário tardias e períodos neonatais em modelos de ratos de doenças humanas.
Nós descrevemos um método para medir pressão do VE, no final deembrionário (E18) e pós-natal precoce (P1 - 20) camundongos. Uma agulha ligada a um transdutor de pressão cheio de fluido é inserido no ventrículo esquerdo sob a orientação de ultra-som. É tomado cuidado para manter a função cardíaca normal durante o protocolo experimental, especialmente para os ratos embrionários. Os dados representativos são apresentados e limitações do protocolo são discutidos.
Protocolo
1. O ultra-som e sistema de pressão
- Iniciar o sistema de ultra-som de acordo com as instruções dos fabricantes (Vevo 770, Visualsonics). Preencha a sonda apropriado (idade E18 - P7 = modelo 708, idade> = P7 modelo 707B) com água destilada e se conectar ao sistema de ultra-som. Coloque a sonda no suporte ajustável na orientação aproximada necessária para obter uma vista LV longo do eixo para um rato montado na plataforma de imagem de modo que o vértice do VE é apontada para o braço de injecção.
- O sistema de pressão é constituído por um transdutor de pressão cheio de fluido, amplificador ponte, o sistema de aquisição de dados e de software de gravação de dados (LabChart). As conexões consistem em três vias, torneiras, tubos, fechaduras luer e farpas mangueira. Uma seringa de 20 mL é preenchido com 10% de solução salina heparinizada para a lavagem em uma extremidade. A outra extremidade liga-se uma agulha e um corpo de seringa de 3 ml são modificados para uso como um invólucro para segurar o tubo da agulha no braço de injecção (Figura 1).
- Calibrar o sistema transdutor de pressão com um manômetro.
- Montar o tubo da agulha eo invólucro no braço de injecção do sistema de ultra-som. Clamp o transdutor de pressão em um suporte de anel na altura aproximada da plataforma de imagem. Coloque uma agulha apropriada para a idade do mouse (idade E18 - P3 = 30G, idade P3> = 25G) para a agulha. Agulhas menores ficam obstruídos mais fácil, são mais difíceis de avançar através da parede torácica, e tem um tempo de resposta mais lento. Assim, o maior tamanho de agulha que se encaixa no lúmen do VE é usada para cada idade.
- Coloque um montículo de gel de ultra-som na plataforma de imagem e cuidadosamente alinhar a sonda utilizando o suporte ajustável de modo a que a agulha pode ser avançado directamente para o gel sob o centro da sonda de imagem (Figura 2). A agulha deve ser suficientemente abaixo da sonda para não perfurar a tampa da sonda, mas suficientemente perto para estar dentro da profundidade da sonda focal. Se necessário, a agulha pode ser dobrado à mão de modo a que permaneça em poe plano correto ao longo de sua viagem.
- Mantendo o alinhamento, retrair a agulha e elevar a sonda de imagem para colocar um rato sobre a plataforma de imagem. Lavar a agulha para eliminar qualquer gel que possa ter entrado na ponta.
2. Preparação de camundongo
- Todos os métodos mostrados neste protocolo ter sido aprovado pelo Institutional Animal Care e do Comitê uso. Anestesiar uma mãe grávida cronometrado (E18) ou rato neonatal (P1 - 20) por inalação contínua de isoflurano a 1,5%. Tubo pode ser inserido um cone de nariz padrão para acomodar a cabeça pequena de um rato neonatal precoce (P1 - 15).
- Fixe o mouse para a plataforma de imagens do sistema de ultra-som em uma posição de decúbito dorsal, com o ápice do VE na direção do braço para injeções. Para as mães grávidas, aplicar ultra-som gel para monitorar a freqüência cardíaca com o detector de ECG em anexo e inserir o termômetro retal para controle de feedback da temperatura corporal. Camundongos recém-nascidos são muito pequenos fou estes detectores, de modo a frequência cardíaca é monitorizada durante as medições de pressão e temperatura corporal é mantida com uma lâmpada de calor externo.
- Remova o cabelo do abdômen da gestante ou no peito do rato jovem com um creme depilatório. Ratos neonatos (P1 - 10) não requer qualquer remoção de pêlos.
- Para as mães grávidas, cortou o abdome utilizando tesoura de dissecção e pinças curvas. Externalizar um corno uterino e local em gaze umedecida com soro fisiológico morno. Cuidadosamente manipular um embrião para a posição adequada para se obter um corte paraesternal eixo longo do VE utilizando a sonda de ultra-som. Medir a pressão em todos os embriões deste lado antes externalização o corno uterino outro. Mantenha todos os embriões e do abdômen da mãe úmida com adição periódica de solução fisiológica aquecida.
3. Medição de pressão
- Lugar pré-aquecido, gel de ultra-som desgaseificado no mouse embrionário ou neonatal. Camundongos recém-nascidos que não foram ddepilada deve ter uma pequena quantidade de gel de ultra-som esfregada na sua caixa antes do gel de ultra-som restante é aplicado para melhorar o acoplamento. Abaixar a sonda de imagem e ajustar o ângulo da plataforma de imagem para obter uma óptima para-esternal LV vista eixo longo. Não ajustar o ângulo da sonda porque o alinhamento da agulha será perdido.
- Enquanto o controlo da imagem LV na tela de ultra-som, lentamente avançar a agulha até que seja perto da parte inferior da sonda. Ajustar a posição da agulha e da sonda, se necessário, para corrigir alterações de alinhamento. Gentilmente limpar a agulha com solução salina. Iniciar os dados de pressão de gravação e zero o transdutor de pressão com o software LabChart. O transdutor deriva com a temperatura e de posição, por isso é importante para zero apenas antes da medição da pressão em cada rato.
- Lentamente avanço da agulha até que possa ser visto na borda da imagem de ultra-som, mas ainda não no VE. Ajustar a posição da agulha, se necessário, para entrar no VE noápice. Ajustar a posição da sonda, se necessário, para manter uma imagem clara da agulha. Avançar a agulha para dentro do lúmen do VE (Figura 3), durante a gravação de dados de pressão e monitorando a localização da agulha sobre a imagem ultra-som. O início de gravações pulsáteis a partir do transdutor de pressão confirma a localização no interior do lúmen LV (Figura 4).
- Se a agulha parece ser no lúmen do VE, mas gravações de pressão não são pulsátil, nivelada com uma torneira de luz sobre o êmbolo da seringa, apenas até um aumento de pressão é detectada (cerca de 5 - 10 do volume uL). Isso deve apagar quaisquer obstruções que podem estar impedindo uma leitura precisa. Se as leituras de pressão não são ainda pulsátil, a agulha pode estar acima ou abaixo do plano correcta e não ser inserido no lúmen do VE. Retrair a agulha, lave com soro fisiológico, e avançar novamente. Se as leituras pulsáteis ainda não obteve, passar para o próximo rato. Utilize uma agulha nova para cada rato.
- Leituras da pressão de sucesso pode ser obtido a partir de 75% doos ratos embrionários e neonatal tentada. As leituras devem tomar 5 - 10 minutos cada e os dados de pressão para um mouse não devem ser incluídos se os batimentos cardíacos são significativamente diferentes do que o esperado (Figura 5A). A frequência cardíaca tem um efeito significativo sobre as medidas cardiovasculares e taxas de coração alterados são indicativos de distúrbios cardíacos. Angústia embrionário ocorre geralmente 1 - 1,5 horas após a primeira externalização do útero, assim que a velocidade é importante para medir as pressões em uma ninhada inteira.
4. Os resultados representativos
Todos os resultados são indicados para ratos C57BL6J. Uma imagem da agulha no lúmen do VE para um rato P1 é mostrada na Figura 3. A agulha é necessário para perfurar a parede do tórax e ganhar acesso ao lúmen do VE pequena, mas aumenta significativamente o tempo de resposta do sistema de pressão. Quando um aumento passo aproximada de pressão é aplicada manualmente para o sistema, o tempo para alcançar 67% da pressão máxima é de 0,067 sic com a tubagem apenas (mais provavelmente indicativa do tempo real para aplicar o passo de pressão), 0,105 seg com uma agulha G 25 e 0,529 seg com uma agulha 30 G. O atraso em alcançar a pressão máxima pode ser visto nos traçados completa mostrada na Figura 4A e 4C. Embora o tempo de resposta é mais lento com a agulha 30G, a forma de onda é melhor capturado com os estádios de desenvolvimento embrionário precoce e neonatais, porque a taxa cardíaca aumenta com a idade nos ratinhos 5. Apesar desta limitação, a pressão sistólica pode ser calculada assumindo que a verdadeira LV pressão (mínimo) diastólica é zero, e as pressões sistólica (máxima) a pressão do VE é duas vezes a pressão de VE média determinada a partir das leituras no estado estacionário (Figura 4B e 4D ) 6. Supõe-se geralmente que a sistólica e pressão arterial são iguais. As pressões medidos frequências cardíacas e calculado LV para várias idades entre E18 e P14 são mostrados na Figura 5.

Figura 1. Imagem do transdutor de pressão com anexados torneiras de três vias, do sexo masculino (M) e feminino (F) conexões luer lock, farpas de mangueiras, tubos, seringas e agulhas.

Figura 2. Imagem da. Configurado para alinhar a agulha com a sonda de imagem (A) A plataforma de imagem é girada de modo que o vértice do VE do rato é de frente para o braço de injecção. A sonda é montado no suporte ajustável na orientação aproximada necessária para obter uma imagem do VE longo do eixo. O invólucro tubo da agulha está montada no braço de injecção. A agulha é avançado para dentro de um monte de gel de ultra-som na plataforma de imagem para determinar o ângulo adequado e na posição vertical e horizontal em relação à sonda de imagem (B).
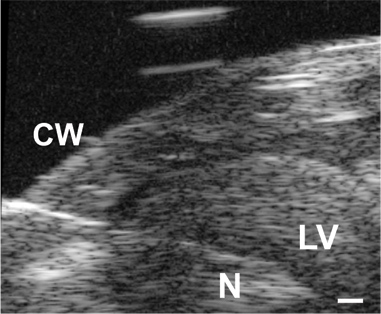
Figura 3. Imagem da agulha (N) avançado através da parede torácica (CW) epara dentro do lúmen do VE em um rato P1. Barra de escala = 0,1 mm.
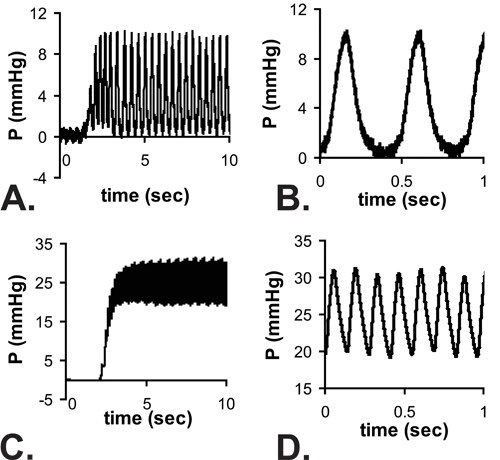
Figura 4. Leituras Exemplo pulsáteis de pressão quando a agulha entra no ventrículo esquerdo de um E18 (A) e P14 (C) do rato. Há um atraso em alcançar um estado estacionário, devido ao tempo de resposta do sistema com a agulha colocada. Vistas Zoom das leituras no estado estacionário são mostrados na B e D. Nota que os mínimos E18 pressões do VE, são perto de zero, mas a forma de onda completa de zero para a pressão máxima não pode ser gravado com as taxas mais altas do coração de ratos P14. As pressões médias são medidas a partir das leituras de estado estacionário e é assumido que a pressão sistólica do VE = 2 x média medida de pressão.
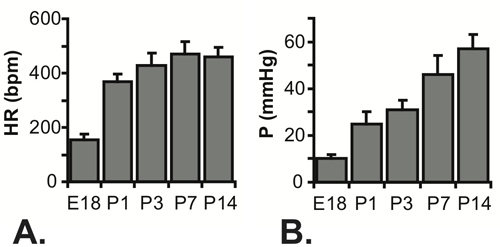
Figura 5 batimentos cardíacos medidos (A) e calculadas as pressões sistólica do VE (B) para E18 -. P14 camundongos. N = 7 para E18, 5 para a P1, 22 para P3, 23 para a P7 e 16 para P14 5-7.
Discussão
O protocolo apresentado aqui fornece um método para medir a pressão no VE embrionário atrasado e cedo ratinhos neonatais. A principal limitação deste protocolo é a resolução temporal do sistema de pressão. O sinal de pressão é amortecido à medida que viaja a partir do VE, através da agulha para o transdutor, e apenas os valores médios de pressão pode ser gravado. O amortecimento pode ser minimizados através da utilização da maior agulha possível, mas a agulha deve caber dentro do lúmen do VE para dif...
Divulgações
Não há conflitos de interesse declarados.
Agradecimentos
Este trabalho foi financiado, em parte, pelo NIH concede HL087653 e HL105314. Alguns dos métodos foram desenvolvidos no laboratório do Dr. Robert Mecham da Universidade de Washington School of Medicine.
Materiais
| Name | Company | Catalog Number | Comments |
| Nome do reagente / equipamentos | Companhia | Número de catálogo | Comentários |
| Sistema de ultra-sonografia de alta resolução | Visualsonics | Vevo 770 | Ou outro sistema de ultra apropriado |
| Sondas de ultra-som de alta freqüência | Visualsonics | 708 e 707B | |
| Plataforma de imagem e braço para injeções | Visualsonics | Imagem Station 2 | Com ECG e controle de temperatura gabarito da plataforma |
| Transdutor de pressão | Instrumentos AD | MLT 844 | |
| Amplificador Ponte | Instrumentos AD | ML221 | |
| Dados do sistema de aquisição | Instrumentos AD | ML866 | |
| Dados software de gravação | Instrumentos AD | LabChart | |
| Anel de pé e braçadeira | Diversos fornecedores | Para segurar transdutor de pressão durante as medições | |
| Torneiras de 3 vias com conexões luer, bloqueio masculino | Cole Parmer | 30600-02 | |
| 1/16 "Tubo Tygon ID | Cole Parmer | 06408 | |
| Luers masculino e feminino w espigão / 1/16 " | Cole Parmer | 45510-50 45510-00 | |
| 24 tubo "com luer macho e fêmea em cada extremidade | Cole Parmer | 30600-60 | |
| 3 e 10 mL seringas | BD Biosciences | ||
| 30 e 25G agulhas | BD Biosciences | 1,5 polegadas de comprimento | |
| Big Ben manômetro | Riester | 1456-100 | |
| Salina | Diversos fornecedores | ||
| Heparina | Diversos fornecedores | ||
| Gel de ultra-som | Parker | Aquasonic 100 | |
| Loção removedor de pêlos | Nair |
Referências
- Ji, R. P. Onset of cardiac function during early mouse embryogenesis coincides with entry of primitive erythroblasts into the embryo proper. Circ. Res. 92 (2), 133-135 (2003).
- Ishiwata, T., Nakazawa, M., Pu, W. T., Tevosian, S. G., Izumo, S. Developmental changes in ventricular diastolic function correlate with changes in ventricular myoarchitecture in normal mouse embryos. Circ. Res. 93 (9), 857-865 (2003).
- Huang, Y., Guo, X., Kassab, G. S. Axial nonuniformity of geometric and mechanical properties of mouse aorta is increased during postnatal growth. Am. J. Physiol. Heart Circ. Physiol. 290 (2), H657-H664 (2006).
- Ishii, T., Kuwaki, T., Masuda, Y., Fukuda, Y. Postnatal development of blood pressure and baroreflex in mice. Auton. Neurosci. 94 (1-2), 34-41 (2001).
- Le, V. P., Knutsen, R. H., Mecham, R. P., Wagenseil, J. E. Decreased aortic diameter and compliance precedes blood pressure increases in postnatal development of elastin-insufficient mice. Am. J. Physiol. Heart Circ. Physiol. , (2011).
- Wagenseil, J. E. Reduced vessel elasticity alters cardiovascular structure and function in newborn mice. Circ. Res. 104 (10), 1217-1224 (2009).
- Wagenseil, J. E. The importance of elastin to aortic development in mice. Am. J. Physiol. Heart Circ. Physiol. 299 (2), H257-H264 (2010).
- Ramirez, F., Sakai, L. Y., Rifkin, D. B., Dietz, H. C. Extracellular microfibrils in development and disease. Cell. Mol. Life Sci. 64 (18), 2437-2446 (2007).
- Li, D. Y. Elastin point mutations cause an obstructive vascular disease, supravalvular aortic stenosis. Hum. Mol. Genet. 6 (7), 1021-1028 (1997).
- Roth, D. M., Swaney, J. S., Dalton, N. D., Gilpin, E. A., Ross, J. Impact of anesthesia on cardiac function during echocardiography in mice. Am. J. Physiol. Heart Circ. Physiol. 282 (6), H2134-H2140 (2002).
- Phoon, C. K. Imaging tools for the developmental biologist: ultrasound biomicroscopy of mouse embryonic development. Pediatr. Res. 60 (1), 14-21 (2006).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados