È necessario avere un abbonamento a JoVE per visualizzare questo. Accedi o inizia la tua prova gratuita.
Method Article
Misurazione della pressione ventricolare sinistra nel tardo Mice embrionali e neonatale
In questo articolo
Riepilogo
Misurazione della pressione ventricolare sinistra (LV) nei topi embrionali e neonatale è descritto. La pressione è misurata inserendo un ago connesso ad un trasduttore riempito di fluido nella LV sotto guida ecografica. Si deve prestare attenzione a mantenere una normale funzione cardiaca durante il protocollo sperimentale.
Abstract
La pressione sanguigna aumenta in modo significativo durante lo sviluppo embrionale e postnatale negli animali vertebrati. Nel topo, flusso di sangue è rilevabile prima intorno giorni embrionale (E) 8,5 1. Sistolica del ventricolo sinistro (LV) è di 2 mmHg di pressione a E9.5 e 11 mmHg a E14.5 2. A queste fasi di mid-embrionali, la LV è chiaramente visibile attraverso la parete toracica per la misurazione della pressione invasive, perché le costole e la pelle non sono pienamente sviluppati. Tra E14.5 e la nascita (circa E21) i metodi di imaging deve essere utilizzato per visualizzare il LV. Dopo la nascita, significa aumento della pressione arteriosa da 30 a 70 mmHg fin dal primo giorno post-natale (P) 2 - 35 3. Oltre P20, la pressione arteriosa può essere misurata con cateteri a stato solido (cioè Millar o Scisense). Prima di P20, questi cateteri sono troppo grandi per lo sviluppo di arterie del mouse e la pressione arteriosa deve essere misurata con l'abitudine tirato cateteri di plastica attaccati al piene di liquido trasduttori di pressione 3 o vetro micropipette attdoleva di servo trasduttori di pressione nulle 4.
Il nostro lavoro recente ha dimostrato che il maggior incremento della pressione arteriosa avviene durante le embrionali tardivi al primo periodo post-natale nei topi 5-7. Questo forte aumento della pressione arteriosa può influenzare cellule muscolari lisce (SMC) fenotipo nelle arterie di sviluppo e innescare eventi meccanotrasduzione importanti. Nella malattia umana, dove vengono compromesse le proprietà meccaniche delle arterie in via di sviluppo da difetti di proteine della matrice extracellulare (ad esempio sindrome di Marfan 8 e stenosi aortica sopravalvolare 9) i rapidi cambiamenti della pressione sanguigna durante questo periodo può contribuire al fenotipo della malattia e la gravità con alterazioni meccanotrasduzione segnali. Pertanto, è importante essere in grado di misurare le variazioni della pressione durante il fine embrionale e periodi neonatali in modelli murini di malattie umane.
Noi descriviamo un metodo per la misurazione della pressione LV fineembrionale (E18) e l'inizio del post-natale (P1 - 20) i topi. Un ago attaccato ad una piena di fluido trasduttore di pressione viene inserito nella LV sotto guida ecografica. Si presta attenzione a mantenere una normale funzione cardiaca durante il protocollo di sperimentazione, soprattutto per i topi embrionali. Dati rappresentativi sono presentati e le limitazioni del protocollo sono discussi.
Protocollo
1. L'ecografia e la pressione del sistema
- Avviare il sistema ad ultrasuoni secondo le istruzioni del produttore (Vevo 770, Visualsonics). Riempire il sonda appropriata (età E18 - P7 = modello 708, età> = P7 modello 707B) con acqua distillata e connettersi al sistema ad ultrasuoni. Posizionare la sonda nel supporto regolabile in orientamento approssimativo necessaria per ottenere un asse lungo LV per un mouse montato sulla piattaforma di imaging in modo che l'apice LV è puntato verso il braccio di iniezione.
- Il sistema di pressione costituito da un fluido-riempita trasduttore di pressione, amplificatore a ponte, sistema di acquisizione dati e software di registrazione dati (LabChart). I collegamenti sono costituiti da tre vie rubinetti, tubi, blocchi luer e giunzioni dei tubi. Una siringa da 20 ml viene riempita con 10% soluzione salina eparinizzata per il lavaggio ad una estremità. L'altra estremità si collega ad un ago e un corpo 3 della siringa mL viene modificato per l'utilizzo come involucro per tenere il tubo dell'ago nel braccio di iniezione (Figura 1).
- Calibrare il sistema trasduttore di pressione con un manometro.
- Montare il tubo dell'ago e corpo nel braccio di iniezione del sistema ad ultrasuoni. Bloccare il trasduttore di pressione in uno stand anello all'altezza approssimativa della piattaforma di imaging. Inserire un ago appropriato per l'età del mouse (età E18 - P3 = 30G, età> P3 = 25G) per il tubo dell'ago. Piccoli aghi intasarsi più facile, sono più difficili da passare attraverso la parete toracica, e hanno un tempo di risposta più lento. Quindi, la dimensione più grande ago che si inserisce nel lume LV viene utilizzato per ogni età.
- Inserire un cumulo di gel ultrasuoni sulla piattaforma di imaging e accuratamente allineare la sonda con il supporto regolabile in modo che l'ago può essere fatto avanzare direttamente nel gel sotto il centro della sonda di imaging (Figura 2). L'ago deve essere sufficientemente al di sotto della sonda non forare la copertura di sonda, ma abbastanza vicino per essere all'interno della profondità focale della sonda. Se necessario, l'ago può essere piegato a mano in modo che rimanga in the piano corretto per tutta la sua corsa.
- Mantenere l'allineamento, ritirare l'ago e innalzare la sonda di imaging per posizionare il mouse sulla piattaforma di imaging. Lavare l'ago per eliminare qualsiasi gel che possono essere entrati la punta.
2. Preparazione del mouse
- Tutti i metodi illustrati in questo protocollo sono stati approvati dalla Institutional Animal Care e del Comitato uso. Anestetizzare una madre a tempo in stato di gravidanza (E18) o il mouse neonatale (P1 - 20) per inalazione continua di 1,5% isoflurano. Tubo può essere inserito in un cono standard per accogliere la testa piccola di un mouse neonatale (P1 - 15).
- Fissare il mouse per la piattaforma di imaging del sistema ad ultrasuoni in una posizione di decubito dorsale con il vertice rivolto verso il LV braccio per iniezioni. Per le mamme in gravidanza, applicare gel ultrasuoni per il monitoraggio della frequenza cardiaca con il rivelatore allegato ECG e inserire il termometro rettale per il controllo del feedback della temperatura corporea. F topi neonati sono troppo piccoleo questi rivelatori, così frequenza cardiaca viene monitorata durante le misure di pressione e temperatura corporea viene mantenuta con una lampada di calore esterno.
- Rimuovere i capelli dal ventre della madre in gravidanza o sul petto del mouse giovane con una crema depilatoria. Topi neonati (P1 - 10) non richiedono alcuna depilazione.
- Per le mamme in gravidanza, aprì l'addome con le forbici e pinze sezionare curve. Esternalizzare un corno uterino e il luogo su garza inumidita con soluzione salina calda. Attenzione manipolare un embrione nella posizione corretta per ottenere una visione parasternale asse lungo del ventricolo sinistro usando la sonda ad ultrasuoni. Misurare la pressione in tutti gli embrioni su questo lato, prima esternalizzare l'altro corno uterino. Tenere tutti gli embrioni e l'addome della madre umida con l'aggiunta periodica di soluzione salina calda.
3. Misurazione della pressione
- Luogo preriscaldata, gel ultrasuoni degasificato del mouse embrionale o neonatale. Topi neonati che non sono stati depilata dovrebbe avere una piccola quantità di gel ultrasuoni strofinato sulla loro petto prima che il gel ultrasuoni rimanente viene applicata per migliorare accoppiamento. Abbassare la sonda di imaging e regolare l'angolo della piattaforma di imaging per ottenere una ottimale visione parasternale asse lungo LV. Non regolare l'angolo della sonda poiché l'allineamento dell'ago verranno persi.
- Durante il monitoraggio della immagine LV sullo schermo ultrasuoni, lentamente avanzare l'ago fino a che è vicino al fondo della sonda. Regolare la posizione dell'ago della sonda e, se necessario, correggere spostamenti di allineamento. Delicatamente a filo l'ago con soluzione fisiologica. Avviare la registrazione dei dati di pressione e azzerare il trasduttore di pressione con il software LabChart. Il trasduttore scivola con la temperatura e la posizione, quindi è importante a zero prima di misurare la pressione in ciascun topo.
- Avanzare lentamente fino a che l'ago può essere visto sul bordo della immagine ad ultrasuoni, ma non ancora in LV. Regolare la posizione dell'ago, se necessario, per inserire il LV alapice. Regolare la posizione della sonda, se necessario, per mantenere una chiara immagine dell'ago. Avanzare l'ago nel lume LV (figura 3), durante la registrazione di dati di pressione e monitorare la posizione dell'ago sulla immagine ad ultrasuoni. L'inizio delle registrazioni pulsatili dal trasduttore di pressione conferma la posizione all'interno del lume LV (Figura 4).
- Se l'ago appare nel lume LV, ma non sono le registrazioni di pressione pulsatile, a filo con un rubinetto luce sul pistone della siringa, solo fino a un aumento di pressione viene rilevata (circa 5 - 10 pl di volume). Questo dovrebbe eliminare eventuali ostruzioni che possono impedire una lettura accurata. Se le letture di pressione non sono ancora pulsatile, l'ago può essere sopra o sotto il piano corretto e non essere inserito nel lume LV. Ritrarre l'ago, lavare con soluzione fisiologica, e avanzare ancora. Se le letture pulsatili non ancora ottenuto, passare il mouse successiva. Usare un ago nuovo per ogni mouse.
- Letture di pressione successo può essere ottenuta dal 75% deii topi embrionali e neonatale tentato. Letture dovrebbe prendere 5 - 10 minuti ciascuno ed i dati di pressione per un mouse non devono essere inclusi, se le frequenze cardiache sono significativamente diverso da quello previsto (Figura 5A). La frequenza cardiaca ha un effetto significativo sulle misure cardiovascolari e frequenza cardiaca alterati sono indicativi di sofferenza cardiaca. Distress embrionali di solito si verifica 1 - 1,5 ore dopo la prima esternalizzazione di utero, così la velocità è importante per misurare la pressione in una intera cucciolata.
4. Risultati rappresentativi
Tutti i risultati indicati sono per i topi C57BL6J. Un'immagine dell'ago nel lume LV per un topo in P1 illustrato in Figura 3. L'ago è necessario forare la parete toracica e ottenere l'accesso al lume piccolo LV, ma aumenta notevolmente il tempo di risposta del sistema di pressione. Quando un aumento passo approssimativo in pressione viene applicata manualmente al sistema, il tempo per raggiungere il 67% della pressione massima è di 0,067 séc con la tubazione unica (probabilmente indicativa del tempo reale per applicare la fase di pressione), 0,105 sec con un ago da 25 G e 0,529 sec con un ago 30 G. Il ritardo nel raggiungimento della pressione massima può essere visto nelle tracciati completi mostrate in Figura 4A e 4C. Anche se il tempo di risposta è più lenta con l'ago 30G, la forma d'onda è meglio catturato nelle fasi embrionale e neonatale precoce, in quanto la frequenza cardiaca aumenta con l'età nei topi 5. Nonostante questa limitazione, la pressione sistolica può essere calcolato assumendo che la vera LV diastolica (minima) di pressione è zero, e la (massimo) di pressione sistolica LV è due volte la pressione media LV determinato dalle letture allo stato stazionario (Figura 4B e 4D ) 6. Si ritiene generalmente che la sistolica e la pressione arteriosa sono uguali. Le pressioni misurati frequenza cardiaca e calcolati per BT varie epoche tra E18 e P14 sono mostrati in figura 5.

Figura 1. Immagine del trasduttore di pressione con allegate tre vie rubinetti, di sesso maschile (M) e femminile (F), connessioni Luer lock, le giunzioni dei tubi, tubi, siringhe e aghi.

Figura 2. Immagine della impostato per allineare l'ago con la sonda di imaging (A). La piattaforma di imaging è ruotata in modo che l'apice LV del mouse è di fronte al braccio di iniezione. La sonda è montata nel supporto regolabile in orientamento approssimativo necessaria per ottenere un asse lungo LV immagine. L'involucro tubo dell'ago è montato nel braccio di iniezione. L'ago viene fatto avanzare in un cumulo di gel ultrasuoni sulla piattaforma di imaging per determinare la corretta angolazione e la posizione verticale e orizzontale rispetto alla sonda di imaging (B).
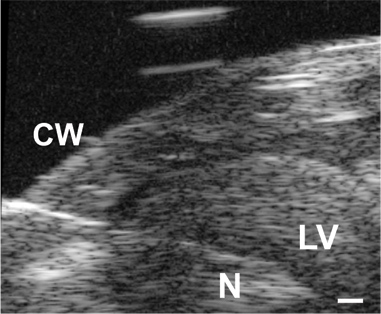
Figura 3. Immagine dell'ago (N) fatto avanzare attraverso la parete toracica (CW) enel lume LV in un topo P1. Barra della scala = 0.1 mm.
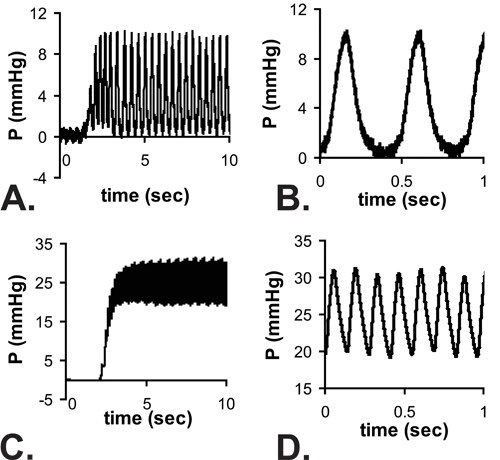
Figura 4. Esempio letture della pressione pulsatili come l'ago entra nel LV di E18 (A) e P14 (C) topo. Vi è un ritardo nel raggiungere uno stato stabile a causa del tempo di risposta del sistema con l'ago inserito. Zoom vista delle letture allo stato stazionario sono mostrati in B e D. Si noti che il minimo E18 pressioni LV sono vicini allo zero, ma la forma d'onda completa da zero alla massima pressione non può essere registrata presso le frequenze cardiache più elevate di P14 topi. Le pressioni medi sono misurati dai valori di stato stazionario e si presume che LV pressione sistolica = 2 x misurata pressione media.
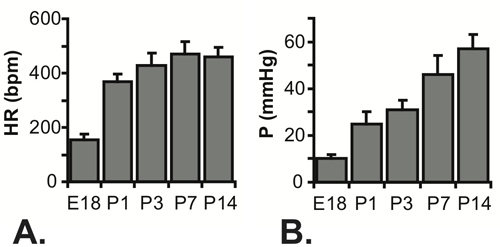
Figura 5 frequenze cardiache di misura (A) e calcolato pressioni sistolica LV (B) per E18 -. P14 topi. N = 7 per E18, 5 per P1, P3 per 22, 23 per P7 e 16 per P14 5-7.
Discussione
Il protocollo qui presentata fornisce un metodo per misurare la pressione in LV fine embrionale e nei primi topi neonati. Il limite principale di questo protocollo è la risoluzione temporale del sistema di pressione. Il segnale di pressione viene smorzato mentre viaggia dal LV attraverso l'ago al trasduttore, e solo i valori medi di pressione possono essere registrati. Lo smorzamento può essere minimizzato utilizzando la più ampia ago possibile, ma l'ago deve inserirsi all'interno del lume LV per diverse ...
Divulgazioni
Non ci sono conflitti di interesse dichiarati.
Riconoscimenti
Questo lavoro è stato finanziato, in parte, da sovvenzioni NIH HL087653 e HL105314. Alcuni dei metodi sono stati sviluppati in laboratorio del Dr. Robert Mecham presso la Washington University School of Medicine.
Materiali
| Name | Company | Catalog Number | Comments |
| Nome del reagente / apparecchiatura | Azienda | Numero di catalogo | Comments |
| Sistema ad ultrasuoni ad alta risoluzione | Visualsonics | Vevo 770 | O un altro sistema ad ultrasuoni appropriato |
| Sonde ad ultrasuoni ad alta frequenza | Visualsonics | 708 e 707B | |
| Imaging piattaforma e braccio per iniezioni | Visualsonics | Imaging Station 2 | Con ECG e il feedback di controllo della temperatura della piattaforma |
| Trasduttore di pressione | AD Instruments | MLT 844 | |
| Ponte amplificatore | AD Instruments | ML221 | |
| Sistema di acquisizione dati | AD Instruments | ML866 | |
| Dati software di registrazione | AD Instruments | LabChart | |
| Anello e morsetto | Diversi fornitori | Per mantenere trasduttore di pressione durante le misurazioni | |
| Rubinetti a 3 vie con connessioni Luer lock maschio | Cole Parmer | 30600-02 | |
| 1/16 "ID Tubing Tygon | Cole Parmer | 06408 | |
| Luer maschio e femmina w "aletta / 1/16 tubo | Cole Parmer | 45510-50 45510-00 | |
| 24 "tubo maschio e femmina luer a ciascuna estremità | Cole Parmer | 30600-60 | |
| 3 e 10 ml siringhe | BD Biosciences | ||
| 30 e aghi 25G | BD Biosciences | 1,5 pollici di lunghezza | |
| Big Ben manometro | Riester | 1456-100 | |
| Salino | Diversi fornitori | ||
| Eparina | Diversi fornitori | ||
| Gel a ultrasuoni | Parker | Aquasonic 100 | |
| Depilatore lozione | Nair |
Riferimenti
- Ji, R. P. Onset of cardiac function during early mouse embryogenesis coincides with entry of primitive erythroblasts into the embryo proper. Circ. Res. 92 (2), 133-135 (2003).
- Ishiwata, T., Nakazawa, M., Pu, W. T., Tevosian, S. G., Izumo, S. Developmental changes in ventricular diastolic function correlate with changes in ventricular myoarchitecture in normal mouse embryos. Circ. Res. 93 (9), 857-865 (2003).
- Huang, Y., Guo, X., Kassab, G. S. Axial nonuniformity of geometric and mechanical properties of mouse aorta is increased during postnatal growth. Am. J. Physiol. Heart Circ. Physiol. 290 (2), H657-H664 (2006).
- Ishii, T., Kuwaki, T., Masuda, Y., Fukuda, Y. Postnatal development of blood pressure and baroreflex in mice. Auton. Neurosci. 94 (1-2), 34-41 (2001).
- Le, V. P., Knutsen, R. H., Mecham, R. P., Wagenseil, J. E. Decreased aortic diameter and compliance precedes blood pressure increases in postnatal development of elastin-insufficient mice. Am. J. Physiol. Heart Circ. Physiol. , (2011).
- Wagenseil, J. E. Reduced vessel elasticity alters cardiovascular structure and function in newborn mice. Circ. Res. 104 (10), 1217-1224 (2009).
- Wagenseil, J. E. The importance of elastin to aortic development in mice. Am. J. Physiol. Heart Circ. Physiol. 299 (2), H257-H264 (2010).
- Ramirez, F., Sakai, L. Y., Rifkin, D. B., Dietz, H. C. Extracellular microfibrils in development and disease. Cell. Mol. Life Sci. 64 (18), 2437-2446 (2007).
- Li, D. Y. Elastin point mutations cause an obstructive vascular disease, supravalvular aortic stenosis. Hum. Mol. Genet. 6 (7), 1021-1028 (1997).
- Roth, D. M., Swaney, J. S., Dalton, N. D., Gilpin, E. A., Ross, J. Impact of anesthesia on cardiac function during echocardiography in mice. Am. J. Physiol. Heart Circ. Physiol. 282 (6), H2134-H2140 (2002).
- Phoon, C. K. Imaging tools for the developmental biologist: ultrasound biomicroscopy of mouse embryonic development. Pediatr. Res. 60 (1), 14-21 (2006).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneEsplora altri articoli
This article has been published
Video Coming Soon