需要订阅 JoVE 才能查看此. 登录或开始免费试用。
Method Article
工程和演变的合成腺相关病毒(AAV),基因治疗载体,通过DNA家族改组
摘要
我们展示了基本的技术,分子工程和发展合成腺相关病毒(AAV),基因治疗载体,通过DNA家族改组。此外,我们在文化或靶细胞在小鼠的增强属性的个体嵌合衣壳的选择和分析,并提供一般的指引,有代表性的例子。
摘要
腺相关病毒(AAV),向量表示由于1有益特性的独特组合,一些用于治疗人类的基因转移的最有力的和有前途的车辆。包括底层野生型病毒和非常先进的方法生产高滴度,高纯度和临床级2重组载体的apathogenicity。另一项特别的优势超过其他病毒的腺相关病毒系统是一个自然发生的血清型,其中不同的基本属性,都可以很容易地设计载体,使用一个共同的协议1,2财富的可用性。此外,包括我们自己的团体最近已制定战略,利用这些天然病毒作为模板创建的合成相结合的多输入血清型的资产,或提高单个孤立的属性载体。各自的技术,以实现这些目标ARé任的DNA家族改组3, 即由他们根据部分同源性(通常> 80%,大多数腺相关病毒血清型),或肽显示4,5, 即通常7个氨基酸插入到重新组装各种AAV衣壳基因 的碎片理想肽介导的重新定位到所需的细胞类型的病毒衣壳的暴露循环。为了获得最大的成功,这两种方法都适用于高吞吐量的时尚据此协议缩放产生大约100万不同的衣壳变种库。每个克隆,然后组成一个独特的组合(DNA改组方法)众多家长病毒或病毒在同一骨干(肽显示方法)包含一个独特的肽。在随后的最后一步是迭代选择这样的靶细胞库,以丰富个人履行或理想的选择过程中的所有要求衣壳。后者最好梳INES积极的压力,如在某些细胞类型,利益与负选择,例如消除所有与抗AAV抗体反应衣壳增长。这种组合增加合成衣壳生存选择,在给定的应用程序可能会发现在任何自然发生的腺相关病毒分离的方式相匹配的需求的机会。在这里,我们专注于DNA家族改组方法的理论和实验两种技术的挑战。我们将介绍和演示洗牌腺相关病毒库的生成和选择( 图1)所有必要的步骤,然后讨论存在的隐患和协议的重要方面,是一个需要知道为了成功与腺相关病毒的分子进化。
研究方案
1。制备质粒AAV衣壳基因编码集
- 为了方便各种AAV衣壳基因 ( 帽 ),随后的DNA改组的足够数量的常规准备,初步亚克隆质粒骨干到一个共同的基因。包括后来作为引物结合的巢式PCR和克隆网站( 图2)使用相同的侧翼> 20个核苷酸序列,这是非常重要的。
- 使用适当的引物(见AAV5模范引物表),从常见的腺相关病毒载体通常包含AAV2 rep基因的选择帽基因的PCR扩增所需的cap基因。 〜1微克纯化的产品,因为将使用标准的克隆PCR产物,已经是足够的,因此可以被用于任何常规PCR协议。
- 消化纯化PCR产物( 例如 ,使用琼脂糖凝胶净化标准的PCR纯化试剂盒)收件人质粒限制性内切酶的识别位点是在目前使用的上限扩增(1.1),以及在收件人质粒引物。在我们的实验室中,我们使用的Pac I和 Asc 我的网站( 图2),因为它们在大多数自动增值服务的缺席。
2。基于DNase的Cap基因碎片
- 从1.1-1.3步骤生成的质粒PCR扩增cap基因的选择。下文所述的一个反应会产生PCR产物〜3微克。根据cap基因库中包含的数量,这足以最多六个洗牌反应的。
- 对于PCR,建立50μL含有200毫微克帽质粒,每个引物终浓度为2微米,10微升5倍的HiFi缓冲区和1μL高保真聚合酶反应。开始5分钟,在95°C,然后运行40个周期15秒94°,30秒57°C和68分钟3℃,最后10分钟的步72°C。纯化的PCR产物经凝胶或套件,然后成立一个控制DNA酶消化创建帽基因片段重新组装成嵌合体。
- 因此,同样混合了各种帽 PCR产物到4微克的总金额在54μL的H 2 O加入6μLDNA酶反应缓冲液和0.5μLDNA酶I的反应,仔细拂去三次,旋转简要立即放入25°C加热块。孵育1至2分钟(设置多个平行反应和终止以15秒为增量),然后停止反应,加入6μL25 mM的EDTA,并简要涡旋和孵化10分钟,在75°C。
- 在一个标准的1%琼脂糖凝胶净化帽碎片。理想的情况下,一抹黑,应该是100和500个碱基对之间可见。由于抗酶是一种高效酶,妥善处理和时序是在这一步的关键和步骤2.3在孵化时间的多种变化,可能需要最佳的水库ULTS( 图3)。净化洗脱DNA使用一个标准的工具包,并确定其浓度。
3。 DNA家族改组
- 首先,重新组装成帽片段通过PCR扩增全长序列中,他们自贷部分同源性为基础的。因此,建立与500纳克纯化片段(步骤2.4),10μL10X Phusion缓冲区,1μL10 mM的dNTPs浓度,1.5μLDMSO和0.5μL的Phusion二聚合酶的50μL的反应。孵育30秒至98°C,然后运行40周期10秒98°C间,30秒42°C和45秒72°C时,最后10分钟的步在72°C。
- 在随后进行的第二次PCR,随后克隆扩增为cap基因重新组装,用引物结合到保守的侧翼序列( 图2)。因此,建立50μl的反应体系中含有2μl第一次PCR(步骤3.1),每个引物终浓度在2微米,0.5μL氯化镁的,10μL5倍的HiFi缓冲区和1μL高保真聚合酶。我们建议运行16-24完成报告,以确保足够高的收益率,为后续的克隆。在PCRS池和净化全长帽带(凝胶或套件)。
- 消化与克隆的Pac I和 Asc 我纯化帽基因库复制主管腺相关病毒载体携带AAV的国际电信规则“(末端反向重复序列;复制和包装信号)以及AAV2 rep基因。后者应遵循相同的网站,以适应帽基因库“的框架”(详见图2)。为了实现完全消化PCR产物,孵化过夜过剩酶。
- 在3:1的摩尔比结扎帽的片段,并适当削减腺艾提科信/ REP骨干。 40μl总体积mastermix(20转换足够)与最终的DNA浓度为50 ng /μl和孵育过夜在16°C。
- 变换与30μL电主管大肠杆菌混合(冰)2μL连接反应大肠杆菌 (从商业细胞的生长和主管使用任何标准的协议)。添加到预冷电试管冰(1毫米的差距)。 Electroporate在1.8千伏,200Ω和25μF。应该接近5毫秒的时间常数。立即加入1毫升预热的SOC培养基,转移到250毫升容量瓶。等20 electroporations将产生约1×10 6个不同的克隆多样性的图书馆。
- 1卷预热的SOC培养基添加汇集的转换,并在37°C和180转速为1小时摇。然后把LB培养基中加氨苄青霉素(终浓度为50微克/毫升)的总容积为800毫升和另外16小时在相同条件下孵化。净化库使用,如质粒DNA。 1 Qiagen公司兆丰准备套件。
可选步骤3.6:要计算出准确的库多样性,板在aliquOT 800毫升溶液LB-氨苄青霉素板( 例如 ,10μL10厘米板)和计数菌落第二天(前16小时的潜伏期)。此外,为了验证高的洗牌效率,序列,例如 24的克隆和调整他们的父母盖基因(又见图8)。最后,确认图书馆的生命力和高功能的多样性,亚克隆随机挑选到AAV帮手cap基因的质粒,并利用它们生产和分析在小规模的重组载体( 图4-5)(见下面的步骤5.4)。
4。生产的病毒库
- 种子10 15厘米HEK293T细胞菜(4.5x10 6细胞/皿)和48 h后转染与220微克的AAV库和220微克腺病毒载体(腺相关病毒繁殖所需的)。因此,预暖PEI(聚乙烯)和37毫米氯化钠300°C。再拌入7.9毫升氯化钠和DNA,并添加H 2 O总VOLU我15.8毫升。在一个单独的管,混合裴毫升,7.9毫升氯化钠3.52和4.38毫升H 2 O(十转染的所有卷)。结合的混合物(涡)和均匀分布在菜(每盘3毫升)的解决方案之前,在室温孵育10分钟。
- 48 h后,刮去到培养基中的细胞,在15分钟1200转速旋转下来。在6毫升裂解液(50毫米的Tris-HCl pH值8.5,50毫米碳酸氢钠3)和5冻融(-80/37℃)重悬细胞沉淀。孵育50 benzonaseü每毫升为1小时37°C间,纺前20分钟在3750转的细胞碎片。
- 准备15%,25%和40%稀释从60%碘克沙醇(PBS-MK OptiPrep)在PBS-MK(1X PBS,1毫米氯化镁 ,氯化钾2.5毫米)的股票(用2.5μL/毫升phenolred的的)。
- 用巴斯德吸管添加到1贝克曼快速密封的离心管(14x89毫米)5毫升病毒悬液,成立了由腺相关病毒纯化的梯度,其次是1.5毫升EAC15%,25%和40%的碘克沙醇溶液小时。顶过裂解液的梯度。
- 在4°C在1贝克曼Ti70.1转子的超速离心机在50.000ķ为2小时。然后用70%乙醇的清洁外管,坚持到针管的顶部通风和吸取1.2毫升40%的碘克沙醇用针的分数。照顾,以避免画从25%的分数,因为它包含空的腺相关病毒衣壳。
5。筛选和选择
- 在这一点上,人们可以反复放大在细胞培养或动物在整个库,直到嵌合体衣壳参展所需的属性已经出现( 图6-11)。
- 要选择在培养的细胞,感染各种等分库( 例如 ,1,10和100μL)和腺病毒5支持AAV的增长。多个图书馆的变化和腺病毒辅助测试是必不可少的,在一个特定的细胞类型的传染性库无法预测。收获〜3天的细胞后,通过冻融提取扩增腺相关病毒灭活腺病毒为30分钟,56°C和再感染新的细胞。重复了5次,直到鲜明的衣壳成为丰富(测序验证)。
- 对于选择在动物体内,感染库和提取所需的组织或细胞类型〜1周后。不要合作,腺病毒感染,因为这会造成不良的动物毒性。拯救病毒DNA通过PCR,使用前相同的引物( 图2),重新克隆帽池,产生不同的衣壳,直到成为丰富(测序验证)一个新的库和重复。
- 选择在体内的确切条件(体积,效价,路线)将取决于靶组织的利益。对肝,老鼠通常在经尾静脉注射(IV)的总体积200μLPBS 1×11到1x10 12病毒颗粒感染。限制因素是通常的origina的病毒滴度L编制,因为注射1×10 12 200μL的AAV滴度至少5×12 / ml的要求,这不是所有的实验室常规实现。因此,虽然最高滴度为首次感染是有利的,因为库尚未被浓缩在一个特定组织的高效衣壳,因此可能有一个相对较低的整体感染力,我们会建议使用至少1×11颗粒每小鼠肝选择。
- 如果多个小鼠,这是非常有用的注入类似于在培养的细胞选择不同的粒子数,使用每组小鼠(然后集中收集肝脏内各组),以尽量减少变异,并增加成功利率,如3小鼠在1×11和3小鼠在1×12颗粒。
- AAV是一种非致病性和复制,不称职的(不含helpervirus)病毒以来,在亚丁的情况下看有没有不良反应ovirus。
- 对于euthanization,动物anesthesized使用异氟醚蒸发器和随后通过颈椎脱位安乐死。
- 组织(在这种情况下,肝脏),收获后证实动物安乐死。在一般情况下,有没有还需要其他组织灌注的动物或收获腺病毒感染的器官之前死亡,因为AAV DNA是稳定的,并可以很容易地从冷冻细胞/组织抢救。
- 学习单衣壳(从库(步骤3.6),或选择后(步骤5.2-5.3)),生产编码基因( 如GFP 6)以下步骤4.1-4.5记者AAV载体。因此,利率上限基因的克隆到一个标准的腺相关病毒辅助质粒2。在4.1步,三转染与14.7微克每腺相关病毒载体(记者编码),AAV的助手和腺病毒辅助细胞。感染的细胞培养与纯化的病毒或动物在不同的数额和决定NE传导效率,例如通过流式细胞仪或显微镜。
6。代表结果
这里列出使用该协议的结果通常在病毒库约1×10 6,然后可以为单一显示大多数颗粒或一个给定的细胞株或动物所需的所有属性筛选的独特衣壳的多样性。在下面,我们将提供从体外或体内放映的结果有代表性的例子。
在此之前,但是,我们认为重要的是再次指出,个别克隆分析它们的功能和多样性(可选步骤3.6)从原来的质粒库的实用性。这是因为后者的两个参数是选择实际的病毒库,从质粒库成功的最关键的先决条件。因此,人们可以随意选择单洗牌cap基因,并用它们来表达一种轻松地检测和量化的报告基因的重组腺相关病毒载体(粗提物或纯化的颗粒,根据所需的准确度)。然后比较不同的衣壳的变种,是一个典型的检测荧光显微镜,作为代表性的例子在图中所示。 4。
另一种方法是基于流式细胞仪测量荧光报告基因的表达,拥有额外的好处,它也允许每个细胞的基因表达的决心,加上它悬浮细胞。 图。 5显示了一个典型的原油腺相关病毒载体在不同的细胞类型裂解流式细胞仪为基础的分析结果。
因为上面介绍的个别上限嵌合体的选择是随机的和有限制的,这当然不是一个理想的候选人富集的实际方法非常有用。相反,选择的VIRAL库中的靶细胞或动物组织是比较合适的。由于条件和参数会随每个应用程序,我们将只突出几个有代表性的指导方针和结果。
最简单的选择是迭代图书馆放大培养的细胞系或原代细胞(步骤5.2)。由于腺需要共同感染腺病毒的传播,靶细胞必须对腺病毒易感。一个可以成长和感染他们,例如,在6孔板持有足够的细胞数量,每口井,库,以确保全覆盖。第二个重要的概念是平衡和腺病毒的AAV细腻;太多的AAV将抑制腺病毒,而后者的过剩会杀死细胞(不像腺相关病毒,腺病毒引起的溶骨性感染),自动增值服务之前可以复制。
然而,由于库传染性上有一定的细胞类型是未知的,寻找“好”腺相关病毒:腺病毒比率这都可以传播需要并行测试各种组合库的剂量和腺病毒辅助( 例如 ,10:1,1:1和1:10)。一个良好的措施是有力的腺病毒感染发生病毒接种后3天的细胞病变效应,证明了细胞四舍五入和分离图。 6, 反之亦然 ,为腺相关病毒感染的有效读出和放大衣壳西方印迹蛋白质的检测,使用B1抗体承认一个高度保守的AAV衣壳抗原( 图7)7。
原油腺提取物挑随后的新鲜细胞再感染(5.2步),然后是一个重要的决定。理想的情况下,将采取那些AAV衣壳带至少显着( 图7),因为这些建议紧密的基因型-表型之间的联系。后者描述的情况,其中一个基因编码有一定的衣壳变种其实打包成相应的衣壳。为了实现和保持紧密的基因型 - 表型之间的联系是成功选择个别的病毒候选人的关键,因为它反过来,确保所需的属性衣壳进入细胞提供感染在连续两轮的同源基因模板。因此,我们建议选择中度衣壳表达对再感染的粗提取物,并使用极少量。总之,这两项措施将防止衣壳蛋白/基因组的不同组合,否则可能扰乱基因型 - 表型之间的联系,一旦再感染病毒开始到非同源衣壳的基因组复制和重新包装,新感染的细胞超载。
此外,它是监测期间反复感染DNA测序轮库多样性的关键。理想的情况下,人们会发现个别克隆组成的变化,表明成功的选择, 即 accum不同的血清型片段和他人损失的,在图为例,ulation的。 8。在完美的情况下,只有少数几个甚至一个单一的克隆最终将被检测到,然后可以分析如上所述。但是,如果没有变化观察4或5代后,应增加选择压力(见讨论),或认为所使用的细胞株可能是不适当的,因为它可能是太容易受到太多的血清型。
库体内扩增(步骤5.3),适用相同的规则和注意事项,两个关键的区别:首先,不会在屏幕上随机选择的克隆动物由于相关的成本和伦理方面的考虑。其次,一个不会合作与辅助腺病毒感染,因为它会导致动物的毒性反应或死亡,再加上腺病毒的取向将辅助病毒的细胞容易受到限制的选择。相反,腺相关病毒库注入日ê动物,通过聚合酶链反应( 图9)从靶细胞/组织抢救,然后再克隆和重新打包为一个新一轮感染。作为与文化的选择,这个过程反复进行,直至出现了个别考生。
无论选择程序,最后一步是验证在适当的系统的富集衣壳变种。 图。 10和11显示执行在组织培养或在小鼠肝脏异常的AAV嵌合体从我们自己先前的选择有代表性的例子。正如图。 10,一个特定的克隆(3)的AAV-DJ确实优于广泛的细胞株中的8个自然的AAV wildtypes集合。最后,在培养肝癌行选择另一个克隆表现出了较高的小鼠肝的取向和相应少小康目标时,周注入到成年小鼠比烈性AAV8控制测试向量直接COM比较( 图11)。请注意,虽然是肝脏更具体,克隆AAV-DN的实际转导少一点效率比AAV8这个器官。在这方面,AAV-DN的腺相关病毒的进化和选择最终候选人通常表现出所需的属性的数量,但不一定是在各方面的完美的结果是良好的代表性的例子。
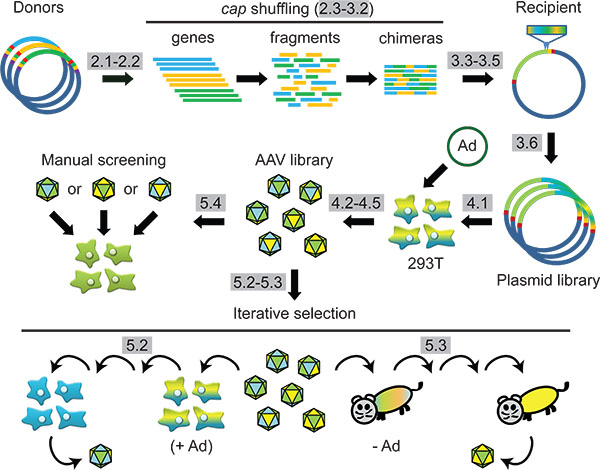
图1计划:合成AAV衣壳工程通过DNA家族改组和随后在细胞或动物的选择。议定书“的步骤,以灰色突出。
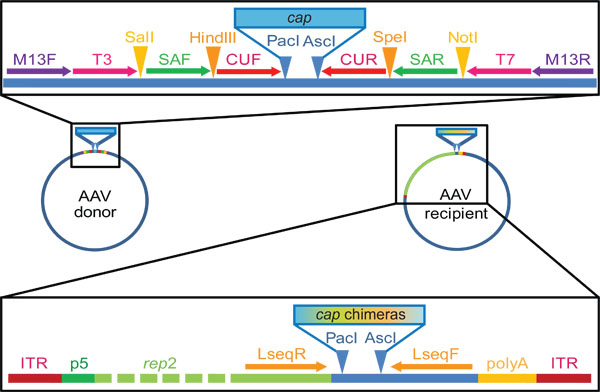
图2。AAV的cap基因捐助者和在我们的实验室中使用收件人质粒DNA家族改组和库代。请注意,这些是唯一有代表性的例子,确切地点和序列可定制。市售载体pBluescript II KS(+)的载体,我们设计包含显示的引物结合以及酶切位点,描绘箭头或三角形,分别来自我们的基本捐助质粒。然后,我们克隆到该质粒帽基因的腺相关病毒血清型1-9(CAPF /引物扩增), 经 Pac I和ASC我酶切位点两侧。塞夫/ R或CUF /右,或在巢式PCR引物T3和T7用于盖在步骤2.2隔离,而使用或者对引物,可以完成后重新组装的嵌合序列(步骤3.2)放大。进行收件人质粒的复制能力的AAV反向末端重复序列(ITRS,复制和包装信号)侧翼AAV2代表基因控制下的AAV P5启动。 的Pac I和 ASC 我酶切位点下游的代表允许框架“克隆”池洗牌cap基因。 “显示Lseq引物结合位点有用的是帽基因测序(步骤3.6)。

图3。cap基因的DNA酶I消化(AAV2,8和9)的范例。 cap基因的产品的琼脂糖凝胶电泳分析显示,消化,使用指定的不同的孵育时间(分钟:秒)。巷u显示未消化的控制输入帽片段池。车道中的DNA标记带的大小M是个碱基。在这个例子中,理想的消化与孵化时间1:45或下午2:00分,取得了约100至500个碱基对的主要首选峰(黄色框)获得。

图4与5个不同的重组YFP表达腺相关病毒已经感染了三种人类细胞系的显微镜为基础的分析为例。构造函数(在上面的名字)洗牌cap基因AAV2,8日和9为基础的原始库随机抽取。

图5。基于流式细胞仪分析细胞感染类型,与18个不同的重组YFP表达AAV载体(上面的名字,包括那些从图4)(串行10倍稀释)与洗牌帽基因随机选择从原来的库(AAV2,8和9)。 YFP表达颜色编码,方便的可视化。描绘的百分比转导的细胞,即黑总是显示0%和白色在不同的细胞类型测量的最高数字。克隆B2(红色),充分体现了总体疗效差的克隆,可以预计未选择衣壳。请注意,流式细胞仪分析更为敏感,也可以用于悬浮细胞(如SupT1)是较难显微镜。胡锦涛,人;万亩,鼠。
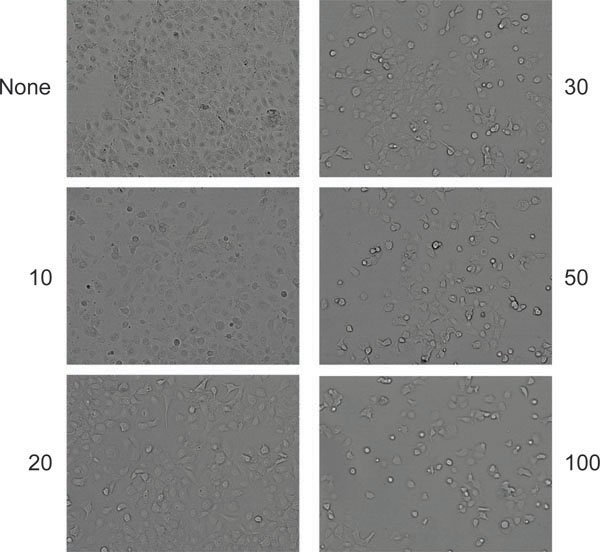
图6。富有成效的合作与腺相关病毒和腺病毒感染后细胞病变效应(在这种情况下,HeLa细胞)的典型外观。细胞被留下未受感染者(左上角的面板),或与指定金额(每单元的粒子)的腺病毒感染。

图7。西方印迹作为衡量图书馆的感染和放大AAV衣壳蛋白表达的检测。左印迹显示与各卷(微升)的腺相关病毒库和辅助腺病毒共同感染的细胞。前两个车道是合作的好例子nditions产生几乎检测不到的腺相关病毒蛋白的表达,表明足够的,但没有过多的腺相关病毒感染和放大,因此所需的严密的基因型 - 表型联动。因此,0.1,1或10微升这些上清用于新鲜细胞再感染(右印迹)。车道ç细胞感染腺单独作为阴性对照组(没有检测到表达由于没有helpervirus)。
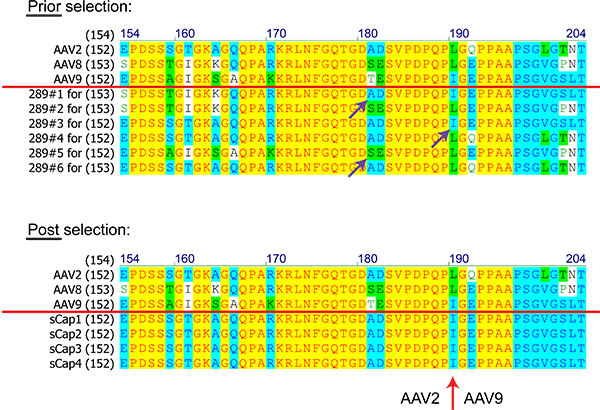
从库的蛋白质序列的AAV克隆(数字氨基酸)的比较图8。基于AAV2,8日和9之前和之后的选择。红线以上的序列表明,父母的自动增值服务。紫色箭头表示同源重组事件。红色箭头标志着跨比AAV2和AAV9在所有选定的克隆指出。
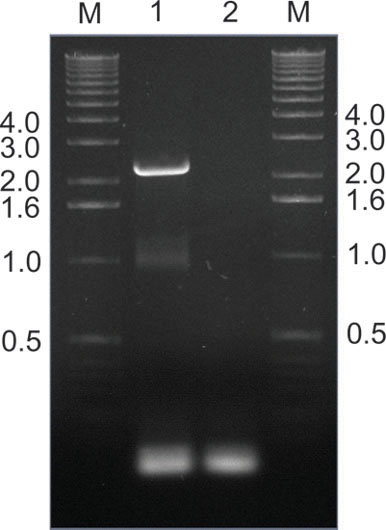
图9。</ STRONG>救援成功感染AAV的克隆,通过PCR技术从小鼠组织。在这个例子中,AAV的cap基因为PCR扩增小鼠肝脏中提取外设库输液一个星期后,用引物对苏丹武装部队/( 图2)。巷1显示了预期的2.2碱基带,而2巷是一个非模板控制。以下的Pac I和AscⅠ酶切 ,扩增片段进行重新克隆到质粒,为后续生产和一所中学的图书馆重新灌注原始收件人( 图2)。在碱基的DNA分子标记在小巷中号带的大小表示。

图10。丰富的腺相关病毒在培养细胞嵌合体的性能优越的范例。我们已克隆腺相关病毒的DJ前3;它主要代表了腺相关病毒血清型2,8和9之间的混合,并已选择从librar Ÿ存在汇集人类血清中含有这些人类肝细胞中的其他血清型的三加五。比较其效率,以8个自然腺相关病毒血清型(顶部1-6,8日和9所示),所有cap基因被用于生产纯化的自我互补的GFP表达载体8,19。这些正常化每毫升含有2X10 9载体的基因组,然后使用转导在10倍系列稀释的细胞株。三天后,表达GFP的细胞计数和感染性滴度测定,考虑稀释因子。在对比图中的代码。 5,较深的颜色在这里表示infectivities每个粒子数较高。很明显,所选的AAV-DJ嵌合体优于所有的天然的腺wildtypes,彰显成功应用的选择方案。 fibr,成纤维细胞;公顷,仓鼠;胡锦涛,人力;万亩,鼠,猴; SI。

图11。分析选定的AAV嵌合体小鼠肝为例。克隆人的AAV-DN的是选择对小鼠肝癌细胞,然后用于生产荧光素酶表达的重组载体8。所示的代表小鼠(每组3个)上已知的最有力的天然菌株在小鼠肝9野生AAV8,根据这个载体或控制的同等剂量的外围输液后一个星期。请注意,虽然AAV-DN的克隆使肝(面板( 我 ))整体表现略少,是因为它更适合本机关的具体表现大大低于非肝组织中的小康目标,一旦肝脏表达水平已经通过调整成像软件(面板( 二 ))。
讨论
在这里,我们提出必要的实验步骤和AAV衣壳工程的指导方针,通过DNA家族改组,并在细胞或动物的进化。从本质上讲,这些协议是标准化的程序,我们的腺相关病毒领域内首次报道于2008年3版本。虽然一阵别人的后续研究已经报道了许多修改,例如 ,10-13,我们目前的版本代表产生重复性的结果,而服从缩放和适应任何需要的基本策略。
尽管我们的努?...
披露声明
所有作者的声明,他们没有透露。
致谢
感谢作者在海德堡大学卓越CellNetworks的集群Chica和海因茨·夏勒博士(CHS)的基础以及出色的支持,他们的实验室,团队成员和工作。我们对此表示赞赏腺相关病毒的分子进化,通过DNA家族改组已成为一个非常活跃的领域,我们三年前首次出版以来,因此不能引用在这里由于篇幅所限,其工作的有关出版物的所有作者道歉。
材料
| Name | Company | Catalog Number | Comments |
| 试剂名称 | 公司 | 目录编号 | |
| DNA酶I | Invitrogen公司 | 18068-015 | |
| 聚乙烯亚胺(PEI) | Sigma-Aldrich公司 | 408727 | |
| 限制性内切酶 | NEB | 各个 | |
| T4 DNA连接酶 | NEB | M0202T | |
| 凝胶提取试剂盒 | Qiagen公司 | 28704 | |
| phusion二聚合酶套件 | finnzymes(NEB) | 的F-540S | |
| HotStar高保真聚合酶试剂盒 | Qiagen公司 | 202602 | |
| 二甲基亚砜 | finnzymes(NEB) | 的F-540S(套件的一部分) | |
| EDTA(25毫米) | Invitrogen公司 | 18068-015(套件的一部分) | |
| 三 | 罗斯 | 4855.2 | |
| 氨苄西林钠盐 | 罗斯 | K029.2 | |
| dNTPs浓度(10毫米,100微升) | Invitrogen公司 | 18427013 | |
| 碘克沙醇(OptiPrep) | 轴盾 | 1114739 | |
| Phenolred | 默克公司 | 107241 | |
| 巨型质粒准备套件 | Qiagen公司 | 12181 | |
| 超速离心机 | 贝克曼 - 库尔特 | 舰L90K | |
| 快速密封离心管 | 贝克曼 - 库尔特 | 342414 | |
| 电单位 | BIO-RAD | GenePulserXcell | |
| 热循环仪 | Eppendorf公司 | VAPO保护 | |
| 加热块 | 博日 | MB-102 | |
| 荧光显微镜 | 奥林巴斯 | IX81 | |
| 流式细胞仪 | 贝克曼 - 库尔特 | cytomics FC500的MLP | |
| MegaX DH10B T1R细胞 | Invitrogen公司 | C640003 | |
| benzonase | 默克公司 | 101695 | |
| 腺病毒5 | ATCC | VR-5 | |
| 载体pBluescript二KS(+)质粒 | Stratagene公司 | 212207 | |
| cap5F(PAC我在网站黄色,cap5的特定序列大胆): GACTCTTAATTAACAGGT ATGTCTTTTGTTGATCACCCTCC | IDTDNA | 自定义底漆 | |
| cap5R(ASC绿色,在的大胆cap5特定序列)在我的网站: GTGAGGGCGCGCC TTAAAGGGGTCGGGTAAGGTATC | IDTDNA | 自定义底漆 |
参考文献
- Grimm, D., Kay, M. A. From virus evolution to vector revolution: use of naturally occurring serotypes of adeno-associated virus (AAV) as novel vectors for human gene therapy. Curr. Gene Ther. 3, 281-304 (2003).
- Grimm, D. Production methods for gene transfer vectors based on adeno-associated virus serotypes. Methods. 28, 146-157 (2002).
- Grimm, D. In vitro and in vivo gene therapy vector evolution via multispecies interbreeding and retargeting of adeno-associated viruses. J. Virol. 82, 5887-5911 (2008).
- Muller, O. J. Random peptide libraries displayed on adeno-associated virus to select for targeted gene therapy vectors. Nat. Biotechnol. 21, 1040-1046 (2003).
- Perabo, L. In vitro selection of viral vectors with modified tropism: the adeno-associated virus display. Mol. Ther. 8, 151-157 (2003).
- Zolotukhin, S., Potter, M., Hauswirth, W. W., Guy, J., Muzyczka, N. A "humanized" green fluorescent protein cDNA adapted for high-level expression in mammalian cells. J. Virol. 70, 4646-4654 (1996).
- Wobus, C. E. Monoclonal antibodies against the adeno-associated virus type 2 (AAV-2) capsid: epitope mapping and identification of capsid domains involved in AAV-2-cell interaction and neutralization of AAV-2 infection. J. Virol. 74, 9281-9293 (2000).
- Grimm, D. Fatality in mice due to oversaturation of cellular microRNA/short hairpin RNA pathways. Nature. 441, 537-541 (2006).
- Nakai, H. Unrestricted hepatocyte transduction with adeno-associated virus serotype 8 vectors in mice. J. Virol. 79, 214-224 (2005).
- Koerber, J. T., Jang, J. H., Schaffer, D. V. DNA shuffling of adeno-associated virus yields functionally diverse viral progeny. Mol. Ther. 16, 1703-1709 (2008).
- Li, W. Engineering and selection of shuffled AAV genomes: a new strategy for producing targeted biological nanoparticles. Mol. Ther. 16, 1252-1260 (2008).
- Ward, P., Walsh, C. E. Chimeric AAV Cap sequences alter gene transduction. Virology. 386, 237-248 (2009).
- Yang, L. A myocardium tropic adeno-associated virus (AAV) evolved by DNA shuffling and in vivo selection. Proc. Natl. Acad. Sci. U.S.A. 106, 3946-3951 (2009).
- Perabo, L. Combinatorial engineering of a gene therapy vector: directed evolution of adeno-associated virus. J. Gene. Med. 8, 155-162 (2006).
- Maheshri, N., Koerber, J. T., Kaspar, B. K., Schaffer, D. V. Directed evolution of adeno-associated virus yields enhanced gene delivery vectors. Nat. Biotechnol. 24, 198-204 (2006).
- Wu, Z., Asokan, A., Samulski, R. J. Adeno-associated virus serotypes: vector toolkit for human gene therapy. Mol. Ther. 14, 316-327 (2006).
- Kwon, I., Schaffer, D. V. Designer gene delivery vectors: molecular engineering and evolution of adeno-associated viral vectors for enhanced gene transfer. Pharm. Res. 25, 489-499 (2008).
- Perabo, L., Huber, A., Marsch, S., Hallek, M., Buning, H. Artificial evolution with adeno-associated viral libraries. Comb. Chem. High. Throughput. Screen. 11, 118-126 (2008).
- McCarty, D. M., Monahan, P. E., Samulski, R. J. Self-complementary recombinant adeno-associated virus (scAAV) vectors promote efficient transduction independently of DNA synthesis. Gene Ther. 8, 1248-1254 (2001).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。