JoVE 비디오를 활용하시려면 도서관을 통한 기관 구독이 필요합니다. 전체 비디오를 보시려면 로그인하거나 무료 트라이얼을 시작하세요.
Method Article
유전자 가족 걸어갔다 통해 공학 및 합성 Adeno-관련 바이러스의 진화 (AAV) 유전자 치료 벡터
* 이 저자들은 동등하게 기여했습니다
요약
우리는 molecularly 유전자 가족 걸어갔다 통해 합성 Adeno-관련 바이러스 (AAV) 유전자 치료 벡터를 엔지니어이며 진화하는 기본적인 기법을 보여줍니다. 더욱이, 우리는 선택과 문화 혹은 생쥐의 표적 세포에 대한 향상된 특성을 가진 각각의 키메라 capsids의 분석을위한 일반 지침 및 대표 예제를 제공합니다.
초록
Adeno - 관련 바이러스 (AAV) 벡터 인해 유익한 특성 1의 독특한 조합으로 치료 인간의 유전자 전달을위한 가장 강력하고 유망한 차량의 일부를 나타냅니다. 이들은 기본 wildtype 바이러스와 높은 titer, 고순도 및 임상 수준의 재조합 벡터 2의 생산을위한 고도의 방법론의 apathogenicity을 포함합니다. 다른 바이러스여 AAV 시스템의 더욱 특별한 장점은 자연스럽게 모두 쉽게 일반적인 프로토콜 1,2을 사용하여 벡터로 설계하실 수 있습니다 아직 필수 속성에 차이가 serotypes을 발생 풍부한의 가용성이다. 또한, 우리 자신을 포함한 그룹의 숫자가 최근 중 여러 입력 serotypes의 자산, 또는 어떤 분리 하나의 속성을 강화를 결합하여 합성 벡터의 생성을위한 템플릿으로 이러한 자연적인 바이러스를 사용하는 전략을 고안했습니다. 각각의 기술은 이러한 목표에게 AR를 달성하기전자 하나의 DNA 가족 걸어갔다 3 부분 homologies (일반적으로 대부분의 AAV의 serotypes을위한> 80 %), 또는 4,5 펩타이드 디스플레이, 보통 일곱 아미노산, 즉 삽입로를 기반으로 자신을 다시 조립 뒤에는 다양한 AAV capsid 유전자의 예 조각화 원하는 세포 유형에 펩타이드가 이상적으로 mediates을 다시 타겟팅 바이러스 capsid의 노출 루프. 최대 성공을위한 두 가지 방법은 프로토콜 백만 번째를 둘러싸고 뚜렷한 capsid 변종의 라이브러리를 양보하도록 상향 조정됩니다 의하여 높은 처리량 방식으로 적용됩니다. 각 클론 그 후 수많은 부모 바이러스의 고유한 조합 (유전자 걸어갔다 접근 방식)으로 구성하거나 동일한 바이러스 백본 (펩타이드 디스플레이 방식) 내에서 독특한 펩타이드를 포함합니다. 이후 마지막 단계는 대부분 또는 선택 과정에 이상적으로 모든 요구 사항을 충족 개별 capsids에 대해 풍부하게하기 위해서는 대상 세포에 이러한 라이브러리의 선택을 반복합니다. 선호 빗 후기같은 반 AAV 항체와 반응 모든 capsids의 인스턴스 제거에 대한 부정적인 선택과 관심이 특정 세포 종류,,에 성장 등 아이 네스 긍정적인 압력. 이 조합은 선택을 이겨낸 합성 capsids은 아마 모든 자연적으로 발생하는 AAV 고립에서 발견되지 않았 방식으로 주어진 어플 리케이션의 요구와 일치하는 확률이 높아집니다. 여기서는 이론적으로 두 개의 기술을 실험적으로 많은 도전과 같은 DNA의 가족 걸어갔다 방법에 초점을 맞춥니다. 우리는 설명하고 보여주 단행 AAV 라이브러리 생성 및 선택 (그림 1)에 대한 모든 필수 단계를, 다음 하나는 이에 분자 AAV의 진화와 함께 성공하기 위해 알아야 할 것이 프로토콜의 함정과 중요한 측면을 논의합니다.
프로토콜
1. AAV Capsid의 유전자를 인코딩 플라스미드 세트의 작성
- 이후 DNA를 걸어갔다위한 다양한 AAV capsid (캡) 유전자의 충분한 양의 일상적인 준비를 용이하게하기 위해 초기에는 일반적인 플라스미드 백본으로 이러한 유전자를 subclone. 그것은 중첩된 PCR 및 클로닝을위한 프라이머 바인딩 사이트 (그림 2)처럼 나중에 사용하기 위해> 20 세포핵의 동일한 측면 시퀀스를 포함하는 것이 중요합니다.
- (AAV5을위한 모범적인 primers에 대한 표 참조) 적절한 primers를 사용하여 PCR 일반적으로 선택 캡 유전자 옆에 AAV2 대리인 유전자를 포함하는 일반적으로 사용 가능한 AAV의 plasmids에서 원하는 캡 유전자를 증폭. PCR 제품이 표준 복제에 사용될 것이므로 제품을 정화 중 ~ 1 μg은 이미 충분하고, 모든 기존의 PCR 프로토콜은 따라서 사용할 수 있습니다.
- 정화 PCR 제품 (예 : 아가로 오스 겔 정화 또는 표준 PCR 정화 키트를 사용)와 소화수신자가 누구인지 사이트 캡 증폭 (1.1)에 대한뿐만 아니라 플라스미드 수신자 사용된 primers에 존재 제한 효소로 플라스미드. 그들이 가장 AAVs에 결석 그대로 우리 연구실에서는 PAC I 및 ASC 나 사이트 (그림 2)를 사용합니다.
2. DNase 기반 캡 진 조각화
- PCR은 1.1-1.3 단계에서 생성된 plasmids에서 선택 캡 유전자를 증폭. 아래 설명된 바와 같이 하나의 반응은 PCR 제품의 ~ 3 μg를 얻을 것입니다. 이 suffices 여섯 걸어갔다 반응까지, 라이브러리에 포함시킬 캡 유전자의 수를 위해 따라.
- PCR의 경우 플라스미드 200 NG 캡, 2 μm의 최종 농도에서 각각 입문서, 10 μl 5 배 고음질 버퍼와 1 μl 고음질의 효소를 포함하는 50 μl 반응을 설정합니다. 95 ° C 그리고 15의 40주기를 실행할 초 94 ° C, 30 초 57 ° C와 3 분 68 ° C, 최종 10 분 단계 다음에서에서 5 분,로 시작72 ° C. 겔 또는 키트를 통해 PCR 제품을 정화하고 chimeras로 다시 조립 캡 유전자 조각을 만드는 제어 DNase 다이제스트를 설정합니다.
- 따라서 똑같이 54 μl H 2 O에에서 4 μg의 총 금액 다양한 캡 PCR 제품을 섞어 , 반응에 6 μl DNase 반응 버퍼와 0.5 μl DNase I을 추가 신중을 세 번 동요, 간단히 돌리고 즉시 25 ° C 가열 블록을 입고. 1 사이의 2 분 (다중 병렬 반응 설정한 15 초 단위로 그들을 종료) 부화 후 6 μl 25 밀리미터 EDTA (에틸렌 다이아 민 테트라 초산)를 추가하여하고 간략하게 75시 10 분 vortexing하고 잠복기 ° C를하여 반응을 중지
- 표준 1퍼센트 아가로 오스 겔에 캡 조각을 정화. 이상적으로, 비방 100 500 기본 쌍 사이에 볼 수 있어야합니다. DNase 나 높은 적정량 효소, 적절한 취급과 타이밍이기 때문에이 단계에서 중요하며, 단계 2.3의 배양 시간에 여러 유사 콘텐츠는 최적의 해상도에 필요한 수도ults (그림 3). 표준 키트를 사용 eluted DNA를 정화하고 농도를 결정합니다.
3. 유전자 가족 걸어갔다
- 첫째, 그들은 스스로 소수 부분 homologies을 기반으로하는 PCR을 통해 장편 시퀀스로 뚜껑 조각을 다시 조립. 따라서, 500 NG 정화 조각 (2.4 단계), 10 μl 10X Phusion 버퍼, 1 μl 10 밀리미터 dNTPs, 1.5 μl DMSO와 0.5 μl Phusion II의 효소와 50 μl 반응을 설정합니다. 부화 30 초 98에 ° C ~ 그리고 10의 40 사이클을 실행하는 초 98 ° C, 30 초 42 ° C에서 45 초 72 72시 10 분 최종 단계 뒤에 ° C, ° C.
- 다음의 두번째 PCR에서 보존 측면 시퀀스 (그림 2)에 바인딩 primers를 사용하여 후속 복제를 위해 다시 조립된 캡 유전자를 증폭. 따라서, 첫 번째 PCR (단계 3.1), 2 μm의, 0.5 μl MgCl2의 최종 농도에서 각 프라이머의 2 μl를 포함한 50 μl 반응을 설정10 μl 5 배 고음질 버퍼와 1 μl 고음질의 중합 효소. 우리는 이후 복제에 대해 충분히 높은 수율을 보장하기 위해 16-24 PCRs를 실행하는 것이 좋습니다. 풀 PCRs하고 전체 길이 캡 밴드 (젤 또는 키트)를 정화.
- 에 클로닝을위한 PAC I 및 ASC 나와 함께 정화 캡 유전자 풀을 소화 복제 - 관할 AAV AAV ITRs (거꾸로 터미널 반복, 복제 및 포장 신호) 나르는 플라스미드뿐만 아니라 AAV2 대리인 유전자를. 후자는 (자세한 내용은 그림. 2 참조) "프레임에서"캡의 종자를 수용하기 위해 동일한 사이트 다음에해야합니다. PCR 제품의 완전한 소화를 달성하기 위해 과잉 효소와 하룻밤 알을 품다.
- 3시 1분 어금니 비율 캡 조각과 적절하게 잘라내 AAV ITR / 대표가 기개를 Ligate. 50 16시 μl / NG와 하룻밤 품어 ° C의 최종 DNA 농도와 40 μl 총 볼륨 mastermix (20 변환하기에 충분) 만들기
- 30 μl 전자 관할 E. 함께 혼합하여 결합 반응 (얼음) 2 μl를 변환 대장균 (상업용 세포의 성장 및 표준 프로토콜을 사용하여 유능한했다). 얼음 사전 냉각 electroporation의 cuvettes (1 밀리미터 간격)에 추가합니다. 1.8 kV, 200 Ω 및 25 μF에서 Electroporate. 지속 시간은 5 MS 가까이 있어야합니다. 당장 1 ML 미리 예열 SOC 매체와 250 ML 플라스크에 전송을 추가합니다. 20 등 electroporations 6 1x10에 대한 서로 다른 클론의 다양성과 함께 도서관을 얻을 것입니다.
- 풀링된 변환 1 볼륨 사전 예열 SOC 매체를 추가하고 37 ° C 및 1 H 180 rpm으로 흔들. 그런 다음 LB 매체 플러스 암피실린 (50 μg / ML의 최종 농도)과 총 볼륨 800 ML에 데리고와 같은 조건 하에서 다른 16 H 위해 품어. 예 :를 사용하여 라이브러리 플라스미드 DNA를 정화. Qiagen 메가 간이 키트.
정확한 라이브러리 다양성, 플레이트 aliqu을 계산하려면 다음 단계를 3.6에서 선택적LB-암피실린 판 (예, 10cm 접시 10 μl)와 카운트 식민지 다음날에 800 ML 솔루션 (이전 16 H 보육까지)의에게도. 또한, (그림도 참조하십시오. 8) 높은 걸어갔다 효율성, 시퀀스 예 : 24 클론을 확인하고 부모 캡 유전자로 정렬합니다. 마지막으로, 도서관 활력과 높은 기능적 다양성을 확인하고, subclone 무작위로 플라스미드 AAV 도우미로 캡 유전자를 포착하고 (아래 5.4 단계도 참조) 작은 규모 (Figs. 4-5)에서 재조합 벡터를 생성하고 분석하기 위해 그들을 사용합니다.
4. 바이러스성 라이브러리 제작
- 종자 10 15cm HEK293T 세포의 2 요리 (4.5x10 6 셀 / 접시) 및 48 H 220 μg AAV 라이브러리하기 transfect 및 adenoviral 플라스미드 220 μg을 (AAV 전파를 위해 필요). 따라서 사전 따뜻한 PEI (polyethylenimine)과 37 300 MM NaCl ° C. 그렇다면 7.9 ML NaCl과 DNA를 섞어, 그리고 총 volu에 H 2 O를 추가15.8 ML의 나. 별도의 튜브에서 3.52 ML PEI, 7.9 ML NaCl과 4.38 ML H 2 O를 (10 transfections의 모든 볼륨) 섞는다. 믹스 (소용돌이)를 결합하고 요리 (접시 당 3 ML)에 걸쳐 균등하게 솔루션을 배포하기 전에 상온에서 10 분 동안 품어.
- 48 H 후, 매체에 세포 긁어서 15 분 1,200 rpm으로 그들을 돌리다. 6 ML의 용해 완충액 (50 MM 트리스-HCL pH는 8.5, 50 MM NaHCO 3)과 5 냉동 해동 사이클 (-80/37 ° C)의 대상으로 세포 펠렛을 Resuspend. 20 분 대한 3,750 rpm으로 세포 파편을 회전하기 전에 37 일 H 용 ML 당 50 U benzonase ° C로 품어.
- 15%, 25 % 및 60 % iodixanol (PBS-MK의 OptiPrep) PBS-MK (1X PBS, 1 밀리미터 MgCl 2, 2.5 MM KCl)의 주식 40 %를 dilutions을 (2.5 μl / ML phenolred 포함) 준비합니다.
- Beckman 빠른 인감 원심 튜브 (14x89 ㎜)로 5 ML 바이러스 서스펜션을 추가하는 파스퇴르 피펫을 사용하여 AAV 정화를위한 그라디언트를 설정, 1.5 ML EAC 뒤에15%, 25 % 및 40 % iodixanol 솔루션의 H. 용해 버퍼와 그라디언트 꽉 채워.
- 4에 2 시인데위한 50.000 K에서 Ultracentrifuge ° Beckman Ti70.1 로터의 C #. 그런 다음 70 % 에탄올로 튜브의 외부를 청소, 환기를 위해 튜브의 상단에 바늘로 찌르는와 바늘을 사용하여 40 % iodixanol 분율 1.2 ML을 그립니다. 그것이 비어 AAV의 capsids가 들어 있으므로 25 %의 분획에서 그리기 피하기 위해주의를 기울입니다.
5. 심사 및 선정
- 원하는 성질을 전시 키메라 capsids은 (Figs. 6-11) 등장 때까지이 시점에서, 하나 하나 iteratively 교양 세포 또는 동물의 전체 라이브러리를 증폭하실 수 있습니다.
- 교양 세포에 선택하려면, AAV의 성장을 지원하기위한 다양한 라이브러리의 aliquots (예 : 1, 10 및 100 μl)와 아데노 바이러스-5를 공동 감염. 예측할 수없는 특정 세포 유형의 도서관 감염으로 라이브러리 및 adenoviral 헬퍼의 여러 유사 콘텐츠를 테스트하는 것은 필수적입니다. 을 수확~ 3 일 후에 세포, 56시 30 분 ° C와 다시 감염 새로운 세포에 대한 아데노 바이러스를 inactivate, 동결 - 해동을 통해 증폭 AAV 압축을 풉니다. 독특한 capsids은 (시퀀싱에 의해 검증) 풍부한 될 때까지 5 회까지 반복합니다.
- 동물의 선택은 도서관과 함께 감염과 ~ 1 일주일 뒤에 원하는 조직이나 세포 유형을 추출합니다. 이것이 동물에서 불리한 독성을 일으킬 것입니다로서 아데노 바이러스와 공동 감염하지 마십시오. 이전과 동일한 primers (그림 2)를 이용하여 PCR을 통한 바이러스의 DNA를 구출, 캡 수영장을 다시 복제, 독특한 capsids은 (시퀀싱에 의해 검증) 풍부한 될 때까지 신선 도서관과 반복을 생산하고 있습니다.
- 생체내의 선택에 대한 정확한 조건 (볼륨, titer, 노선)의 관심 대상 조직에 따라 달라집니다. 간장의 경우, 마우스는 일반적으로 꼬리 정맥 주사 (IV)를 통해 200 μl PBS의 총 볼륨의 1x10 1x10 11 ~ 12 바이러스성 입자에 감염됩니다. 제한 요소는 일반적으로 origina의 바이러스 titer입니다200 μl의 1x10 12 AAV의 주입은 적어도 5x10 12 / ML의 titer가 필요하기 때문에 내가 준비는 어떤 모든 연구소가 정기적으로 달성할 수 없습니다. 최대 titer은 (라이브러리는 아직 특정 조직의 효율적인 capsids에 대한 풍부한되어 오지 않았으며, 따라서 상대적으로 낮은 전반적인 감염이있을 수 있기 때문에) 첫 감염 유익 반면 따라서, 우리는 적어도 초당 1x10 11 입자를 사용하도록 권장 간 선택을위한 마우스.
- 여러 개의 마우스를 사용할 경우 서로 다른 입자 번호 교양 세포에서의 선택에 유사를 주입하고, 다양성을 최소화하고 성공을 높이기 위해 그룹 당 여러 생쥐 (다음 각 그룹 내에서 수집된 간은를 풀) 순서를 사용하는 것은 매우 유용하다 요금, 1x10 11시 등 세 생쥐와 1x10 12 입자에서 3 생쥐.
- AAV는 비 병원성 및 복제 - 무능한 (helpervirus 제외) 바이러스이기 때문에 아덴의 부재에서 찾고만한 불리한 반응은 없습니다ovirus.
- euthanization 들어, 동물 isoflurane 기화기 및 경추 탈구를 통해 이후 euthanized을 사용 anesthesized되었다.
- 동물 euthanized 확인되었다 후 티슈는 (이 경우 간암) 수확했다. 일반적으로 AAV의 DNA가 안정 쉽고 냉동 세포 / 조직부터 구조될 수 있기 때문에, 동물 perfuse하거나 죽기 전에 AAV에 감염된 장기를 적출하고 다른 조직에도 필요가 없습니다.
- 단일 capsids을 (라이브러리 (3.6 단계)에서 또는 선택 후 (단계 5.2-5.3)) 공부하려면 단계 4.1-4.5를 수행하여 리포터 유전자를 (예 : GFP 6) 인코딩 AAV 벡터를 생성합니다. 따라서, 2 플라스미드 표준 AAV 도우미에 관심 캡 유전자를 복제. 단계는 4.1에서 14.7 μg AAV 벡터 (기자 인코딩), AAV 헬퍼 및 adenoviral 헬퍼의 각각 세포를 트리플 transfect. 다양한 금액과 determi에서 정화 바이러스와 교양 세포 또는 동물을 감염FACS이나 현미경을 통해 NE 형질 도입 효율 예.
6. 대표 결과
프로토콜의 사용 후 주어진 세포주이나 동물의 대부분을 표시하는 단일 입자 또는 모든 필요한 속성에 대한 검사를하실 수 있습니다 6 1x10에 대한 독특한 capsids의 다양성과 바이러스성 도서관에서 일반적으로 결과를 여기에 설명했다. 다음에서 우리는 같은 시험 관내 또는 생체내 검사의 결과에 대한 대표 예제를 제공합니다.
그 전에는, 그러나, 우리는 그것이 중요한 또 자신의 기능과 다양성 (3.6 단계에서 선택 사항) 원래 플라스미드 라이브러리에서 각각의 클론을 분석의 유용성을 지적하는 것을 고려하십시오. 후자의 두 매개 변수는 플라스미드 도서관에서 만든 실제 바이러스 라이브러리의 선택의 성공을 위해 최대한의 중요한 전제가 있기 때문입니다. 따라서, 하나는 무작위로 단행 하나 선택할 수 있습니다캡 유전자와 쉽게 감지 및 같지는 리포터 유전자를 표현하는 재조합 AAV 벡터 (원유 추출물이나 정제된 입자, 정확성 원하는 정도에 따라)을 생산하도록 사용합니다. 다른 capsid 변종을 비교하기위한 전형적인 분석은 그림의 대표적인 예제와 같이 다음 형광 현미경입니다. 4.
다른 방법은 현탁액 세포에 대해 작동하는지 그것은 또한 세포 당 유전자 발현의 결정을 허용하는 추가적인 장점을 보유하고 형광 리포터 유전자 발현의 FACS 기반의 측정이고, 플러스. 그림. 5 다양한 세포 유형에 원유 AAV 벡터 lysates 같은 FACS 기반 분석의 전형적인 결과를 보여줍니다.
개별 캡 chimeras의 위에서 설명한 선택이 임의하고 제한된이기 때문에 원하는 후보자의 농축을위한 실제적인 접근과 같은 유용하지 물론이다. 바이올렛 대신, 선택동물의 표적 세포 또는 조직의 ral 라이브러리는 더 적합합니다. 조건과 매개 변수는 각 응용 프로그램과 다를 수 있으므로, 단지 몇 대표 지침과 결과를 강조 표시됩니다.
가장 쉬운 선택은 교양 세포 라인이나 일차 전지 (5.2 단계)에 도서관 증폭을 반복합니다. AAV는 전파를위한 아데노 공동 감염을 필요로하기 때문에, 대상 세포가 아데노 바이러스에 대한 취약 있어야합니다. 하나는 다음 라이브러리의 전체 커버 리지를 보장하기 위해 잘마다 충분한 세포 숫자를 개최 6 - 잘 접시에 성장하고 그들이 예 감염시킬 수 있습니다. 두 번째로 중요한 개념은 AAV의 균형과 아데노 바이러스가 섬세하다고이다; AAVs 복제 전에 후자의 과잉은 세포 (AAV 달리 아데노 바이러스는 lytic 감염을 일으키는) 죽일 것이다 동안 너무 AAV는 아데노 바이러스를 억제합니다.
아데노 바이러스 비율에서 : 특정 세포 유형에 대한 라이브러리 감염 알 수 있기 때문에 다만, "좋은"AAV를 찾는어느 모두 전파할 수있다는 도서관의 복용과 adenoviral 헬퍼 (예 : 10시 1분, 1시 1분 및 1시 10분)의 다양한 조합의 병렬 테스트를 필요로합니다. 유력한 아데노 바이러스 감염에 대한 좋은 척도가 사흘 바이러스 접종 후 cytopathic 효과, 세포 라운딩에 의해 입증하고 그림에서 본대로 분리의 발생이다. 6. 그 반대로, AAV 감염에 대한 읽기 밖으로 유용하고 증폭은 고도로 보존되어 AAV capsid 에피토프 (그림 7) 7 인식 지하 1 항체를 이용하여 모래 바닥은 서양에 의해 capsid 단백질의 검출이다.
중요한 결정은 원유 AAV 신선한 세포의 이후 다시 감염 (5.2 단계)를 선택할 추출하는 다음이다. 이들은 꽉 유전자형 - 표현형 연계를 제안하기 때문에 이상 적으로는, 하나는 AAV capsid 밴드는 (그림 7) 이상의 주목할 어디들을 취할 것입니다. 후자는 특정 capsid 변종을 인코딩 게놈되는 상황을 설명실제로 해당 capsid로 포장. 그것이 나아가 원하는 특성을 가진 capsids는 연속 감염 순찰 중에 세포에 기원 유전 템플릿을 제공한다는 보장으로 꽉 유전자형 - 표현형 연계를 달성하고 유지하기 위해서는 개별 바이러스 후보자의 성공적인 선택에 중요한 역할을합니다. 따라서, 우리는 다시 감염에 대한 중간 capsid 표정으로 원유 추출물을 선택하고 최소한의 금액을 사용하는 것이 좋습니다. 함께,이 두 조치는 다시 감염된 바이러스가 아닌 동족의 capsids으로 그들의 genomes를 복제하고 다시 포장을 시작 한 번 달리 유전자형 - 표현형 연계를 교란시키다 수있는 다른 capsid / 게놈 조합으로 새로 감염된 세포의 오버로드를 방지할 수 있습니다.
또한, 그것은 유전자 시퀀싱에 의한 반복 감염 순찰 도중 라이브러리 다양성을 모니터링하는 것이 중요합니다. 이상적으로, 하나는 성공적인 선택 지표로 개별 클론의 구성의 변화, 즉 accum를 느낄 것이다같은 그림 exemplified 다른 사람의 고유한 혈청형 조각과 손실의 ulation. 8. 완벽한 경우도 단지 몇이나 단일 클론은 궁극적으로 위에서 설명한 후 분석할 수있는 검색됩니다. 그러나, 어떠한 변화는 4 ~ 5 구절 후에 관찰하지 않으면, 하나 중 선택 압력 (토론 참조) 늘리거나 너무 많은 serotypes 너무 감염될 수 있기 때문에 사용되는 세포주가 부적 절한있을 수 고려해야합니다.
생체내의 도서관 증폭 (단계 5.3)의 경우, 동일한 규칙과 고려 사항 두 가지 중요한 차이점으로 적용 : 첫째, 하나는 관련 비용 및 윤리적 고려 사항으로 인해 동물에 화면이 무작위로 선택된 클론을하지 않습니다. 그것이 동물에 toxicities 또는 사망자가 발생, 플러스 adenoviral tropism이 헬퍼 바이러스에 감염될 세포에 선택을 제한하는 것처럼 둘째, 하나는 헬퍼 아데노 바이러스와 공동 감염되지 않습니다. 대신, AAV 라이브러리 번째로 생긴PCR (그림 9)에 의해 표적 세포 / 조직으로부터 구출한 후 다시 복제하고 새로운 감염 원형을 위해 다시 포장 E 동물. 개별 후보가 등장하기 전까지 문화 선택과 마찬가지로,이 프로세스가 반복됩니다.
에 관계없이 선정 절차, 마지막 단계는 적절한 시스템의 농축 capsid 변종의 검증이다. 무화과. 10 조직 배양이나 생쥐의 간은에 매우 잘 수행 AAV의 chimeras의 우리 자신의 이전 선택 11 쇼 대표적인 사례. 다른 이름으로 그림에서 본. 10, 하나의 특별한 클론 (AAV-DJ 3) 실제로 세포 라인의 광범에서 8 자연 AAV의 wildtypes의 컬렉션을 능가하는 성능. 마지막으로, 교양 간암 라인에서 선택된 다른 클론이 murine 간 높은 tropism을 전시하고 peripherally 직접 co.kr 사이트에서 테스트를 적정량 AAV8 제어 벡터보다 어른 생쥐에 주입했을 때 적절하게 적은 오프 타겟팅parison (그림 11). 간장에 대한 더 구체되고이라도 클론 AAV-DN 실제로 AAV8보다 조금 덜 효율적이 오르간을 transduces합니다. 이러한 측면에서, AAV-DN은 최종 후보자는 일반적으로 원하는 속성의 숫자를 전시하지만 모든 측면에서 반드시 완벽하지는 않지만 AAV 진화와 선택의 결과에 대한 좋은 대표적인 예입니다.
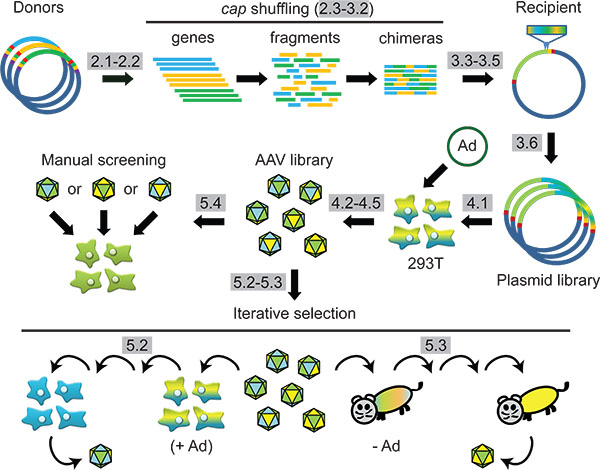
그림 1 계획 :. DNA 가족 걸어갔다 및 세포 또는 동물의 후속 선택을 통해 합성 AAV capsid 엔지니어링. 프로토콜 단계는 회색으로 강조 표시됩니다.
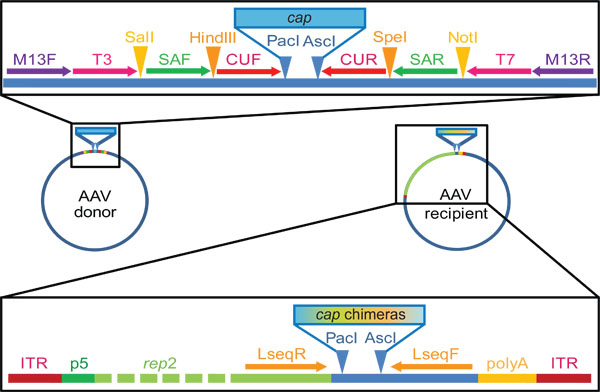
그림 2. AAV 캡 유전자 기증자와 DNA 가족 걸어갔다 및 도서관 발전을 위해 우리가 실험실에서 사용되는받는 사람 plasmids. 이 밖에 대표적인 예입니다 유의하고, 정확한 사이트와 순서 것을사용자 정의할 수 있습니다. 우리의 기본적인 기증자 플라스미드는 우리가 각각 화살표 또는 삼각형으로 그려진 그림 프라이머의 결합뿐만 아니라 제한 사이트를 포함할 수 있도록 설계 상용 pBlueScript II KS (+) 벡터에서 파생됩니다. 그러면 PAC I 및 ASC 저는 제한 사이트의 어귀가되고,이 플라스미드에 AAV serotypes 1-9 (primers capF / R로 증폭)의 캡 유전자를 복제. 다시 조립된 키메라 시퀀스 (단계 3.2) 이후 증폭이 프라이머 쌍을 사용하여 수행할 수 있습니다 반면 Primers T3과 T7은 단계 2.2의 캡 분리에 사용되는 SAF / R 또는 CUF / R, 또는 중첩된 PCR에서 모두. 플라스미드 복제 - 관할받는 AAV P5 프로 모터의 조절하에 AAV2 대리인 유전자 측면을 노릴 AAV 거꾸로 터미널 반복 (ITRs, 복제 및 포장 신호)를 운반합니다. 하류 대표가의 PAC I 및 ASC 저는 제한 사이트는 복제 "프레임"에 대한 허용 의 수영장 밖 캡 유전자 단행.그림 Lseq 프라이머 바인딩 사이트는 모자 유전자 시퀀싱 (3.6 단계)하는 데 유용합니다.

그림 3. 캡 유전자의 DNase I 다이제스트 (AAV2, 8 및 9)의 예제. 캡 유전자의 제품의 아가로 오스 겔 전기 영동 분석이 표시된 지정된 다른 배양 시간 (분 : 초)를 사용하여 소화. 차선 U는 컨트롤과 같은 소화되지 않은 입력 캡 조각 수영장을 보여줍니다. 레인의 유전자 마커 밴드의 크기는 M kilobases에 있습니다. 이 예제에서 이상이 소화가 100-500 기본 쌍 주위 선호하는 주된 피크 (노란색 상자)를 굴복 1시 45분 또는 2시 분의 배양 시간으로 획득했다.

그림 4. 다섯 가지 재조합 Yfp-표현 AAV를했습니다 감염된 세 인간의 세포 라인의 현미경 기반의 분석을위한 예제ctors (위에 이름) 단행 캡 유전자로 만든 무작위 AAV2, 8, 9를 기반으로 원본 라이브러리에서 선택했습니다.

무작위로 선택된 캡 유전자를 단행와 그림 5. 18 가지 재조합 Yfp-표현 AAV 벡터 (그림에서 포함 위에 이름. 4)에 감염된 네 세포 종류 (직렬 10 배로 dilutions에서)의 FACS 기반의 분석을위한 예제가 만들어 원래 도서관에서 (AAV2, 8 및 9). Yfp 표현은 쉽게 시각화를위한 색으로되었다. 검은색은 항상 0 %와 흰 각 세포 유형에서 측정된 가장 높은 숫자를 나타내는 약자의 위치 묘사된 비율은 세포를 transduced. 선택되지 않은 capsids 기대를 할 수있는 클론 B2 (빨간색)은 가난한 전반적인 효능과 클론을 exemplifies. FACS 분석이 더 민감하고 또한 현미경으로 덜 의무가 있습니다 서스펜션 세포 (예 : SupT1 등)에 사용될 수 있습니다. 후, 인간, 무, murine.
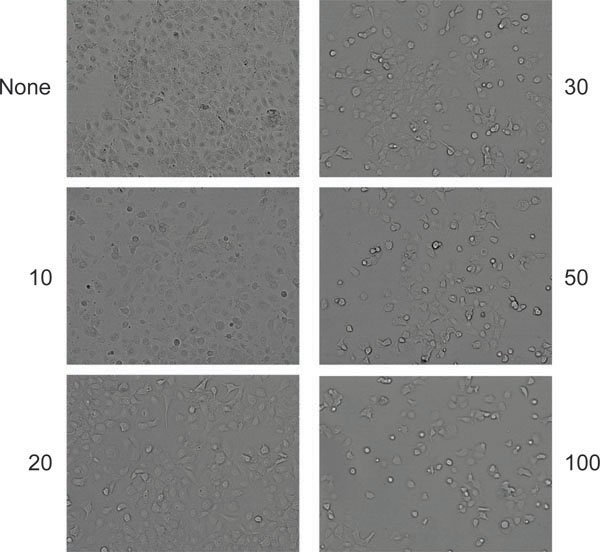
그림 6. AAV와 아데노 바이러스와 공동 감염 생산성 후 세포의 cytopathic 효과의 전형적인 모습 (이 경우 HELA). 세포 중 감염되지 않은 (맨 왼쪽 패널) 왼쪽 또는 아데노 바이러스의 지정된 금액 (셀 당 입자)에 감염되었다.

그림 7. 서부 도서관 감염 및 증폭을위한 조치로 모래 바닥에 의한 AAV capsid 단백질 표현의 감지. 왼쪽 얼룩은 세포 AAV 라이브러리 및 도우미 아데노 바이러스의 여러 볼륨 (μl의)와 함께 공동 감염을 보여줍니다. 처음 두 차선은 공동 좋은 예입니다충분하지만, 과도한되지 AAV 감염 및 증폭시키고 그럼으로써 원하는 꽉 유전자형 - 표현형 연계를 나타내는, 거의 감지 AAV 단백질 식을하였으며 nditions. 따라서 이러한 supernatants의 0.1, 1, 10 μl는 신선한 세포를 다시 감염 (오른쪽 얼룩)을 사용하였습니다. 차선 C의 세포는 부정적인 제어 (helpervirus의 부재로 인해 노 감지 표현)로 AAV 혼자에 감염되었다.
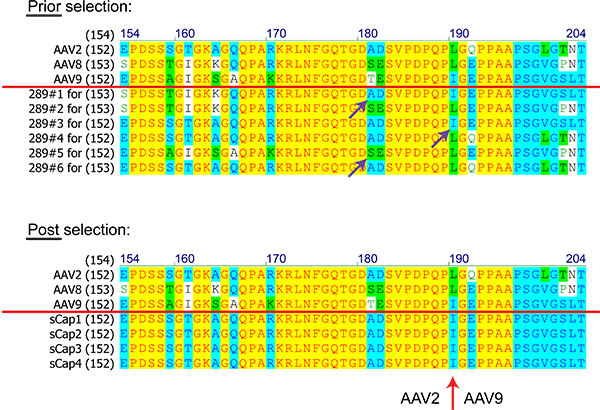
도서관에서 AAV 클론의 단백질 시퀀스 (숫자가 아미노산입니다)의 그림 8. 비교는 선택 전후 AAV2, 8 및 9에 기초. 빨간색 선은 위의 절차가 부모 AAVs을 보여줍니다. 보라색 화살표가 동종 재조합 이벤트를 나타냅니다. 빨간색 화살표는 크로스 오버 AAV2 사이 AAV9가 선택한 모든 클론에서 적어 표시한다.
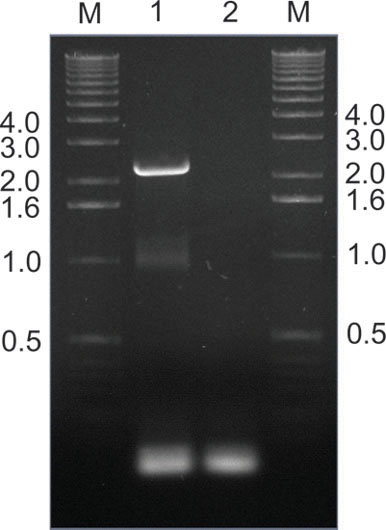
그림 9. </ 강한> 복구가 성공적으로 마우스 조직에서 PCR을 통해 AAV의 클론을 감염. 이 예제에서 AAV 캡 유전자였다 PCR - 증폭 마우스 간은에서 프라이머 쌍 SAF / R을 (그림 2)를 사용하여, 주변 장치 라이브러리 주입 후 일주 추출. 레인 2는 않은 템플릿 컨트롤 반면 레인 1, 예상 2.2 kilobase 밴드를 보여줍니다. PAC I 및 ASC 나는 제한에 따라 증폭된 파편이 보조 라이브러리의 후속 생산 및 재 주입을위한 플라스미드 원래 수신자 (그림 2)로 다시 복제되었습니다. 레인의 M의 유전자 마커 밴드의 크기는 kilobases에 표시됩니다.

그림 10. 교양 세포의 키메라 농축 AAV의 우수한 성능에 대한 예제. 클론 AAV-DJ는 3 전에 회사에 의해보고되었습니다, 그것은 대부분 AAV의 serotypes 2, 8과 9 사이의 하이브리드를 대표하고, librar로 선정되었습니다 y는 풀링된 인간 antisera의 면전에서 인간 간암 세포에서이 세 더하기 다섯 추가 serotypes을 포함. 여덟 자연 AAV의 serotypes (1-6, 8, 상위 9로 표시)에 자사의 효율성을 비교하려면 모든 캡 유전자는 자체 보완 GFP-표현하는 벡터에게 8,19 투석을 생산하는 데 사용되었습니다. 이들은 ML 당 2x10 9 벡터 genomes를 포함하도록 정규화 후 10 배로 직렬 dilutions에 표시된 셀 라인을 transduce하는 데 사용되었다. 3 일 후 통장으로 희석 요인을 복용함으로써 GFP-표현 세포 집계되었으며 전염성 titers가 결정됩니다. 그림의 코드와는 달리. 여기에 5 일, 어두운 색상은 입자 번호 당 높은 infectivities를 나타냅니다. 분명로 선택한 AAV-DJ 키메라가 적용된 선택 제도의 성공을 exemplifying 모든 자연 AAV의 wildtypes을 능가하는 성능. fibr, 섬유아 세포, 하, 햄스터, 후진타오, 인간, 무, murine, 씨, 유인원.

그림 11. 마우스 간장의 키메라 선택 AAV의 분석에 대한 예제. 클론 AAV-DN은 murine 간암 세포에서 선택한 후 루시페라제-표현하는 재조합 벡터에게 8을 생산하는 데 사용되었다. 표시는 대표적인 쥐 (그룹 지당 3)이 벡터 또는 wildtype AAV8, 마우스 간 9 가장 유력한 알려진 천연 격리 중 하나를 기반으로 컨트롤의 동등한 복용의 말초 주입 후 일주 있습니다. AAV-DN의 클론이 간 (패널 (I))에서 약간 덜 전반적인 표현을 제공하면서 간 표현 수준이되고 나면 그것이 아닌 간장 조직에 그냥 타겟팅 실질적으로 더 적은을 전시하고 있기 때문에, 그것이 장기에 대한보다 구체적인 유의 이미징 소프트웨어 (패널 (II))를 통해 조정.
토론
여기서는 유전자 가족 걸어갔다 통해 그리고 세포 또는 동물의 진화에 필수적인 실험 단계와 AAV capsid 엔지니어링에 대한 지침을 마련했습니다. 본질적으로 이러한 프로토콜은 우리가 처음 2008 3 AAV 필드 내에 신고 절차의 표준 버전입니다. 다른 사람이 연구 후속의 한바탕 소동은 다양한 수법의 예를 들면, 10-13를보고했지만, 우리의 현재 버전 업 - 스케일링 및 기타 요구에 ...
공개
모든 저자들은 공개할 게 없다는 것을 선언합니다.
감사의 말
저자들은 기꺼이 그 하이 델베르크 대학에서 우수 CellNetworks의 클러스터에서뿐만 아니라 애인과 하인즈 Schaller (CHS) 재단이 뛰어난 자신의 실험실 지원, 팀 구성원 및 작품을 인정합니다. 유전자 가족 걸어갔다 3 년 전 우리의 첫 출간 이후 매우 활동적인 분야가되므로 작업으로 인해 공간상의 제약으로 여기서 따온 수없는 관련 서적의 모든 저자에게 사과했다 통해 우리는 그 분자 AAV 진화에 감사드립니다.
자료
| Name | Company | Catalog Number | Comments |
| 시약의 이름 | 회사 | 카탈로그 번호 | |
| DNase I | Invitrogen | 18068-015 | |
| Polyethylenimine (PEI) | 시그마 - 올드 리치 | 408,727 | |
| 제한 효소 | 코 | 여러 | |
| T4의 DNA Ligase | 코 | M0202T | |
| 젤 추출 키트 | Qiagen | 28,704 | |
| Phusion II의 효소 키트 | Finnzymes (코) | F-540S | |
| HotStar 고음질의 효소 키트 | Qiagen | 202,602 | |
| DMSO | Finnzymes (코) | F-540S (키트의 일부) | |
| EDTA (에틸렌 다이아 민 테트라 초산) (25 ㎜) | Invitrogen | 18068-015 (키트의 일부) | |
| 트리스 | 로스 | 4855.2 | |
| Ampicilin 나트륨 염 | 로스 | K029.2 | |
| dNTPs (10 밀리미터, 100 μl) | Invitrogen | 18427013 | |
| Iodixanol (OptiPrep) | 축 - 방패 | 1,114,739 | |
| Phenolred | 머크 | 107,241 | |
| 플라스미드 메가 간이 키트 | Qiagen | 12,181 | |
| Ultracentrifuge | Beckman - 보습 바로 앞에 달린 풀베는 날 | Optima L90K | |
| 빠른 인감 원심 분리기 튜브 | Beckman - 보습 바로 앞에 달린 풀베는 날 | 342,414 | |
| Electroporation 단위 | 바이오 방사선 | GenePulserXcell | |
| 열전달 자전거 타는 사람 | Eppendorf | Vapo 보호 | |
| 가열 블록 | BIOER | 메가바이트-102 | |
| 형광 현미경 | 올림포스 산 | IX81 | |
| FACS 분석기 | Beckman - 보습 바로 앞에 달린 풀베는 날 | Cytomics FC500 MLP | |
| MegaX DH10B T1R 세포 | Invitrogen | C640003 | |
| Benzonase | 머크 | 101,695 | |
| 아데노 바이러스-5 | ATCC | VR-5 | |
| 플라스미드 pBlueScript II KS (+) | Stratagene | 212,207 | |
| cap5F (굵게 표시된 노란색, cap5 특정 시퀀스에서 PAC 제가 사이트) : GACTCTTAATTAACAGGT ATGTCTTTTGTTGATCACCCTCC | IDTDNA | 사용자 정의 프라이머 | |
| cap5R (녹색, 굵게 cap5 특정 시퀀스에서 ASC 제가 사이트) : GTGAGGGCGCGCC TTAAAGGGGTCGGGTAAGGTATC | IDTDNA | 사용자 정의 프라이머 |
참고문헌
- Grimm, D., Kay, M. A. From virus evolution to vector revolution: use of naturally occurring serotypes of adeno-associated virus (AAV) as novel vectors for human gene therapy. Curr. Gene Ther. 3, 281-304 (2003).
- Grimm, D. Production methods for gene transfer vectors based on adeno-associated virus serotypes. Methods. 28, 146-157 (2002).
- Grimm, D. In vitro and in vivo gene therapy vector evolution via multispecies interbreeding and retargeting of adeno-associated viruses. J. Virol. 82, 5887-5911 (2008).
- Muller, O. J. Random peptide libraries displayed on adeno-associated virus to select for targeted gene therapy vectors. Nat. Biotechnol. 21, 1040-1046 (2003).
- Perabo, L. In vitro selection of viral vectors with modified tropism: the adeno-associated virus display. Mol. Ther. 8, 151-157 (2003).
- Zolotukhin, S., Potter, M., Hauswirth, W. W., Guy, J., Muzyczka, N. A "humanized" green fluorescent protein cDNA adapted for high-level expression in mammalian cells. J. Virol. 70, 4646-4654 (1996).
- Wobus, C. E. Monoclonal antibodies against the adeno-associated virus type 2 (AAV-2) capsid: epitope mapping and identification of capsid domains involved in AAV-2-cell interaction and neutralization of AAV-2 infection. J. Virol. 74, 9281-9293 (2000).
- Grimm, D. Fatality in mice due to oversaturation of cellular microRNA/short hairpin RNA pathways. Nature. 441, 537-541 (2006).
- Nakai, H. Unrestricted hepatocyte transduction with adeno-associated virus serotype 8 vectors in mice. J. Virol. 79, 214-224 (2005).
- Koerber, J. T., Jang, J. H., Schaffer, D. V. DNA shuffling of adeno-associated virus yields functionally diverse viral progeny. Mol. Ther. 16, 1703-1709 (2008).
- Li, W. Engineering and selection of shuffled AAV genomes: a new strategy for producing targeted biological nanoparticles. Mol. Ther. 16, 1252-1260 (2008).
- Ward, P., Walsh, C. E. Chimeric AAV Cap sequences alter gene transduction. Virology. 386, 237-248 (2009).
- Yang, L. A myocardium tropic adeno-associated virus (AAV) evolved by DNA shuffling and in vivo selection. Proc. Natl. Acad. Sci. U.S.A. 106, 3946-3951 (2009).
- Perabo, L. Combinatorial engineering of a gene therapy vector: directed evolution of adeno-associated virus. J. Gene. Med. 8, 155-162 (2006).
- Maheshri, N., Koerber, J. T., Kaspar, B. K., Schaffer, D. V. Directed evolution of adeno-associated virus yields enhanced gene delivery vectors. Nat. Biotechnol. 24, 198-204 (2006).
- Wu, Z., Asokan, A., Samulski, R. J. Adeno-associated virus serotypes: vector toolkit for human gene therapy. Mol. Ther. 14, 316-327 (2006).
- Kwon, I., Schaffer, D. V. Designer gene delivery vectors: molecular engineering and evolution of adeno-associated viral vectors for enhanced gene transfer. Pharm. Res. 25, 489-499 (2008).
- Perabo, L., Huber, A., Marsch, S., Hallek, M., Buning, H. Artificial evolution with adeno-associated viral libraries. Comb. Chem. High. Throughput. Screen. 11, 118-126 (2008).
- McCarty, D. M., Monahan, P. E., Samulski, R. J. Self-complementary recombinant adeno-associated virus (scAAV) vectors promote efficient transduction independently of DNA synthesis. Gene Ther. 8, 1248-1254 (2001).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유