Bu içeriği görüntülemek için JoVE aboneliği gereklidir. Oturum açın veya ücretsiz deneme sürümünü başlatın.
Method Article
DNA Aile karıştırma ile Mühendislik ve Sentetik adeno-ilişkili virüs Evrimi (AAV) Gen Terapisi Vektörler
* Bu yazarlar eşit katkıda bulunmuştur
Bu Makalede
Özet
Biz, moleküler DNA aile karıştırma yoluyla sentetik Adeno ilişkili viral (AAV) gen tedavisi vektörleri mühendisi ve gelişmeye temel tekniği göstermek. Ayrıca, biz seçimi ve kültür veya farelerde hedef hücreler üzerinde gelişmiş özellikleri ile bireysel kimerik capsids analizi için genel kurallar ve temsili örnekler sunuyor.
Özet
Adeno-ilişkili virüs (AAV) vektörler nedeniyle yararlı özellikleri 1 benzersiz bir kombinasyonu terapötik insan gen transferi için en güçlü ve gelecek vaat eden bazı araçlar temsil eder. Bu altta yatan wild tip virüsler ve yüksek titresi, yüksek saflıkta ve klinik dereceli rekombinant vektörler 2 üretimi için son derece gelişmiş metodolojileri apathogenicity içerir. Diğer virüsler üzerinde AAV sisteminin bir diğer özel avantajı doğal olarak tüm kolayca ortak bir protokol 1,2 kullanarak vektör olarak tasarlanmış olabilir ama temel özellikleri bakımından farklıdır serotipleri ortaya çıkan bir zenginlik mevcudiyetidir. Ayrıca, kendi de dahil olmak üzere gruba bir dizi son zamanlarda da birden fazla giriş serotiplerin varlıkları, ya da izole bir tek özelliklerini geliştirmek birleştirmek sentetik vektörlerin oluşturulması için şablon olarak bu doğal virüsler kullanma stratejileri geliştirdiler. Ilgili teknolojileri bu hedeflere ulaşmak için are ya DNA aile karılma 3, kısmi benzerliklerin (tipik olarak en AAV serotip için>% 80) veya 4,5 peptid ekran, genellikle yedi amino asitlerin yani ekleme içine dayanarak yeniden montaj ile değişik AAV kapsid genlerin yani parçalanma istenen bir hücre türüne peptid ideal aracılık yeniden hedefleyen viral kapsid bir maruz döngü. Maksimum başarı için her iki yöntem protokolleri yaklaşık bir milyon farklı kapsid varyantların kütüphaneler verim kadar boyutlandırıldıktan sayede Yüksek verimli bir şekilde uygulanır. Her klon, daha sonra birçok ebeveyn virüs benzersiz bir kombinasyonu (DNA karılma yaklaşım) oluşan veya aynı viral omurga (peptid ekran yaklaşım) kendine has bir peptid içerir. Sonraki son adım en veya seçim sürecinin ideal tüm gereklerini yerine getirerek bireysel capsids için zenginleştirmek için hedef hücreler üzerindeki böyle bir kütüphane seçimi iteratif olduğunu. Tercihen tarak ikincisiBöyle anti-AAV antikorları ile reaksiyona tüm capsids örneği ortadan kaldırılması için negatif seçimi ile ilgi belirli bir hücre tipi, üzerinde büyüme gibi ines pozitif basınç,. Bu kombinasyon seçimi kalan sentetik capsids muhtemelen herhangi bir doğal AAV izole bulunan olmazdı şekilde verilen uygulama ihtiyaçlarını eşleşen şansını artırır. Burada, teorik ve iki teknolojinin deneysel daha zorlu olarak DNA aile karıştırma yöntemi odaklanın. Biz açıklamak ve göstermek karıştırılır AAV kütüphanelerinin oluşturulması ve seçim (Şekil 1) için gerekli tüm adımları ve sonra bir ihtiyacı moleküler AAV evrimi ile başarılı olmak için farkında olmak bu protokollerin tuzaklar ve eleştirel yönlerini tartışmak.
Protokol
1. AAV kapsid Genler Kodlama Plazmid Setleri Hazırlanması
- Sonraki DNA karıştırma için çeşitli AAV kapsid (kap) genlerin yeterli miktarda rutin hazırlanmasını kolaylaştırmak için, başlangıçta ortak bir plazmid omurga içine bu genlerin subclone. Bu, iç içe geçmiş ve PCR için primer klonlanması için bağlanma yerleri (Şekil 2) daha sonra kullanım için> 20 nükleotid özdeş taarruzcu sekanslar dahil etmek önemlidir.
- (AAV5 için örnek primerler Tablo bakınız) uygun primerler kullanılarak PCR genellikle tercih kap gen yanındaki AAV2 rep geni içeren yaygın kullanılabilir AAV plasmidlerden istenilen kap genler yükseltmek. PCR ürün standart Klonlama için kullanılan edilecektir, çünkü, saflaştınlmış ürün ~ 1 ug zaten yeterlidir ve herhangi bir geleneksel PCR protokolü dolayısıyla da kullanılabilir.
- Saflaştırılmış PCR ürünü (örneğin, agaroz jel arıtma veya standart PCR saflaştırma kiti kullanın) ve hazmıAlıcı olan tanıma bölgelerini kap amplifikasyonu (1,1) ve aynı zamanda plazmid alıcı kullanılan primerler mevcuttur kısıtlama enzimleri ile birlikte plazmid. En çok AAVs bulunmaz olarak laboratuvarda, biz Pac I ve Asc ben siteleri (Şekil 2) kullanabilirsiniz.
2. DNaz tabanlı Cap Gen Parçalanma
- PCR adımları 1.1-1.3 üretilen plasmidlerden seçim kap genler yükseltmek. Aşağıda tarif edildiği gibi tek bir reaksiyon PCR ürün ~ 3 ug elde edilir. Bu yeterli altı üreticimizin tepkiler kadar, kütüphaneye dahil edilecek kap genlerin sayısına bağlı olarak için.
- PCR için, plazmid 200 ng kap, 2 uM son konsantrasyonunda her astar, 10 ul 5x Hifi tampon ve 1 ul Hifi polimeraz içeren 50 ul reaksiyon oluşturdu. 95 ° C'de ve daha sonra 15 döngü 40 saniye 94 çalıştırmak ° C, 30 saniye 57 ° C'de ve 3 dakika 68 ° C, 10 dak, bir nihai adım takiben de 5 dakika ile başlamak72 ° C. Jel veya kiti ile PCR ürünleri arındırmak ve sonra kimeralar içine yeniden montaj için cap gen parçalarını oluşturmak için kontrollü bir DNaz özeti kurdu.
- Bu nedenle, eşit 54 ul H 2 O. içinde 4 mg toplam miktarı ile, çeşitli kap PCR ürünleri karıştırarak , Reaksiyon 6 ul DNaz reaksiyon tamponu ve 0.5 ul DNaz I ekle dikkatle üç kez hafifçe vurun, kısaca dönmeye ve hemen bir 25 ° C ısıtma blok koymak. 1 ile 2 dk (birden fazla paralel reaksiyonlar kurmak ve 15 sn artışlarla olarak sona erdirme) inkübe, sonra 6 ul 25 mM EDTA ekleyerek ve kısaca 75 10 dakika karıştırın ve kuluçkaya ° C ile reaksiyonu durdurmak
- Standart% 1 agaroz jel üzerinde kap parçaları arındırın. İdeal olarak, bir karalama 100 ve 500 baz çiftleri arasında görünür olmalıdır. DNaz Ben potent bir enzim, uygun taşıma ve zamanlama olduğu için bu aşamada kritik olan, ve adım 2.3 inkübasyon süresi içinde birden fazla varyasyon optimum res için gerekli olabilirults (Şekil 3). Standart bir kit kullanılarak yıkanan DNA arındırmak ve konsantrasyonu belirler.
3. DNA Aile karılma
- İlk olarak, kendini-prime kısmi benzerliklerin dayalı olduğu bir PCR aracılığıyla tam uzunlukta dizileri içine kap parçaları yeniden bir araya getirin. Bu nedenle, 500 ng saflaştırılmış parçaları (adım 2.4), 10 ul 10x Phusion tampon, 1 ul 10 mM dNTP, 1.5 ul DMSO ve 0,5 ul Phusion II polimeraz ile 50 ul reaksiyon oluşturdu. Inkübe 30 sn 98 ° C'de ve daha sonra 10 döngü 40 saniye 98 çalıştırmak ° C, 30 saniye 42 ° C ve 45 saniye 72 72 azından bir son 10 dakika adımı takip ° C, ° C.
- Bunu takip eden ikinci bir PCR olarak, korunmuş taarruzcu sekanslar (Şekil 2) bağlanan primerler kullanılarak, ardıl klonlamaya için yeniden monte kap genler amplifiye. Bu nedenle, ilk PCR (adım 3.1), 2 uM, 0.5 ul MgCl2 bir son konsantrasyon her primerden 2 ul ihtiva eden bir 50 ul reaksiyon ayarlamak10 ul 5x Hifi tampon ve 1 ul Hifi polimeraz. Biz daha sonraki klonlama için yeterince yüksek verimi sağlamak için 16-24 PCR çalıştırmanızı öneririz. Havuz PCR ve tam boy kap bant (jel veya kit) arındırmak.
- Içine klonlama için Pac I ve Asc ben saflaştırılmış kap gen havuzu sindirimi bir çoğaltma-yetkili AAV AAV ITRs (ters terminali tekrarlar; çoğaltma ve paketleme sinyalleri) taşıyan plazmid gibi AAV2 rep gen. İkincisi (detaylar için Şek. 2) "çerçevesinde" kapak gen havuzu karşılamak için aynı site tarafından takip edilmelidir. PCR ürün tam bir sindirim sağlamak için, aşırı enzim ile gece inkübe edin.
- 3:1 molar oranda az kap parçaları ve uygun kesilmiş AAV ITR / rep omurgası Ligate. 50 16 ul / ng ve bir gece boyunca inkübe ° C arasında bir nihai DNA konsantrasyonu ile 40 ul toplam hacim Mastermix (20 dönüşümler için yeterli) yapmak
- 30 ul elektro-yetkili E. ile karıştırılması ile ligasyon reaksiyonu (buzda) 2 ul Transform coli (ticari hücrelerinden büyüdü ve herhangi bir standart protokolü kullanarak yetkili yaptı). Buz üzerinde önceden soğutulmuş elektroporasyon küvetler (1 mm boşluk) içine ekleyin. 1.8 kV, 200 Ω ve 25 uF at Electroporate. Sabit süresi 5 ms yakın olmalıdır. Derhal 1 ml önceden ısıtılmış SOC orta ve bir 250 ml'lik şişe transfer edin. 20 gibi electroporations 6 1x10 hakkında farklı klon çeşitliliği ile bir kütüphane verecektir.
- Havuzlanmış dönüşümlere 1 hacim önceden ısıtılmış orta SOC ekleyin ve 37 ° C ve 1 saat süreyle 180 rpm'de sallayın. Sonra LB ortamı artı ampisilin (50 ug / ml 'lik nihai konsantrasyon) ile toplam hacmi 800 ml kadar getirmek ve aynı koşullar altında bir 16 saat süre ile inkübe edilir. Örneğin kullanarak kitaplığı plazmid DNA arındırın. Bir Qiagen Mega hazırlık kiti.
Tam kütüphanesi çeşitlilik, plağı aliqu hesaplamak için: adım 3.6 at OpsiyonelLB-ampisilin levhalar (örneğin, 10 cm plaka üzerinde 10 ul) ve sayımı koloniler ertesi gün 800 ml solüsyon (önceki 16 saat inkübasyon için) ot. Ayrıca, (Şekil ayrıca bkz. 8) yüksek karıştırma verimi, sırası örneğin 24 klonları doğrulamak ve ebeveyn kap genleri onları hizalamak. Son olarak, kütüphane canlılık ve yüksek fonksiyonel çeşitlilik onaylamak için, subclone rastgele plazmid bir AAV yardımcı içine kap genlerin aldı ve (aşağıda 5.4 adıma bakınız) küçük ölçekli (Res. 4-5) rekombinant vektörler üretmek ve analiz etmek için bunları kullanın.
4. Viral Kütüphane Üretimi
- Tohum 10 15 cm HEK293T hücrelerin 2 yemekleri (4.5x10 6 hücre / çanak) ve 48 saat 220 mg AAV kütüphane ile daha sonra transferinde ve adenoviral plazmid 220 mikrogram (AAV yayılımı için gerekli). Bu nedenle, önceden sıcak PEI (polietilenimin) ve 37, 300 mM NaCl ° C. Ardından 7.9 ml NaCl ve DNA karıştırmak ve toplam volu H 2 O ekleyin15.8 ml bana. Ayrı bir tüp içinde, 3.52 ml PEI, 7.9 ml NaCl ve 4.38 ml H 2 O (on Transfeksiyonlar için tüm birimleri) karıştırın. Karışımları (vorteks) birleştirin ve yemekleri (tabağı başına 3 ml) arasında eşit şekilde çözümü dağıtmadan önce, oda sıcaklığında 10 dakika inkübe edin.
- 48 saat sonra, orta içine hücreleri kazıma ve 15 dakika süre ile 1200 rpm'de aşağı dönerler. 6 ml lizis tamponu (50 mM Tris-HCl pH 8.5, 50 mM NaHCO 3) ve 5 dondurma-eritme döngüleri (-80 / 37 ° C) tabi içinde hücre pelletini. 20 dk için 3750 rpm de hücre enkazları aşağı iplik önce 37 az 1 saat süreyle ml başına 50 U Benzonase ° C ile inkübe edilir.
- % 15,% 25 ve% 60 iodixanol (PBS-MK OptiPrep) PBS-MK (1x PBS, 1 mM MgCl2, 2.5 mM KCI) içinde stok% 40 dilüsyonları (2.5 ul / ml PHENOLRED ile) hazırlayın.
- Beckman Hızlı-Seal santrifüj tüpüne (14x89 mm) içine 5 ml virus süspansiyonu eklemek için bir Pasteur pipeti kullanarak AAV arınma için bir degrade ayarlama, 1.5 ml EAC izledi% 15,% 25 ve% 40 iodixanol çözeltisi h. Lizis tamponu ile degrade üstlük.
- 4 de 2 saat süreyle 50,000 K'de ultrasantrifüjdeki ° bir Beckman Ti70.1 rotorda C. Sonra% 70 etanol ile borunun dışından temizlenmesi, havalandırma için tüpün üstüne bir iğne yapışabilir ve bir iğne kullanılarak% 40 iodixanol fraksiyonun 1.2 ml çizer. Boş AAV capsids içerdiği% 25 kısmını çizmeye özen göstermeli.
5.. Tarama ve Seçim
- Istenen özellikleri sergileyen kimerik capsids (Şekiller 6-11) ortaya çıktı kadar Bu noktada, bir ya iteratif kültürlenmiş hücrelerde ya da hayvanlarda bütün kütüphane yükseltmek olabilir.
- Kültürlenmiş hücrelerde seçmek için, AAV büyümeyi desteklemek için çeşitli kütüphane hacimde (örneğin, 1, 10 ve 100 ul) ve Adenovirüs-5 co-bulaştırmak. Tahmin edilemez belirli bir hücre tipi kütüphane enfektivite olarak kütüphane ve adenoviral yardımcı birden fazla varyasyon test edilmesi şarttır. Harvest~ 3 gün sonra hücreler, 56, 30 dakika ° C ve yeniden enfekte yeni hücrelerin Adenovirüs inaktive, donma-çözülme ile amplifiye AAV ayıklayın. Farklı capsids (sekanslamasıyla doğrulamak) zenginleştirilmiş hale gelene kadar 5 kez tekrarlayın.
- Hayvanlarda seçimi için, kütüphane ile enfekte ve ~ 1 hafta sonra istenilen doku veya hücre tipi ayıklayın. Bu hayvanlarda olumsuz toksisiteye neden olacak gibi Adenovirüs ile birlikte bulaştırma. Eskisi gibi primer (Şekil 2) kullanılarak PCR ile viral DNA Rescue, kap havuzunu yeniden klonlamak, farklı capsids (sekanslamasıyla doğrulamak) zenginleştirilmiş olana kadar taze bir kütüphane ve tekrar üretmek.
- In vivo seçimi için kesin koşullar (hacim, titre, rota) ilgi hedef dokuya bağlıdır. Karaciğer için, farelerin tipik kuyruk damarından enjeksiyon (IV) ile 200 ul PBS bir toplam hacim içinde 1x10 11 ila 12 1x10 viral partiküllerin ile enfekte edilmiştir. Sınırlayıcı faktör, genellikle Origina ait viral titrenin olduğu200 ul içinde 12 1x10 AAV enjeksiyonu, en azından 5x10 12 / ml 'lik bir titresi gerektirdiğinden l hazırlanmasında, bu tüm Labs rutin olarak elde olmayabilir. Maksimum titresi (kütüphanesi henüz verilen bir doku içinde etkin capsids için zenginleştirilmiş edilmemiştir ve böylece nispeten düşük bir toplam enfektivite sahip olabilir, çünkü) ilk enfeksiyonu için yararlı ise, bu nedenle, bu başına en az 11 1x10 parçacıklar kullanılması tavsiye edilir olacaktır Karaciğer seçimi için fare.
- Birden fazla fare varsa, farklı tanecik sayısı kültürlü hücrelerde seçim benzer enjekte etmek ve değişkenliği en aza indirmek ve başarıyı artırmak için grup başına birkaç fare (ve daha sonra her grup içinde toplanan ciğeri havuzundan) için kullanmak çok yararlıdır oranları, 1x10 11 örn. 3 fareler ve 1x10 12 parçacıklar az 3 fareler.
- AAV olmayan bir patogenik ve replikasyon-yeteneksiz (olarak yardımcı olmadan) virüsü olduğundan, Aden yokluğunda aramak için hiçbir yan vardırovirus.
- Euthanization için, hayvanların izofluran vaporizatör ve servikal dislokasyon ile sonradan ötanazi ile anestezi sağlandı.
- Hayvanların ötenazi teyit edildi sonra dokular (bu durumda, karaciğer) hasat edilmiştir. Genel olarak, AAV DNA stabil olduğu ve kolayca dondurulmuş hücre / doku kurtarılmış bir getirildiğinden dolayı, hayvanların serpmek için veya önceden ölüm organlara AAV-enfekte hasat etmek için diğer dokulara için, aynı zamanda gerek yoktur.
- Tek capsids (kütüphane (adım 3.6) veya seçimden sonra (adım 5,2-5,3)) çalışmak için, 4.1-4.5 adımları izleyerek bir gazeteci gen (örn., gfp 6) kodlayan AAV vektörleri üretirler. Bu nedenle, 2 plazmid bir standart AAV yardımcısı olarak ilgi kap geni klon. Adım 4,1 az, 14,7 mikrogram AAV vektörü (raportör kodlayan), AAV helper ve adenoviral helper her biri ile hücreleri üçlü-transfekte. Değişik miktarlarda ve saptamaya azından saflaştırılmış virüs ile kültürlenmiş hücrelerde enfekte veya hayvanlaraFACS veya mikroskopi ile ne transdüksiyon etkinliğini örneğin.
6. Temsilcisi Sonuçlar
Protokol Kullanım sonra belirli bir hücre hattı üzerinde veya hayvanların çoğu gösteren tek parçacıkları veya istediğiniz tüm özellikleri için taranabilen 6 1x10 hakkında eşsiz capsids çeşitliliği ile viral kütüphanelerinde tipik sonuçları burada sıraladı. Takip eden bölümde, örneğin in vitro veya in vivo gösterimleri içinde elde edilen sonuçlar için temsili örnekler sağlayacaktır.
Bundan önce, ancak, önemli tekrar işlevsellikleri ve çeşitlilik (adım 3.6 de isteğe bağlı) için orijinal plazmid kütüphaneden tek tek klonlar analiz yararlılığını işaret düşünün. Son iki parametre plazmid kütüphane yapılır gerçek viral kütüphane seçimi başarısı için son derece kritik bir önkoşul olmasıdır. Bu nedenle, rastgele karıştırılan tek seçebilirsinizkap genler ve kolay algılanabilir ve ölçülebilir raportör gen ifade rekombinant AAV vektörleri (özütleri veya saf parçacıklar, doğruluk istenen derecesine bağlı olarak) üretmek için bunları kullanın. Farklı kapsid türevleri karşılaştırmak için Tipik bir deneyde Şekil temsili örnekte gösterildiği gibi, daha sonra floresans mikroskobu olup. 4.
Alternatif bir yöntem süspansiyon hücreleri için çalıştığını da hücre başına gen ifadesinin tespiti için izin verdiği ekstra faydalar tutan floresan reporter gen ekspresyon FACS tabanlı ölçüm, artı. Şekil. 5, çeşitli hücre tiplerinde in ham AAV vektörü lizatlarının böyle bir FACS analizi bazlı tipik bir sonucunu göstermektedir.
Bireysel kap heykellere yukarıda açıklanan seçimi rastgele ve sınırlı olduğundan, istenilen adayların zenginleştirmek için gerçek bir yaklaşım olarak yararlı değildir elbette. Vi yerine, seçimhayvanlarda hedef hücre veya dokularda ral kütüphane daha uygundur. Koşulları ve parametreleri her uygulama ile değişecektir olarak, sadece bir kaç temsilcisi kuralları ve sonuçları vurgulayacak.
En kolay seçim kültürlü hücre hatları veya birincil hücre (adım 5.2) üzerine kütüphane amplifikasyon iteratif olduğunu. AAV yayılmasını için Adenovirüs ko-enfeksiyon gerektirdiğinden, hedef hücreler Adenovirüs için duyarlı olmalıdır. Bir sonra kütüphanenin tam kapsama sağlamak için de başına yeterli hücre sayıları tutun 6-iyi plakaları büyür ve bunları örneğin bulaşabilir. İkinci önemli kavram AAV denge ve Adenovirüs hassas olmasıdır; AAVs çoğaltmak edemeden ikinci bir aşırı hücreleri (AAV aksine, Adenovirüs litik enfeksiyonlar neden olur) öldürecek ise çok fazla AAV, Adenovirüs engeller.
Adenovirüs oranlarda: belirli bir hücre türüne göre kütüphane enfektivite bilinmemektedir Bununla birlikte, "iyi" AAV bulmahangi iki yayılması kütüphane doz ve adenoviral yardımcı (örneğin, 10:1, 1:1 ve 1:10) çeşitli kombinasyonları paralel test gerektirir. Güçlü Adenovirüs enfeksiyonu için iyi bir ölçü üç gün virüs inokülasyonundan sitopatik etkileri, hücre yuvarlama kanıtladığı ve Şekil görüldüğü gibi ayırmanın bir durum. 6. Tersine, bir AAV enfeksiyon için okuma-out yararlı ve amplifikasyon bir ölçüde korunmuş AAV kapsid epitop (Şekil 7) 7 tanır B1 antikor kullanarak, Western blot ile kapsid proteinleri tespit edilmesidir.
Önemli bir karar ham AAV taze hücrelerin buna yeniden enfeksiyon (adım 5.2) için almak için ayıklar hangi sonra olduğunu. Bu sıkı bir genotip-fenotip bağlantıyı ortaya koyar, çünkü İdeal olan, bir AAV kapsid bantları (Şekil 7) en kayda değer nerede bu alacaktır. İkincisi, belirli bir kapsid türevi genomunu kodlayan bir olduğu durumda açıklarAslında, karşılık gelen kapsid içinde ambalajlandı. Bu da istenilen özelliklere sahip capsids arda enfeksiyon tur sırasında hücre içine soydaş genetik şablon teslim sağlar gibi sıkı bir genotip-fenotip bağlantı sağlamak ve korumak için bireysel viral adayların başarılı seçim anahtarıdır. Bu nedenle, yeniden enfeksiyon orta kapsid ifade ile özütleri almak ve az miktarda kullanmanızı öneririz. Birlikte bu iki tedbir yeniden enfekte virüs olmayan soydaş capsids içine genomlarındaki çoğaltılıyor ve yeniden paketleme başladığınızda aksi genotip-fenotip bağlantı karıştırmayı olabilir farklı kapsid / genom kombinasyonları ile yeni enfekte olmuş hücrelerin aşırı yüklenmesini önlemek olacaktır.
Buna ek olarak, DNA sekanslama yöntemiyle tekrarlanmıştır enfeksiyonların turda kütüphanesi çeşitliliği izlemek için kritiktir. İdeal olarak, bir seçimi başarılı bir göstergesidir bireysel klonlarının bileşimi kaymalar, yani, accum fark edecektirŞekil örneklenen başkalarının farklı serotip parçaları ve kayıplar, bir ulation. 8. Mükemmel bir durumda bile, yalnızca, birkaç veya tek bir klon sonuçta daha sonra yukarıda anlatıldığı gibi analiz edilebilir olduğu tespit edilecektir. Ancak, hiçbir vardiya dört veya beş pasaj sonra gözlenirse, kişinin ya seçim baskısı (Tartışma bakınız) artırmak veya çok serotipleri için çok hassas olabilir, çünkü kullanılan hücre hattı uygunsuz olabileceğini düşünmelisiniz.
In vivo kütüphane amplifikasyon (adım 5.3) için de aynı usul ve değerlendirmeler iki kritik farklılıklar, uygulanır: Birincisi, bir ilişkili maliyetleri ve etik kaygılar nedeniyle hayvanlarda ekran rastgele seçilen klonlar değildir. Bu hayvanlarda toksisite veya ölümler neden olur, artı adenoviral tropizm yardımcı virüsü duyarlı hücrelere seçimi kısıtlar İkinci olarak, bir yardımcı Adenovirüs ile birlikte enfekte olmaz. Bunun yerine, AAV kütüphane inci infüze edilirPCR (Şekil 9) tarafından hedef hücre / doku kurtarıldı ve ardından yeniden klonlanmış ve yeni bir enfeksiyon tur için yeniden paketlenmiş e hayvanlar. Bireysel adaylara ortaya çıkmıştır kadar kültür seçim olduğu gibi, bu işlem tekrarlanır.
Ne olursa olsun seçim prosedürü, son adım uygun sistemlerinde zenginleştirilmiş kapsid varyantların doğrulama olduğunu. İncir. 10 ve doku kültürü veya farelerin karaciğerlerinde derece iyi performans AAV kimeralar bizim kendi önceki seçim 11 gösteri temsilcisi örnekleri. Şekil görülmektedir. 10, belirli bir klon (AAV-DJ 3) gerçekten hücre hatları, geniş bir alanda sekiz doğal AAV wildtypes bir koleksiyon geride bırakıyor. Son olarak, kültürlü hepatomalı hatları seçilen başka bir klon fare karaciğer için daha yüksek bir tropizm sergiler ve periferik doğrudan com test güçlü AAV8 vektör kontrolü daha yetişkin fareler doldurulan zaman buna göre daha az off-hedeflemeparison (Şekil 11). Karaciğer için daha spesifik olmak olsa da, klon AAV-DN aslında AAV8 biraz daha az verimli bu organ transduces unutmayın. Bu bağlamda, AAV-DN son adaylar genellikle istenen birtakım özelliklerini gösterirler ama bütün yönleriyle mutlaka mükemmel değildir AAV evrim ve seçim sonucunu iyi bir temsili örnek.
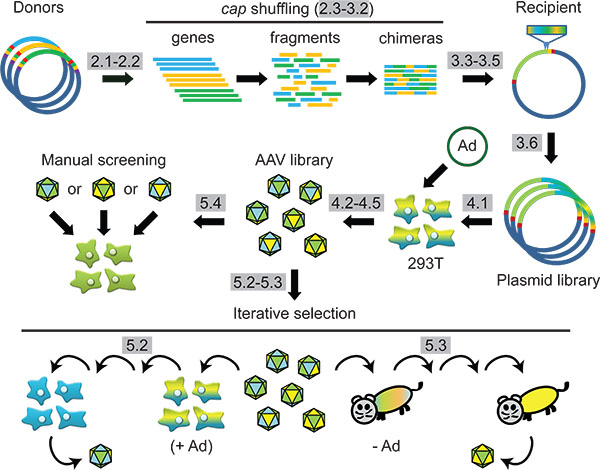
Şekil 1 Programı:. DNA aile karıştırma ve hücrelerin ya da hayvanlarda sonraki seçimi ile Sentetik AAV kapsid mühendisliği. Protokol adımlar gri vurgulanır.
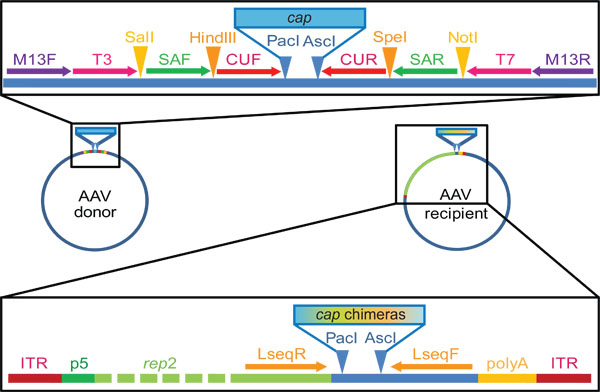
Şekil 2. AAV kap gen donör ve DNA aile karıştırma ve kütüphane nesil için laboratuarımızda kullanılan alıcı plazmidler. Bu sadece tipik örneklerdir unutmayın, tam siteleri ve dizileriözelleştirilebilir. Temel donör plazmid biz, sırasıyla oklar veya üçgen tarafından tasvir gösterildiği primer bağlanma gibi kısıtlayıcı siteleri, içermesi tasarlandı ticari olarak mevcut pBluescript KS II (+) vektörü elde edilir. Daha sonra Pac I ve Asc I restriksiyon siteleri çevrili olmak, bu plazmid içine AAV serotipleri 1-9 (primerler capF / R ile amplifiye) tavanı genleri klonlanmış. Yeniden monte kimerik sekanslar (adım 3.2) daha sonra amplifikasyon primer çiftleri kullanılarak gerçekleştirilebilir ederken primerleri, T3 ve T7, adım 2.2 kap izolasyon için kullanılır SAF / veya R CUF / R, ya da bir iç içe geçmiş iki PCR. Plazmid çoğaltma-yetkili alıcı AAV p5 promotör kontrolü altında AAV2 rep gen kuşatan AAV ters terminali tekrarlar (ITRs, çoğaltma ve paketleme sinyalleri) taşır. Aşağı rep Pac I ve Asc I restriksiyon siteleri klonlama "çerçeve" için izin bir havuzun kapağını genler karıştırılır.gösterildiği Lseq astar bağlanma yerleri kap geninin sekans (adım 3.6) için yararlıdır.

Şekil 3. Kap genlerin DNase I özeti (AAV2, 8 ve 9) Örnek. Kap gen ürünlerinin agaroz jel elektroforez analizi gösterildiği belirtilen farklı inkübasyon süreleri (dakika: saniye) kullanarak sindirir. Lane U kontrol olarak sindirilmemiş giriş kap parçası havuzu gösterir. Şerit DNA markör bantların büyüklüğü M kilobases bulunmaktadır. Bu örnekte, ideal digests 100 ila 500 baz çifti etrafında tercih edilen hakim tepe (sarı kutu) vermiştir 1:45 ya da 2:00 dk, kuluçka süreleri ile elde edilmiştir.

Şekil 4. Beş farklı rekombinant YFP-ifade AAV ve bulaşmış üç insan hücre hatları mikroskopisi tabanlı analiz için örnekctors (üstte adları) karıştırılan kap genleri ile yapılan rastgele AAV2, 8 ve 9 dayalı orijinal bir kitaplıktan seçilir.

Rastgele seçilen kap genleri karıştırılarak Şekil 5. 18 farklı rekombinant YFP-ifade AAV vektörleri (Şekil de dahil olmak üzere üst adları. 4) ile enfekte dört hücre tipleri (seri on kat dilüsyonlarda) ve FACS tabanlı analiz için örnek yaptı orijinal bir kütüphane (AAV2, 8 ve 9). YFP ifadesi daha kolay görüntüleme için renk kodlu edildi. Siyah her zaman% 0 ve beyaz her hücre tipinde ölçülen en yüksek sayısını gösterir sayede taşımaktadır tasvir yüzdeleri, hücrelerin transdük. Seçilmemiş capsids beklenebilir gibi Clone B2 (kırmızı), kötü genel etkinliğe sahip bir klon örnekliyor. FACS analizi daha hassas olan ve aynı zamanda mikroskopi için daha az uygundurlar süspansiyon hücreleri (örneğin SupT1 gibi) için kullanılabilir dikkat ediniz. hu, Insan; mu, fare.
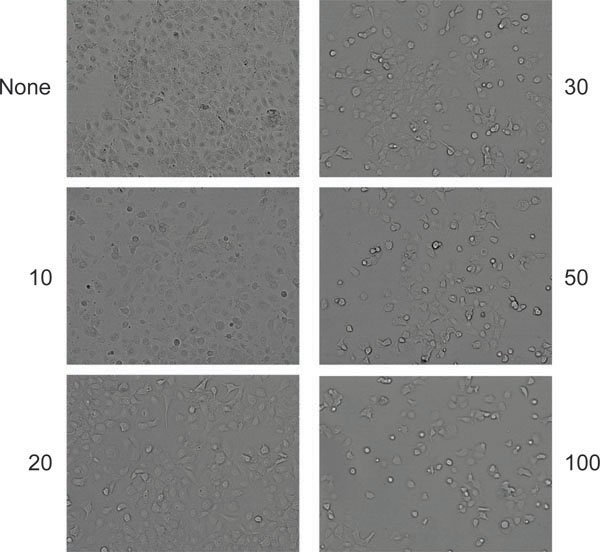
Şekil 6. AAV ve Adenovirüs ile ko-enfeksiyon üretken sonra hücrelerde sitopatik etkiler tipik görünümü (bu durumda HeLa). Hücreler ya enfekte olmayan (sol üst panel) sola veya Adenovirüs, belirtilen miktarda (hücre başına parçacıklar) ile enfekte edildi.

Şekil 7. Batı kütüphane enfeksiyonu ve güçlendirme için bir tedbir olarak blotting tarafından AAV kapsid proteini ifade Algılama. Sol leke hücreleri AAV kütüphane ve yardımcı Adenovirüs çeşitli cilt (ul) ile ko-enfekte gösterir. İlk iki şerit co için iyi bir örnektiryeterli ama aşırı değil AAV enfeksiyon ve büyütmesi ve dolayısıyla istenen sıkı genotip-fenotip bağlantı gösteren, neredeyse tespit AAV protein ekspresyonu veren nditions. Böylece, bu süpernatanlar 0.1, 1 veya 10 ul Taze hücreler tekrar enfekte (sağ blot) için kullanıldı. Şeritte C Hücreler bir negatif kontrol (olarak yardımcı olmaması nedeniyle saptanabilir ifade) olarak AAV yalnız ile enfekte edildi.
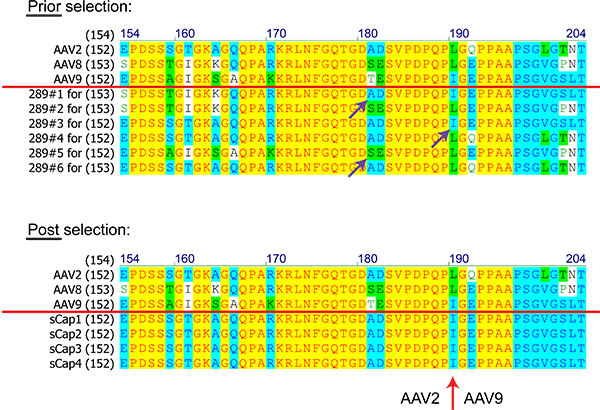
Bir kütüphaneden AAV klon protein dizileri (sayı amino asitler) Şekil 8. Karşılaştırmalar seçim öncesi ve sonrası AAV2, 8 ve 9 dayalı. Kırmızı çizgi üzerinde Diziler ebeveyn AAVs göstermektedir. Mor oklar homolog rekombinasyon göstermektedir. Kırmızı ok bir cross-over AAV2 arasında ve AAV9 seçilen tüm klonlar not işaretler.
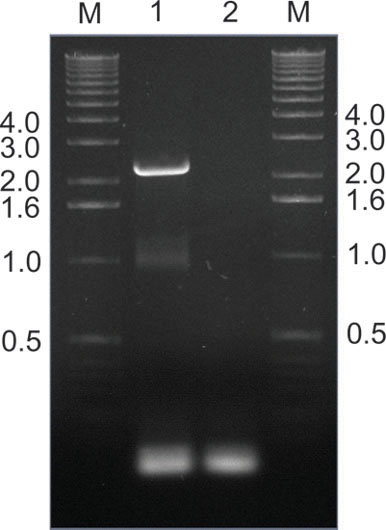
Şekil 9. </ Strong> Kurtarma başarıyla fare dokulardan PCR aracılığıyla AAV klonlar bulaşmış. Bu örnekte, AAV kap genleri olduğu PCR-amplifiye fare karaciğerler ikinci primer çifti SAF / R (Şekil 2) kullanılarak, periferal kütüphanesi infüzyon bir hafta sonra ekstre edilmiştir. Hat 2 olmayan bir şablon kontrol ederken Lane 1, beklenen 2,2 kilobaz grubu gösterir. Pac I ve Artan I restriksiyon takiben, amplifiye fragmanları ikincil bir kütüphanenin sonraki üretim ve re-infüzyon için plazmit orijinal alıcının (Şekil 2) içine yeniden klonlandı. Şeritlerinin M DNA işaretleyici gruplarından boyutları kilobases belirtilmiştir.

Şekil 10. Kültürlenmiş hücrelerde chimera zenginleştirilmiş bir AAV üstün performans örneği. Clone AAV-DJ 3 önce bizim tarafımızdan bildirilmiştir; çoğunlukla AAV serotipleri 2, 8 ve 9 arasında bir melez temsil eder ve bir librar seçilmişse y toplanmış insan antiserumlar varlığında insan karaciğer hücrelerinin bu üç artı beş ek serotipleri içeren. Sekiz serotip, doğal AAV (1-6, 8 ve 9 üstüne ile belirtilen) verimliliği karşılaştırmak için, her kap genler kendi kendini tamamlayan Gfp-ifade vektörlerinin 8,19 saflaştırılmış üretmek için kullanıldı. Bunlar, ml başına 2x10 9 vektörü genomları ihtiva normalize ve sonra on kat seri seyreltiler de gösterilen hücre çizgileri transdüksiyonu için kullanılmıştır. Üç gün sonra, göz önüne alarak, seyreltme faktörü Gfp-salgılayan hücre sayımı yapıldı ve bulaşıcı titreleri belirlendi. Şekil kodu aksine. Burada 5, koyu renkler partikül sayısı başına daha yüksek infectivities göstermektedir. Görüldüğü gibi, seçilen AAV-DJ chimera uygulanan seçim düzeninin başarısı örnekleme, tüm doğal AAV wildtypes geride bırakıyor. fibr, fibroblastlar; ha, hamster, hu, insan; mu, fare; si, simian.

Şekil 11. Fare karaciğerinde chimera seçilen AAV analizi için örnek. Klon AAV-DN mürin hepatoma hücreleri üzerinde seçilir ve daha sonra lusiferaz-salgılayan rekombinant vektör 8 üretmek için kullanıldı. Gösterilen temsilcisi fareleri (grup başına üç) bu vektör veya wild tip AAV8, fare karaciğerinde 9. en güçlü bilinen doğal izolatlar birine dayalı bir kontrol eşit dozlarda periferik infüzyondan sonra bir hafta vardır. AAV-DN klon karaciğer (paneli (I)) biraz daha genel bir ifade verir iken karaciğer ekspresyon düzeyleri olmuştur kez non-hepatik dokularda off hedefleyen önemli ölçüde daha az sergileyen bu yana, bu organ için daha özel olduğunu unutmayın görüntüleme yazılımı (paneli (II) ') aracılığı ile ayarlanabilir.
Tartışmalar
Burada, DNA aile karıştırma yoluyla ve hücrelerin ya da hayvanlarda evrim için gerekli deneysel adımlar ve AAV kapsid mühendisliği için yönergeleri hazırladık var. Özünde, bu protokoller biz ilk 3, 2008 yılında AAV alanı içinde bildirilen prosedürler standart versiyonları vardır. Başkaları tarafından çalışmaları takip bir telaş birçok değişiklik, örneğin, 10-13 bildirdin iken, bugünkü versiyonları yukarı ölçeklendirme ve herhangi ihtiyaçlarına uyum...
Açıklamalar
Tüm yazarlar ifşa için bir neden olmadığını beyan ederim.
Teşekkürler
Yazarlar minnetle Heidelberg Üniversitesi Mükemmeliyet CellNetworks arasında Küme tarafından yanı sıra Chica ve Heinz Schaller (CHS) vakıf tarafından olağanüstü kendi laboratuvar desteği, ekip üyeleri ve iş kabul ediyorsunuz. DNA aile karıştırma, üç yıl önce bizim ilk yayınlandığından beri çok aktif bir alan haline gelmiştir ve bu nedenle çalışma nedeniyle mekan kısıtlamaları için buraya iktibas edilemedi ilgili yayınların tüm yazarlara özür etti yoluyla Biz moleküler AAV evrim teşekkür ederiz.
Malzemeler
| Name | Company | Catalog Number | Comments |
| Reaktif Adı | Şirket | Katalog numarası | |
| DNase I | Invitrogen | 18068-015 | |
| Polietilenimin (PEI) | Sigma-Aldrich | 408727 | |
| Kısıtlama enzimleri | NEB | Çeşitli | |
| T4 DNA ligaz | NEB | M0202T | |
| Jel ekstraksiyon kiti | Qiagen | 28704 | |
| Phusion II polimeraz Kiti | Finnzymes (NEB) | F-540S | |
| Hotstar Hifi polimeraz Kiti | Qiagen | 202602 | |
| DMSO | Finnzymes (NEB) | F-540S (kit parçası) | |
| EDTA (25 mM) | Invitrogen | 18068-015 (kit parçası) | |
| Tris | Roth | 4855.2 | |
| Ampisilin sodyum tuzu | Roth | K029.2 | |
| dNTP (10 mM, 100 ul) | Invitrogen | 18427013 | |
| Iodixanol (OptiPrep) | Eksen-kalkan | 1114739 | |
| PHENOLRED | Merck | 107241 | |
| Plazmid mega hazırlık seti | Qiagen | 12181 | |
| Ultrasantrifüjdeki | Beckman-Coulter | Optima L90K | |
| Hızlı-Seal santrifüj tüplerine | Beckman-Coulter | 342414 | |
| Elektroporasyon ünitesi | Bio-Rad | GenePulserXcell | |
| Termal cycler | Eppendorf | Vapo Koru | |
| Isıtma bloğu | BIOER | MB-102 | |
| Floresans mikroskobu | Olympus | IX81 | |
| FACS analizörü | Beckman-Coulter | Cytomics FC500 MLP | |
| MegaX DH10B T1R hücreleri | Invitrogen | C640003 | |
| Benzonase | Merck | 101695 | |
| Adenovirüs-5 | ATCC | VR-5 | |
| plazmid pBluescript KS II (+) | Stratagene | 212207 | |
| cap5F (koyu sarı, cap5 özel dizilerde Pac I site): GACTCTTAATTAACAGGT ATGTCTTTTGTTGATCACCCTCC | IDTDNA | Özel astar | |
| cap5R (yeşil, kalın cap5 özel dizilerde Asc I site): GTGAGGGCGCGCC TTAAAGGGGTCGGGTAAGGTATC | IDTDNA | Özel astar |
Referanslar
- Grimm, D., Kay, M. A. From virus evolution to vector revolution: use of naturally occurring serotypes of adeno-associated virus (AAV) as novel vectors for human gene therapy. Curr. Gene Ther. 3, 281-304 (2003).
- Grimm, D. Production methods for gene transfer vectors based on adeno-associated virus serotypes. Methods. 28, 146-157 (2002).
- Grimm, D. In vitro and in vivo gene therapy vector evolution via multispecies interbreeding and retargeting of adeno-associated viruses. J. Virol. 82, 5887-5911 (2008).
- Muller, O. J. Random peptide libraries displayed on adeno-associated virus to select for targeted gene therapy vectors. Nat. Biotechnol. 21, 1040-1046 (2003).
- Perabo, L. In vitro selection of viral vectors with modified tropism: the adeno-associated virus display. Mol. Ther. 8, 151-157 (2003).
- Zolotukhin, S., Potter, M., Hauswirth, W. W., Guy, J., Muzyczka, N. A "humanized" green fluorescent protein cDNA adapted for high-level expression in mammalian cells. J. Virol. 70, 4646-4654 (1996).
- Wobus, C. E. Monoclonal antibodies against the adeno-associated virus type 2 (AAV-2) capsid: epitope mapping and identification of capsid domains involved in AAV-2-cell interaction and neutralization of AAV-2 infection. J. Virol. 74, 9281-9293 (2000).
- Grimm, D. Fatality in mice due to oversaturation of cellular microRNA/short hairpin RNA pathways. Nature. 441, 537-541 (2006).
- Nakai, H. Unrestricted hepatocyte transduction with adeno-associated virus serotype 8 vectors in mice. J. Virol. 79, 214-224 (2005).
- Koerber, J. T., Jang, J. H., Schaffer, D. V. DNA shuffling of adeno-associated virus yields functionally diverse viral progeny. Mol. Ther. 16, 1703-1709 (2008).
- Li, W. Engineering and selection of shuffled AAV genomes: a new strategy for producing targeted biological nanoparticles. Mol. Ther. 16, 1252-1260 (2008).
- Ward, P., Walsh, C. E. Chimeric AAV Cap sequences alter gene transduction. Virology. 386, 237-248 (2009).
- Yang, L. A myocardium tropic adeno-associated virus (AAV) evolved by DNA shuffling and in vivo selection. Proc. Natl. Acad. Sci. U.S.A. 106, 3946-3951 (2009).
- Perabo, L. Combinatorial engineering of a gene therapy vector: directed evolution of adeno-associated virus. J. Gene. Med. 8, 155-162 (2006).
- Maheshri, N., Koerber, J. T., Kaspar, B. K., Schaffer, D. V. Directed evolution of adeno-associated virus yields enhanced gene delivery vectors. Nat. Biotechnol. 24, 198-204 (2006).
- Wu, Z., Asokan, A., Samulski, R. J. Adeno-associated virus serotypes: vector toolkit for human gene therapy. Mol. Ther. 14, 316-327 (2006).
- Kwon, I., Schaffer, D. V. Designer gene delivery vectors: molecular engineering and evolution of adeno-associated viral vectors for enhanced gene transfer. Pharm. Res. 25, 489-499 (2008).
- Perabo, L., Huber, A., Marsch, S., Hallek, M., Buning, H. Artificial evolution with adeno-associated viral libraries. Comb. Chem. High. Throughput. Screen. 11, 118-126 (2008).
- McCarty, D. M., Monahan, P. E., Samulski, R. J. Self-complementary recombinant adeno-associated virus (scAAV) vectors promote efficient transduction independently of DNA synthesis. Gene Ther. 8, 1248-1254 (2001).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır