A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
الهندسة وتطور فيروس الغدة اسوشيتد الاصطناعية (AAV) المتجهات العلاج الجيني عن طريق الحمض النووي العائلة الخلط
* These authors contributed equally
In This Article
Summary
علينا أن نبرهن التقنية الأساسية لهندسة جزيئيا وتتطور الغدة المرتبطة الفيروسية الاصطناعية العلاج الجيني (AAV) ناقلات عن طريق الحمض النووي عائلة خلط. وعلاوة على ذلك، ونحن نقدم مبادئ توجيهية عامة وأمثلة لاختيار ممثل وتحليل capsids خيالية فردية مع خصائص محسنة على الخلايا المستهدفة في الثقافة أو في الفئران.
Abstract
الغدة المرتبطة الفيروسية (AAV) النواقل وتمثل بعض من أكثر السيارات قوة واعدة لنقل الجينات العلاجية الإنسان نتيجة لمزيج فريد من الخصائص المفيدة 1. وتشمل هذه apathogenicity من الفيروسات wildtype الكامنة ومنهجيات متقدمة للغاية لإنتاج عالية عيار، نقاء عالية والسريرية الصف ناقلات المؤتلف 2. وثمة ميزة أخرى خاصة من خلال نظام AAV الفيروسات الأخرى هو توفر ثروة من الأنماط المصلية التي تحدث بشكل طبيعي والتي تختلف في الخصائص الأساسية حتى الآن يمكن أن تكون جميع هندسيا بسهولة كما ناقلات باستخدام 1،2 بروتوكول مشترك. وعلاوة على ذلك، قد وضعت عددا من المجموعات بما فيها منطقتنا مؤخرا استراتيجيات لاستخدام هذه الفيروسات الطبيعية كقوالب لإنشاء ناقلات الاصطناعية التي تجمع بين أي من أصول الأنماط المصلية مدخلات متعددة، أو التي تعزز خصائص عزل وحيد. التقنيات ذات الصلة لتحقيق هذه الأهداف ARه إما خلط الدنا العائلة 3، أي تجزئة مختلف الجينات قفيصة AAV يليه التجمع إعادة الخاصة بهم على أساس homologies جزئي (عادة> 80٪ لمعظم الأنماط المصلية AAV)، أو عرض 4،5 الببتيد، إدخال أي من الأحماض الأمينية عادة من سبعة إلى حلقة المكشوفة من قفيصة الفيروسية حيث الببتيد يتوسط مثالي إعادة الاستهداف إلى نوع من الخلايا المطلوبة. لأقصى قدر من النجاح، وتطبق كل الأساليب بطريقة عالية الإنتاجية التي يتم من خلالها البروتوكولات تصل إلى تحجيم تسفر عن المكتبات من المتغيرات نحو مليون قفيصة متميزة. وتتألف ثم كل نسخة من مزيج فريد من الفيروسات العديدة الأبوية (DNA خلط نهج) أو يحتوي على الببتيد مميزة داخل العمود الفقري للفيروسات نفسها (الببتيد نهج العرض). الخطوة اللاحقة النهائي هو اختيار متكررة من مكتبة من هذا القبيل على الخلايا المستهدفة من أجل إثراء للفرد capsids الوفاء معظم أو من الناحية المثالية جميع متطلبات عملية الاختيار. ويفضل هذا الأخير مشطإيناس ضغط إيجابي، مثل النمو على نوع معين من الخلايا الفائدة، مع اختيار سلبي، للقضاء على سبيل المثال من جميع capsids التفاعل مع المضادة للAAV الأجسام المضادة. هذا المزيج الذي يزيد من احتمالات أن capsids الاصطناعية على قيد الحياة في اختيار تطابق احتياجات تطبيق معين بطريقة ربما لا يكون قد تم العثور عليها في أي AAV التي تحدث بشكل طبيعي عزل. هنا، ونحن نركز على الحمض النووي طريقة عائلة خلط كما نظريا وتجريبيا أكثر تحديا من التقنيات اثنين. وصفنا وشرح جميع الخطوات الضرورية لتوليد واختيار المكتبات AAV تعديلا (الشكل 1)، ومن ثم مناقشة المخاطر والجوانب الهامة من البروتوكولات التي يحتاج المرء أن يكون على علم لكي تنجح مع تطور AAV الجزيئية.
Protocol
1. إعداد مجموعات البلازميد ترميز AAV الجينات قفيصة
- لتسهيل إعداد الروتيني للكميات كافية من مختلف الجينات AAV (CAP) قفيصة لخلط الحمض النووي لاحق، في البداية subclone هذه الجينات في العمود الفقري البلازميد مشترك. من المهم أن تشمل مطابقة تسلسل من النيوكليوتيدات المرافقة> 20 لاستخدامها لاحقا كمواقع التمهيدي ملزمة لPCR متداخلة والاستنساخ (الشكل 2).
- باستخدام الاشعال المناسب (انظر الجدول لالاشعال مثالي لAAV5)، PCR تضخيم الجينات قبعة المطلوب من البلازميدات AAV المتاحة عموما التي تحتوي عادة على هذا الجين مندوب AAV2 بجانب الجينات قبعة من خيار. لأنه سيتم استخدام المنتج PCR لاستنساخ القياسية، ~ 1 ميكروغرام من تنقية المنتج هو بالفعل ما يكفي، وبالتالي يمكن أن تستخدم أي بروتوكول PCR التقليدية يمكن.
- هضم PCR تنقية المنتج (على سبيل المثال، استخدم الاغاروز هلام تنقية أو تنقية PCR عدة قياسي) والمتلقي البلازميد مع إنزيمات التقييد الذي اعتراف المواقع موجودة في الاشعال تستخدم لتضخيم قبعة (1.1) وكذلك في المتلقي البلازميد. في المختبر، ونحن نستخدم باك أنا وأنا تصاعديا المواقع (الشكل 2) كما أنها غائبة في معظم AAVs.
2. الدناز القائم على تجزئة كاب جين
- PCR تضخيم الجينات قبعة من خيار من البلازميدات ولدت في خطوات 1،1-1،3. سيكون رد فعل واحد كما هو موضح أدناه تسفر ~ 3 ميكروغرام من الناتج PCR. اعتمادا على عدد من الجينات قبعة ليتم تضمينها في المكتبة، وهذا يكفي لمدة تصل إلى ستة ردود فعل خلط.
- لPCR، اقامة رد فعل 50 ميكرولتر التي تحتوي على 200 نانوغرام قبعة البلازميد، كل التمهيدي في تركيز 2 ميكرومتر النهائي، و 10 ميكرولتر العازلة ايفي 5X و 1 بوليميريز ايفي ميكرولتر. تبدأ في 5 دقائق و 95 درجة مئوية ثم قم بتشغيل 40 دورة من 15 ثانية 94 درجة مئوية، و 30 ثانية 57 درجة مئوية و 3 دقائق و 68 درجة مئوية، تليها الخطوة النهائية في 10 دقيقة72 درجة مئوية. تنقية منتجات PCR عبر هلام أو عدة ومن ثم تشكيل لرقابة الدناز هضم لخلق شظايا الجين غطاء للجمعية ثانية في الوهم.
- ولذلك، خلط بالتساوي على مختلف المنتجات قبعة PCR إلى مبلغ إجمالي قدره 4 ميكروغرام في 54 ميكرولتر O. 2 H إضافة 6 رد فعل الدناز ميكرولتر العازلة و 0.5 الدناز ميكرولتر الأول لهذا التفاعل، ونفض الغبار بعناية ثلاث مرات، وتدور لفترة وجيزة ووضع على الفور على كتلة ° 25 C التدفئة. احتضان بين 1 و 2 دقيقة (إعداد ردود فعل موازية متعددة وإنهائها في الزيادات من 15 ثانية)، ثم وقف رد فعل عن طريق إضافة 6 ميكرولتر EDTA 25 ملم والتي vortexing لفترة وجيزة واحتضان 10 دقيقة عند 75 درجة مئوية.
- تنقية شظايا قبعة على هلام الاغاروز معيار 1٪. من الناحية المثالية، ينبغي أن تكون واضحة لطاخة بين أزواج قاعدة 100 و 500. منذ الدناز أنا هو انزيم فعال للغاية، والتعامل السليم والتوقيت حاسمة في هذه الخطوة، وربما تكون هناك حاجة إلى تغيرات متعددة في وقت حضانة في الخطوة 2.3 لالدقة المثلىults (الشكل 3). تنقية الحمض النووي مزال استخدام عدة وتحديد مستوى تركيزه.
3. الحمض النووي الأسرة الخلط
- أولا، إعادة تجميع شظايا قبعة في كامل طول تسلسل عن طريق PCR الذي والذاتي الوزراء بناء على homologies جزئي. ولذلك، تشكيل لرد فعل 50 ميكرولتر مع شظايا 500 نانوغرام المنقى (الخطوة 2.4)، 10 ميكرولتر العازلة Phusion 10X، 1 ميكرولتر dNTPs 10 ملم، و 1.5 و 0.5 ميكرولتر DMSO ميكرولتر بوليميريز الثاني Phusion. احتضان 30 ثانية عند 98 درجة مئوية ثم قم بتشغيل 40 دورة من 10 ثانية 98 درجة مئوية، و 30 ثانية و 42 درجة مئوية و 45 ثانية 72 درجة مئوية، تليها الخطوة الاخيرة في 10 دقيقة عند 72 درجة مئوية.
- في PCR 1 2 التي تلت ذلك، تضخيم الجينات قبعة إعادة تجميعها لاستنساخ لاحق، وذلك باستخدام بادئات التي تربط لتسلسل الحفظ المرافقة (الشكل 2). ولذلك، تشكيل لرد فعل 50 ميكرولتر يحتوي على 2 ميكرولتر من PCR الأول (خطوة 3.1)، كل التمهيدي بتركيز نهائي من 2 ميكرومتر، 0.5 ميكرولتر MgCl2،10 ميكرولتر العازلة ايفي 5X و 1 بوليميريز ايفي ميكرولتر. نوصي تشغيل 16-24 تقارير إتمام المشروعات لضمان إنتاجية عالية بما فيه الكفاية لاستنساخ لاحق. تجمع تقارير إتمام المشروعات وتنقية الفرقة قبعة كامل طول (جل أو عدة).
- هضم الجين قبعة تنقية حوض السباحة مع باك أنا وأنا تصاعديا للاستنساخ في تكرارها، المختصة AAV بلازميد يحمل AAV نظام الإسناد الأرضي (يكرر محطة مقلوب؛ التكرار وإشارات التعبئة والتغليف)، فضلا عن الجين مندوب AAV2. وينبغي اتباع هذا الأخير من قبل نفس المواقع لاستيعاب الجينات كاب "في إطار" (انظر الشكل 2 للحصول على التفاصيل). لتحقيق الهضم الكامل للمنتج PCR، احتضان بين عشية وضحاها مع انزيم الزائدة.
- Ligate شظايا قبعة وخفض مناسب AAV العمود الفقري ITR / ممثلا في نسبة 1 المولي 3:1. تقديم 40 ميكرولتر مجموع حجم mastermix (يكفي لمدة 20 التحولات) مع تركيز الحمض النووي النهائية من 50 جيم نانوغرام / ميكروليتر واحتضان بين عشية وضحاها على 16 درجة
- تحول رد فعل الربط عن طريق خلط (على الجليد) 2 ميكروليتر مع 30 هاء الكهربائية المختصة ميكرولتر كولاي (نمت من خلايا التجارية وجعلت المختصة باستخدام أي بروتوكول قياسي). إضافة إلى ما قبل cuvettes electroporation المبردة (1 فجوة ملم) على الجليد. Electroporate عند 1.8 كيلو فولت، 200 Ω وμF 25. وينبغي أن الوقت ثابت أن تكون قريبة من 5 مللي. إضافة على الفور 1 مل المتوسطة SOC قبل حرارة ونقلها إلى قارورة 250 مل. وسوف تسفر عن 20 electroporations هذه المكتبة مع مجموعة متنوعة من الحيوانات المستنسخة عن 1x10 6 مختلفة.
- إضافة 1 متوسط حجم شركة نفط الجنوب قبل حرارة إلى التحولات المجمعة ويهز على 37 درجة مئوية و 180 دورة في الدقيقة لمدة 1 ساعة. جلب ثم يصل إجمالي حجم إلى 800 مل مع متوسط LB زائد الأمبيسيلين (تركيز النهائي من 50 ميكروغرام / مل)، واحتضان لمدة 16 ساعة في ظل نفس الظروف. تنقية الحمض النووي البلازميد باستخدام مكتبة على سبيل المثال. مجموعة QIAGEN ميجا الإعدادية.
اختياري في خطوة 3.6: لحساب التنوع مكتبة على وجه الدقة، لوحة 1 aliquبعد التمديد للحل مل 800 (قبل الحضانة ح 16) عن LB-الأمبيسيلين لوحات (على سبيل المثال، 10 ميكرولتر على طبق 10 سم)، وعدد المستعمرات في اليوم التالي. أيضا، للتحقق من صحة عالية الكفاءة خلط، على سبيل المثال تسلسل 24 الحيوانات المستنسخة ومواءمتها للجينات قبعة الأبوية (انظر أيضا الشكل رقم 8). أخيرا، لتأكيد حيوية مكتبة والتنوع الوظيفي العالي، subclone اختار عشوائيا الجينات قبعة الى المساعد AAV البلازميد واستخدامها لإنتاج وتحليل ناقلات المؤتلف في نطاق ضيق (الشكلان 4-5) (انظر أيضا خطوة 5.4 أدناه).
4. إنتاج مكتبة الفيروسية
- البذور 10 15 سم 2 أطباق من الخلايا HEK293T (4.5x10 6 خلية / طبق) وح 48 transfect في وقت لاحق مع 220 ميكروغرام AAV مكتبة و 220 ميكروغرام البلازميد الفيروسة الغدانية (مطلوب لنشر AAV). لذلك، قبل دافئ PEI (polyethylenimine) كلوريد الصوديوم و 300 ملم على 37 درجة مئوية. ثم خلط 7.9 مل من كلوريد الصوديوم والحمض النووي، وإضافة H 2 O إلى مجموع voluلي من 15.8 ملم. في أنبوب منفصل، مزيج 3.52 مل PEI، 7.9 مل كلوريد الصوديوم و 4.38 مل H 2 O (كافة وحدات التخزين لمدة عشرة transfections). الجمع بين يمزج (دوامة) واحتضان لمدة 10 دقيقة في درجة حرارة الغرفة، وذلك قبل توزيع حل بالتساوي على أطباق (3 مل لكل طبق).
- بعد 48 ساعة، وكشط الخلايا في الأجلين المتوسط وتدور عليهم في 1200 دورة في الدقيقة لمدة 15 دقيقة. Resuspend وبيليه الخلية في 6 مل العازلة تحلل (50 ملم تريس، حمض الهيدروكلوريك 8،5 درجة الحموضة، 50 مم NaHCO 3) وتخضع لدورات تجميد ذوبان 5 (-80 / 37 درجة مئوية). احتضان مع benzonase يو 50 في مل لمدة 1 ساعة عند 37 درجة مئوية، قبل الغزل أسفل حطام خلية في 3750 دورة في الدقيقة لمدة 20 دقيقة.
- إعداد 15٪، 25٪ و 40٪ التخفيفات (مع 2.5 ميكروليتر / phenolred مل) من iodixanol 60٪ (OptiPrep في برنامج تلفزيوني، MK) الأوراق المالية في برنامج تلفزيوني، عضو الكنيست (1X PBS، 1 ملم MgCl 2، 2.5 ملم بوكل).
- ثم اقامة معامل لتنقية AAV باستخدام ماصة باستير إلى إضافة 5 مل تعليق فيروس في جهاز للطرد المركزي بيكمان أنبوب السريع الختم (14x89 ملم)، من قبل مجموعة شرق افريقيا 1.5 ملح 15٪، 25٪ و 40٪ حل iodixanol. تتويج التدرج مع عازلة تحلل.
- منبذة فائقة في 50،000 K لمدة 2 ساعة في 4 درجات مئوية في الدوار Ti70.1 بيكمان. ثم تنظيف السطح الخارجي للأنبوب مع الايثانول 70٪، والعصا إبرة في الجزء العلوي من أنبوب للتهوية وسحب 1،2 مل من الكسر iodixanol 40٪ باستخدام إبرة. أن تحرص على تجنب رسم جزء من 25٪ كما أنه يحتوي على فارغ capsids AAV.
5. الفرز والاختيار
- عند هذه النقطة، يمكن للمرء إما تضخيم تكراري مكتبة بأكملها في الخلايا مثقف أو في الحيوانات حتى capsids خيالية واظهار الخصائص المطلوبة وظهرت (الشكلان 6-11).
- حدد في الخلايا المستزرعة، وشارك في تصيب aliquots مختلفة من مكتبة (على سبيل المثال، 1 و 10 و ميكرولتر 100) واتش 5-AAV لدعم النمو. اختبار العديد من الصيغ المختلفة من مكتبة والمساعد الفيروسة الغدانية ضروري لان العدوى مكتبة في نوع خلية معينة لا يمكن التنبؤ بها. حصادالخلايا بعد أيام 3 ~، استخراج AAV تضخيمها عبر ذوبان للتجمد، تعطيل اتش لمدة 30 دقيقة عند 56 درجة مئوية خلايا جديدة وإعادة العدوى. كرر تصل إلى 5 مرات حتى يصبح capsids متميزة المخصب (التحقق من التسلسل).
- للاختيار في الحيوانات، وإصابة مع المكتبة واستخراج نوع النسيج أو الخلية المطلوبة بعد أسبوع 1 ~. لا مع اتش شارك تصيب، وهذا سوف يسبب سمية ضارة في الحيوانات. إنقاذ الحمض النووي الفيروسي عن طريق PCR باستخدام بادئات نفسه كما كان من قبل (الشكل 2)، وإعادة استنساخ تجمع كأب، وإنتاج مكتبة جديدة وتكرار حتى capsids متميزة أصبح أثرى (التحقق من التسلسل).
- والظروف الدقيقة (حجم، عيار، الطريق) للاختيار في الجسم الحي تعتمد على النسيج المستهدف من الفائدة. للكبد، يصاب عادة الفئران مع 1x10 1x10 11 إلى 12 الجسيمات الفيروسية في وحدة تخزين ما مجموعه 200 PBS ميكرولتر عن طريق حقن الوريد الذيل (IV). العامل المحدد هو عادة عيار الفيروسية من الاصلل إعداد، لأن حقن AAV 12 1x10 في 200 ميكروليتر يتطلب ما لا يقل عن عيار 5x10 مل / 12، والتي لا يمكن أن جميع معامل تحقيق روتيني. وبالتالي، في حين أن الحد الأقصى هو عيار مفيدة للعدوى الأولى (لأنه لم يتم حتى الآن في المكتبة المخصب لcapsids فعال في نسيج معين، وبالتالي قد يكون لها العدوى منخفضة نسبيا عموما)، فإننا نوصي باستخدام ما لا يقل عن 11 1x10 الجسيمات في الماوس لاختيار الكبد.
- إذا الفئران متعددة متوفرة، فإنه من المفيد جدا لحقن أعداد الجسيمات مختلفة أقرب إلى التحديد في الخلايا المستزرعة، واستخدام عدة الفئران في كل مجموعة (وبعد ذلك تجمع الأكباد التي تم جمعها في كل مجموعة)، وذلك للحد من التقلبات وزيادة نجاح أسعار الفائدة، على سبيل المثال 3 الفئران في 1x10 11 و 3 فئران في الجسيمات 12 1x10.
- منذ AAV هو فيروس غير ممرضة والتكرار غير كفء، (بدون helpervirus)، ليست هناك ردود فعل سلبية للبحث عن في غياب عدنovirus.
- لeuthanization، وanesthesized الحيوانات باستخدام المرذاذ isoflurane والموت الرحيم في وقت لاحق عن طريق التفكك عنق الرحم.
- تم حصاد أنسجة الجسم (الكبد في هذه الحالة) بعد أن أكدت الحيوانات الموت الرحيم. بشكل عام، ليست هناك حاجة أيضا لأنسجة أخرى ليروي للحيوانات أو لجني AAV الأجهزة المصابة قبل وفاته، لأن الحمض النووي AAV مستقرة ويمكن بسهولة أن انقاذهم من خلايا مجمدة / الأنسجة.
- لدراسة capsids واحد (من مكتبة (الخطوة 3.6) أو بعد اختيار (خطوات 5،2-5،3))، إنتاج ناقلات AAV ترميز الجين مراسل (وعلى سبيل المثال، GFP 6) وذلك باتباع الخطوات 4،1-4،5. ولذلك، استنساخ الجينات الحد الأقصى من الفائدة إلى مساعد AAV معيار البلازميد 2. في خطوة 4.1، الثلاثي transfect الخلايا مع 14.7 ميكروغرام كل من ناقلات AAV (ترميز المراسل)، والمساعد AAV المساعد الفيروسة الغدانية. تصيب الخلايا مثقف أو الحيوانات مع الفيروس في تنقية كميات مختلفة والتصميم لعلى سبيل المثال شمال شرق كفاءة ترنسدوكأيشن عن طريق نظام مراقبة الأصول الميدانية أو المجهري.
6. ممثل النتائج
حدد استخدام بروتوكول هنا النتائج عادة في المكتبات الفيروسية مع مجموعة متنوعة من حول 1x10 6 capsids فريد الذي يمكن بعد ذلك عرض فيلم واحد للجسيمات عرض معظم أو كل الخصائص المطلوبة على خط خلية معينة أو في الحيوانات. في ما يلي، وسوف نقدم نماذج تمثيلية لتحقيق نتائج من هذا القبيل في المختبر أو في العروض الحية.
قبل ذلك، ومع ذلك، فإننا نعتبر أن من المهم أن نشير مرة أخرى إلى فائدة تحليل استنساخ فرد من مكتبة البلازميد الأصلي للحصول على الوظائف وتنوعها (اختياري في خطوة 3.6). وذلك لأن هذا الأخير معلمتين هي شروط مسبقة حرجة قصوى لنجاح اختيار مكتبة الفيروسية الفعلية التي تتم من مكتبة البلازميد. ولذلك، يمكن للمرء اختيار عشوائيا واحدة تعديلاالجينات قبعة واستخدامها لانتاج ناقلات AAV المؤتلف (مقتطفات الخام أو جزيئات تنقيته، اعتمادا على الدرجة المطلوبة من الدقة) التعبير عن الجينات مراسل يسهل اكتشافها وقابلة للقياس الكمي. وفحص نموذجي للمقارنة بين أنواع مختلفة قفيصة هو ثم مضان المجهري، كما هو مبين في المثال ممثل في الشكل. 4.
أسلوب بديل هو نظام مراقبة الأصول الميدانية القائمة على قياس فلوري مراسل التعبير الجيني الذي يحمل فوائد اضافية من أنه يسمح أيضا للبت في التعبير الجيني للخلية، بالإضافة إلى أنه يعمل لخلايا تعليق. الشكل. 5 يبين نتيجة نموذجية من نظام مراقبة الأصول الميدانية لمثل هذا التحليل قائم على النفط الخام lysates ناقلات AAV في مختلف أنواع الخلايا.
لأن اختيار الموصوفة أعلاه من الوهم كاب فردي عشوائي والمقيدة، وهو بالطبع ليس من المفيد كنهج الفعلية لتخصيب اليورانيوم من المرشحين المطلوب. بدلا من ذلك، اختيار السادسراؤول مكتبة في الخلايا المستهدفة أو الأنسجة في الحيوانات أكثر ملاءمة. كما للشروط والمعايير سوف تختلف مع كل طلب، وسوف نسلط الضوء فقط على المبادئ التوجيهية للممثل قليلة والنتائج.
أسهل الاختيار هو تكراري التضخيم المكتبة على خطوط خلايا مستنبتة أو الخلايا الأولية (الخطوة 5.2). منذ AAV يتطلب اتش شارك في عدوى للنشر لها، ويجب أن الخلايا المستهدفة تكون عرضة لاتش. يمكن للمرء أن تنمو ثم وتصيب منهم على سبيل المثال في لوحات 6 البئر الذي عقد أعداد كافية لكل خلية بشكل جيد لضمان التغطية الكاملة للمكتبة. وفكرة الهامة الثانية هي أن ميزان AAV واتش غير دقيق؛ AAV الكثير سوف تمنع اتش، في حين وجود فائض من هذا الأخير سوف تقتل الخلايا (على عكس AAV، اتش يسبب التهابات التحللي) قبل AAVs يمكن تكرارها.
ومع ذلك، منذ العدوى مكتبة على نوع من الخلايا معينة غير معروف، وإيجاد "جيدة" AAV: نسب اتش فيوكلاهما يمكن نشر يتطلب اختبار مواز من توليفات مختلفة من جرعات من المكتبة والمساعد الفيروسة الغدانية (على سبيل المثال، 10:1، 1:1 و 1:10). مقياس جيد لعدوى اتش قوي هو وقوع آثار الاعتلال الخلوي بعد ثلاثة أيام من تلقيح الفيروس، ويتضح من التقريب الخلية وفصل كما رأينا في الشكل. نائب العكس 6.، وهو مفيد للقراءة من اصل لعدوى AAV والتضخيم هو الكشف عن البروتينات قفيصة من قبل الغرب النشاف، وذلك باستخدام الأجسام المضادة B1 أن يعترف الحفظ جدا AAV قفيصة حاتمة (الشكل 7) 7.
قرار مهم ومن ثم استخراج النفط الخام الذي AAV لاختيار لاحقة عدوى إعادة الخلايا الحية (الخطوة 5.2). من الناحية المثالية، فإن للمرء أن يأخذ تلك التي تكون فيها قفيصة العصابات AAV هي الأقل ملحوظ (الشكل 7)، لأن هذه تشير إلى ضيق الوراثي، النمط الظاهري الربط. هذا الأخير يصف الوضع في الجينوم الذي ترميز متغير معين هو قفيصةوتعبئتها في الواقع في قفيصة المقابلة. لتحقيق والحفاظ على ضيق الوراثي، النمط الظاهري الربط هو المفتاح لنجاح اختيار المرشحين الفيروسية الفردية لأنها في المقابل يضمن capsids مع الخصائص المطلوبة تسليم قالب وما شابه ذلك الوراثية في الخلايا خلال جولات متتالية عدوى. ولذلك، فإننا نوصي لاختيار استخراج النفط الخام مع التعبير قفيصة معتدل لعودة العدوى واستخدام كميات ضئيلة. معا، وهذه التدابير 2 منع الحمل الزائد من الخلايا المصابة حديثا مع مجموعات قفيصة / الجينوم المختلفة التي يمكن أن التشويش على خلاف ذلك الربط الوراثي، مرة واحدة النمط الظاهري للفيروسات إعادة المصابة بدء تكرار وإعادة التغليف الجينوم الخاصة بهم إلى عدم capsids وما شابه ذلك.
وبالإضافة إلى ذلك، فإن من الأهمية بمكان لرصد التنوع المكتبة خلال جولات العدوى المتكررة من جانب تسلسل الحمض النووي. من الناحية المثالية، واحد لاحظ التغيرات في تكوين الحيوانات المستنسخة الفردية يدل على اختيار ناجح، أي accumulation من شظايا المصلي متميزة وخسائر للآخرين، كما يتضح في الشكل. 8. في الحالة المثالية، وسوف في نهاية المطاف سوى عدد قليل أو حتى استنساخ واحد يتم الكشف ومن ثم يمكن تحليلها على النحو المبين أعلاه. إذا، ومع ذلك، لم يلاحظ أي تغيرات بعد أربع أو خمس فقرات، ينبغي للمرء إما زيادة الضغط اختيار (انظر المناقشة)، أو أن أعتبر أن خط الخلية المستخدمة قد تكون غير مناسبة لأنه قد يكون عرضة للغاية لعدد كبير جدا من الأنماط المصلية.
لتضخيم مكتبة في الجسم الحي (الخطوة 5.3)، لنفس القواعد والاعتبارات تنطبق، مع اثنين من وجود اختلافات هامة: أولا، فإن المرء لا استنساخ شاشة تم اختيارها عشوائيا في الحيوانات بسبب التكاليف المرتبطة بها، والاعتبارات الأخلاقية. ثانيا، واحد لا مع اتش المساعد شارك تصيب، كما أنه يسبب السميات أو الوفيات في الحيوانات، بالإضافة إلى tropism الفيروسة الغدانية شأنه أن يحد من التحديد إلى الخلايا عرضة لهذا الفيروس المساعد. بدلا من ذلك، هي التي غرست في مكتبة AAV إلى عشرةالحيوانات ه، انقاذهم من الخلايا المستهدفة / الأنسجة بواسطة PCR (الشكل 9) ومن ثم إعادة استنساخ وإعادة تعبئتها لجولة عدوى جديدة. كما هو الحال مع اختيار في الثقافة، وتتكرر هذه العملية حتى المرشحين الأفراد ظهرت.
بغض النظر عن إجراءات الاختيار، والخطوة الأخيرة هي التحقق من المتغيرات قفيصة المخصب في النظم الملائمة. التين. 10 و 11 أمثلة ممثل المعرض من اختيارنا السابقة الخاصة من الوهم AAV التي تحقق أداء جيدا للغاية في مجال زراعة الأنسجة أو في كبد الفئران. كما رأينا في الشكل. 10، 1 نسخة خاصة (AAV-DJ 3) يتفوق في الواقع عبارة عن مجموعة من ثمانية wildtypes AAV الطبيعي في مجموعة واسعة من خطوط الخلايا. أخيرا، يعرض آخر نسخة مختارة في خطوط الكبدي مثقف أعلى tropism للكبد الفئران، وبالتالي أقل من استهداف عندما غرست محيطيا في فئران بالغة من ناقلات قوية تحكم AAV8 اختبارها في COM مباشرةparison (الشكل 11). ولو نلاحظ أن يكون أكثر تحديدا في الكبد، واستنساخ AAV-DN transduces فعلا هذا الجهاز قليلا أقل كفاءة من AAV8. وفي هذا الصدد، AAV-DN هو مثال جيد لممثل نتائج تطور AAV واختيار المرشحين النهائيين حيث تظهر عادة على عدد من الخصائص المطلوبة ولكنها ليست بالضرورة الكمال في كل الجوانب.
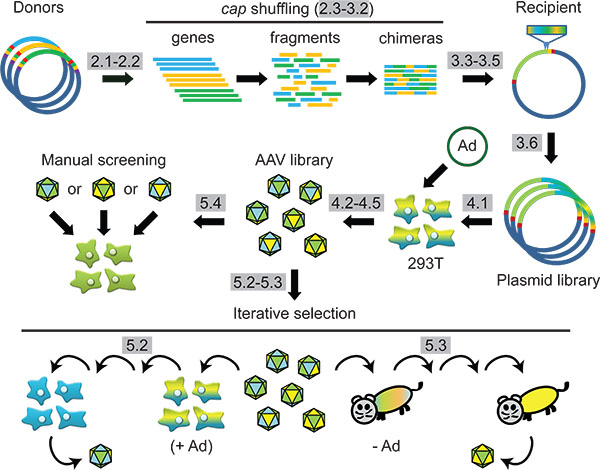
الشكل 1 مخطط:. الاصطناعية الهندسة قفيصة AAV عن طريق الحمض النووي عائلة خلط واختيار اللاحقة في الخلايا أو في الحيوانات. وتبرز الخطوات بروتوكول في الرمادي.
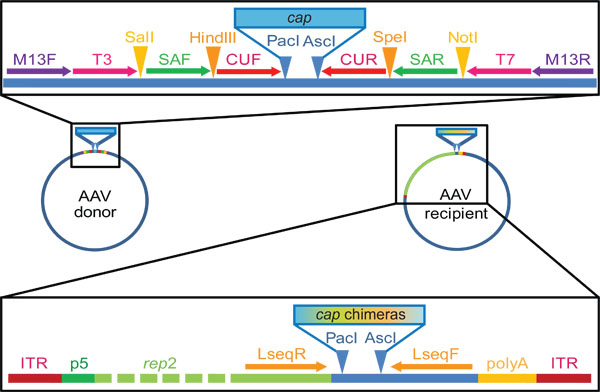
الشكل 2. الجينات قبعة AAV المانحة والمتلقية البلازميدات المستخدمة في المختبر للأسرة خلط الحمض النووي وتوليد مكتبة. لاحظ أن هذه أمثلة فقط ممثل، وذلك في المواقع المحددة ومتوالياتيمكن تخصيص. مشتق من الجهات المانحة الأساسية لدينا البلازميد من كانساس المتاحة تجاريا الثاني pBlueScript (+) ناقلات التي نحن هندسيا لاحتواء ملزم التمهيدي كما هو مبين كذلك المواقع تقييد، صورت من قبل السهام أو مثلثات، على التوالي. نحن المستنسخة ثم الجينات قبعة من الأنماط المصلية AAV 1-9 (تضخيم مع capF الاشعال / R) في هذا البلازميد، لتصبح محاطة أنا باك ومواقع تصاعديا تقييد أنا. وتستخدم الاشعال T3 و T7 لعزل سقف في الخطوة 2.2، في حين يمكن تحقيق التضخيم في وقت لاحق من إعادة تجميع سلاسل خيالية (الخطوة 3.2) باستخدام أزواج التمهيدي إما القوات المسلحة السودانية / R أو حزب الجبهة المدنية المتحدة / R، أو على حد سواء في PCR المتداخلة. المتلقي تكرارها، المختصة بلازميد يحمل يكرر AAV محطة المقلوب (نظام الإسناد الأرضي، والنسخ وإشارات التعبئة والتغليف) المرافقة للجين مندوب AAV2 تحت سيطرة المروج P5 AAV. باك أنا ومواقع تصاعديا تقييد أنا المصب من مندوب تسمح "في إطار" الاستنساخ من مجموعة من الجينات تعديلا قبعة. وأظهرت مواقع التمهيدي Lseq ملزم مفيدة لقبعة التسلسل الجيني (الخطوة 3.6).

الشكل 3. مثال للهضم الدناز أنا من الجينات قبعة (AAV2، 8 و 9). أظهرت هو التحليل الكهربائي للهلام الاغاروز من المنتجات من الجينات قبعة هضم باستخدام المشار مرات حضانة مختلفة (في دقائق: ثواني). لين يو يظهر الغطاء مساهمة عسر الهضم تجمع جزء من السيطرة. أحجام مختلفة من العصابات علامة الحمض النووي في الممرات هي M في kilobases. تم الحصول عليها في هذا المثال، يساعد على هضم المثالي مع أوقات حضانة 1:45 أو 2:00 دقيقة، والتي أسفرت عن ذروة المفضل السائد حول أزواج قاعدة 100-500 (المربع الأصفر).

الشكل 4. مثال للفحص المجهري التحليل القائم على ثلاثة خطوط الخلايا البشرية المصابين الخمسة المختلفة المؤتلف لقد AAV Yfp في التعبير عنctors (أسماء على رأس) مصنوعة من الجينات قبعة تعديلا تم اختيارهم عشوائيا من مكتبة الأصلي استنادا إلى 8، و 9 AAV2.

جعل الشكل 5. مثال لنظام مراقبة الأصول الميدانية المستندة إلى تحليل أنواع الخلايا المصابة 4 (في التخفيفات عشرة أضعاف المسلسل) مع 18 مختلفة المؤتلف ناقلات AAV Yfp في التعبير عن (أسماء على أعلى، بما فيها تلك التي من الشكل 4) مع تعديلا الجينات قبعة تم اختيارها عشوائيا من مكتبة الأصلي (AAV2، 8 و 9). وكان Yfp التعبير مرمزة لتسهيل التصور. transduced نسب الموصفة من الخلايا، حيث الأسود يشير دائما 0٪ والأبيض وهو أعلى رقم قياس في كل نوع من الخلايا. B2 استنساخ (الحمراء) تجسد استنساخ مع فعاليتها الشاملة الفقراء، كما يمكن أن يتوقع من capsids غير محددة. نلاحظ أن نظام مراقبة الأصول الميدانية تحليل أكثر حساسية ويمكن أن تستخدم أيضا لخلايا التعليق (مثل SupT1) التي هي أقل قابلية لالمجهري. هو جين تاو، الإنسان؛ مو، والفئران.
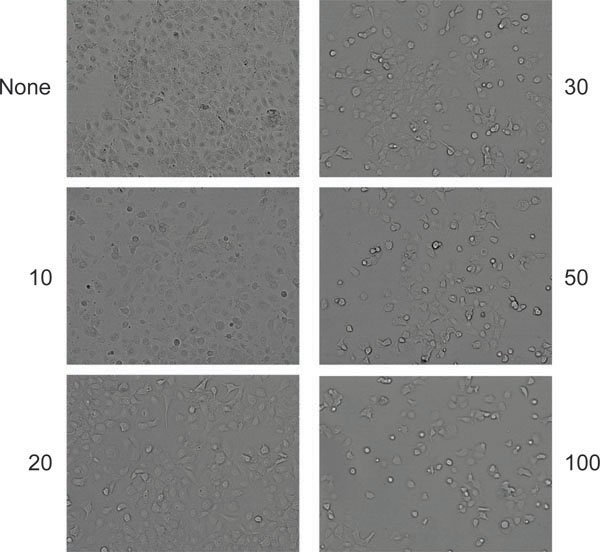
الشكل (6). مظهر نموذجي للآثار الاعتلال الخلوي في خلايا (هيلا في هذه الحالة) بعد منتجة شاركت في عدوى مع AAV واتش. لم يبق أي خلايا غير مصاب (لوحة أعلى اليسار) أو المصابين المبالغ المشار إليها (جسيمات لكل خلية) من اتش.

الشكل 7. الكشف عن التعبير AAV البروتين قفيصة من قبل الغرب النشاف كمقياس للعدوى مكتبة والتضخيم. وصمة عار اليسار تظهر الخلايا المصابة شارك في مجلدات مختلفة (في ميكرولتر) من مكتبة AAV واتش المساعد. أول مسربين أمثلة جيدة للتعاونnditions الرضوخ للكشف بالكاد بروتين تعبير AAV، مشيرا كافية ولكن ليس مفرطة AAV العدوى والتضخيم، وبالتالي المطلوب محكم الربط الوراثي، النمط الظاهري. وبالتالي، تم استخدام 0.1، 1 أو 10 ميكرولتر من هذه supernatants لعودة العدوى من الخلايا الحية (وصمة عار على اليمين). أصيب الخلايا في C حارة مع وحده AAV كوسيلة لمراقبة سلبية (لا يمكن كشفها التعبير بسبب غياب helpervirus).
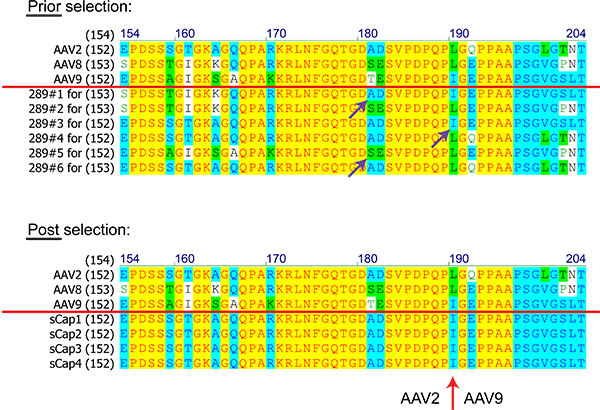
الرقم 8. مقارنات تسلسل البروتين (الأرقام هي الأحماض الأمينية) من الحيوانات المستنسخة AAV من مكتبة على أساس 8، و 9 AAV2 قبل وبعد اختيار. متواليات فوق خط أحمر يظهر AAVs الوالدين. الأرجواني السهام تشير إلى أحداث إعادة التركيب مثلي. السهم الأحمر يمثل عبر أكثر من بين AAV2 وAAV9 لوحظ في جميع الحيوانات المستنسخة المحددة.
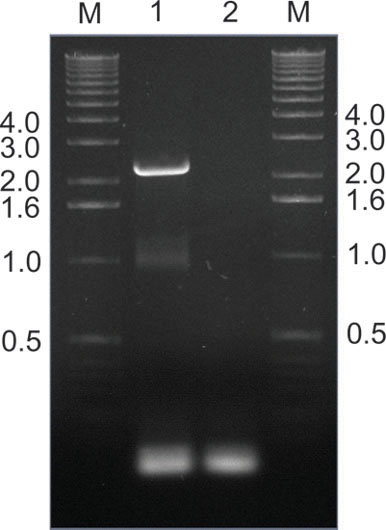
الشكل 9. </ قوي الإنقاذ> من المصابين بنجاح استنساخ AAV من الأنسجة الماوس عن طريق PCR. في هذا المثال، كانت AAV الجينات قبعة PCR-تضخيمها من كبد فأر المستخرجة بعد أسبوع واحد ضخ مكتبة الطرفية، وذلك باستخدام زوج التمهيدي القوات المسلحة السودانية / R (الشكل 2). لين 1 يبين المتوقعة الفرقة kilobase 2.2، في حين لين 2 هو سيطرة غير القالب. بعد أنا باك وتصاعديا تقييد أنا، كانت شظايا تضخيم إعادة استنساخ إلى المتلقي الأصلي البلازميد (الشكل 2) لإنتاج لاحق، وإعادة ضخ، من مكتبة الثانوية. يشار إلى أحجام العصابات علامة M الحمض النووي في الممرات في kilobases.

الشكل 10. مثال للحصول على أداء متفوق للAAV المخصب الوهم في الخلايا المستزرعة. تم الإبلاغ عن استنساخ AAV-DJ من قبلنا قبل 3؛ لأنها تمثل في معظمها مختلطة بين الأنماط المصلية AAV 2 و 8 و 9، و قد تم اختيارها من المكتبه ذ المحتوية على هذه الأنماط المصلية بالإضافة إلى خمسة أخرى في خلايا الكبد البشرية في وجود أمصال مضادة الإنسان المجمعة. لمقارنة فعاليتها إلى ثمانية أنماط مصلية AAV الطبيعية (وأشار بنسبة 8 و 1-6 و 9 في أعلى)، واستخدمت كل الجينات غطاء لانتاج تنقية ذاتية تكميلية في Gfp في التعبير عن ناقلات 8،19. وتم تطبيع هذه لاحتواء الجينوم ناقلات 2x10 9 في مل واستخدمت بعد ذلك لtransduce خطوط الخلية هو مبين في عشرة أضعاف التخفيفات المسلسل. بعد ثلاثة أيام، احصي في Gfp، معربا عن الخلايا وكانوا مصممين التتر المعدية من قبل مع الأخذ في الاعتبار عامل تخفيف. وعلى النقيض من رمز في الشكل. 5، والألوان الداكنة هنا تشير إلى ارتفاع عدد infectivities لكل جسيم. كما هو واضح، والمحدد AAV-DJ الوهم يتفوق كل wildtypes AAV الطبيعية، لاثبات نجاح هذه الخطة اختيار تطبيق. fibr، الخلايا الليفية، هكتار، الهامستر، هو جين تاو، الإنسان؛ مو، والفئران، الاشتراكية، قرد.

الرقم 11. مثال للتحليل لتحديد AAV الوهم في كبد الفأر. وقد تم اختيار استنساخ AAV-DN على خلايا الفئران الكبدي ومن ثم استخدامها لانتاج ناقلات luciferase المراسل في التعبير عن المؤتلف 8. أظهرت الفئران هي ممثل (ثلاثة في كل مجموعة) بعد أسبوع واحد ضخ الطرفية من جرعات متساوية من هذه النواقل أو عنصر تحكم استنادا wildtype AAV8، واحدة من العزلات أقوى الطبيعية المعروفة في كبد الفأر 9. لاحظ أنه في حين أن استنساخ AAV-DN يعطي التعبير أقل قليلا شامل في الكبد (لوحة (I))، وهو أكثر محددة لهذا الجهاز لأنه يسلك أقل بكثير خارج الاستهداف في أنسجة الكبد غير مرة واحدة في مستويات التعبير الكبد كانت عدلت عن طريق برامج التصوير (لوحة (II)).
Discussion
هنا، وقد أوجزنا الخطوات التجريبية الأساسية والمبادئ التوجيهية لAAV قفيصة الهندسية عن طريق الحمض النووي الأسرة وخلط للتطور في الخلايا أو في الحيوانات. في جوهره، وهذه البروتوكولات هي إصدارات موحدة من الإجراءات نحن لاول مرة في مجال AAV في 2008 3. في حين أن سلسلة من درا?...
Disclosures
جميع المؤلفين أن تعلن أنها ليس لديها ما تكشف.
Acknowledgements
المؤلفين الامتنان الدعم المعلقة من مختبرهم، أعضاء الفريق والعمل الذي قامت به الكتلة من CellNetworks التميز في جامعة هايدلبرغ، وكذلك من تشيكا وهاينز شالر (CHS) الأساس. نحن نقدر أن تطور AAV الجزيئية عن طريق الحمض النووي عائلة خلط أصبح حقل نشط جدا منذ نشر موقفنا المبدئي منذ ثلاث سنوات وبالتالي الاعتذار لجميع الكتاب من المنشورات ذات الصلة العمل الذي لا يمكن ونقلت هنا بسبب ضيق المساحة.
Materials
| Name | Company | Catalog Number | Comments |
| اسم كاشف | شركة | فهرس العدد | |
| أنا الدناز | إينفيتروجن | 18068-015 | |
| Polyethylenimine (PEI) | سيغما الدريخ | 408727 | |
| تقييد الانزيمات | NEB | مختلف | |
| T4 الحمض النووي يغاز | NEB | M0202T | |
| جل استخلاص عدة | QIAGEN | 28704 | |
| Phusion كيت الثاني بوليميريز | Finnzymes (NEB) | F-540S | |
| HotStar كيت ايفي بوليميريز | QIAGEN | 202602 | |
| DMSO | Finnzymes (NEB) | F-540S (جزء من مجموعة) | |
| EDTA (25 ملم) | إينفيتروجن | 18068-015 (جزء من مجموعة) | |
| تريس | روث | 4855.2 | |
| Ampicilin ملح الصوديوم | روث | K029.2 | |
| dNTPs (10 ملم، و 100 ميكرولتر) | إينفيتروجن | 18427013 | |
| Iodixanol (OptiPrep) | محور درع | 1114739 | |
| Phenolred | ميرك | 107241 | |
| البلازميد عدة الإعدادية ميجا | QIAGEN | 12181 | |
| منبذة فائقة | بيكمان كولتر، | أوبتيما L90K | |
| أنابيب الطرد المركزي السريعة الختم | بيكمان كولتر، | 342414 | |
| Electroporation وحدة | الحيوي راد | GenePulserXcell | |
| الحرارية cycler | إيبندورف | Vapo حمايه | |
| تسخين كتلة | BIOER | MB-102 | |
| مضان المجهر | أوليمبوس | IX81 | |
| FACS محلل | بيكمان كولتر، | Cytomics FC500 MLP | |
| MegaX DH10B الخلايا T1R | إينفيتروجن | C640003 | |
| Benzonase | ميرك | 101695 | |
| اتش-5 | ATCC | VR-5 | |
| pBlueScript الثاني كانساس (+) البلازميد | Stratagene | 212207 | |
| cap5F (PAC أنا في موقع أصفر متواليات cap5 محددة، في جريئة): GACTCTTAATTAACAGGT ATGTCTTTTGTTGATCACCCTCC | IDTDNA | عرف التمهيدي | |
| cap5R (موقع أنا تصاعديا في الخضراء، cap5 محددة متواليات في جريئة): GTGAGGGCGCGCC TTAAAGGGGTCGGGTAAGGTATC | IDTDNA | عرف التمهيدي |
References
- Grimm, D., Kay, M. A. From virus evolution to vector revolution: use of naturally occurring serotypes of adeno-associated virus (AAV) as novel vectors for human gene therapy. Curr. Gene Ther. 3, 281-304 (2003).
- Grimm, D. Production methods for gene transfer vectors based on adeno-associated virus serotypes. Methods. 28, 146-157 (2002).
- Grimm, D. In vitro and in vivo gene therapy vector evolution via multispecies interbreeding and retargeting of adeno-associated viruses. J. Virol. 82, 5887-5911 (2008).
- Muller, O. J. Random peptide libraries displayed on adeno-associated virus to select for targeted gene therapy vectors. Nat. Biotechnol. 21, 1040-1046 (2003).
- Perabo, L. In vitro selection of viral vectors with modified tropism: the adeno-associated virus display. Mol. Ther. 8, 151-157 (2003).
- Zolotukhin, S., Potter, M., Hauswirth, W. W., Guy, J., Muzyczka, N. A "humanized" green fluorescent protein cDNA adapted for high-level expression in mammalian cells. J. Virol. 70, 4646-4654 (1996).
- Wobus, C. E. Monoclonal antibodies against the adeno-associated virus type 2 (AAV-2) capsid: epitope mapping and identification of capsid domains involved in AAV-2-cell interaction and neutralization of AAV-2 infection. J. Virol. 74, 9281-9293 (2000).
- Grimm, D. Fatality in mice due to oversaturation of cellular microRNA/short hairpin RNA pathways. Nature. 441, 537-541 (2006).
- Nakai, H. Unrestricted hepatocyte transduction with adeno-associated virus serotype 8 vectors in mice. J. Virol. 79, 214-224 (2005).
- Koerber, J. T., Jang, J. H., Schaffer, D. V. DNA shuffling of adeno-associated virus yields functionally diverse viral progeny. Mol. Ther. 16, 1703-1709 (2008).
- Li, W. Engineering and selection of shuffled AAV genomes: a new strategy for producing targeted biological nanoparticles. Mol. Ther. 16, 1252-1260 (2008).
- Ward, P., Walsh, C. E. Chimeric AAV Cap sequences alter gene transduction. Virology. 386, 237-248 (2009).
- Yang, L. A myocardium tropic adeno-associated virus (AAV) evolved by DNA shuffling and in vivo selection. Proc. Natl. Acad. Sci. U.S.A. 106, 3946-3951 (2009).
- Perabo, L. Combinatorial engineering of a gene therapy vector: directed evolution of adeno-associated virus. J. Gene. Med. 8, 155-162 (2006).
- Maheshri, N., Koerber, J. T., Kaspar, B. K., Schaffer, D. V. Directed evolution of adeno-associated virus yields enhanced gene delivery vectors. Nat. Biotechnol. 24, 198-204 (2006).
- Wu, Z., Asokan, A., Samulski, R. J. Adeno-associated virus serotypes: vector toolkit for human gene therapy. Mol. Ther. 14, 316-327 (2006).
- Kwon, I., Schaffer, D. V. Designer gene delivery vectors: molecular engineering and evolution of adeno-associated viral vectors for enhanced gene transfer. Pharm. Res. 25, 489-499 (2008).
- Perabo, L., Huber, A., Marsch, S., Hallek, M., Buning, H. Artificial evolution with adeno-associated viral libraries. Comb. Chem. High. Throughput. Screen. 11, 118-126 (2008).
- McCarty, D. M., Monahan, P. E., Samulski, R. J. Self-complementary recombinant adeno-associated virus (scAAV) vectors promote efficient transduction independently of DNA synthesis. Gene Ther. 8, 1248-1254 (2001).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved