Для просмотра этого контента требуется подписка на Jove Войдите в систему или начните бесплатную пробную версию.
Method Article
Инженерные и эволюции Синтетическая адено-связанный вирус (AAV) генной терапии векторы с помощью ДНК семьи Перетасовка
* Эти авторы внесли равный вклад
В этой статье
Резюме
Мы показываем основные техники молекулярной инженерии и развиваться синтетические адено-ассоциированные вирусные (ААВ) вектора генной терапии с помощью ДНК семьи перетасовки. Кроме того, мы предоставляем общие принципы и характерные примеры для отбора и анализа отдельных химерных капсид с улучшенными свойствами на клетки-мишени в культуре или в организме мышей.
Аннотация
Adeno-associated viral (AAV) vectors represent some of the most potent and promising vehicles for therapeutic human gene transfer due to a unique combination of beneficial properties1. These include the apathogenicity of the underlying wildtype viruses and the highly advanced methodologies for production of high-titer, high-purity and clinical-grade recombinant vectors2. A further particular advantage of the AAV system over other viruses is the availability of a wealth of naturally occurring serotypes which differ in essential properties yet can all be easily engineered as vectors using a common protocol1,2. Moreover, a number of groups including our own have recently devised strategies to use these natural viruses as templates for the creation of synthetic vectors which either combine the assets of multiple input serotypes, or which enhance the properties of a single isolate. The respective technologies to achieve these goals are either DNA family shuffling3, i.e. fragmentation of various AAV capsid genes followed by their re-assembly based on partial homologies (typically >80% for most AAV serotypes), or peptide display4,5, i.e. insertion of usually seven amino acids into an exposed loop of the viral capsid where the peptide ideally mediates re-targeting to a desired cell type. For maximum success, both methods are applied in a high-throughput fashion whereby the protocols are up-scaled to yield libraries of around one million distinct capsid variants. Each clone is then comprised of a unique combination of numerous parental viruses (DNA shuffling approach) or contains a distinctive peptide within the same viral backbone (peptide display approach). The subsequent final step is iterative selection of such a library on target cells in order to enrich for individual capsids fulfilling most or ideally all requirements of the selection process. The latter preferably combines positive pressure, such as growth on a certain cell type of interest, with negative selection, for instance elimination of all capsids reacting with anti-AAV antibodies. This combination increases chances that synthetic capsids surviving the selection match the needs of the given application in a manner that would probably not have been found in any naturally occurring AAV isolate. Here, we focus on the DNA family shuffling method as the theoretically and experimentally more challenging of the two technologies. We describe and demonstrate all essential steps for the generation and selection of shuffled AAV libraries (Fig. 1), and then discuss the pitfalls and critical aspects of the protocols that one needs to be aware of in order to succeed with molecular AAV evolution.
протокол
1. Подготовка плазмиды наборы Кодирование AAV капсида Гены
- Для облегчения рутинной подготовки достаточного количества различных AAV капсида (крышка) гены последующим перетасовка ДНК, первоначально субклон этих генов в общем плазмиды позвоночника. Важно включают идентичные фланговые последовательности> 20 нуклеотидов для последующего использования в качестве грунтовки сайты связывания для ПЦР и для клонирования (рис. 2).
- Используя соответствующие праймеры (см. таблицу за образцовое праймеров для AAV5), ПЦР усиливают желаемые гены крышка из общедоступных плазмиды AAV, которые обычно содержат AAV2 представитель ген рядом с крышкой ген выбора. Поскольку ПЦР-продукт будет использоваться для стандартного клонирования, ~ 1 мкг очищенного продукта уже достаточно, и любой обычный протокол ПЦР может поэтому быть использованы.
- Дайджест очищенного продукта ПЦР (например, использование геля агарозы очистки или стандартный комплект очистки ПЦР) иполучатель плазмид ферментами рестрикции которых сайты узнавания присутствуют в праймеров для амплификации крышкой (1.1), а также в принимающих плазмиды. В нашей лаборатории мы используем Pac я и Asc я объектов (рис. 2), поскольку они отсутствуют в большинстве AAVs.
2. ДНКазы основе Cap Гена Фрагментация
- ПЦР усилить крышку гены выбор из плазмид генерируется в 1,1-1,3 шагов. Одной из реакций, как описано ниже даст ~ 3 мкг продукта ПЦР. В зависимости от количества генов крышки должны быть включены в библиотеку, этого достаточно на срок до шести перетасовки реакций.
- Для ПЦР, создана 50 мкл реакции, содержащей 200 нг крышка плазмиды каждого праймера в 2 мкм конечной концентрации 10 мкл 5х буфера Hi-Fi и 1 мкл полимеразы Hi-Fi. Начните с 5 минут при 95 ° C, а затем запустить 40 циклов 15 сек 94 ° С, 30 сек 57 ° С и 3 мин 68 ° С, а затем последние 10 мин шаг за шагом72 ° C. Очисти продуктов ПЦР с помощью гель или комплект, а затем создать управляемый ДНКазы дайджест создать шапку фрагменты генов для повторной сборки в химеры.
- Таким образом, в равной степени смешивать различные крышки продуктов ПЦР на общую сумму 4 мкг в 54 мкл H 2 O. Добавить 6 мкл реакции ДНКазы буфера и 0,5 мкл ДНКазы I к реакции, осторожно вылить в три раза, спина коротко и сразу же поставить на 25 ° C блок отопления. Инкубируйте от 1 до 2 минут (настроить несколько параллельных реакций и прекратить их с шагом 15 сек), то остановить реакцию, добавив 6 мкл 25 мМ ЭДТА и коротко встряхивая и инкубации 10 мин при 75 ° C.
- Очистите крышку фрагментов на стандартный 1% агарозном геле. В идеале, мазок должен быть виден между 100 и 500 пар оснований. С ДНКазы I является сильнодействующим фермент, правильное обращение и сроки имеют решающее значение на этом этапе, и несколько изменений в инкубационный период в 2,3 шага могут быть необходимы для оптимального разрешенияULTS (рис. 3). Очисти элюированных ДНК с использованием стандартного набора и определить его концентрацию.
3. ДНК семьи Перетасовка
- Во-первых, соберите крышку фрагментов в полнометражных последовательности с помощью ПЦР, в котором они себя-премьер на основе частичной гомологии. Таким образом, созданы 50 мкл реакции с 500 нг очищенного фрагменты (шаг 2.4), 10 мкл 10х буфера Phusion, 1 мкл 10 дНТФ мм, 1,5 мкл ДМСО и 0,5 мкл полимеразы II Phusion. Инкубировать 30 секунд при 98 ° C, а затем запустить 40 циклов по 10 сек 98 ° С, 30 сек 42 ° С и 45 сек 72 ° С, после чего окончательный шаг 10 мин при 72 ° C.
- В последующие второй ПЦР, усиливают повторно собраны гены крышка для последующего клонирования с использованием праймеров, которые связывают с сохраняющимися фланговые последовательности (рис. 2). Таким образом, созданы 50 мкл реакции, содержащую 2 мкл первом ПЦР (шаг 3.1), каждого праймера в конечной концентрации 2 мкМ, 0,5 мкл MgCl2,10 мкл 5х буфера Hi-Fi и 1 мкл полимеразы Hi-Fi. Мы рекомендуем запускать 16-24 ПЦР обеспечить достаточно высокий урожай для последующего клонирования. Бассейн ПЦР и очистить полнометражный крышка группы (гель или комплект).
- Дайджест очищенной бассейн крышкой гена Pac я и Asc я для клонирования в репликации компетентных AAV плазмиды проведение AAV РМЭ (перевернутая концевых повторов, репликации и упаковки сигналов), а также AAV2 представитель ген. Последние должны следовать те же места для размещения бассейна шапку ген "в кадре" (см. рис. 2 детали). Для достижения полного переваривания продуктов ПЦР, инкубировать ночь с избытком фермента.
- Перевязывать крышку фрагменты и соответствующим образом сократить AAV ITR / повторений позвоночник в молярном соотношении 3:01. Сделайте 40 мкл объема Mastermix (достаточно для 20 преобразований) с конечной концентрации ДНК 50 нг / мкл и инкубировать в течение ночи при 16 ° C.
- Преобразование реакции лигирования путем смешивания (на льду) 2 мкл 30 мкл электро-компетентный E. палочки (выращенные из клеток коммерческих и сделал компетентный, используя любой стандартный протокол). Добавить в предварительно охлажденный электропорации кюветы (1 мм зазора) на льду. Electroporate 1,8 кВ, 200 Ω и 25 мкФ. Постоянная времени должна быть близка к 5 мс. Сразу добавляют 1 мл подогретого SOC среднего и передачи в 250 мл колбу. 20 таких electroporations даст библиотека с разнообразием около 1х10 6 различных клонов.
- Добавьте 1 объема подогретого SOC среды в объединенных преобразований и трясти при 37 ° C и 180 оборотов в минуту в течение 1 часа. Затем довести до общего объема в 800 мл со средним LB плюс ампициллин (конечная концентрация 50 мкг / мл) и инкубировать в течение еще 16 ч при тех же условиях. Очищать библиотеку ДНК плазмиды с помощью, например. Qiagen Mega Подготовка комплекта.
Дополнительно на шаге 3.6: Чтобы вычислить точный разнообразию библиотеке, плиты aliquО.Т. из 800 мл раствора (до 16 ч инкубации) на LB-ампициллин пластины (например, 10 мкл на 10 см пластины) и количество колоний на следующий день. Кроме того, для подтверждения высокой эффективности перетасовки, последовательность например, 24 клонов и приведения их в соответствие с родительскими генами крышку (см. также рис. 8). Наконец, чтобы подтвердить жизнеспособность библиотеки и высоким функциональным разнообразием, субклон случайно взял шапку генов в плазмиды помощник AAV и использовать их для получения и анализа рекомбинантных векторов в малом масштабе (рис. 4-5) (см. также шаг 5.4).
4. Производство вирусных библиотеки
- Семенной 10 15 см 2 блюда HEK293T клеток (4.5x10 6 клеток / блюдо) и 48 ч позже трансфекции с 220 мкг AAV библиотеки и 220 мкг аденовирусной плазмиды (требуется для распространения AAV). Таким образом, предварительно теплой PEI (полиэтиленимина) и 300 мМ NaCl при 37 ° C. Затем смешать 7,9 мл NaCl и ДНК, и добавьте H 2 O на общую Voluмне 15,8 мл. В отдельной трубки, смешать 3,52 мл PEI, 7,9 мл NaCl и 4.38 мл H 2 O (все объемы в течение десяти трансфекции). Объединить смесей (вихрь) и инкубировать в течение 10 мин при комнатной температуре, прежде чем распространять решение равномерно по всей блюд (3 мл на чашку).
- После 48 часов, соскоблить клеток в среду и спина их, при 1200 оборотов в минуту в течение 15 мин. Ресуспендируйте осадок клеток в 6 мл лизис буфера (50 мМ Трис-HCl, рН 8,5, 50 мМ NaHCO 3) и с учетом 5 циклов замораживания-оттаивания (-80/37 ° C). Инкубируйте 50 U benzonase на мл в течение 1 ч при 37 ° C, летел вниз до ячейки мусора при 3750 оборотов в минуту в течение 20 мин.
- Подготовить 15%, 25% и 40% разведения (с 2,5 мкл / мл phenolred) от 60% иодиксанол (OptiPrep в PBS-МК) акций PBS-МК (1x PBS, 1 мМ MgCl 2, 2,5 мМ KCl).
- Настройте градиент для очистки AAV с помощью пипетки Пастера добавить 5 мл суспензии вируса в Beckman Быстрый Печать центрифуги трубы (14x89 мм), а затем 1,5 мл EACч на 15%, 25% и 40% иодиксанол решение. Довершение градиент лизис буфера.
- Ультрацентрифуге на 50,000 К в течение 2 ч при температуре 4 ° С в Beckman Ti70.1 ротора. Затем очистите снаружи трубки 70% этанолом, придерживаться иглы в верхней части трубы для вентиляции и привлечь 1,2 мл 40% иодиксанол фракция с помощью иглы. Будьте осторожны, чтобы избежать опираясь на 25% доли, поскольку она содержит пустой капсид AAV.
5. Отбор и подбор
- На данный момент, можно либо многократно усиливают целую библиотеку в культуре клеток и на животных, пока химерные капсид выставке заданными свойствами появилось (рис. 6-11).
- Чтобы выбрать в культуре клеток, со-заражают различными порциями библиотеки (например, 1, 10 и 100 мкл) и аденовируса-5 для поддержки AAV роста. Тестирование нескольких вариациях библиотеки и аденовирусной помощник важное значение, поскольку библиотеки инфекционности в данном типе клеток не может быть предсказано. Заготавливаютклеток после ~ 3 дня, усиливается AAV извлечь с помощью замораживания-оттаивания, инактивируют аденовирус течение 30 мин при 56 ° С и повторно заражать новые клетки. Повторить до 5 раз, пока отдельные капсид обогащаться (проверка по последовательности).
- Для отбора животных, заражают с библиотекой и извлечения нужной ткани или типа клеток после ~ 1 недели. Не совместно заразить аденовирус, так как это приведет к неблагоприятным токсичности у животных. Спасение вирусной ДНК с помощью ПЦР с использованием праймеров же как и раньше (рис. 2), повторного клонирования крышку бассейн, производить новую библиотеку и повторите до различных капсид обогащаться (проверка по последовательности).
- Точные условия (объем, титр, маршрут) для отбора в естественных условиях, будет зависеть от ткани-мишени интерес. Для печени, мыши, как правило, инфицированы 1x10 11 до 1x10 12 вирусных частиц в общем объеме 200 мкл PBS через хвостовую вену для инъекций (IV). Лимитирующим фактором обычно является вирусная титр originaл препарата, так как введение 1x10 12 AAV в 200 мкл требует титр не менее 5х10 12 / мл, что не все лаборатории могут всегда по силам. Таким образом, в то время как максимальный титр выгодно для первой инфекции (потому что библиотека до сих пор не обогащенный для эффективного капсид в той или иной ткани и может, таким образом, относительно низкой общей инфекционной), мы рекомендуем использовать как минимум 1x10 11 частиц на мышь для печени выбор.
- Если несколько мышей доступны, это очень полезно вводить различные числа частиц похоже на отбор в культуре клеток, а также использовать несколько мышей в каждой группе (а затем и объединить собранные печени в каждой группе), чтобы минимизировать изменчивость и повысить успех ставки, например, 3 мыши в 1x10 11 и 3 мыши в 1x10 12 частиц.
- С AAV не является патогенным и репликации некомпетентного (без helpervirus) вируса, нет побочных реакций нужно искать в отсутствии Аденovirus.
- Для euthanization, животные anesthesized использованием ИФ испаритель, а затем с помощью эвтаназии шейки дислокации.
- Ткани (печень в этом случае) были собраны после того, как животные были подтверждены эвтаназии. В общем, нет необходимости и для других тканей обрызгивать животных или собирать AAV-инфицированных органов до смерти, так как ДНК AAV является стабильным и может быть легко спасли из замороженных клеток / тканей.
- Для изучения одного капсид (из библиотеки (шаг 3.6), либо после выбора (шаги 5.2-5.3)), производить AAV векторов, кодирующих гена-репортера (например, GFP 6) следующие шаги 4.1-4.5. Таким образом, клонирование крышку гена в стандартный помощник AAV плазмиды 2. На шаге 4.1, тройной трансфекции клеток с 14,7 мкг каждая из AAV вектор (кодирующий репортер), AAV помощником и аденовирусной помощника. Инфекция культуре клеток или животных с очищенной вируса в разных количествах и определепе трансдукции эффективность например, с помощью FACS или микроскопа.
6. Представитель Результаты
Использование протокола, изложенные здесь, обычно приводит к вирусной библиотеки с разнообразием около 1х10 6 уникальных капсид, которые затем могут быть обследованы на отдельных частиц отображения все или почти все желаемые свойства данной линии клеток или животных. В дальнейшем мы будем предоставлять представитель примеры результатов такой в пробирке или в естественных условиях фильмов.
До этого, однако, мы считаем необходимым еще раз указать на целесообразность анализа индивидуальных клонов от оригинальных плазмиды библиотеки для их функциональность и разнообразие (опционально на шаге 3.6). Это потому, что последние два параметра максимальной критической предпосылкой для успешного выбора фактически вирусного библиотеку, которая состоит из плазмиды библиотеки. Таким образом, можно случайно выбрать один перетасовываютсякрышки гены и использовать их для производства рекомбинантных AAV векторов (неочищенного экстракта или очищенных частиц, в зависимости от требуемой точности), выражающая легко обнаружить и количественно ген-репортер. Типичный тест, чтобы сравнить различные варианты капсида тогда флуоресцентной микроскопии, как показано на типичный пример на рис. 4.
Альтернативным методом является FACS на основе измерения флуоресцентных экспрессии гена репортера, которая содержит дополнительные преимущества, что позволяет для определения экспрессии генов в клетки, а также, что он работает для приготовления суспензии клеток. Рис. 5 показан типичный результат такого FACS-анализа на основе сырой вектора AAV лизатов в различных типах клеток.
Поскольку описанный выше выбор отдельных химеры крышка случайно и ограничения, это, конечно, не используется в качестве фактического подхода к обогащению желаемого кандидата. Вместо этого, выбор В.И.RAL библиотеки в клетки-мишени или тканей у животных является более целесообразным. Поскольку условия и параметры будут меняться в зависимости от каждого приложения, мы будем только выделить несколько принципов представительной и результаты.
Самый простой выбор итерационного библиотеки усиления на культуру клеточных линий и первичных ячеек (шаг 5.2). С AAV требует аденовирус ко-инфекции для его распространения, клетки-мишени должны быть чувствительны к аденовирус. Тогда можно выращивать и заражать их, например, в 6-луночных которые содержат достаточного количества клеток на лунку для обеспечения полного охвата библиотеки. Вторым важным понятием является то, что баланс AAV и аденовирус является деликатным, слишком много AAV будет препятствовать аденовирус, а избыток последнего убьет клетки (в отличие от AAV, аденовирус вызывает литической инфекции) до AAVs может повторить.
Однако, поскольку библиотеки инфекционности на определенный тип клеток, неизвестно, найти «хороший» AAV: аденовирус отношений вкоторые могут распространяться как требует параллельного тестирования различных комбинаций доз библиотеки и аденовирусной помощник (например, 10:1, 1:1 и 1:10). Хорошим показателем для мощных инфекции является аденовирус появление цитопатического эффекта через три дня после прививки вирус, о чем свидетельствует клетка округления и отделения, как показано на рис. 6. И наоборот, полезны для чтения за инфекцией AAV и усиление обнаружения капсид белков Западной блоттинга, используя антитела, B1, который признает высоко консервативны AAV капсида эпитопу (рис. 7) 7.
Важным решением является то какой сырой AAV извлекает выбрать для последующего повторного заражения свежих клеток (шаг 5.2). В идеале, он будет принимать тех, где AAV капсида группы наименее заметным (рис. 7), поскольку эти предлагают жесткие генотип-фенотип связи. Последний описывает ситуацию, в которой геноме кодирующих определенные капсида вариантфактически упакованы в соответствующую капсида. Для достижения и поддержания жесткой генотип-фенотип связь является ключом к успешному выбору индивидуальных вирусных кандидатов, как это, в свою очередь гарантирует, что капсид с заданными свойствами доставить родственные генетические шаблоны в клетках в течение последовательных раундов инфекции. Поэтому, мы рекомендуем выбрать сырой экстракт с умеренным капсида выражение для повторного заражения и использовать минимальное количество. Вместе, эти две меры предотвращения перегрузки вновь инфицированных клеток с различными капсида / генома комбинации, которые могли бы возмутить генотип-фенотип связь только вновь инфицированных вирусами начать тиражирование и переупаковка их геномов в не-родственных капсид.
Кроме того, важно следить библиотеки разнообразие при повторных инфекций раундов секвенирования ДНК. В идеале, можно заметить изменения в состав отдельных клонов свидетельствует успешный выбор, то есть, аккумуляторulation различных фрагментов серотипа и убытки других, а показан на рис. 8. В идеальном случае, всего в нескольких или даже одного клона в конечном итоге будет обнаружен, которые затем могут быть проанализированы как описано выше. Если, однако, не сдвиги наблюдаются после четырех или пяти проходов, нужно либо увеличить давление отбора (см. обсуждение), либо считают, что клеточная линия может быть использована неуместно, потому что это может быть слишком чувствительны к слишком много серотипов.
Для усиления библиотеки в естественных условиях (пункт 5.3), те же правила и соображения применимы, с двумя важные различия: во-первых, никто не экран случайно выбранных клонов животных из-за связанных с этим расходов и этических соображений. Во-вторых, не будут сотрудничать заразить помощник аденовирус, так как вызывает токсических или погибших животных, а также аденовирусной тропизм бы ограничить выбор в клетки восприимчивыми к вирусу помощник. Вместо этого, в библиотеке AAV вводят в гоэлектронной животных, спасаясь от клетки-мишени / ткани с помощью ПЦР (рис. 9), а затем снова клонировали и вновь упакованы для нового раунда инфекции. Как и отбор в области культуры, этот процесс повторяется, пока не отдельных кандидатов появились.
Независимо от процедуры отбора, последним шагом является проверка обогащенного варианты капсида в соответствующих системах. Рис. 10 и 11 показывают типичные примеры из собственного предыдущего выбора химер AAV, которые выполняют исключительно хорошо в культуре ткани и в печени мышей. Как видно на рис. 10, одного конкретного клона (ААВ-DJ 3) действительно превосходит набор из восьми природных wildtypes AAV в широком спектре клеточных линий. Наконец, еще один клон выбран в культуре линий гепатомы демонстрирует более высокий тропизм к мышиной печени и, соответственно, меньше от таргетирования при периферических вливаются взрослых мышей, чем мощный AAV8 векторное управление испытания в прямом комСравнение (рис. 11). Обратите внимание, что хотя и будучи более специфичным для печени, клон AAV-DN фактически преобразовывает этот орган немного менее эффективно, чем AAV8. В связи с этим, AAV-DN является хорошим примером для представителей результат AAV эволюции и отбора кандидатов-финалистов, где обычно обладают рядом нужных свойств, но не обязательно идеальный во всех отношениях.
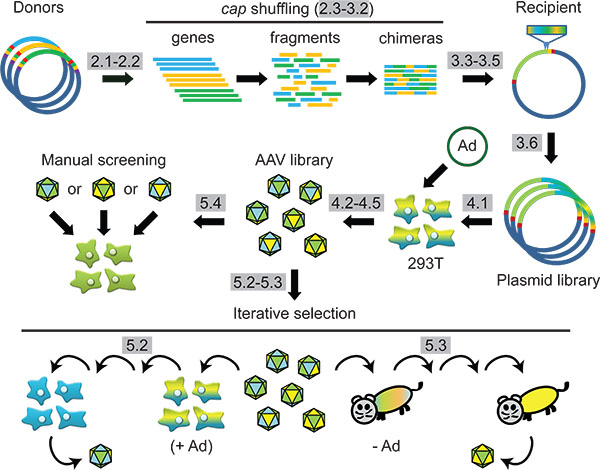
Рисунок 1 Схема. Синтетические AAV капсида инженерных через ДНК семьи перетасовки и последующего отбора в клетках или в животных. Протокол шаги будут выделены серым цветом.
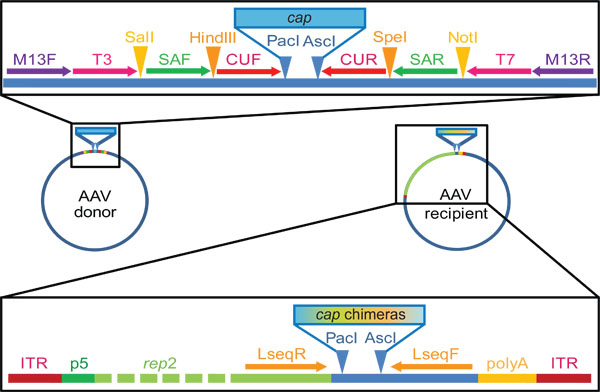
Рисунок 2. AAV крышка донора и реципиента генов плазмид, используемых в нашей лаборатории для ДНК семьи перетасовки и библиотечной поколения. Обратите внимание, что это всего лишь типичные примеры, и что точное сайтов и последовательностимогут быть настроены. Наши основные доноры плазмиды, полученные из коммерчески доступного pBlueScript II KS (+) вектор, который мы инженерии содержать показали связывания праймера, а также сайты рестрикции, изображенные стрелки или треугольника, соответственно. Затем клонированный крышку гены AAV серотипы 1-9 (усиливается с праймерами capF / R) в этой плазмиды, чтобы стать в окружении Pac я и Asc сайтов, которые я ограничений. Грунтовки Т3 и Т7 используется для крышки изоляции в шаге 2.2, а позже усиления повторно собраны химерных последовательностей (п. 3.2) может быть достигнуто с помощью либо пары праймеров SAF / R или CUF / R, или, как в ПЦР. Репликации компетентных получателя плазмида несет AAV перевернутой концевых повторов (РМЭ, репликации и упаковки сигналов) фланговые AAV2 представитель ген под контролем промотора AAV p5. Pac я и Asc сайтов, которые я ограничение на выходе репутация позволяет "в кадре" клонирование в бассейне перемешиваются крышка генов.показано Lseq связывания праймера сайты полезны для крышки секвенирования генов (шаг 3.6).

Рисунок 3. Пример для ДНКазы I дайджест генов крышкой (AAV2, 8 и 9). Показана электрофореза в агарозном геле анализ продуктов генной крышка дайджестов с использованием указанного разное время инкубации (в минутах: секундах). Лейн U показывает непереваренной вход крышка фрагмент бассейн в качестве контроля. Размеры ДНК-маркер полосы полосы M в килобаз. В этом примере идеального дайджесты были получены при инкубации время 1:45 или 2:00 мин, что дало предпочтительным преобладает пик около 100 500 пар оснований (желтая коробка).

Рисунок 4. Пример для микроскопии на основе анализа трех человеческих клеточных линий, инфицированных пяти различных рекомбинантных YFP экспрессией ве AAVctors (имена на вершине), выполненного на гены перемешиваются крышка случайно выбранных из исходной библиотеки на основе AAV2, 8 и 9.

Рисунок 5. Пример FACS-анализа на основе четырех типов клеток, инфицированных (на серийных десятикратное разведение) с 18 различных рекомбинантных YFP экспрессирующие векторы AAV (имена на вершине, в том числе и из рис. 4) сделаны с крышкой гены перемешиваются случайно выбранных от первоначальной библиотеки (AAV2, 8 и 9). YFP выражение цветовую кодировку для облегчения визуализации. Изображенный в процентах от трансдуцированных клеток, в результате чего черный всегда указывает на 0% и белый наибольшее количество измеряется в каждом типе клеток. Клон B2 (красный) пример клона с плохой общей эффективности, как можно ожидать от невыбранных капсид. Обратите внимание, что FACS анализ является более чувствительным, а также может быть использована для приготовления суспензии клеток (например, SupT1), которые менее поддаются микроскопии. ху, Человека, мю, мышиный.
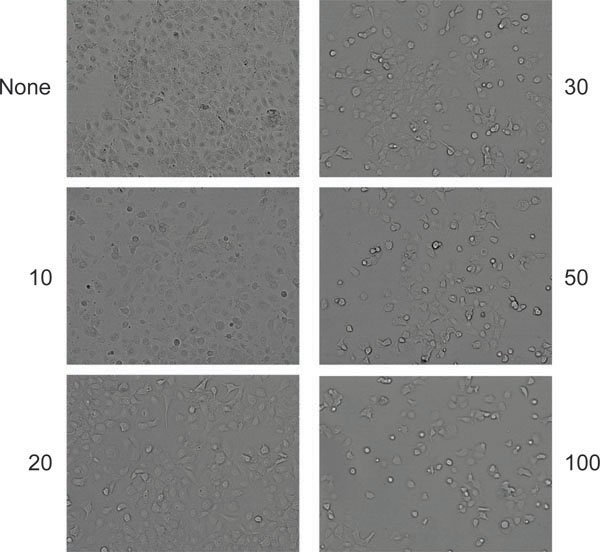
Рисунок 6. Типичный вид цитопатического эффекта в клетках (HeLa в данном случае) после продуктивной ко-инфекции с AAV и аденовирус. Клетки либо оставить неинфицированных (верхняя левая панель) или инфицированных указанной суммы (частиц на клетку) аденовируса.

Рисунок 7. Обнаружение AAV белок капсида выражению западных промокательной в качестве меры для инфекции библиотеки и усиления. Левое пятно показывает, клетки с сочетанной инфекцией различных объемов (в мкл) библиотека AAV и помощника аденовируса. Первые две полосы являются хорошим примером для сотрудничестваnditions уступая едва уловимым AAV экспрессии белка, что указывает на достаточно, но не чрезмерной AAV инфекции и усиления и, следовательно, желаемый жесткий генотип-фенотип связи. Таким образом, 0,1, 1 или 10 мкл эти супернатанты были использованы для повторного заражения свежих клеток (справа пятно). Ячейки в полосе С были заражены AAV только в качестве отрицательного контроля (отсутствием экспрессии в связи с отсутствием helpervirus).
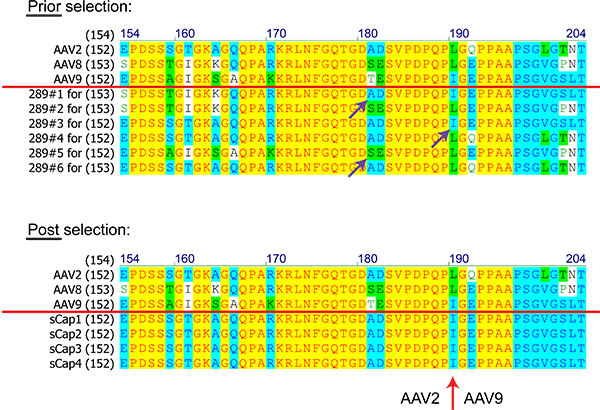
Рисунок 8. Сравнение белковых последовательностей (числа аминокислотных остатков) AAV клонов из библиотеки на основе AAV2, 8 и 9 до и после отбора. Последовательности выше красной линии показывают родительских AAVs. Фиолетовый стрелки показывают события гомологичной рекомбинации. Красная стрелка знаменует собой переход между AAV2 и AAV9 отмечено во всех выбранных клонов.
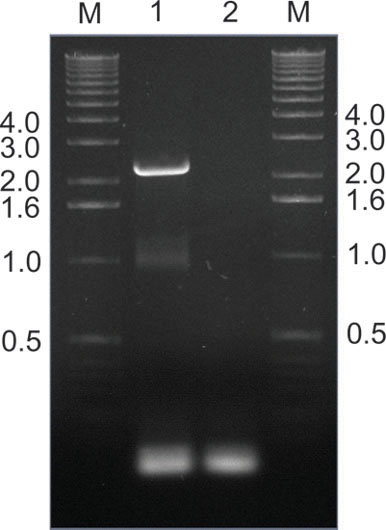
Рисунок 9. </ Сильный спасения> успешно инфицированы AAV клонов из тканей мышей с помощью ПЦР. В этом примере, AAV крышки гены ПЦР усиливается от мышей печень извлечены через неделю после периферической инфузии библиотеку, используя пары праймеров SAF / R (рис. 2). Полоса 1 показывает ожидаемую 2,2 килобаз группы, в то время как дорожка 2 не является шаблоном контроля. После Pac я и Asc я ограничения, усиленный фрагменты были вновь клонирован в плазмиду первоначального получателя (рис. 2) для последующего производства и повторное вливание вторичном библиотеки. Размеры ДНК-маркер полосы M полос указаны в килобаз.

Рисунок 10. Пример для превосходной производительности AAV обогащенного химера в культуре клеток. Клон AAV-DJ сообщалось нами ранее 3; это в основном представляет собой гибрид между AAV серотипов 2, 8 и 9, и был выбран из librar у, содержащий эти три плюс пять дополнительных серотипов в человеческие клетки печени в присутствии сыворотки объединенных человека. Для сравнения эффективности до восьми природных серотипов AAV (указывается 1-6, 8 и 9 на вершине), все крышки гены были использованы для производства очищенной самодополнительных GFP-выражения векторов 8,19. Они были нормированы на содержать 2х10 9 векторных генома в мл, а затем использовали для трансдукции показали клеточных линий в десять раз серийных разведений. Три дня спустя, GFP-экспрессирующие клетки были подсчитаны и инфекционные титры были определены с учетом коэффициент разбавления. В отличие от кода на рис. 5, темные цвета здесь показывают более высокий infectivities в число частиц. Как видно, выбранная AAV-DJ химера превосходит все природные wildtypes AAV, иллюстрирующих успехи прикладного выбора схемы. ФиБр, фибробласты; га, хомяк, ху, человека, мю, мышиные, си, обезьяний.

Рисунок 11. Пример для анализа выбраны AAV химера в печени мышей. Клон AAV-DN был выбран на мышиных клетках гепатомы, а затем используется для получения люциферазы экспрессирующих рекомбинантный векторов 8. Показаны представитель мышей (по три в каждой группе), через неделю после периферической инфузии равные дозы этого вектора или элемента управления на основе дикого типа AAV8, один из самых мощных известных природных изолятов в печени мышей 9. Обратите внимание, что ААВ-DN клон дает чуть меньше всего выражения в печени (панель (I)), более специфичные для этого органа, поскольку она обладает значительно меньшей от таргетирования, не связанных с печеночной ткани после уровни печени выражение было настраивается с помощью программного обеспечения визуализации (панель (II)).
Обсуждение
Здесь мы выделили существенные экспериментальные шаги и рекомендации по AAV капсида инженерных через ДНК семьи перетасовки и эволюции в клетках или в животных. В сущности, эти протоколы являются стандартными версиями процедуры мы впервые сообщили в поле AAV в 2008 году 3. В то время ка...
Раскрытие информации
Все авторы заявляют, что они не имеют ничего раскрывать.
Благодарности
Авторы выражают благодарность выдающимся поддержку своей лаборатории, членов команды и работы кластера передового опыта CellNetworks в Гейдельбергском университете, а также Чика и Хайнц Шаллер (CHS) фундамент. Мы понимаем, что молекулярная эволюция AAV с помощью ДНК перетасовки семья стала очень активной области с нашей первой публикации три года назад, и поэтому извинения всем авторам соответствующих публикаций, работа которых не может быть заключено в кавычки здесь из-за нехватки места.
Материалы
| Name | Company | Catalog Number | Comments |
| Название реагента | Компания | Номер по каталогу | |
| ДНКазы I | Invitrogen | 18068-015 | |
| Полиэтиленимина (PEI) | Sigma-Aldrich | 408727 | |
| Ограничение ферменты | NEB | Различный | |
| T4 ДНК-лигазы | NEB | M0202T | |
| Гель для извлечения набора | Qiagen | 28704 | |
| Phusion II полимеразной Kit | Finnzymes (НЭБ) | F-540S | |
| HotStar Hifi полимеразной Kit | Qiagen | 202602 | |
| ДМСО | Finnzymes (НЭБ) | F-540S (часть комплекта) | |
| ЭДТА (25 мМ) | Invitrogen | 18068-015 (часть комплекта) | |
| Трис | Рот | 4855,2 | |
| Ампициллина натриевая соль | Рот | K029.2 | |
| дНТФ (10 мм, 100 мкл) | Invitrogen | 18427013 | |
| Иодиксанол (OptiPrep) | Axis-экран | 1114739 | |
| Phenolred | Merck | 107241 | |
| Плазмиды мега комплект подготовительной | Qiagen | 12181 | |
| Ультрацентрифуге | Beckman Coulter- | Optima L90K | |
| Быстрая печать пробирки | Beckman Coulter- | 342414 | |
| Электропорация блок | Bio-Rad | GenePulserXcell | |
| Термоциклер | Эппендорф | Vapo Protect | |
| Нагревательный блок | BIOER | MB-102 | |
| Флуоресцентный микроскоп | Олимп | IX81 | |
| FACS анализатор | Beckman Coulter- | Cytomics FC500 MLP | |
| MegaX DH10B T1R клеток | Invitrogen | C640003 | |
| Benzonase | Merck | 101695 | |
| Аденовирус-5 | ATCC | VR-5 | |
| pBlueScript II KS (+) плазмиды | Stratagene | 212207 | |
| cap5F (Pac я сайта желтый, CAP5-специфических последовательностей выделены жирным шрифтом): GACTCTTAATTAACAGGT ATGTCTTTTGTTGATCACCCTCC | IDTDNA | Пользовательские грунтовка | |
| cap5R (по возрастанию я сайт в зеленый, CAP5-специфических последовательностей выделены жирным шрифтом): GTGAGGGCGCGCC TTAAAGGGGTCGGGTAAGGTATC | IDTDNA | Пользовательские грунтовка |
Ссылки
- Grimm, D., Kay, M. A. From virus evolution to vector revolution: use of naturally occurring serotypes of adeno-associated virus (AAV) as novel vectors for human gene therapy. Curr. Gene Ther. 3, 281-304 (2003).
- Grimm, D. Production methods for gene transfer vectors based on adeno-associated virus serotypes. Methods. 28, 146-157 (2002).
- Grimm, D. In vitro and in vivo gene therapy vector evolution via multispecies interbreeding and retargeting of adeno-associated viruses. J. Virol. 82, 5887-5911 (2008).
- Muller, O. J. Random peptide libraries displayed on adeno-associated virus to select for targeted gene therapy vectors. Nat. Biotechnol. 21, 1040-1046 (2003).
- Perabo, L. In vitro selection of viral vectors with modified tropism: the adeno-associated virus display. Mol. Ther. 8, 151-157 (2003).
- Zolotukhin, S., Potter, M., Hauswirth, W. W., Guy, J., Muzyczka, N. A "humanized" green fluorescent protein cDNA adapted for high-level expression in mammalian cells. J. Virol. 70, 4646-4654 (1996).
- Wobus, C. E. Monoclonal antibodies against the adeno-associated virus type 2 (AAV-2) capsid: epitope mapping and identification of capsid domains involved in AAV-2-cell interaction and neutralization of AAV-2 infection. J. Virol. 74, 9281-9293 (2000).
- Grimm, D. Fatality in mice due to oversaturation of cellular microRNA/short hairpin RNA pathways. Nature. 441, 537-541 (2006).
- Nakai, H. Unrestricted hepatocyte transduction with adeno-associated virus serotype 8 vectors in mice. J. Virol. 79, 214-224 (2005).
- Koerber, J. T., Jang, J. H., Schaffer, D. V. DNA shuffling of adeno-associated virus yields functionally diverse viral progeny. Mol. Ther. 16, 1703-1709 (2008).
- Li, W. Engineering and selection of shuffled AAV genomes: a new strategy for producing targeted biological nanoparticles. Mol. Ther. 16, 1252-1260 (2008).
- Ward, P., Walsh, C. E. Chimeric AAV Cap sequences alter gene transduction. Virology. 386, 237-248 (2009).
- Yang, L. A myocardium tropic adeno-associated virus (AAV) evolved by DNA shuffling and in vivo selection. Proc. Natl. Acad. Sci. U.S.A. 106, 3946-3951 (2009).
- Perabo, L. Combinatorial engineering of a gene therapy vector: directed evolution of adeno-associated virus. J. Gene. Med. 8, 155-162 (2006).
- Maheshri, N., Koerber, J. T., Kaspar, B. K., Schaffer, D. V. Directed evolution of adeno-associated virus yields enhanced gene delivery vectors. Nat. Biotechnol. 24, 198-204 (2006).
- Wu, Z., Asokan, A., Samulski, R. J. Adeno-associated virus serotypes: vector toolkit for human gene therapy. Mol. Ther. 14, 316-327 (2006).
- Kwon, I., Schaffer, D. V. Designer gene delivery vectors: molecular engineering and evolution of adeno-associated viral vectors for enhanced gene transfer. Pharm. Res. 25, 489-499 (2008).
- Perabo, L., Huber, A., Marsch, S., Hallek, M., Buning, H. Artificial evolution with adeno-associated viral libraries. Comb. Chem. High. Throughput. Screen. 11, 118-126 (2008).
- McCarty, D. M., Monahan, P. E., Samulski, R. J. Self-complementary recombinant adeno-associated virus (scAAV) vectors promote efficient transduction independently of DNA synthesis. Gene Ther. 8, 1248-1254 (2001).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеThis article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены