Method Article
在收缩力测量评估肌肉功能在斑马鱼幼虫
摘要
力的测量可以用来演示肌肉功能的变化,由于开发,损伤,疾病,治疗或化学毒性。在这段视频中,我们展示了一个方法来测量期间最大的斑马鱼幼体躯干肌肉收缩力。
摘要
斑马鱼幼虫提供模型,肌肉发达,肌肉疾病和肌肉相关的化学毒性,但相关的研究往往缺乏功能性的措施肌肉健康。在这个视频文章中,我们展示了在斑马鱼幼体躯干肌肉收缩力产生的方法来衡量。力的测量是通过将麻醉幼虫与盐溶液填充到腔室中。幼虫的前端绑绑力传感器和幼虫的后端的长度控制器。的等距抽搐收缩引起的电场刺激力响应的记录,可进行分析。强制收缩过程中产生提供了一个衡量的整体肌肉的健康,并特别提供了一个衡量的肌肉功能。虽然,我们描述这种技术用于与野生型幼虫,此方法可用于转基因的幼虫或治疗的药物或毒物的幼虫,表征肌肉疾病模型,并评估治疗,或研究肌肉的发育,损伤或化学毒性。
引言
年轻的斑马鱼( 斑马鱼 )幼虫3-7天受精后(DPF),正日益被视为一个有用的生物骨骼肌研究。年轻的幼虫是用来模型人体肌肉疾病1-9,评估药物和治疗策略10-11,研究肌肉损伤12,了解肌肉发展13-16,调查肌肉相关化学毒性17-19。在这些领域的典型研究探讨在何种程度上呈现健康的肌肉异常的遗传操作或接触毒物,和一些研究肌肉异常的程度,对治疗的反应。这些研究的成功的关键是能够准确评估肌肉健康。
虽然有多种方法可用来评估在斑马鱼幼虫的肌肉健康,很少有肌肉功能提供了直接的信息。通常由appearanc评估肌肉健康E,组织学染色6,8,11,免疫组化9,15,16,18光显微镜3,13,电子显微镜3,4,14,16或双折射7,9,11评估,但是这些技术提供形态学信息。躯干和尾的位移和游泳速度4,17评估运动功能,但这些都不是肌肉功能的直接措施,因为它们也反映了神经元的输入,能量代谢,和其他进程。
相比之下,测量力产生收缩时,肌肉功能的评估提供了一个直接代表一个衡量整体肌肉健康。添加这种方法的好处包括简单的数据分析与定量结果。在这个视频文章中,我们提供了测力代幼虫的肌肉,希望更多的研究人员将使用这种方法来补充现有措施的肌肉的健康,在他们的研究中的详细步骤。
这种方法的总体目标是测量在斑马鱼幼体躯干肌肉收缩力产生。为了实现这个目标,是斑马鱼幼虫麻醉并置于一个腔室填充有盐溶液。幼虫的前端绑绑力传感器和幼虫的后端的长度控制器。肌肉活化是通过电场刺激,刺激电流和幼虫的长度调整,以产生最大抽搐力。引起的等距抽搐收缩力响应的记录,可进行分析。要清楚,这种技术不测量幼虫的肌肉在游泳过程中所产生的力量。由于幼虫两端被连接到设备,因为幼虫保持麻醉,不能启动在测试过程中的运动。此外,电场刺激激活所有的肌纤维在同一时间,以诱导亿抵押品的收缩,而这并不是自然发生20。因此,而不是测量游泳过程中产生的实际力量,这种技术决定幼虫肌肉的力量发电能力。
我们已经使用这种技术来证明肌肉无力的杆状体肌病21斑马鱼的模型,以及多的MiniCore疾病22在斑马鱼模型来评价对肌肉功能的抗氧化处理的效果。其他已经使用了类似的技术23检查19对肌肉功能的一种环境污染物的影响。
研究方案
注:按照有关准则,法规,监管机构应进行所有程序,涉及斑马鱼。在这篇文章中所显示的所有动物使用手续大学密歇根委员会对动物的使用和护理(UCUCA)批准。
1。进行缝合循环
- 使用镊子非无菌缝合(USP 10/0尼龙单丝,3层)分离成三股。
- 开始配合一个双反手结在一条链。前停止把结抽紧完全做一个小的(〜1毫米直径)的循环,而不是一个结。
- 用剪刀剪下多余的缝线从循环尾巴。一个完整的循环,例如,在图1中所示。
- 将循环粘边发表注意供以后使用。缝合环将被用来保持力试验期间幼虫。
- 重复步骤1.1-1.4必要的。麦E两个缝合循环每个幼虫将被测试。
2。测试解决方案
- 通过添加氯化钠7.977克,氯化钾0.373克,0.265克二水氯化钙,氯化镁六水合物0.102克,0.048克磷酸二氢钠,碳酸氢钠1.000克,和0.037克的乙二胺四乙酸二钠盐二水合物的1000ml的Tyrodes溶液纯水中。
- 搅拌该溶液直到盐完全溶解。该解决方案可以在4℃下储存一个月
- 添加2.1毫升4毫克/毫升三卡因,准备根据斑马鱼书24,至47.9毫升的Tyrodes溶液和混合。从光存储在一个黑暗的玻璃瓶或在一个玻璃酒瓶盖用铝箔保护这一解决方案。该溶液应在室温下储存,并取得了新的每一天。
3。领带Aanesthetized的幼虫进入实验商会
- 将测试装置( 图2),在舞台上的立体显微镜。
- 力传感器和长度控制器电缆连接到测试装置。开启力传感器。打开长度控制器上,所以它仍然是刚性的。 ( 注:长度控制器提供拉长或缩短的肌肉编写过程中的收缩的能力。但是,此功能的长度控制器不使用本文所述的方法,因此,长度控制器可以被认为是作为一个刚性附件点安装到一个XYZ定位系统)。
- 一次性移液管,填补了试验室测试解决方案。
- 使用镊子,拿起了一个尾巴缝线环,并把它挂在力传感器管。杭的第二连接管的长度控制器的缝合线套环。 ( 注:在弯曲部分夹住缝线环扭结缝合及CAU本身它打破在随后的步骤)。
- 一次性移液管,斑马鱼幼虫转移到一个小培养皿中充满的测试解决方案。等待麻醉生效(约1分钟)的测试解决方案(三卡因)。随着镊子,轻轻轻推的尾巴和验证的幼虫麻醉缺乏触摸诱发游泳。
- 使用的玻璃吸管的幼虫转移到试验室。
- 通过轻轻轻推幼虫封闭镊子,引导幼虫的前部通过缝线环上的力传感器管。引导幼虫的前部,通过在管上的缝合线套环。抓住两个镊子缝线环的尾巴,拉他们同时收紧缝线环后卵黄囊或鱼鳔( 图3A)。
- 用的钳子,按住一个缝合线套环尾和拉,导致幼虫幼虫面的侧方管,直到旋转90°左右s最高( 图3B)。如果循环不够紧,会有一些阻力拉幼虫不能旋转容易。如果循环被拧得过紧,幼虫不能旋转管周围。
- 使用的的XYZ定位装置的长度控制器,将沿X轴(在图2A中的轴定义)和下幼虫的躯干和尾管的长度控制器。发表的长度控制器管的力换能器管的端部之间的空间。
- 如前所述( 图3C),引导缝线环幼虫尾部收紧缝线环。您可能需要旋转幼虫后壁的部分,从而使侧面朝上。修剪缝合循环的尾巴( 图3D)。
4。在试验室的位置幼虫
- 幼虫移动到一个适当的腔室底部的距离,以保证幼虫瓦特病是在一个倒置的显微镜物镜的“工作距离”之内,在随后的步骤中。要做到这一点,使用的XYZ定位装置,,慢慢降低管沿Z轴,直到(附带幼虫)管触底室。然后,提高管,直到幼虫是一个适当的腔室底部的距离(〜100微米)。
- 使用的的XYZ定位装置的长度控制器,调整管沿Y轴的长度控制器中的幼虫的力换能器管的长轴对齐的长轴。
5。记录期间最大抽搐收缩力
- 移动检测装置的阶段,在倒置显微镜。
- 室的温度调节到所需的值。要开始,水浴循环器,温度计,温度控制器的测试装置连接。开启的必要组成部分,并调整设定的温度对照直到温度计奥勒报告所需的值。本文中所包含的数据被收集,在25℃,但测量也可以在室温下或在28.5℃。
- 连接电缆的测试装置的刺激。打开电源的刺激,但不刺激幼虫,直到步骤5.6。
- 确保幼虫室底部平行。通过一个40倍的目标,查看部的管子的端部之间的幼虫。如果底部平行,两端的幼虫将成为市场关注焦点。如果需要,沿Z轴的调节力传感器管,,直到两端焦点。
- 验证幼虫的长度是小于最佳。打开视频肌节长度系统和旋转摄像机,例如,所述视频帧的侧面平行的条纹。通过分析沿一个用户定义的感兴趣区域内的每个水平行的像素的像素强度的变化,此系统监控辉纹间距(ROI)。在ROI内的所有行的结果的平均值,并报告与频率相当于该视频帧速率(≥80秒-1)。条纹的间距是用来作为一个指标小节的长度。
- 调整显微镜,把重点放在外围纤维,并注意所指示的肌节长度。如有必要,可使用的的XYZ定位装置连接的长度控制器来调整幼虫的长度(X轴),直到肌节的长度是小于最佳的( 如 1.90微米)。
- 调整的刺激电流,以优化抽搐力。开始,设置输出电流低幅度的刺激( 如 100 mA时)。刺激可以手动触发或由一台计算机上运行一个自定义的LabVIEW程序。引起抽搐幼虫肌肉与一个电流脉冲持续时间为0.2毫秒。
- 使用示波器记录力输出,并使用示波器的光标测量峰值抽搐力。增加电流50 mA递增,并测量每个电流峰值抽搐力。等待30秒之间抽搐,防止过度疲劳。作为刺激电流增加,峰值抽搐力通常增大到最大,然后逐渐减小。幼虫产生的最大动力是目前的最佳刺激电流。设置最佳刺激电流的电流的幅值。
- 使用的XYZ定位装置,调节幼虫(因此,肌节长度)的长度,以引起最大抽动力。野生型斑马鱼幼虫(3-7日龄)产生最大抽搐力肌节长度为2.10微米或2.15微米。然而,肌节长度可以设置为2.08微米,以避免过量的压力的幼虫。
- 引起幼虫肌肉抽搐。使用示波器记录力响应,并保存记录以供后续分析。
6。幼虫在最佳长度测量肌肉组织尺寸
- 移动检测装置的立体显微镜。
- 使用目镜规模,测量的高度,从侧面观察的肌肉组织。然后,照顾不改变长度的幼虫,旋转幼虫90°使用缝线环以查看幼虫从底部的尾巴。测量的宽度为从底部看的肌肉系统。径的测量的解剖标志( 例如,泌尿生殖道的开口)( 图4)。
- 切开缝合循环释放的幼虫从测试设备与microblade。
结果
在健康的野生型斑马鱼幼虫,肌纤维应是平行的,而无需在它们之间的间隙过大,有明显的条纹状( 图5A)。野生型斑马鱼幼虫不表现出这些功能,或有明显的损坏,如分离的纤维( 图5B),应该被丢弃。
峰的抽动力与刺激电流为一个单一的斑马鱼幼虫有代表性的情节,如图6所示。对于野生型之间的斑马鱼幼虫3-7单丝旦,最佳刺激电流通常是在400-600毫安之间,3单丝旦幼虫通常需要更大的刺激电流比6-7单丝旦幼虫。
原力数据(步骤5.8中收集)具有与数据分析软件进行处理和分析。首先,力记录的基线设置为零。其次,力传感器的输出电压被转换为强制(米N)(参见制造商的说明,产生的力传感器的校准曲线)。 图7中所示的一位代表一个单一的幼虫一个最大抽搐收缩过程中收集的力响应。数据分析软件,可以用来测量峰值力力响应和其他功能。
图8A最大肌收缩力峰值数据显示一组有代表性。的典型峰值抽搐力值3-7 DPF野生型幼虫范围从0.9至1.7百万元,老幼虫产生更多的力量比低龄幼虫。抽动力峰值的差异可以是由于增长和发展的正常过程,如( 图8)或不正常的过程,如基因突变相关的病理21,22。
由肌肉的横截面面积(CSA)的归一化可以被用来确定在何种程度上抽动力峰值的差异只是由于各色郴州大小的肌肉系统21,22。肌肉CSA可以使用下面的公式估算:CSA =π(A / 2)(B / 2),其中A是从侧面观察的肌肉组织的高度,B为从底部看的宽度的肌肉,和一个椭圆形横截面是假定的。野生型的3-7的DPF的幼虫范围从0.027到0.034毫米2,用3-4 DPF幼虫一般较小的CSA值比5-7 DPF幼虫的典型CSA值。一批有代表性的最大肌收缩的的标准化峰力数据如图8B所示。野生型3-7 DPF幼虫范围从34到51万/月2,用4-7 DPF幼虫通常表现出更大的价值,而不是3 DPF幼虫典型的标准化峰的抽动力值。

图1。缝线环。箭头指向缝线环的尾巴。

图2。 (一)测试设备与标签组件。 (B)关闭试验室的意见(一)试验室的透明底(二)力传感器(三)长度(D)控制器。XYZ定位装置。的X,Y和Z轴被定义在右上角(五)利用热电模块的温度控制系统。油管可容纳冷却水流量的热电模块。(六)不锈钢管连接到力传感器(G)不锈钢管连接长度控制器(H)温度计探针(I)铂金平行电极板,跨越的长度在室。铂金板是2.5毫米和0.255毫米厚的。
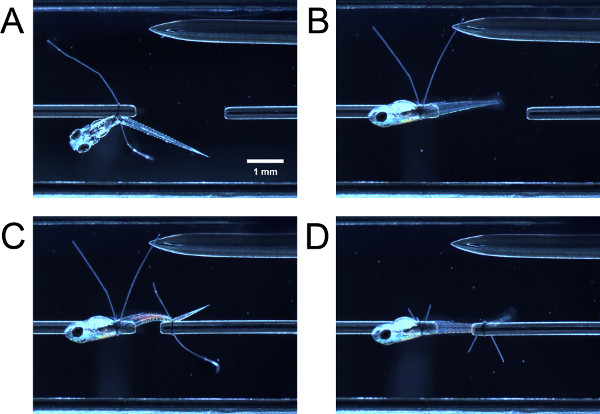
图3。搭售幼虫分为实验室(A)幼虫绑在前端,但尚未旋转90°(B)回转90°(C)幼虫绑在后端,但尚未旋转后幼虫(D)幼虫后回转的缝线环尾巴修剪。
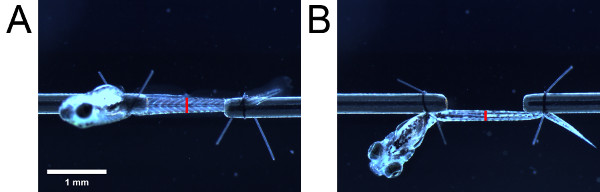
图4。横截面面积的测量估计。肌肉组织作为从(A)侧和(B) 的底部。配售红柱表明泌尿生殖系统的开口的位置。红色条的长度表示分别从侧面和底部观察的肌肉的高度和宽度。
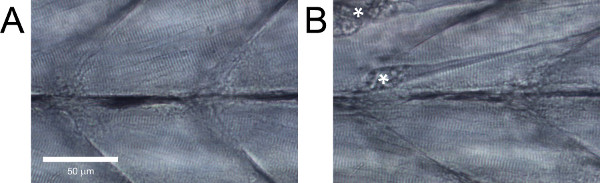
图5。斑马鱼幼虫躯干肌肉横向视图(A)(B)的健康组织。组织具有明显的损害。挛缩导致纤维分队的标有星号。
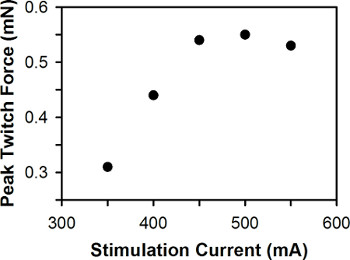
图6。峰的抽动力与刺激的情节。代表最佳刺激电流为500毫安。
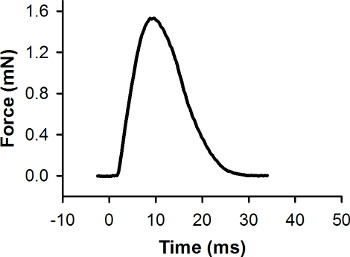
图7。代表力记录为一个单一的抽搐收缩,这种收缩引起的刺激脉冲在0毫秒。峰力为1.56亿。
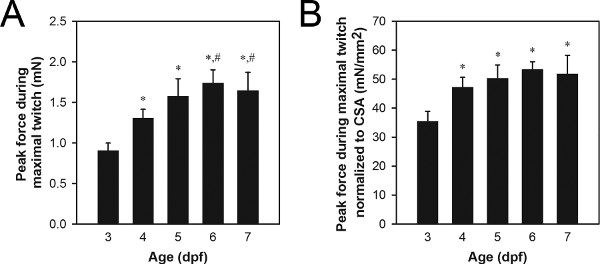
图8。 3-7 DPF幼虫。代表力数据(A)峰值最大肌收缩力数据(B)最大肌收缩力峰值数据标准化CSA。较早的幼虫(6-7日龄),美联储Hatchfry Encapsulon 0级与螺旋藻(银色实验室)开始在5 DPF。均值+标准偏差报告,各组N = 5。明显不同于3 DPF幼虫(*)和4 DPF幼虫(#)表示组(ANOVA,P <0.05)。归力3和4 DPF(B)之间的显着增加,表明增长的内在动力产生能力,而在这段时间内增加武力4和6-7 DPF(A)之间的基础上没有增长改变DPF归力4至7。
讨论
这种方法测量力产生评估肌肉功能的斑马鱼幼虫的躯干肌肉在抽搐。虽然强直收缩,可引起斑马鱼幼虫( 如 200个刺激脉冲/秒的持续时间为0.2秒),最大强直收缩力大于最大抽搐力只有10-15%。因此,抽动过程中产生的力力发电能力是一个合理的措施。抽搐优于强直收缩,因为抽搐是不太可能导致抓取或打滑缝线处的关系。
为了产生有意义的数据,使用这种技术,最大抽搐力应达到每幼虫,应尽量减少和实验组之间的可变性。考虑到这些目标,我们提出以下建议。首先,照顾绑幼虫时,力传感器和控制器管长度。 ,如果缝合回路拧得过紧多,缝合肌肉组织将通过削减。如果没有足够的拧紧的缝合线回路,幼虫产生的力将不会被完全传递力传感器。这两种情况下,尤其是后者,低估抽搐力最大。其次,由于多个实验组的测试,可能需要几个小时(20-30分钟/幼虫),群体之间的交替,因为幼虫测试期间将继续发展。
虽然有些人提到的设备是必不可少的测量最大抽搐力( 如力传感器,电流刺激),其他物品都是绝对必要的。视频肌节长度系统是可取的,但不是必需的。作为替代方案,可用于一系列抽搐来找到最优的长度,在此期间,幼虫的长度进行调整,直到达到最大抽搐力。一个温度控制系统也并非绝对必要。测量时,温度控制是关键一定抽搐动力学,这是对温度高度敏感,而最大抽搐力不是特别敏感温度的微小变化,并且可以在室温下测量。请注意,无论力试验过程中的腔室中的温度,幼虫应保持在最佳生长温度为28.5°C 24前力测试准确分期。
幼虫的Tyrodes解决方案,其中包含三卡因在测试。我们用0.02%(W / V)三卡因,建议麻醉24的浓度,以消除由神经系统诱发的自发性收缩,从而防止疲劳力测试期间。三卡因也促进了系上的步骤,并降低了整体测试时间。然而,我们观察到,包括在测试溶液中的三卡因持续时间约30%的最大抽搐力。蝌蚪的尾巴肌肉也观察到类似的效果,其中tricai东北力一代又降低神经肌肉的传导受阻,这表明三卡因25肌肉有直接的影响。三卡因可减少通过减少钠离子传导穿过细胞膜,肌细胞的兴奋性,因为它在神经细胞26。阻止运动神经元的激活的其他可供选择的是 d-筒箭毒碱和α-银环蛇毒素,但不像三卡因,这些化合物不透皮肤,必须直接注射到头部,脊髓,或心脏27。个别研究者将需要评估是否三卡因是可取其具体应用。如果三卡因被包括在测试溶液中的浓度应该是一致的实验和研究人员之间应验证,三卡因的效果实验组之间不发生变化。
我们描述了这种方法,3 DPF和年轻的老7 DPF幼虫。虽然肌纤维出现富nctional早在受精后17小时,自发尾巴运动开始时,27日 ,短尾巴的长度,前3 DPF阻碍把幼虫的检测设备。我们通常不测试后7日龄幼虫,因为许多疾病模型不生存更长的时间超过这个时间。测试5 DPF幼虫超越,如果要喂幼虫。我们观察到,不喂食幼虫有较小的肌肉和生成较少的最大抽动力比喂养幼虫,可能是由于减少卵黄囊。因此,它可能是可取的测试3-5单丝旦数之间的幼虫,避免了额外的外部馈送的变量。
综上所述,我们描述了一个定量的,可靠的方法测量期间最大的斑马鱼幼体躯干肌肉抽搐收缩力产生。这种方法可以用来评估整体健康的斑马鱼幼虫的肌肉,并明确规定有关肌肉功能。除了提供有关力产生的大小,这种技术可以用于研究动力学的力的产生,或适用于研究肌肉疲劳22。虽然我们描述这种技术用于与野生型幼虫,此方法可用于转基因的幼虫或治疗用药物或毒物的幼虫,表征肌肉疾病模型和评价治疗或研究肌肉的发育,肌肉损伤,或肌肉相关的化学毒性。
披露声明
作者宣称,他们有没有竞争经济利益。
致谢
作者感谢安吉拉·布斯塔与斑马鱼养殖的援助。这项工作是由美国国立卫生研究院(AG-020591 SVB和1K08AR054835 JJD),支持。
材料
| Name | Company | Catalog Number | Comments |
| REAGENTS | |||
| Tricaine powder | Sigma-Aldrich | A5040 | |
| Sodium chloride | Sigma-Aldrich | S7653 | |
| Potassium chloride | Sigma-Aldrich | P9541 | |
| Calcium chloride dihydrate | Sigma-Aldrich | 223506 | |
| Magnesium chloride hexahydrate | Sigma-Aldrich | M2670 | |
| Sodium phosphate monobasic | Sigma-Aldrich | S0751 | |
| Sodium bicarbonate | Sigma-Aldrich | S6297 | |
| Ethylenediaminetetraacetic acid disodium salt dihydrate | Sigma-Aldrich | E5134 | |
| EQUIPMENT | |||
| Nonsterile-suture | Ashaway Line Twine | S30002 | USP 10/0 monofilament nylon (3 ply) |
| Forceps | Fine Science Tools | 11251-20 | Dumont #5 |
| Spring scissors | Fine Science Tools | 15000-08 | Vannas |
| Stereo microscope | Leica Microsystems | MZ8 | Illuminated with Fostec EKE ACE I light source |
| Force transducer |  Aurora Scientific Aurora Scientific | 400A | |
| Length controller |  Aurora Scientific Aurora Scientific | 318B | |
| XYZ positioning devices | Parker Hannifin | 3936M | |
| Thermometer | Physitemp | BAT-12 | |
| Disposable transfer pipette | Fisher Scientific | 13-711-9AM | Cut end to widen opening and facilitate larva transfer |
| Petri dish | Fisher Scientific | 08-757-11YZ | |
| Glass pipette | Fisher Scientific | 13-678-8B | Cut end (and fire-polish) to widen opening and facilitate larva transfer |
| Inverted microscope | Carl Zeiss Microscopy | Axiovert 100 | |
| Water bath circulator | Neslab Instruments | RTE-111 | |
| Temperature controller | Alpha Omega Instruments | Series 800 | |
| Stimulator |  Aurora Scientific Aurora Scientific | 701C | High-power, follow stimulator |
| Video sarcomere length system |  Aurora Scientific Aurora Scientific | 900B-5A | |
| LabVIEW software | National Instruments | ||
| Oscilloscope | Nicolet Technologies | ACCURA 100 | |
| Microblade | Fine Science Tools | 10050-00 | |
| Microblade holder | Fine Science Tools | 10053-13 | |
| Data analysis software (Signo) | Alameda Applied Sciences | ||
参考文献
- Bassett, D. I., Bryson-Richardson, R. J., Daggett, D. F., Gautier, P., Keenan, D. G., Currie, P. D. Dystrophin is required for the formation of stable muscle attachments in the zebrafish embryo. Development. 130 (23), 5851-5860 (2003).
- Nixon, S. J., Wegner, J., et al. Zebrafish as a model for caveolin-associated muscle disease; caveolin-3 is required for myofibril organization and muscle cell patterning. Hum. Mol. Genet. 14 (13), 1727-1743 (2005).
- Hall, T. E., Bryson-Richardson, R. J., et al. The zebrafish candyfloss mutant implicates extracellular matrix adhesion failure in laminin α2-deficient congenital muscular dystrophy. PNAS. 104 (17), 7092-7097 (2007).
- Hirata, H., Watanabe, T., et al. Zebrafish relatively relaxed mutants have a ryanodine receptor defect, show slow swimming and provide a model of multi-minicore disease. Development. 134, 2771-2781 (2007).
- Dowling, J. J., Vreede, A. P., et al. Loss of myotubularin function results in t-tubule disorganization in zebrafish and human myotubular myopathy. PLoS Genet. 5 (2), e1000372 (2009).
- Berger, J., Berger, S., Hall, T. E., Lieschke, G. J., Currie, P. D. Dystrophin-deficient zebrafish feature aspects of the Duchenne muscular dystrophy pathology. Neuromuscul. Disord. 20 (12), 826-832 (2010).
- Kawahara, G., Guyon, J. R., Nakamura, Y., Kunkel, L. M. Zebrafish models for human FKRP muscular dystrophies. Hum. Mol. Genet. 19 (4), 623-633 (2010).
- Wallace, L. M., Garwick, S. E., et al. DUX4, a candidate gene for facioscapulohumeral muscular dystrophy, causes p53-dependent myopathy in vivo. Ann. Neurol. 69, 540-552 (2011).
- Sztal, T. E., Sonntag, C., Hall, T. E., Currie, P. D. Epistatic dissection of laminin-receptor interactions in dystrophic zebrafish muscle. Hum. Mol. Genet. , (1093).
- Kawahara, G., Karpf, J. A., Myers, J. A., Alexander, M. S., Guyon, J. R., Kunkel, L. M. Drug screening in a zebrafish model of Duchenne muscular dystrophy. PNAS. 108 (13), 5331-5336 (2011).
- Berger, J., Berger, S., Jacoby, A. S., Wilton, S. D., Currie, P. D. Evaluation of exon-skipping strategies for Duchenne muscular dystrophy utilizing dystrophin-deficient zebrafish. J. Cell Mol. Med. 15 (12), 2643-2651 (2011).
- Seger, C., Hargrave, M., Wang, X., Chai, R. J., Elworthy, S., Ingham, P. W. Analysis of Pax7 expressing myogenic cells in zebrafish muscle development, injury, and models of disease. Dev. Dyn. 240, 2440-2451 (2011).
- Postel, R., Vakeel, P., Topczewski, J., Knöll, R., Bakkers, J. Zebrafish integrin-linked kinase is required in skeletal muscles for strengthening the integrin-ECM adhesion complex. Dev. Biol. 318 (1), 92-101 (2008).
- Zoeller, J. J., McQuillan, A., Whitelock, J., Ho, S. Y., Iozzo, R. V. A central function for perlecan in skeletal muscle and cardiovascular development. J. Cell Biol. 181 (2), 381-394 (2008).
- Kim, H. R., Ingham, P. W. The extracellular matrix protein TGFBI promotes myofibril bundling and muscle fibre growth in the zebrafish embryo. Dev. Dyn. 238, 56-65 (2009).
- Beqqali, A., Monshouwer-Kloots, J., et al. CHAP is a newly identified Z-disc protein essential for heart and skeletal muscle function. J. Cell Sci. 123 (7), 1141-1150 (2010).
- Huang, H., Huang, C., et al. Toxicity, uptake kinetics and behavior assessment in zebrafish embryos following exposure to perfluorooctanesulphonicacid (PFOS). Aquat. Toxicol. 98 (2), 139-147 (2010).
- Sylvain, N. J., Brewster, D. L., Ali, D. W. Zebrafish embryos exposed to alcohol undergo abnormal development of motor neurons and muscle fibers. Neurotoxicol. Teratol. 32 (4), 472-480 (2010).
- Chandrasekar, G., Arner, A., Kitambi, S. S., Dahlman-Wright, K., Andersson-Lendahl, M. Developmental toxicity of the environmental pollutant 4-nonylphenol in zebrafish. Neurotoxicol. Teratol. 33 (6), 752-764 (2011).
- Buss, R. R., Drapeau, P. Activation of embryonic red and white muscle fibers during fictive swimming in the developing zebrafish. J. Neurophysiol. 87 (3), 1244-1251 (2002).
- Telfer, W. R., Nelson, D. D., Waugh, T., Brooks, S. V., Dowling, J. J. neb: a zebrafish model of nemaline myopathy due to nebulin mutation. Dis Model Mech. 5, 389-396 (2012).
- Dowling, J. J., Arbogast, S., et al. Oxidative stress and successful antioxidant treatment in models of RYR1-related myopathy. Brain. 135 (4), 1115-1127 (2012).
- Dou, Y., Andersson-Lendahl, M., Arner, A. Structure and function of skeletal muscle in zebrafish early larvae. J. Gen. Physiol. 131, 445-453 (2008).
- Westerfield, M. . The zebrafish book: a guide for the laboratory use of zebrafish (Danio rerio). , (2000).
- Herr, V. D., Sonnenburg, D. C., Courogen, P. M., Fiamengo, S. A., Downes, H. Muscle weakness during tricaine anesthesia. Comp Biochem Physiol Part C. 110 (3), 289-296 (1995).
- Frazier, D. T., Narahashi, T. Tricaine (MS-222): effects of ionic conductances of squid axon membranes. Eur. J. Pharmacol. 33 (2), 313-317 (1975).
- Saint-Amant, L., Drapeau, P. Time course of the development of motor behaviors in the zebrafish embryo. J. Neurobiol. 37 (4), 622-632 (1998).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。