Method Article
Medição de força durante a contração para avaliar a função muscular em larvas do peixe
Neste Artigo
Resumo
Medições da força pode ser usada para demonstrar as alterações na função muscular, devido ao desenvolvimento, lesões, doença, o tratamento ou a toxicidade química. Neste vídeo, demonstramos um método para medir a força durante uma contração máxima de zebrafish músculos do tronco larval.
Resumo
Larvas do peixe fornecer modelos de desenvolvimento muscular, doença muscular e toxicidade química músculo-relacionados, mas os estudos relacionados muitas vezes a falta de medidas funcionais de saúde muscular. Neste artigo, vídeo, demonstramos um método para medir a geração de força durante a contração dos músculos do tronco de zebrafish larval. Força medições são realizadas por uma larva de anestesiados colocando dentro de uma câmara cheia com uma solução salina. A extremidade anterior da larva é ligada a um transdutor de força e a extremidade posterior da larva está ligada a um controlador de comprimento. Uma contração contração isométrica é provocada por estimulação do campo elétrico ea resposta vigor é gravado para análise. A geração de força durante a contracção proporciona uma medida da saúde em geral e, especificamente, do músculo, dá uma medida da função do músculo. Embora nós descrevemos esta técnica para uso com larvas de tipo selvagem, este método pode ser usado com larvas geneticamente modificado ou com larvas tratadas com drogas ou substâncias tóxicas,para caracterizar modelos de doenças musculares e avaliar tratamentos, ou para estudar o desenvolvimento muscular, lesão ou toxicidade química.
Introdução
Larvas de peixe-zebra mulher (Danio rerio), 3-7 dias pós-fertilização (dpf), estão cada vez mais reconhecido como um organismo útil para a pesquisa do músculo esquelético. Larvas jovens são usados para modelar doenças músculo humano 1-9, avaliação de medicamentos e estratégias terapêuticas 10-11, estudo de lesão muscular 12, compreender desenvolvimento muscular 13-16, e investigar a toxicidade química muscular relacionada com 17-19. Estudos típicos nessas áreas examinar o grau a que o músculo saudável é processado por manipulação genética anormal ou a exposição a produtos tóxicos, e alguns estudos examinar o grau a que muscular anormal responde ao tratamento. Fundamental para o sucesso destes estudos é a capacidade de avaliar com precisão a saúde muscular.
Embora haja uma variedade de métodos disponíveis para avaliar a saúde muscular em larvas de peixe-zebra, poucos fornecem informação directa sobre a função muscular. Saúde muscular é geralmente avaliada por apariçõE, tal como avaliado por coloração histológica 6,8,11, imunocoloração 9,15,16,18, 3,13 microscopia de luz, microscopia electrónica 3,4,14,16, ou birrefringência 7,9,11, mas estas técnicas proporcionam informação morfológica só. Tronco e deslocamentos cauda e natação Velocidade 4,17 avaliar a função motora, mas estas não são medidas diretas da função muscular, uma vez que também refletem input neural, no metabolismo energético, e outros processos.
Em contraste, medindo a geração de força durante a contração fornece uma avaliação direta da função muscular e representa uma medida de saúde geral muscular. Adicionado benefícios dessa abordagem incluem a análise de dados simples e resultados quantitativos. Neste artigo de vídeo, nós fornecemos um procedimento detalhado para medir a geração de força pelos músculos das larvas, na esperança de que mais pesquisadores vão usar esse método para complementar as medidas existentes de saúde muscular em suas pesquisas.
O objetivo geral deste método é medir a geração de força durante a contração dos músculos do tronco zebrafish larval. Para alcançar este objetivo, uma larva do peixe-zebra é anestesiado e colocado dentro de uma câmara cheia com uma solução salina. A extremidade anterior da larva é ligada a um transdutor de força e a extremidade posterior da larva está ligada a um controlador de comprimento. Activação do músculo é conseguido por estimulação do campo eléctrico, e a corrente de estimulação e a duração da larva são ajustadas para produzir a força máxima de contração. Uma contração contração isométrica é provocada ea resposta vigor é gravado para análise.Para ser claro, esta técnica não mede forças geradas pelos músculos das larvas durante a natação. Como ambas as extremidades da larva estão ligados ao equipamento e devido à permanência da larva anestesiado, não pode iniciar o movimento durante o ensaio. Além disso, a estimulação do campo activa todas as fibras musculares ao mesmo tempo, para induzir uma bilateral contracção, o que não é o que ocorre naturalmente 20. Portanto, em vez de medir forças reais gerados durante a natação, esta técnica determina a capacidade de geração de força dos músculos das larvas.
Usámos esta técnica para demonstrar a fraqueza muscular em um modelo de peixe-zebra de nemalínica miopatia 21, assim como para avaliar o efeito do tratamento antioxidante em função muscular em peixes-zebra de um modelo de doença multi-minifocos 22. Outros usaram uma técnica semelhante 23 para examinar os efeitos de um poluente ambiental em função do músculo 19.
Protocolo
Nota: todos os procedimentos envolvendo zebrafish deve ser realizado em conformidade com as diretrizes, regulamentos, e as agências reguladoras. Todos os procedimentos de uso de animais mostrados neste artigo foram aprovados pela Universidade de Michigan Comitê sobre o Uso e tratamento de animais (UCUCA).
1. Faça Loops Sutura
- Use uma pinça para separar sutura não estéril (USP 10/0 monofilamento de nylon, 3 ply) em três vertentes.
- Comece a dar um nó duplo overhand em uma das vertentes. Pare antes de apertar o nó completamente para fazer um pequeno laço (~ 1 mm de diâmetro) em vez de um nó.
- Use a tesoura para cortar o excesso de sutura da cauda do laço. Um exemplo de um ciclo final é mostrado na Figura 1.
- Coloque o laço no lado pegajoso de um post-it para uso posterior. Os laços de sutura será utilizado para conter as larvas no lugar durante o teste de força.
- Repita os passos de 1,1-1,4, se necessário. Makdois circuitos electrónicos de sutura para cada larva que irá ser testada.
2. Faça testes Solution
- Adicione solução de Tyrodes, adicionando 7,977 g de cloreto de sódio, 0,373 g de cloreto de potássio, 0,265 g de cloreto de cálcio di-hidratado, 0,102 g de cloreto de magnésio hexa-hidratado, 0,048 g de fosfato de sódio monobásico, 1,000 g de bicarbonato de sódio e 0,037 g de ácido etilenodiaminotetracético dissódico dihidratado sal a 1.000 ml de água purificada.
- Agita-se a solução até que os sais sejam completamente dissolvidos. Esta solução pode ser armazenada durante um mês a 4 ° C.
- Adicionar 2,1 ml de 4 mg / ml tricaina, preparadas de acordo com O Livro Zebrafish 24, para 47,9 ml de solução Tyrodes e misture. Proteger a solução da luz, armazenando-o em uma garrafa de vidro escuro ou em uma garrafa de vidro coberto com papel alumínio. Esta solução deve ser conservada à temperatura ambiente e feita a cada dia.
3. Amarre Zergling Aanesthetized na Câmara Experimental
- Local do dispositivo de ensaio (Figura 2) sobre a plataforma de um microscópio estéreo.
- Conecte o transdutor de força e cabos controlador do comprimento do aparelho de teste. Ligue o transdutor de força. Ligue o controlador de comprimento para que ele permaneça rígida. (Nota:.. Controlador de comprimento proporciona a capacidade para alongar ou encurtar uma preparação de músculo durante uma contracção No entanto, esta característica do controlador de comprimento não é usado no método descrito aqui, portanto, o controlador de comprimento pode ser pensado como um acessório rígido ponto montado um sistema de posicionamento XYZ).
- Com uma pipeta descartável, encher a câmara com a solução de teste experimental.
- Use uma pinça para pegar uma alça de sutura por uma das caudas e pendurá-lo no tubo do transdutor de força. Desligar uma segunda alça de fio de sutura sobre o tubo ligado ao controlador de comprimento. (Nota: segurando um laço de sutura na parte curva pode dobrar a sutura e cauSé de quebrar durante as etapas subseqüentes).
- Com uma pipeta descartável, transferir uma larva de peixe-zebra de uma pequena placa de Petri com solução de teste. Aguarde até que o anestésico na solução de teste (tricaina) para entrar em vigor (~ 1 min). Com uma pinça, empurrar delicadamente a cauda e verificar se a larva é anestesiado pela falta de touch-evocado natação.
- Usar uma pipeta de vidro para transferir a larva para a câmara experimental.
- Por empurrando suavemente a larva com uma pinça fechadas, guiar a porção anterior da larva através do laço de sutura sobre o tubo de transdutor de força. Orientar a porção anterior da larva através do laço de sutura sobre o tubo. Compreender tanto caudas laço de sutura com uma pinça e puxá-los simultaneamente para apertar o anel de sutura para posterior do saco vitelino ou swimbladder (Figura 3A).
- Com uma pinça, mantenha uma cauda laço de sutura e puxar, fazendo com que a larva para rodar 90 ° em torno do tubo até que a face lateral da face larvas para cima (Figura 3B). Se o laço foi apertado o suficiente, haverá alguma resistência à tração, a larva não deve girar facilmente. Se o circuito foi muito apertado, a larva não vai rodar em torno do tubo.
- Utilizando o dispositivo de posicionamento XYZ ligada ao controlador de comprimento, mova o tubo controlador de comprimento ao longo do eixo X (definições dos eixos na figura 2A) e do tronco e cauda da larva. Deixe espaço entre as extremidades do tubo controlador comprimento eo tubo transdutor de força.
- Guiar o laço de sutura sobre a cauda da larva e apertar o anel de sutura conforme anteriormente descrito (Figura 3C). Pode ser necessário girar a parte posterior da larva para que o lateral voltado para cima. Apare as pontas do laço de sutura (Figura 3D).
4. Posição Zergling na Câmara Experimental
- Mover a larva a uma distância adequada da câmara de fundo para assegurar a w larvamal estar dentro da "distância de trabalho" de uma objetiva de microscópio invertido durante as etapas subseqüentes. Para fazer isso, use os dispositivos de posicionamento XYZ para reduzir lentamente os tubos (com larva em anexo) ao longo do eixo Z até que os tubos apenas tocar no fundo da câmara. Em seguida, aumentar os tubos até que a larva é uma distância adequada da parte inferior da câmara (~ 100 mm).
- Utilizando o dispositivo de posicionamento XYZ ligada ao controlador de comprimento, ajustar o tubo controlador de comprimento ao longo do eixo Y para alinhar o eixo longo da larva com o eixo longitudinal do tubo de transdutor de força.
5. Grave Força durante uma contração Twitch Maximal
- Mover o aparelho de teste para a fase de um microscópio invertido.
- Ajustar a temperatura da câmara para um valor desejado. Para começar, ligar o circulador de água do banho, termómetro, e controlador de temperatura para o dispositivo de ensaio. Ligue os componentes necessários e ajustar a configuração no contr temperaturaOller até o termômetro informa o valor desejado. Os dados incluídos neste artigo foram coletados a 25 ° C, mas as medições também podem ser feitas à temperatura ambiente ou a 28,5 ° C.
- Ligar cabos do estimulador para o aparelho de teste. Ligue a alimentação do estimulador, mas não estimular a larva até o passo 5.6.
- Certifique-se a larva é paralela ao fundo da câmara. Por meio de uma objectiva de 40x, ver a porção da larva entre as extremidades dos tubos. Se paralelo à parte inferior, ambas as extremidades da larva estará em foco. Se for necessário, ajustar o tubo transdutor de força ao longo do eixo Z até que ambas as extremidades estão no foco.
- Verificar se o comprimento da larva é mais curto do que óptima. Ligue o sistema de comprimento sarcómero vídeo e rodar a câmara de vídeo de modo que as estrias são paralelas aos lados do quadro de vídeo. Este sistema monitoriza o espaçamento de estrias para analisar as alterações em intensidade de pixel ao longo de cada linha horizontal de pixels dentro de uma região definida pelo utilizador de interesse(ROI). Os resultados de todas as linhas dentro do ROI são calculados e relatados com uma freqüência equivalente ao frame-rate (≥ 80 seg -1) vídeo. O espaçamento de estrias é utilizado como um indicador de comprimento sarcómero.
- Ajuste o microscópio para se concentrar em fibras periféricas e anote o comprimento de sarcômero indicado. Se necessário, utilizar o dispositivo de posicionamento XYZ ligada ao controlador de comprimento para ajustar o comprimento da larva (eixo X), até que o comprimento do sarcómero é inferior a óptimo (por exemplo, 1,90 mm).
- Ajustar a corrente para otimizar força contração estimulação. Para começar, defina a atual sobre o estimulador para uma magnitude baixa (por exemplo, 100 mA) de saída. O estimulador pode ser acionado manualmente ou através de um computador que executa um programa LabVIEW personalizado. Extrair uma contração dos músculos larvais com um pulso de corrente de 0,2 ms de duração.
- Use um osciloscópio para gravar a produção de força e medir a força de contração de pico usando cursores do osciloscópio. Aumentar a correntepor incrementos de 50 mA e medir a força de contração de pico em cada nível atual. Espere 30 segundos entre as contrações musculares para evitar a fadiga. Como estímulo corrente aumenta, a força contração de pico normalmente aumenta até um máximo e depois diminui gradualmente. A corrente para o qual a larva gera a maior força é a corrente de estimulação óptima. Definir a amplitude da corrente à corrente de estimulação óptima.
- Utilizando o dispositivo de posicionamento XYZ, ajustar o comprimento da larva (e, portanto, o comprimento sarcómero) a fim de obter máxima força de contração. Larvas do peixe do tipo selvagem (3-7 dpf) gerar força máxima contração de comprimentos de sarcômero de 2,10 m ou 2,15 mM. No entanto, o comprimento do sarcómero pode ser ajustado para 2,08 mM para evitar o excesso de pressão sobre a larva.
- Provocar uma contração dos músculos das larvas. Utilize o osciloscópio para gravar a resposta força e salvar o registro para posterior análise.
6. Mensurar as dimensões Musculatura com Larva em Optimal Comprimento
- Mova o aparelho de teste de volta ao microscópio estéreo.
- Usando a escala ocular, medir a altura da musculatura como visto a partir do lado. Em seguida, tomando cuidado para não alterar o comprimento da larva, rodar a larva de 90 ° utilizando as caudas de alça de sutura de modo a visualizar a larva do fundo. Medir a largura da musculatura como visto a partir do fundo. Tome as medições em um marco anatômico (por exemplo, abertura urogenital) (Figura 4).
- Cortar as laçadas da sutura com uma micro-lâmina para libertar a larva do equipamento de teste.
Resultados
Em larvas de peixe-zebra de tipo selvagem saudável, as fibras musculares devem ser paralelos um ao outro, sem grandes intervalos entre eles e têm estrias evidente (Figura 5A). Larvas de peixe-zebra de tipo selvagem que não apresentam estas características, ou com danos evidentes, tais como fibras isoladas (Figura 5B), deve ser descartada.
Um gráfico representativo da força de contração pico versus corrente de uma única larva de peixe-zebra de estimulação é mostrado na Figura 6. Para larvas do peixe do tipo selvagem entre 3-7 dpf, a corrente de estimulação ideal é normalmente entre 400-600 mA, com três larvas dpf requerendo atual de larvas dpf 6-7 maior estimulação.
Os dados de força em bruto (recolhido durante o passo 5.8) tem de ser processados e analisados com o software de análise de dados. Em primeiro lugar, a linha de base do registro de força é definido como zero. Em segundo lugar, a voltagem de saída do transdutor de força é convertido para forçar (mN) (ver as instruções do fabricante para gerar uma curva de calibração para o transdutor de força). Uma resposta força representativa recolhidas durante uma contracção contração máxima de uma única larva é mostrado na Figura 7. Software de análise de dados pode ser usada para medir a força máxima e outras características da resposta força.
Um conjunto representativo de dados de força pico de contração contracções máximas é mostrada na Figura 8A. Valores de força de contração de pico típicos para o tipo selvagem 3-7 dpf gama larvas 0,9-1,7 milhões, com larvas mais velhas, gerando mais força do que as larvas jovens. As diferenças na força de contração de pico pode ser devido a processos usuais, tais como crescimento e desenvolvimento (Figura 8) ou processos anormais, tais como a mutação de genes relacionados com a patologia 21,22.
A normalização de área de secção transversal do músculo (CSA), pode ser usado para determinar o grau em que as diferenças na força de contração pico são simplesmente devido difere ECN no tamanho da musculatura 21,22. CSA músculo pode ser estimada utilizando a seguinte fórmula: CSA = π (A / 2) (B / 2), em que A é a altura da musculatura como visto de lado, B é a largura da musculatura como visto a partir do fundo, e uma secção transversal elíptica é assumido. CSA valores típicos para o tipo selvagem 3-7 dpf gama larvas 0,027-,034 mm 2, com larvas dpf 3-4, geralmente com valores menores do que o CSA larvas dpf 5-7. Um conjunto representativo de dados de força de pico normalizada de contrações contração máxima é mostrada na Figura 8B. Os valores típicos normalizados pico de contração da força para o tipo selvagem 3-7 dpf gama larvas 34-51 mN / mm 2, com 4-7 larvas dpf geralmente apresentando valores superiores a 3 larvas dpf.

Figura 1. Laço de sutura. Setas apontam para as caudas laço de sutura.

Figura 2. (A) aparelho de teste com componentes identificados. (B) vistas close-up da câmara experimental. (A) câmara experimental com fundo transparente. (B) transdutor de força. (C) controlador do comprimento. (D) Os dispositivos de posicionamento XYZ. O X, Y e Z são definidos no canto superior direito. (E) o sistema de controle de temperatura, utilizando os módulos termoeléctricos. Tubos acomoda o fluxo de água para o arrefecimento dos módulos termoeléctricos. (F), o tubo de aço inoxidável ligado ao transdutor de força. (G) do tubo de aço inoxidável ligado ao controlador de comprimento. Eléctrodos de platina de placas paralelas (h) Termómetro microssonda. (I), que mede o comprimento do ocâmara. Placas de platina são de 2,5 mm de altura e 0,255 milímetros de espessura.
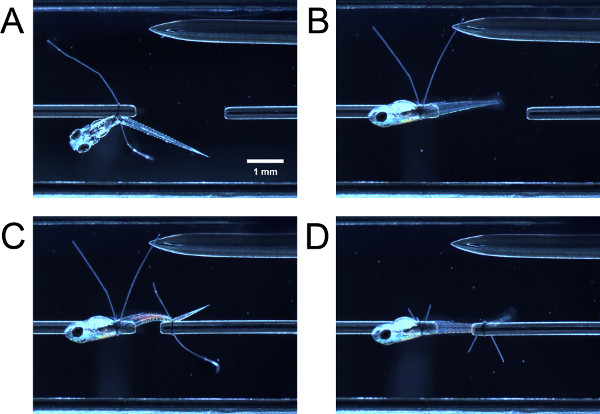
Figura 3. Amarrar larva na câmara experimental. (A) Larva amarrado em no final anterior, mas ainda não virou 90 °. (B) Larva depois virou 90 °. (C) Larva amarrado em no final posterior, mas ainda não virou. (D) Larva depois caudas laço giratórias e sutura são cortados.
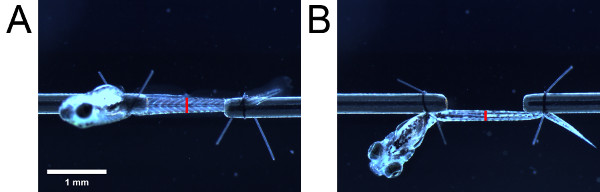
Figura 4. Medições para a estimativa da área em corte transversal. Musculatura como visto a partir do lado (A) e (B), fundo. Colocação das barras vermelhas indicam a localização da abertura urogenital. O comprimento das barras vermelhas indicam a altura ea largura da musculatura como visto de lado e da parte inferior, respectivamente.
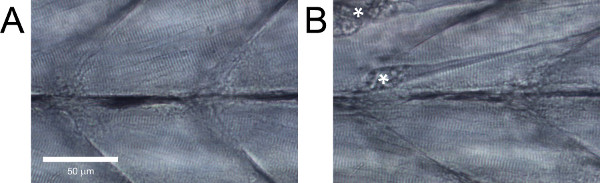
Figura 5. Vista lateral do tronco do peixe-zebra larvas musculatura. (A) do tecido saudável. (B) do tecido com dano evidente. As contraturas resultantes de separações de fibras estão marcados com asteriscos.
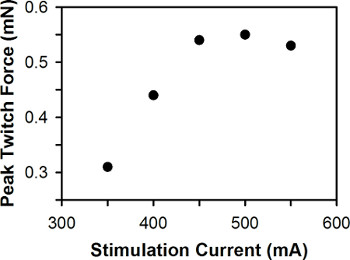
Figura 6. Parcela representativa da força contração de pico contra a estimulação atual. A corrente de estimulação ideal é de 500 mA.
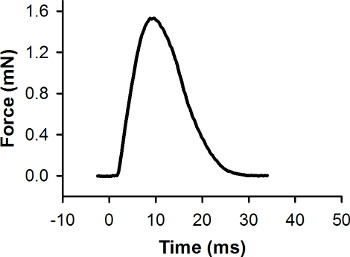
Figura 7. Registro força representativa para uma única contração contração. Essa contração foi provocada com um pulso de estímulo em 0 ms. A força máxima é de 1,56 mN.
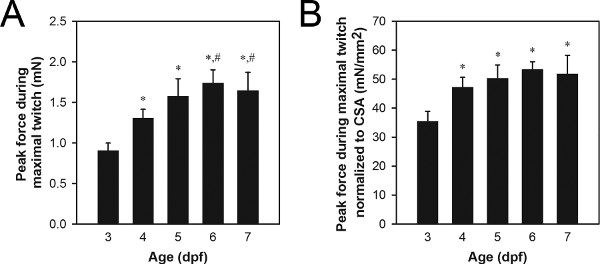
Figura 8. Dados de força representativas 3-7 larvas dpf. (A) dados pico de força de contração de contração máxima. (B) dados pico de força de contração contrações máximas normalizadas para CSA. Larvas mais velhas (6-7 dpf) foram alimentados Hatchfry Encapsulon Grade 0 com Spirulina (Argent Laboratories), a partir de 5 dpf. Meios + desvios padrão são relatadas com n = 5 em cada grupo. Grupos significativamente diferentes das larvas de 3 dpf (*) e larvas de 4 dpf (#) são indicados (ANOVA, P <0,05). O aumento significativo na força normalizada entre 3 e 4 dpf (B) indica um aumento da capacidade de geração de força intrínseca durante este período de tempo, enquanto que o aumento da força, entre 4 e 6-7 dpf (A) é atribuída ao crescimento baseado em nenhuma alterar 4-7 dpf na força normalizada.
Discussão
Este método mede a geração de força durante uma contração muscular para avaliar a função muscular em músculos do tronco de larvas de peixe-zebra. Embora as contracções tetânica pode ser atingida em larvas do peixe (por exemplo, através de estimulação de 200 pulsos / seg para uma duração de 0,2 segundos), a força máxima tetânica é só 10-15% maior do que a força máxima de contração. Portanto, a força gerada durante um tique é uma medida razoável da capacidade de geração de força. Twitches têm preferência sobre contrações tetânicas porque contracções são menos propensos a causar rasgar ou escorregar na sutura laços.
A fim de gerar dados significativos com esta técnica, a força máxima de contração deve ser conseguida para cada larva e a variabilidade entre os grupos experimentais, deve ser minimizado. Com esses objetivos em mente, oferecemos as seguintes sugestões. Primeiro, tome cuidado ao amarrar a larva do transdutor de força e os tubos de controlador de comprimento. Se os lacetes de suturas são apertadas demaisem muito, a sutura vai cortar através do tecido muscular. Se os lacetes de sutura não são suficientemente apertada, a força gerada pela larva não será totalmente transmitida ao transdutor de força. Ambas as situações, mas especialmente o último, subestimar a força máxima contração muscular. Em segundo lugar, uma vez testando vários grupos experimentais, pode levar várias horas (20-30 min / larva), alternam entre os dois grupos, pois as larvas continuarão a desenvolver-se durante o período de testes.
Enquanto alguns dos equipamentos mencionados é essencial para a medição da força máxima contração muscular (por exemplo, transdutor de força, estimulador de corrente), outros itens não são absolutamente necessárias. O sistema de comprimento de sarcômero vídeo é desejável, mas não é obrigatório. Como uma alternativa, uma série de contracções podem ser usados para encontrar a duração óptima, durante o qual o comprimento da larva é ajustado até a força de contração máxima é alcançada. Um sistema de controlo de temperatura também não é absolutamente necessário. O controle de temperatura é crítico quando measuring cinética contração, que são altamente sensíveis à temperatura, ainda que a força máxima de contração não é particularmente sensível a pequenas mudanças na temperatura e pode ser medida à temperatura ambiente. Note-se que, independentemente da temperatura na câmara de força durante os testes, as larvas devem ser mantidas à temperatura óptima de crescimento de 28,5 ° C, 24, antes de forçar o teste para teste preciso.
As larvas são testados numa solução de Tyrodes contendo tricaina. Usamos 0,02% (w / v) tricaina, a concentração recomendada para a anestesia 24, para eliminar as contracções espontâneas evocadas pelo sistema nervoso e, assim, prevenir a fadiga durante o teste de força. Tricaina também facilita o tie-on passo e reduz tempo de teste em geral. No entanto, observa-se que a inclusão tricaina na solução de teste consistente reduz a força de contração máxima de aproximadamente 30%. Um efeito similar foi também observado em músculo da cauda de girino, onde tricaine reduziu a geração de força após a transmissão neuromuscular foi bloqueado, o que sugere que tricaina tem um efeito direto no músculo 25. Tricaina pode reduzir a excitabilidade das células do músculo, reduzindo a condutância de sódio através da membrana celular, tal como faz em células nervosas 26. Outras opções para bloquear a ativação de neurônios motores são d-tubocurarina e α-bungarotoxina mas, ao contrário tricaina, estes compostos não são pele permeável e deve ser injetado diretamente na cabeça, medula espinhal, ou o coração 27. Pesquisadores individuais terão de avaliar se deve ou não tricaina é desejável para a sua aplicação específica. Se tricaina está incluído na solução de teste, a concentração deve ser consistente entre as experiências e os investigadores devem verificar se o efeito do tricaina não variar entre os grupos experimentais.
Descrevemos este método para as larvas jovens como 3 dpf e tão antiga quanto 7 dpf. Apesar das fibras musculares parece ser functional tão cedo quanto 17 horas após a fecundação, quando os movimentos da cauda espontâneas começam 27, o curto comprimento da cauda antes de 3 de dpf dificulta amarrar a larva para o equipamento de teste. Nós normalmente não testam larva após 7 dpf uma vez que muitos modelos de doenças não sobrevivem muito mais do que este tempo. Se o teste de larvas para além de 5 dpf, as larvas devem ser alimentados. Temos observado que as larvas não alimentadas têm músculos menores e gerar menos força máxima contração de larvas alimentadas, provavelmente devido à diminuição saco vitelino. Assim, pode ser desejável testar larvas entre 3-5 dpf, para evitar a variável adicional de alimentação externa.
Em resumo, nós descrevemos um método quantitativo e confiável para medir a geração de força durante uma contração contração máxima dos músculos do tronco zebrafish larval. Este método pode ser utilizado para avaliar a saúde geral do músculo larvas do peixe-zebra e, especificamente, proporciona informação sobre a função muscular. Além de fornecer informações sobre omagnitude da geração de força, esta técnica pode ser utilizada para estudar a cinética de geração de força ou ser adaptado para estudar a fadiga muscular 22. Embora nós descrevemos esta técnica para uso com larvas de tipo selvagem, este método pode ser utilizado para as larvas geneticamente modificados ou para as larvas tratadas com drogas ou de substâncias tóxicas, para caracterizar modelos de doenças musculares e avaliação de tratamentos, ou para estudar o desenvolvimento muscular, a lesão muscular, ou toxicidade química muscular relacionada.
Divulgações
Os autores declaram que não têm interesses financeiros concorrentes.
Agradecimentos
Os autores agradecem Angela Busta para a assistência com criação de peixes-zebra. Este trabalho foi financiado pelo National Institutes of Health (AG-020591 a SVB e 1K08AR054835 a JJD).
Materiais
| Name | Company | Catalog Number | Comments |
| REAGENTS | |||
| Tricaine powder | Sigma-Aldrich | A5040 | |
| Sodium chloride | Sigma-Aldrich | S7653 | |
| Potassium chloride | Sigma-Aldrich | P9541 | |
| Calcium chloride dihydrate | Sigma-Aldrich | 223506 | |
| Magnesium chloride hexahydrate | Sigma-Aldrich | M2670 | |
| Sodium phosphate monobasic | Sigma-Aldrich | S0751 | |
| Sodium bicarbonate | Sigma-Aldrich | S6297 | |
| Ethylenediaminetetraacetic acid disodium salt dihydrate | Sigma-Aldrich | E5134 | |
| EQUIPMENT | |||
| Nonsterile-suture | Ashaway Line Twine | S30002 | USP 10/0 monofilament nylon (3 ply) |
| Forceps | Fine Science Tools | 11251-20 | Dumont #5 |
| Spring scissors | Fine Science Tools | 15000-08 | Vannas |
| Stereo microscope | Leica Microsystems | MZ8 | Illuminated with Fostec EKE ACE I light source |
| Force transducer |  Aurora Scientific Aurora Scientific | 400A | |
| Length controller |  Aurora Scientific Aurora Scientific | 318B | |
| XYZ positioning devices | Parker Hannifin | 3936M | |
| Thermometer | Physitemp | BAT-12 | |
| Disposable transfer pipette | Fisher Scientific | 13-711-9AM | Cut end to widen opening and facilitate larva transfer |
| Petri dish | Fisher Scientific | 08-757-11YZ | |
| Glass pipette | Fisher Scientific | 13-678-8B | Cut end (and fire-polish) to widen opening and facilitate larva transfer |
| Inverted microscope | Carl Zeiss Microscopy | Axiovert 100 | |
| Water bath circulator | Neslab Instruments | RTE-111 | |
| Temperature controller | Alpha Omega Instruments | Series 800 | |
| Stimulator |  Aurora Scientific Aurora Scientific | 701C | High-power, follow stimulator |
| Video sarcomere length system |  Aurora Scientific Aurora Scientific | 900B-5A | |
| LabVIEW software | National Instruments | ||
| Oscilloscope | Nicolet Technologies | ACCURA 100 | |
| Microblade | Fine Science Tools | 10050-00 | |
| Microblade holder | Fine Science Tools | 10053-13 | |
| Data analysis software (Signo) | Alameda Applied Sciences | ||
Referências
- Bassett, D. I., Bryson-Richardson, R. J., Daggett, D. F., Gautier, P., Keenan, D. G., Currie, P. D. Dystrophin is required for the formation of stable muscle attachments in the zebrafish embryo. Development. 130 (23), 5851-5860 (2003).
- Nixon, S. J., Wegner, J., et al. Zebrafish as a model for caveolin-associated muscle disease; caveolin-3 is required for myofibril organization and muscle cell patterning. Hum. Mol. Genet. 14 (13), 1727-1743 (2005).
- Hall, T. E., Bryson-Richardson, R. J., et al. The zebrafish candyfloss mutant implicates extracellular matrix adhesion failure in laminin α2-deficient congenital muscular dystrophy. PNAS. 104 (17), 7092-7097 (2007).
- Hirata, H., Watanabe, T., et al. Zebrafish relatively relaxed mutants have a ryanodine receptor defect, show slow swimming and provide a model of multi-minicore disease. Development. 134, 2771-2781 (2007).
- Dowling, J. J., Vreede, A. P., et al. Loss of myotubularin function results in t-tubule disorganization in zebrafish and human myotubular myopathy. PLoS Genet. 5 (2), e1000372 (2009).
- Berger, J., Berger, S., Hall, T. E., Lieschke, G. J., Currie, P. D. Dystrophin-deficient zebrafish feature aspects of the Duchenne muscular dystrophy pathology. Neuromuscul. Disord. 20 (12), 826-832 (2010).
- Kawahara, G., Guyon, J. R., Nakamura, Y., Kunkel, L. M. Zebrafish models for human FKRP muscular dystrophies. Hum. Mol. Genet. 19 (4), 623-633 (2010).
- Wallace, L. M., Garwick, S. E., et al. DUX4, a candidate gene for facioscapulohumeral muscular dystrophy, causes p53-dependent myopathy in vivo. Ann. Neurol. 69, 540-552 (2011).
- Sztal, T. E., Sonntag, C., Hall, T. E., Currie, P. D. Epistatic dissection of laminin-receptor interactions in dystrophic zebrafish muscle. Hum. Mol. Genet. , (1093).
- Kawahara, G., Karpf, J. A., Myers, J. A., Alexander, M. S., Guyon, J. R., Kunkel, L. M. Drug screening in a zebrafish model of Duchenne muscular dystrophy. PNAS. 108 (13), 5331-5336 (2011).
- Berger, J., Berger, S., Jacoby, A. S., Wilton, S. D., Currie, P. D. Evaluation of exon-skipping strategies for Duchenne muscular dystrophy utilizing dystrophin-deficient zebrafish. J. Cell Mol. Med. 15 (12), 2643-2651 (2011).
- Seger, C., Hargrave, M., Wang, X., Chai, R. J., Elworthy, S., Ingham, P. W. Analysis of Pax7 expressing myogenic cells in zebrafish muscle development, injury, and models of disease. Dev. Dyn. 240, 2440-2451 (2011).
- Postel, R., Vakeel, P., Topczewski, J., Knöll, R., Bakkers, J. Zebrafish integrin-linked kinase is required in skeletal muscles for strengthening the integrin-ECM adhesion complex. Dev. Biol. 318 (1), 92-101 (2008).
- Zoeller, J. J., McQuillan, A., Whitelock, J., Ho, S. Y., Iozzo, R. V. A central function for perlecan in skeletal muscle and cardiovascular development. J. Cell Biol. 181 (2), 381-394 (2008).
- Kim, H. R., Ingham, P. W. The extracellular matrix protein TGFBI promotes myofibril bundling and muscle fibre growth in the zebrafish embryo. Dev. Dyn. 238, 56-65 (2009).
- Beqqali, A., Monshouwer-Kloots, J., et al. CHAP is a newly identified Z-disc protein essential for heart and skeletal muscle function. J. Cell Sci. 123 (7), 1141-1150 (2010).
- Huang, H., Huang, C., et al. Toxicity, uptake kinetics and behavior assessment in zebrafish embryos following exposure to perfluorooctanesulphonicacid (PFOS). Aquat. Toxicol. 98 (2), 139-147 (2010).
- Sylvain, N. J., Brewster, D. L., Ali, D. W. Zebrafish embryos exposed to alcohol undergo abnormal development of motor neurons and muscle fibers. Neurotoxicol. Teratol. 32 (4), 472-480 (2010).
- Chandrasekar, G., Arner, A., Kitambi, S. S., Dahlman-Wright, K., Andersson-Lendahl, M. Developmental toxicity of the environmental pollutant 4-nonylphenol in zebrafish. Neurotoxicol. Teratol. 33 (6), 752-764 (2011).
- Buss, R. R., Drapeau, P. Activation of embryonic red and white muscle fibers during fictive swimming in the developing zebrafish. J. Neurophysiol. 87 (3), 1244-1251 (2002).
- Telfer, W. R., Nelson, D. D., Waugh, T., Brooks, S. V., Dowling, J. J. neb: a zebrafish model of nemaline myopathy due to nebulin mutation. Dis Model Mech. 5, 389-396 (2012).
- Dowling, J. J., Arbogast, S., et al. Oxidative stress and successful antioxidant treatment in models of RYR1-related myopathy. Brain. 135 (4), 1115-1127 (2012).
- Dou, Y., Andersson-Lendahl, M., Arner, A. Structure and function of skeletal muscle in zebrafish early larvae. J. Gen. Physiol. 131, 445-453 (2008).
- Westerfield, M. . The zebrafish book: a guide for the laboratory use of zebrafish (Danio rerio). , (2000).
- Herr, V. D., Sonnenburg, D. C., Courogen, P. M., Fiamengo, S. A., Downes, H. Muscle weakness during tricaine anesthesia. Comp Biochem Physiol Part C. 110 (3), 289-296 (1995).
- Frazier, D. T., Narahashi, T. Tricaine (MS-222): effects of ionic conductances of squid axon membranes. Eur. J. Pharmacol. 33 (2), 313-317 (1975).
- Saint-Amant, L., Drapeau, P. Time course of the development of motor behaviors in the zebrafish embryo. J. Neurobiol. 37 (4), 622-632 (1998).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados