Method Article
Zebrafish의 유충의 근육 기능을 평가하기 위해 수축하는 동안 힘 측정
요약
힘의 측정은 개발, 부상, 질병, 치료 또는 화학 물질의 독성에 의한 근육 기능의 변화를 보여주기 위해 사용할 수 있습니다. 이 비디오에서는, 우리는 zebrafish의 애벌레 몸통 근육의 최대 수축시 힘을 측정하는 방법을 보여줍니다.
초록
Zebrafish의 유충은 근육 발달, 근육 질환 및 근육 관련 화학 물질의 독성 모델을 제공하지만, 관련 연구는 주로 근육의 건강 기능성 조치를 부족합니다. 이 비디오 문서에서는, 우리는 zebrafish의 애벌레 몸통 근육의 수축시 힘의 생성을 측정하는 방법을 보여줍니다. 힘의 측정은 소금 용액으로 채워진 챔버로 마취 유충을 배치하여 수행됩니다. 유충의 앞쪽 끝은 힘 센서에 연결되어 유충의 뒤쪽 끝은 길이 컨트롤러에 연결됩니다. 사시 트 위치 수축 전기장 자극으로 이끌어되고 강제 응답은 분석을 위해 기록됩니다. 수축시 힘 생성은 전반적인 근육 건강의 측정을 제공하며, 특히 근육 기능의 측정을 제공합니다. 우리는 야생 형 유충과 사용 방법을 설명하지만,이 방법은 유전자 변형 유충이나 약물이나 독성 물질로 치료 애벌레와 함께 사용할 수 있습니다근육 질병 모델의 특성 및 치료를 평가하거나, 근육 발달, 부상 또는 화학 물질의 독성을 연구한다.
서문
젊은 제브라 피쉬 (Danio rerio) 유충, 3-7 일로 포스트 수정 (DPF)는 점점 골격 근육 연구를위한 유용한 유기체로 인식됩니다. 어린 유충이 모델 인간의 근육 질환 1-9에 사용되는, 약 및 치료 전략 10-11, 연구 근육 부상 12 평가 개발 13-16 근육을 이해하고, 근육 관련 화학 물질의 독성 17-19를 조사합니다. 이 지역의 전형적인 연구는 건강한 근육 유전자 조작이나 독성 물질에 노출에 의해 비정상적으로 렌더링되는 정도를 검사하고 어떤 연구는 비정상적인 근육 치료에 반응하는 정도를 검사합니다. 이러한 연구의 성공에 중요한 정확하게 근육의 상태를 평가하는 기능입니다.
zebrafish의 애벌레의 근육 상태를 평가 할 수있는 다양한 방법이 있지만, 몇몇은 근육의 기능에 대한 직접적인 정보를 제공합니다. 근육 건강은 일반적으로 appearanc에 의해 평가된다같은 9,15,16,18를 면역 염색 학적 염색 6,8,11, 광학 현미경 3,13, 전자 현미경 3,4,14,16, 또는 복굴절 7,9,11에 의해 평가 전자,하지만, 이러한 기술 제공 형태 정보 만. 트렁크와 꼬리 변위 및 속도 4,17가 운동 기능을 평가하지만, 그들은 또한 신경 입력, 에너지 대사, 및 다른 프로세스를 반영 때문에 이러한 근육 기능을 직접 측정하지 않습니다 수영.
반면, 수축시 힘 생성을 측정하는 것은 근육 기능의 직접적인 평가를 제공하고 전반적인 근육 건강의 척도를 나타냅니다. 이 방법의 추가적인 장점은 단순 데이터 분석 및 정량 결과를 포함. 이 비디오 문서에서는, 우리는 더 많은 연구자들이 연구에 근육 건강 기존의 조치를 보완하기 위해이 방법을 사용하는 희망, 애벌레 근육에 힘 생성을 측정하기위한 자세한 절차를 제공합니다.
이 방법의 전반적인 목표는 zebrafish의 애벌레 몸통 근육의 수축시 힘의 생성을 측정하는 것입니다. 이 목표를 달성하기 위해, zebrafish의 유충은 마취와 소금 용액으로 채워진 챔버에 배치됩니다. 유충의 앞쪽 끝은 힘 센서에 연결되어 유충의 뒤쪽 끝은 길이 컨트롤러에 연결됩니다. 근육의 활성화는 전기장 자극에 의해 수행되고, 자극 전류와 유충의 길이는 최대 트 힘을 생산하기 위해 조정됩니다. 사시 트 위치 수축 이끌어되고 강제 응답은 분석을 위해 기록됩니다.명확하게,이 기술은 수영하는 동안 애벌레 근육에 의해 생성 된 힘을 측정하지 않습니다. 유충의 양쪽 끝이 장비에 연결되어 유충 마취 남아 있기 때문에이 테스트 기간 동안 운동을 시작할 수 있기 때문이다. 또한, 현장 자극 억을 유도하는 동시에 모든 근육 섬유를 활성화자연스럽게 20 발생하는 것이 아니다 ateral 수축. 따라서 오히려 수영 중에 발생하는 실제 힘을 측정하는 것보다,이 기술 애벌레 근육의 힘 생성 능력을 결정합니다.
우리는 근육 nemaline 근병증 (21)의 제브라 피쉬 모델에서 약점뿐만 아니라, 멀티 MINICORE 질환 (22)의 제브라 피쉬 모델에서 근육 기능에 항산화 치료의 효과를 평가하는을 설명하는이 기술을 사용했습니다. 기타 근육 기능 19 환경 오염 물질의 영향을 조사하기 위해 유사한 기술 23를 사용했습니다.
프로토콜
참고 : 제브라 피쉬와 관련된 모든 절차는 관련 지침, 규정 및 규제 기관에 따라 수행되어야한다. 이 문서에 표시된 모든 동물 사용 절차는 동물의 사용 및 관리에 미시간위원회의 대학 (UCUCA)에 의해 승인되었다.
1. 봉합 루프를 만들
- 세 가닥으로 비 멸균 봉합 (USP 10 / 0 모노 필라멘트 나일론, 3 개 가닥)을 분리하는 집게를 사용합니다.
- 가닥 중 하나를 두 번 돌린 매듭을 시작합니다. 대신 매듭의 작은 (~ 1mm 직경) 루프를 만들기 위해 완전히 매듭을 체결하기 전에 중지합니다.
- 루프 꼬리에서 초과 봉합사를 잘라 가위를 사용합니다. 완성 된 루프의 예는 그림 1에 표시됩니다.
- 이 포스트 나중에 사용하기 위해 참고의 끈끈한면에 루프를 배치합니다. 봉합 루프는 강제 테스트 중에 장소에서 유충을 보유하는 데 사용됩니다.
- 반복 필요에 따라 1.1-1.4 단계를 반복합니다. 막테스트 할 각 유충의 전자 두 봉합 루프.
2. 테스트 솔루션을
- 의 1,000 ml로 7.977 g 나트륨 염화물, 0.373 g 염화 칼륨, 0.265 g의 염화 칼슘 이수화 물, 0.102 g 염화 마그네슘 육수화물, 0.048 g 나트륨 인산, 1.000 g 나트륨 중탄산염, 그리고 0.037 g 에틸렌 산 나트륨 소금 수화물을 추가하여 Tyrodes 솔루션을 물을 정화.
- 염이 완전히 용해 될 때까지 저어. 이 솔루션은 4 ° C.에서 한 달 동안 저장 될 수있다
- 47.9 ML의 Tyrodes 솔루션과 믹스 4 밀리그램 / ML tricaine의 2.1 ML, Zebrafish의 책 24에 따라 제조를 추가합니다. 어두운 유리 병 또는 알루미늄 호일로 덮여 유리 병에 저장하여 빛으로부터이 솔루션을 보호합니다. 이 솔루션은 상온에서 보관하고 매일 신선한 만든되어야한다.
3. 실험 챔버에 Aanesthetized 유충을 연결
- <리> 장소 스테레오 현미경의 무대에 시험 장치 (그림 2).
- 시험 장치에 힘 변환기와 길이 컨트롤러 케이블을 연결합니다. 힘 센서의 전원을 켭니다. 그것은 엄격한 유지되도록 길이 컨트롤러를 켭니다. (참고 :.. 길이 컨트롤러가 수축하는 동안 근육의 준비를 늘리거나 줄일 수있는 기능을 제공하지만, 길이 컨트롤러의이 기능이 여기에 설명 된 방법에 사용하지 않는 때문에, 길이 컨트롤러는 단단한 첨부 파일로 생각할 수 있습니다 점) XYZ 위치 시스템에 장착.
- 처분 할 수있는 이동 피펫, 시험 용액으로 실험 챔버를 입력합니다.
- 꼬리 중 하나를 사용하여 봉합 루프를 선택하고 힘 센서 튜브에 걸고 집게를 사용합니다. 길이 컨트롤러에 연결된 튜브에 두 번째 봉합 루프를 건다. (참고 : 곡선 부분에 봉합 루프를 잡으면 봉합 및 CAU를 꼬 수 있습니다가) 다음 단계에서 휴식 SE.
- 처분 할 수있는 이동 피펫, 시험 용액으로 채워진 작은 페트리 접시에 zebrafish의 유충을 전송합니다. 효과 (~ 1 분) 걸릴 테스트 솔루션 (tricaine)에서 마취 기다립니다. 집게로 조심스럽게 꼬리를 조금씩 이동하고 유충 터치 유발 수영의 부족으로 마취 있는지 확인합니다.
- 실험 챔버에 유충을 전송하는 유리 피펫을 사용합니다.
- 부드럽게 닫힌 집게로 유충을 이끌어 의해, 힘 센서 튜브의 봉합 루프를 통해 유충의 앞쪽 부분을 안내합니다. 튜브 봉합 루프를 통해 유충의 앞쪽 부분을 안내합니다. 집게와 봉합 루프 꼬리를 모두 잡고 난황 또는 swimbladder (그림 3A) 후방 봉합 루프를 강화하는 동시에 당깁니다.
- 포셉 한 봉합 루프 꼬리를 잡고 당겨 유충 얼굴의 측면 측면까지 관의 주위에 90 °를 회전하는 유충의 원인의 최대 (그림 3B). 루프가 충분히 체결 한 경우, 풀에 약간의 저항이있을 것이다 유충은 쉽게 회전하지 않아야합니다. 루프가 너무 체결 한 경우, 유충은 관 주위에 회전하지 않습니다.
- 길이 컨트롤러에 연결된 XYZ 위치 장치를 사용하여 X 축 (그림 2A의 축 정의)을 따라 유충의 트렁크와 꼬리 아래 길이 컨트롤러 튜브를 이동합니다. 길이 컨트롤러 튜브의 끝과 힘 센서 튜브 사이의 공간을 두십시오.
- 유충의 꼬리에 봉합 루프를 안내하고 이전에 (그림 3C) 기술로 봉합 루프를 조입니다. 당신은 측면면이 위로 향하도록 유충의 후방 부분을 회전해야 할 수 있습니다. 봉합 루프 꼬리 (그림 3D)를 트리밍합니다.
4. 실험 챔버에 위치 유충
- 유충 승을 보장하기 위해 챔버 바닥으로부터 적절한 거리에 유충을 이동아픈 이후 단계에서 거꾸로 현미경 목표의 "작동 거리"에서합니다. 이 작업을 수행하려면, 튜브 그냥 챔버의 바닥에 닿을 때까지 천천히 Z-축을 따라 튜브 (첨부 유충)와 낮은 XYZ 위치 장치를 사용합니다. 유충은 챔버 바닥 (~ 100 μm의)에서 적절한 거리입니다 때까지, 튜브를 올립니다.
- 길이 컨트롤러에 연결된 XYZ 위치 장치를 사용하여, 힘 센서 튜브의 긴 축 유충의 긴 축을 정렬 Y 축 방향 길이 컨트롤러 튜브를 조정합니다.
5. 최대한 트 위치 수축하는 동안 레코드 포스
- 거꾸로 현미경의 무대에 시험 기기를 이동합니다.
- 원하는 값으로 챔버의 온도를 조정합니다. 시작하려면, 물 목욕 순환 장치, 온도계 및 시험 기기에 온도 컨트롤러를 연결합니다. 필요한 구성 요소의 전원을 켜고 온도 contr를에 설정을 조정온도계까지 oller 원하는 값을보고합니다. 이 문서에 포함 된 데이터는 25 ° C에서 수집되었지만, 측정은 RT이나 28.5에서 만들 수 있습니다 ° C.
- 시험 기기에 자극에서 케이블을 연결합니다. 자극기의 전원을 켭니다하되, 단계 5.6까지 유충을 자극하지 않습니다.
- 유충은 실 바닥과 평행해야합니다. 40X 목표를 통해 튜브의 끝 사이의 유충의 부분을 볼 수 있습니다. 바닥에 평행 한 경우, 유충의 양쪽 끝이 초점이 될 것입니다. 필요한 경우 양쪽의 초점이 될 때까지, Z-축 힘 센서 튜브를 조정합니다.
- 유충의 길이가 최적보다 짧은 있는지 확인합니다. 비디오 근절 길이 시스템의 전원을 켜고 강선은 비디오 프레임의 측면에 평행 한 비디오 카메라와 같은 회전합니다. 이 시스템은 또한 사용자 정의 영역 내에서 각 픽셀 가로 행을 따라 픽셀의 강도 변화를 분석하여 횡문의 간격을 모니터링(ROI). ROI 내의 모든 행에 대한 결과는 평균과 비디오 프레임 속도 (≥ 80 초 -1)에 해당하는 주파수로보고됩니다. 횡문 간격은 근절 길이의 지표로 사용된다.
- 현미경 주변 섬유에 집중하고 지시 근절의 길이를주의 할을 조정합니다. 필요한 경우, 근절 길이 (예를 들어, 1.90 μm의) 최적 이하가 될 때까지 유충의 길이를 조정하는 길이 컨트롤러 (X-축)에 부착 된 XYZ 위치 장치를 사용하십시오.
- 트 힘을 최적화하는 전류 자극을 조정합니다. 시작하려면, 낮은 정도 (예를 들어, 100mA)로 자극에 대한 출력 전류를 설정합니다. 자극은 수동으로 또는 사용자 정의 LabVIEW 프로그램을 실행하는 컴퓨터에 의해 트리거 될 수 있습니다. 지속 시간이 0.2 밀리의 전류 펄스 애벌레 근육의 경련을 유도.
- 힘 출력을 기록하고 오실로스코프의 커서를 사용 피크 트 힘을 측정하기 위해 오실로스코프를 사용합니다. 전류를 증가50mA의 단위로 각 전류 레벨에서 피크 트 힘을 측정합니다. 피로를 방지하기 위해 경련 사이에 30 초를 기다립니다. 자극 전류가 증가함에 따라, 피크 트의 힘은 일반적으로 최대로 증가하고 서서히 감소한다. 유충은 큰 힘을 생성하는 전류는 최적의 자극 전류이다. 최적의 자극 전류 전류 진폭을 설정합니다.
- XYZ 위치 장치를 사용하여 최대 트의 힘을 유도하기 위해 유충 (따라서, 근절 길이)의 길이를 조정합니다. 야생 유형 zebrafish의 유충 (3-7 DPF)는 2.10 μm의 또는 2.15 ㎛의 근절 길이에서 최대 트 힘을 생성합니다. 그러나, 근절 길이는 유충에 과도한 부담을 피하기 위해 2.08 μM로 설정할 수 있습니다.
- 애벌레 근육의 경련을 유도. 강제 응답을 기록하고 후속 분석을 위해 레코드를 저장하도록 오실로스코프를 사용합니다.
6. 최적의 길이로 유충과 근육 크기를 측정
- 스테레오 현미경으로 다시 테스트 장치를 이동합니다.
- 접안 렌즈의 배율을 사용하여 측면에서 볼 때 근육의 높이를 측정합니다. 그런 다음, 유충의 길이를 변경하지 돌보는, 90으로 유충을 회전 ° 아래에서 애벌레를보기 위해 봉합 루프 꼬리를 사용하여. 아래에서 볼 때 근육의 폭을 측정합니다. 해부학 적 랜드 마크 (예 : 비뇨 생식기 개구부) (그림 4)에서 측정을 가져 가라.
- 시험 장비의 유충을 풀어 microblade로 봉합 루프를 잘라.
결과
건강한 야생 유형 zebrafish의 유충에서 근육 섬유 하나 사이에 큰 격차없이 서로 평행해야하며 분명 강선을 (그림 5A)이 있어야합니다. 이러한 기능을 전시, 또는 분리 된 섬유 (그림 5b)와 같은 명백한 손상하지 않는 야생형 zebrafish의 유충은 폐기되어야한다.
피크 트 힘 대 한 zebrafish의 유충 현재 자극의 대표 플롯은 그림 6에 나와 있습니다. 3-7 DPF 사이의 야생 유형 zebrafish의 애벌레의 경우, 최적의 자극 전류는 3 DPF의 애벌레는 일반적으로 6-7 DPF의 애벌레보다 현재 더 큰 자극을 필요로, 400~600mA 사이에 일반적입니다.
원시 힘 데이터 (단계 5.8에서 수집) 처리 및 데이터 분석 소프트웨어로 분석 할 수있다. 첫째, 힘 레코드의 기본은 0으로 설정됩니다. 둘째, 힘 센서의 전압 출력 (M 강제로 변환N) (힘 센서에 대한 보정 곡선을 생성하기 위해 제조업체의 지침을 참조하십시오). 하나의 애벌레의 최대 트 수축 동안 수집 된 대표적인 강제 응답은 그림 7에 나와 있습니다. 데이터 분석 소프트웨어는 최대 힘과 힘의 응답의 다른 기능을 측정하는 데 사용할 수 있습니다.
최대 트의 수축에서 최대 힘 데이터의 대표적인 세트는 그림 8A에 표시됩니다. 전형적인 피크 트 포스 오래된 유충이 어린 유충보다 더 많은 힘을 생성과 0.9에서 1.7 mN의에 야생 형 3-7 DPF의 애벌레 범위의 값. 피크 트의 힘의 차이는 성장과 발전 등 정상적인 프로세스 (그림 8) 또는 유전자의 돌연변이와 관련된 병리 21,22과 같은 비정상적인 프로세스로 인해 수 있습니다.
근육 단면적 (CSA)에 의해 정규화 피크 트의 힘의 차이가 differe에로 인해 단순히 정도를 확인하는 데 사용할 수 있습니다 근육 21,22의 크기 NCES. 근육 CSA는 공식을 이용하여 추정 할 수있다 : CSA는 (B / 2) (A / 2) = π, A는 측면에서 볼 때 근육의 높이이고, B는, 아래에서 볼 때 근육의 폭 및 단면 타원형으로 간주됩니다. 0.027 3-4 DPF의 애벌레는 일반적으로 5-7 DPF의 애벌레보다 작은 CSA 값을 보여주는 0.034 mm 2, 야생형 3-7 DPF의 애벌레 범위에 대한 일반적인 CSA 값을 입력합니다. 최대 트 수축의 정규화 된 최대 힘 데이터의 대표적인 세트는 그림 8b에 표시됩니다. 4-7 DPF 유충은 일반적으로 3 DPF의 애벌레보다 큰 값을 보여주는 34 51 mN의 / mm 2 야생형 3-7 DPF의 애벌레 범위에 대한 일반적인 표준화 피크 트 힘 값을 입력합니다.

그림 1. 봉합 루프 꼬리에 봉합 루프. 화살표가 가리 킵니다.

그림 2. 레이블 구성 요소 (A) 시험 장치. 실험 챔버 (B) 근접 전망. 투명한 바닥 () 실험 챔버. (B) 힘 센서. (C) 길이 컨트롤러. (D) XYZ 위치 장치. X, Y 및 Z 축이 오른쪽 상단 모서리에 정의되어 있습니다. 열전 모듈을 활용 (E) 온도 제어 시스템. 튜브 열전 모듈의 냉각을 위해 물 흐름을 수용 할 수 있습니다. (F) 스테인리스 관 변환기를 강제로 연결합니다. (G) 스테인레스 스틸 튜브의 길이가 컨트롤러에 연결합니다. (H) 온도계 microprobe. (I) 플래티넘 평행 판 전극의 길이에 걸쳐실. 백금 플레이트는 높은 2.5 ㎜, 두께 0.255 mm이다.
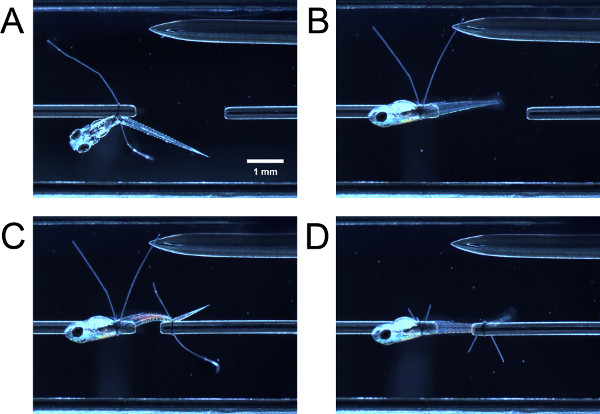
그림 3. 실험 챔버에 유충을 묶는. (A) 유충은 앞쪽 끝 부분에 묶여 있지만, 아직 90 ° 선회 한 없습니다. (B) 유충 스위블 90 아직 선회 한하지 후방 끝 부분에 묶여 °. (C) 유충 후. (D) 유충은 후 스위블 및 봉합 루프 꼬리가 잘립니다.
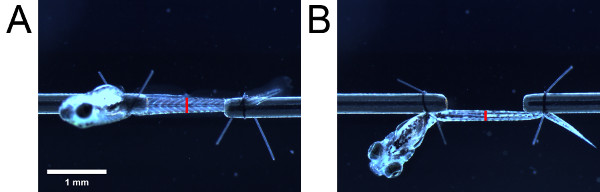
그림 4. 단면적 추정을위한 측정. 근육은 (A) 측면에서 볼 및 (B) 바닥. 빨간색 막대의 위치가 비뇨 생식기 개구부의 위치를 나타냅니다. 빨간색 막대의 길이는 각각 측면과 하단에서 볼 때 근육의 높이와 너비를 나타냅니다.
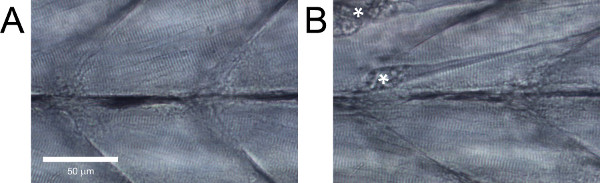
그림 5. zebrafish의 애벌레 몸통 근육의 측면보기. 분명 손상 (A) 건강한 조직. (B) 조직. 섬유 박리로 인한 경축는 별표로 표시됩니다.
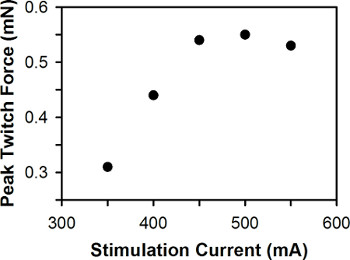
그림 6. 피크 트 힘 비해 자극의 대표 플롯 현재. 최적의 자극 전류는 500mA이다.
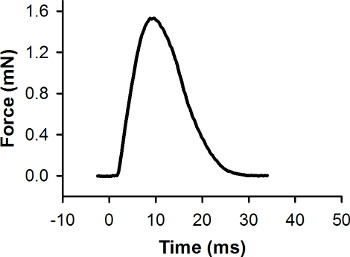
그림 7. 단일 트 수축 대표 힘의 기록.이 수축은 0 밀리 초에 자극 펄스로 이끌어되었다. 최대 힘은 1.56 mN의 것입니다.
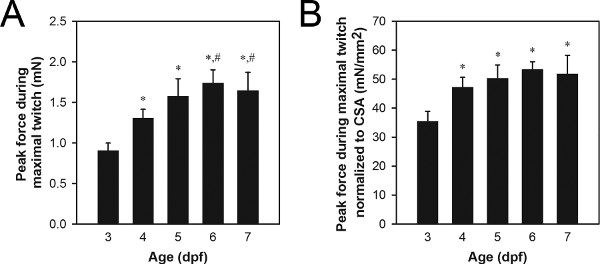
그림 8. 3-7 DPF의 애벌레.에서 대표적인 힘 데이터 (A) 최대 트의 수축에서 피크 힘이 데이터는. (B) 최대 트의 수축에서 피크 포스 데이터는 CSA에 정상화. 이전 유충 (6-7 DPF)는 5 DPF에서 시작 스피루리나와 공급 Hatchfry Encapsulon 0 등급 (은빛 연구소)이었다. 수단 + 표준 편차는 각 그룹 N = 5로보고됩니다. 3 DPF의 애벌레 (*) 4 DPF의 애벌레 (#)에서 유의 한 차이 그룹 (ANOVA, P <0.05 표시됩니다). 4 6-7 DPF (A) 사이의 힘의 증가가 더 정보에 기초 성장에 기인 반면 3, 4 DPF (B) 사이의 정규화 된 힘의 상당한 증가는이 기간 동안 고유의 힘 생성 능력의 증가를 나타냅니다 정규화 된 힘의 4 ~ 7 DPF에서 변경할 수 있습니다.
토론
이 방법은 zebrafish의 애벌레의 몸통 근육의 근육 기능을 평가하는 트하는 동안 힘 생성을 측정합니다. 파상풍의 수축이 (0.2 초 동안 200 자극 펄스 / 초만큼 예) zebrafish의 유충에 이끌려 할 수 있지만, 최대 파상풍의 힘은 최대 트의 힘보다 단지 15 % 크다. 따라서, 트 중에 생성 된 힘은 힘 생성 능력의 합리적인 기준입니다. 경련이 추출하거나 봉합 관계에서 미끄러지 일으킬 가능성이 있기 때문에 경련은 파상풍의 수축을 선호합니다.
이 기술 의미있는 데이터를 생성하기 위해 최대 트의 힘은 각 유충을 위해 달성해야하며, 실험 집단 간의 변화는 최소화되어야한다. 이러한 목표를 염두에두고, 우리는 다음과 같은 제안을 제공합니다. 힘 변환기와 길이 컨트롤러 튜브에 유충을 묶는 때 먼저주의하십시오. 봉합 루프가 너무 죄면많이 봉합은 근육 조직을자를 것이다. 봉합 루프가 충분히 조여지지 않은 경우, 유충에 의해 생성되는 힘은 완전히 힘 센서로 전송되지 않습니다. 두 경우 모두,하지만 특히 후자는 최대 트의 힘을 과소 평가하는 경향이있다. 유충은 테스트 기간 동안 개발을 계속하기 때문에 둘째, 여러 실험 그룹 테스트 이후 그룹 사이에 대체 몇 시간 (20-30 분 / 애벌레)이 걸릴 수 있습니다.
언급 된 장비의 일부는 최대 연축 힘의 측정 (예를 들어, 힘 센서, 전류 자극기)에 필수적이지만, 다른 항목은 절대적으로 필요하지 않습니다. 비디오 근절 길이 시스템은 바람직하지만, 필요하지 않습니다. 대안으로, 기라의 시리즈는 최대 트 힘이 달성 될 때까지 유충의 길이가 조정되는 동안 최적의 길이를 찾을 수 있습니다. 온도 제어 시스템은 절대적으로 필요하지 않습니다. 온도 제어 때 MEA 중요합니다최대 트 힘은 온도의 작은 변화에 특히 민감하지 않고 상온에서 측정 할 수있는 반면, 온도에 매우 민감한 가감하는 트 속도론. 에 관계없이 강제 테스트 중에 챔버 온도, 유충 ° C 24 전에 강제로 28.5의 최적 성장 온도에서 유지되어야합니다 정확한 스테이징 테스트.
애벌레는 tricaine을 포함 Tyrodes 솔루션에서 테스트됩니다. 우리는 신경 시스템에 의해 유발 자발적인 수축을 제거하고, 따라서 힘 테스트 과정에서 피로를 방지하기 위해 (W / V) tricaine, 마취 24에 권장되는 농도 0.02 %를 사용합니다. Tricaine 또한 타이에 단계를 용이하게하고 전체 테스트 시간을 줄일 수 있습니다. 그러나, 우리는 테스트 솔루션에 tricaine을 포함하여 지속적으로 약 30 %의 최대 트 힘을 감소 시킨다는 것을 관찰합니다. 비슷한 효과는 tricai 곳, 올챙이 꼬리 근육에서 관찰되었다신경 근육 학 전송이 차단 된 후 네브래스카 tricaine 근육 25에 직접적인 영향을 가지고 제안, 힘 생성을 감소시켰다. 이 신경 세포 26에서와 같이 Tricaine는 세포막을 통해 나트륨 전도도를 감소시켜 근육 세포의 흥분을 줄일 수 있습니다. 의 motoneurons에 의해 활성화를 차단하는 다른 옵션은 D-tubocurarine 및 α-bungarotoxin하지만, tricaine는 달리,이 화합물은 피부 투과하지 않으며 머리, 척수, 심장 27에 직접 주입해야합니다. 개별 연구자 tricaine가 특정 응용 프로그램에 대한 바람직한 여부를 평가해야합니다. tricaine이 테스트 솔루션에 포함되어있는 경우 tricaine의 효과는 실험군 사이에 차이가 없는지 확인한다 농도는 실험과 연구 사이에 일관성이 있어야합니다.
우리는 3 DPF로 젊고 7 DPF만큼이나 오래된으로 유충이 방법을 설명합니다. 근육 섬유는 푸 것으로 보이지만3 DPF의 테스트 장비에 유충을 묶는 방해하기 전에 자연 꼬리 운동이 27, 꼬리의 짧은 길이 시작 17 시간 후 수정, 빠르면 nctional. 많은 질병 모델이 시간보다 더 오래 생존하지 않기 때문에 우리는 일반적으로 7 DPF 후 유충을 테스트하지 않습니다. 5 DPF 이외의 유충을 테스트하는 경우 유충이 공급되어야한다. 우리는 unfed 유충 가능성이 먹은 애벌레 감소 난황으로 인해보다 작은 근육이 덜 최대 트 힘을 생성하는 것을 관찰했다. 따라서 외부 먹이의 추가 변수를 방지하기 위해, 3-5 DPF 사이의 유충을 테스트하는 것이 바람직 할 수 있습니다.
요약하면, 우리는 zebrafish의 애벌레 몸통 근육의 최대 트 수축시 힘 생성을 측정하기위한 정량적하고 신뢰할 수있는 방법을 설명합니다. 이 방법은 zebrafish의 애벌레 근육의 전반적인 건강을 평가하는 데 특히 근육의 기능에 대한 정보를 제공 할 수 있습니다. 에 대한 정보를 제공 할뿐만 아니라힘 세대의 크기는,이 기술은 힘 세대의 동력학을 연구하는 22 개 피로 근육을 연구에 적용 할 수 있습니다. 우리는 야생 형 유충과 사용 방법을 설명하지만,이 방법은 근육 질병 모델의 특성 및 치료를 평가하거나, 근육 발달, 근육 부상 또는 공부를 위해 유전자 변형 유충 또는 약물이나 독성 물질로 치료 유충 사용할 수 있습니다 근육 관련 화학 물질의 독성.
공개
저자는 그들이 더 경쟁 재정적 이익이 없다는 것을 선언합니다.
감사의 말
저자는 제브라 피쉬 사육에 대한 지원은 안젤라 부스타 감사합니다. 이 작품은 국립 보건원 (AG-020591에 SVB와 JJD에 1K08AR054835)에 의해 지원되었다.
자료
| Name | Company | Catalog Number | Comments |
| REAGENTS | |||
| Tricaine powder | Sigma-Aldrich | A5040 | |
| Sodium chloride | Sigma-Aldrich | S7653 | |
| Potassium chloride | Sigma-Aldrich | P9541 | |
| Calcium chloride dihydrate | Sigma-Aldrich | 223506 | |
| Magnesium chloride hexahydrate | Sigma-Aldrich | M2670 | |
| Sodium phosphate monobasic | Sigma-Aldrich | S0751 | |
| Sodium bicarbonate | Sigma-Aldrich | S6297 | |
| Ethylenediaminetetraacetic acid disodium salt dihydrate | Sigma-Aldrich | E5134 | |
| EQUIPMENT | |||
| Nonsterile-suture | Ashaway Line Twine | S30002 | USP 10/0 monofilament nylon (3 ply) |
| Forceps | Fine Science Tools | 11251-20 | Dumont #5 |
| Spring scissors | Fine Science Tools | 15000-08 | Vannas |
| Stereo microscope | Leica Microsystems | MZ8 | Illuminated with Fostec EKE ACE I light source |
| Force transducer |  Aurora Scientific Aurora Scientific | 400A | |
| Length controller |  Aurora Scientific Aurora Scientific | 318B | |
| XYZ positioning devices | Parker Hannifin | 3936M | |
| Thermometer | Physitemp | BAT-12 | |
| Disposable transfer pipette | Fisher Scientific | 13-711-9AM | Cut end to widen opening and facilitate larva transfer |
| Petri dish | Fisher Scientific | 08-757-11YZ | |
| Glass pipette | Fisher Scientific | 13-678-8B | Cut end (and fire-polish) to widen opening and facilitate larva transfer |
| Inverted microscope | Carl Zeiss Microscopy | Axiovert 100 | |
| Water bath circulator | Neslab Instruments | RTE-111 | |
| Temperature controller | Alpha Omega Instruments | Series 800 | |
| Stimulator |  Aurora Scientific Aurora Scientific | 701C | High-power, follow stimulator |
| Video sarcomere length system |  Aurora Scientific Aurora Scientific | 900B-5A | |
| LabVIEW software | National Instruments | ||
| Oscilloscope | Nicolet Technologies | ACCURA 100 | |
| Microblade | Fine Science Tools | 10050-00 | |
| Microblade holder | Fine Science Tools | 10053-13 | |
| Data analysis software (Signo) | Alameda Applied Sciences | ||
참고문헌
- Bassett, D. I., Bryson-Richardson, R. J., Daggett, D. F., Gautier, P., Keenan, D. G., Currie, P. D. Dystrophin is required for the formation of stable muscle attachments in the zebrafish embryo. Development. 130 (23), 5851-5860 (2003).
- Nixon, S. J., Wegner, J., et al. Zebrafish as a model for caveolin-associated muscle disease; caveolin-3 is required for myofibril organization and muscle cell patterning. Hum. Mol. Genet. 14 (13), 1727-1743 (2005).
- Hall, T. E., Bryson-Richardson, R. J., et al. The zebrafish candyfloss mutant implicates extracellular matrix adhesion failure in laminin α2-deficient congenital muscular dystrophy. PNAS. 104 (17), 7092-7097 (2007).
- Hirata, H., Watanabe, T., et al. Zebrafish relatively relaxed mutants have a ryanodine receptor defect, show slow swimming and provide a model of multi-minicore disease. Development. 134, 2771-2781 (2007).
- Dowling, J. J., Vreede, A. P., et al. Loss of myotubularin function results in t-tubule disorganization in zebrafish and human myotubular myopathy. PLoS Genet. 5 (2), e1000372 (2009).
- Berger, J., Berger, S., Hall, T. E., Lieschke, G. J., Currie, P. D. Dystrophin-deficient zebrafish feature aspects of the Duchenne muscular dystrophy pathology. Neuromuscul. Disord. 20 (12), 826-832 (2010).
- Kawahara, G., Guyon, J. R., Nakamura, Y., Kunkel, L. M. Zebrafish models for human FKRP muscular dystrophies. Hum. Mol. Genet. 19 (4), 623-633 (2010).
- Wallace, L. M., Garwick, S. E., et al. DUX4, a candidate gene for facioscapulohumeral muscular dystrophy, causes p53-dependent myopathy in vivo. Ann. Neurol. 69, 540-552 (2011).
- Sztal, T. E., Sonntag, C., Hall, T. E., Currie, P. D. Epistatic dissection of laminin-receptor interactions in dystrophic zebrafish muscle. Hum. Mol. Genet. , (1093).
- Kawahara, G., Karpf, J. A., Myers, J. A., Alexander, M. S., Guyon, J. R., Kunkel, L. M. Drug screening in a zebrafish model of Duchenne muscular dystrophy. PNAS. 108 (13), 5331-5336 (2011).
- Berger, J., Berger, S., Jacoby, A. S., Wilton, S. D., Currie, P. D. Evaluation of exon-skipping strategies for Duchenne muscular dystrophy utilizing dystrophin-deficient zebrafish. J. Cell Mol. Med. 15 (12), 2643-2651 (2011).
- Seger, C., Hargrave, M., Wang, X., Chai, R. J., Elworthy, S., Ingham, P. W. Analysis of Pax7 expressing myogenic cells in zebrafish muscle development, injury, and models of disease. Dev. Dyn. 240, 2440-2451 (2011).
- Postel, R., Vakeel, P., Topczewski, J., Knöll, R., Bakkers, J. Zebrafish integrin-linked kinase is required in skeletal muscles for strengthening the integrin-ECM adhesion complex. Dev. Biol. 318 (1), 92-101 (2008).
- Zoeller, J. J., McQuillan, A., Whitelock, J., Ho, S. Y., Iozzo, R. V. A central function for perlecan in skeletal muscle and cardiovascular development. J. Cell Biol. 181 (2), 381-394 (2008).
- Kim, H. R., Ingham, P. W. The extracellular matrix protein TGFBI promotes myofibril bundling and muscle fibre growth in the zebrafish embryo. Dev. Dyn. 238, 56-65 (2009).
- Beqqali, A., Monshouwer-Kloots, J., et al. CHAP is a newly identified Z-disc protein essential for heart and skeletal muscle function. J. Cell Sci. 123 (7), 1141-1150 (2010).
- Huang, H., Huang, C., et al. Toxicity, uptake kinetics and behavior assessment in zebrafish embryos following exposure to perfluorooctanesulphonicacid (PFOS). Aquat. Toxicol. 98 (2), 139-147 (2010).
- Sylvain, N. J., Brewster, D. L., Ali, D. W. Zebrafish embryos exposed to alcohol undergo abnormal development of motor neurons and muscle fibers. Neurotoxicol. Teratol. 32 (4), 472-480 (2010).
- Chandrasekar, G., Arner, A., Kitambi, S. S., Dahlman-Wright, K., Andersson-Lendahl, M. Developmental toxicity of the environmental pollutant 4-nonylphenol in zebrafish. Neurotoxicol. Teratol. 33 (6), 752-764 (2011).
- Buss, R. R., Drapeau, P. Activation of embryonic red and white muscle fibers during fictive swimming in the developing zebrafish. J. Neurophysiol. 87 (3), 1244-1251 (2002).
- Telfer, W. R., Nelson, D. D., Waugh, T., Brooks, S. V., Dowling, J. J. neb: a zebrafish model of nemaline myopathy due to nebulin mutation. Dis Model Mech. 5, 389-396 (2012).
- Dowling, J. J., Arbogast, S., et al. Oxidative stress and successful antioxidant treatment in models of RYR1-related myopathy. Brain. 135 (4), 1115-1127 (2012).
- Dou, Y., Andersson-Lendahl, M., Arner, A. Structure and function of skeletal muscle in zebrafish early larvae. J. Gen. Physiol. 131, 445-453 (2008).
- Westerfield, M. . The zebrafish book: a guide for the laboratory use of zebrafish (Danio rerio). , (2000).
- Herr, V. D., Sonnenburg, D. C., Courogen, P. M., Fiamengo, S. A., Downes, H. Muscle weakness during tricaine anesthesia. Comp Biochem Physiol Part C. 110 (3), 289-296 (1995).
- Frazier, D. T., Narahashi, T. Tricaine (MS-222): effects of ionic conductances of squid axon membranes. Eur. J. Pharmacol. 33 (2), 313-317 (1975).
- Saint-Amant, L., Drapeau, P. Time course of the development of motor behaviors in the zebrafish embryo. J. Neurobiol. 37 (4), 622-632 (1998).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기더 많은 기사 탐색
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유