Method Article
Kraftmessung während der Kontraktion zu Muscle Funktion in Zebrafisch-Larven bewerten
In diesem Artikel
Zusammenfassung
Kraftmessungen können verwendet werden, um Veränderungen in Muskel-Funktion aufgrund der Entwicklung, Verletzungen, Krankheit, Behandlung oder chemische Toxizität nachzuweisen. In diesem Video zeigen wir eine Methode, um Kraft während einer maximalen Kontraktion des Zebrafisch-Larven Rumpfmuskulatur zu messen.
Zusammenfassung
Zebrafisch-Larven bieten Modelle der Entwicklung der Muskulatur, Muskel-Erkrankungen und Muskel-bezogene chemische Toxizität, aber verwandte Studien mangelt es häufig an funktionellen Maßnahmen der Muskel Gesundheit. In diesem Video-Artikel zeigen wir eine Methode zur Krafterzeugung während der Kontraktion des Zebrafisch-Larven Rumpfmuskulatur zu messen. Kraftmessungen werden, indem ein narkotisierten Larve in eine Kammer mit einer Salzlösung gefüllt erreicht. Das vordere Ende der Raupe wird mit einem Kraftaufnehmer verbunden und das hintere Ende der Raupe wird auf eine Länge Controller verbunden. Eine isometrische Zuckung Kontraktion wird durch ein elektrisches Feld Stimulation hervorgerufen und die Kraft Reaktion zur Analyse aufgezeichnet. Krafterzeugung während der Kontraktion ein Maß für die allgemeine Gesundheit und speziell Muskel liefert ein Maß für die Muskelfunktion. Obwohl wir diese Technik für den Einsatz mit dem Wildtyp-Larven zu beschreiben, kann dieses Verfahren mit gentechnisch veränderten oder Larven mit Larven mit Medikamenten oder Giftstoffen behandelt werden,zu Muskelerkrankung Modelle charakterisieren und bewerten Behandlungen oder Muskel-Entwicklung, Verletzungen oder chemische Toxizität zu untersuchen.
Einleitung
Junge Zebrafisch (Danio rerio) Larven, 3-7 Tage nach der Befruchtung (DPF), werden zunehmend als nützlich Organismus für Skelettmuskel Forschung anerkannt. Junge Larven Modell menschlichen Muskelerkrankung 1-9 verwendet werden, bewerten Arzneimittel und therapeutische Strategien 10-11, Studie Muskelverletzung 12, verstehen die Entwicklung der Muskulatur 13-16, und zu untersuchen, Muskel-verwandten chemischen Toxizität 17-19. Typische Studien in diesen Bereichen zu untersuchen, inwieweit die gesunden Muskel abnormal wird durch genetische Manipulation oder durch Einwirkung von Schadstoffen gemacht, und einige Studien zu untersuchen, inwieweit die abnorme Muskel auf die Behandlung anspricht. Entscheidend für den Erfolg dieser Studien ist die Fähigkeit, genau zu beurteilen Muskel Gesundheit.
Zwar gibt es eine Vielzahl von Methoden zur Verfügung, um Muskeln Gesundheit in Zebrafisch-Larven zu beurteilen sind, bieten nur wenige direkte Informationen über Muskelfunktion. Muscle Gesundheit wird in der Regel durch appearanc ausgewertete, wie durch histologische Färbung 6,8,11, Immunfärbung 9,15,16,18, Lichtmikroskopie 3,13, Elektronenmikroskopie 3,4,14,16 oder Doppelbrechung 7,9,11 beurteilen, aber diese Techniken bieten morphologische Information. Trunk und Schwanz Verschiebungen und Schwimmen Geschwindigkeit 4,17 auszuwerten Motorik, aber diese sind nicht direkt Maßnahmen der Muskelfunktion, da sie spiegeln auch neuronale Input, Energiestoffwechsel und andere Prozesse.
Im Gegensatz dazu messen Krafterzeugung während der Kontraktion eine direkte Beurteilung der Muskelfunktion und stellt ein Maß für die allgemeine Gesundheit Muskel. Hinzugefügt Vorteile dieses Ansatzes sind einfach Datenanalyse und quantitative Ergebnisse. In diesem Video-Artikel stellen wir ein detailliertes Verfahren zur Messung von Kraft Generation von Larven Muskeln, in der Hoffnung, dass mehr Forscher wird diese Methode verwenden, um bestehende Maßnahmen des Muskels Gesundheit in ihrer Forschung zu ergänzen.
Das übergeordnete Ziel dieser Methode ist es, Krafterzeugung während der Kontraktion des Zebrafisch-Larven Rumpfmuskulatur zu messen. Um dieses Ziel zu erreichen, ist ein Zebrafischlarve betäubt und in eine Kammer mit einer Salzlösung gefüllt ist. Das vordere Ende der Raupe wird mit einem Kraftaufnehmer verbunden und das hintere Ende der Raupe wird auf eine Länge Controller verbunden. Muscle Aktivierung wird durch das elektrische Feld Stimulation erreicht, und die Reizstrom und die Länge der Larven werden eingestellt, um maximale Zuckungskraft erzeugen. Eine isometrische Zuckung Kontraktion ausgelöst und die Kraft Reaktion zur Analyse aufgezeichnet.Um klar zu sein, diese Technik nicht zu messen Kräfte, die durch Larven Muskeln beim Schwimmen generiert. Da beide Enden der Larve zum Gerät gebunden und weil die Larve bleibt anästhesiert, kann es sich nicht in Bewegung während des Tests. Darüber hinaus aktiviert Feldstimulation alle Muskelfasern gleichzeitig eine bil induzierenateral Kontraktion, die nicht ist, was natürlich vorkommt 20. Deshalb, anstatt Messung des tatsächlichen Kräfte beim Schwimmen erzeugt, bestimmt dieser Technik die Kraft erzeugenden Fähigkeit der Larven Muskeln.
Wir haben diese Technik verwendet, um Muskelschwäche in einem Zebrafisch-Modell der Nemalin Myopathie 21, sowie um die Wirkung von antioxidativen Behandlung von Muskel-Funktion in einem Zebrafisch-Modell der multi-minicore Krankheit 22 bewerten demonstrieren. Andere haben eine ähnliche Technik 23, um die Auswirkungen eines Umweltschadstoff auf die Muskelfunktion 19 untersuchen eingesetzt.
Protokoll
Hinweis: Alle Verfahren, die Zebrafisch sollte in Übereinstimmung mit den einschlägigen Richtlinien, Vorschriften und Regulierungsbehörden durchgeführt werden. Alle tierischen Einsatz Verfahren in diesem Artikel gezeigt wurden von der University of Michigan Ausschuss für die Nutzung und Pflege der Tiere (UCUCA) zugelassen.
1. Als Naht Loops
- Verwenden einer Pinzette auf nicht-sterile Nahtmaterial (USP 10/0 Monofilament Nylon, 3-Schicht) in drei Stränge zu trennen.
- Fangen Sie an, einen doppelten Knoten in einem der Stränge binden. Stoppen Sie vor dem Anziehen der Knoten vollständig auf eine kleine (~ 1 mm Durchmesser)-Schleife anstelle von einem Knoten zu machen.
- Mit einer Schere, um überschüssiges Nahtmaterial aus der Schleife Schwänze abgeschnitten. Ein Beispiel für ein fertig Schleife in Abbildung 1 dargestellt.
- Legen Sie die Schleife auf der klebrigen Seite eines Post-it Note für die spätere Verwendung. Die Nahtschleifen wird verwendet, um die Larven in Kraft während Tests zu halten.
- Wiederholen Sie die Schritte 1.1-1.4 wie nötig. Make zwei Nahtschleifen für jede Larve, die getestet werden.
2. Als Testlösung
- Als Tyrodes-Lösung durch Zugabe von 7.977 g Natriumchlorid, 0,373 g Kaliumchlorid, 0,265 g Calciumchlorid-dihydrat, 0,102 g Magnesiumchlorid-Hexahydrat, 0,048 g Natriumdihydrogenphosphat, 1,000 g Natriumbicarbonat und 0,037 g Ethylendiamintetraessigsäure-Dinatriumsalz-Dihydrat in 1000 ml gereinigtes Wasser.
- Rühren Sie die Lösung bis die Salze vollständig gelöst sind. Diese Lösung kann für einen Monat bei 4 ° C gelagert werden
- In 2,1 ml 4 mg / ml Tricaine, hergestellt nach dem Zebrafisch Buch 24, auf 47,9 ml Tyrodes Lösung und mischen. Schützen Sie diese Lösung vor Licht, indem sie in einer dunklen Glasflasche oder in einer Glasflasche mit Aluminiumfolie abgedeckt. Diese Lösung sollte bei Raumtemperatur gelagert werden und machte jeden Tag frisch.
3. Tie Aanesthetized Larve in Experimental Kammer
- Legen Sie das Prüfgerät (Abbildung 2) auf der Bühne eines Stereo-Mikroskop.
- Verbinden Sie den Kraftaufnehmer und Länge Controller Kabel an das Prüfgerät. Schalten Sie den Kraftaufnehmer. Schalten Sie den Controller Länge, so dass es starr bleibt. (Hinweis:.. Die Länge Steuerung bietet die Möglichkeit, sich zu strecken oder verkürzen Muskel-Präparat während einer Kontraktion jedoch dieses Merkmal der Länge Controller nicht in dem hier beschriebenen Verfahren verwendet daher kann die Länge der Controller als starre Verbindung angesehen werden Punkt montiert auf ein XYZ positioning system).
- Mit einem Einweg Transferpipette, füllen Sie den experimentellen Kammer mit Testlösung.
- Verwenden einer Pinzette zu holen ein Fadenschleife von einem der Schwänze und hängen Sie es an der Kraft Schallwandlerrohr. Hängen Sie einen zweiten Fadenschleife auf dem Rohr an der Länge Controller. (Hinweis: Greifen eines Fadenschleife auf dem gekrümmten Teil kann knicken die Naht und cause es während der nachfolgenden Schritte zu brechen).
- Mit einem Einweg-Übertragung abpipettiert, eine Zebrafischlarve einer kleinen Petrischale mit Testlösung gefüllt. Warten, bis die Betäubung in der Testlösung (Tricaine) wirksam (~ 1 min) zu nehmen. Mit einer Pinzette vorsichtig schubsen den Schwanz und sicherstellen, dass die Larve betäubt durch einen Mangel an Berührung-evozierte Schwimmen ist.
- Verwenden Sie eine Glaspipette, die Larve der experimentellen Kammer übertragen.
- Durch leichtes Antippen des Larve mit geschlossenen Pinzette, führen den vorderen Teil der Larve durch die Fadenschleife am Kraftaufnehmer Rohr. Führen des vorderen Teils der Larven durch die Fadenschleife auf dem Schlauch. Fassen Sie beide Fadenschleife Schwänze mit Zange und ziehen Sie gleichzeitig die Fadenschleife hinter dem Dottersack oder Schwimmblase (3A) anziehen.
- Mit einer Pinzette, halten eine Fadenschleife Schwanz und ziehen, wodurch die Larven bis 90 ° um das Rohr drehen, bis der lateralen Seite der Larve Gesichts bis (3B). Wenn die Schleife genug angezogen wurde, wird es einige Widerstand gegen den Zug sein, die Larve nicht leicht schwenken. Wenn die Schleife zu fest angezogen wurde, wird die Larve nicht um das Rohr schwenken.
- Mit dem XYZ-Positioniereinrichtung, die an der Länge Controller, bewegen die Länge Controller Rohr entlang der X-Achse (Achse Definitionen in 2A) und unter dem Rumpf und Schwanz der Larve. Lassen Sie Platz zwischen den Enden der Länge Controller Rohr und der Kraft Schallwandlerrohr.
- Führen Sie den Fadenschleife über den Schwanz der Larve und ziehen Sie die Fadenschleife wie zuvor beschrieben (3C). Möglicherweise müssen Sie den hinteren Teil der Larve schwenken, so dass die seitlichen nach oben zeigt. Schneiden Sie die Fadenschleife Schwänze (3D).
4. Position Larve in Experimental Kammer
- Bewegen Sie die Larve zu einem angemessenen Abstand vom Boden der Kammer, um die Larven zu gewährleisten wkrank im "working distance" von einem inversen Mikroskop objektiv zu sein während der nachfolgenden Schritte. Um dies zu erreichen, verwenden Sie die XYZ-Positionierung Geräte langsam senken die Rohre (mit angeschlossenem Larve) entlang der Z-Achse, bis die Rohre gerade berühren den Boden der Kammer. Dann heben Sie die Rohre bis die Larve ist ein angemessener Abstand vom Boden der Kammer (~ 100 um).
- Mit dem XYZ-Positioniereinrichtung, die an der Länge Controller die Länge Controller Rohr entlang der Y-Achse, um die lange Achse der Larve, wobei die Längsachse des Kraftaufnehmers Rohr auszurichten.
5. Nimm Kraft während einer maximalen Kontraktion Twitch
- Bewegen der Prüfvorrichtung auf die Bühne eines umgekehrten Mikroskops.
- Einstellen der Temperatur der Kammer auf einen gewünschten Wert. Um zu beginnen, verbinden Sie das Wasserbad Thermostat, Thermometer und Temperaturregler auf der Prüfeinrichtung. Schalten Sie die notwendigen Komponenten und die Einstellung der Temperatur controller, bis das Thermometer meldet den gewünschten Wert ein. Die in diesem Artikel aufgenommen wurden bei 25 ° C gesammelt, aber Messungen können auch bei Raumtemperatur oder bei 28,5 ° C durchgeführt werden
- Schließen Sie die Kabel aus dem Stimulator der Prüfeinrichtung. Schalten Sie das Gerät an den Stimulator aber nicht stimulieren die Larve bis Schritt 5.6.
- Achten Sie darauf, die Larve ist parallel zum Boden der Kammer. Durch eine 40X-Objektiv, kommen den Teil des Larven zwischen den Enden der Rohre. Wenn parallel zum Boden, werden beide Enden der Larve in den Mittelpunkt rücken. Falls erforderlich, passen Sie die Kraft Schallwandlerrohr entlang der Z-Achse, bis beide Enden im Fokus sind.
- Überprüfen Sie, dass die Larve kürzer als optimal ist. Das Videogerät Sarkomerlänge und drehen die Videokamera, so dass die Rillen parallel zu den Seiten des Videobildes sind. Dieses System überwacht Streifung Abstand durch Analysieren Variationen in Pixelintensität entlang jeder horizontalen Reihe von Pixeln innerhalb einer benutzerdefinierten Region von Interesse(ROI). Die Ergebnisse für alle Zeilen innerhalb der ROI werden gemittelt und mit einer Frequenz äquivalent zu der Video-Frame-Rate (≥ 80 sec -1). Die Streifenbildung Abstand wird als Indikator für Sarkomerlänge verwendet.
- Stellen Sie das Mikroskop auf die peripheren Fasern konzentrieren und beachten Sie die angegebenen Sarkomerlänge. Falls erforderlich, verwenden Sie die XYZ Positionierung Gerät, das an der Länge Controller Länge der Larve einstellen (X-Achse), bis die Sarkomerlänge weniger als optimal ist (z. B. 1,90 um).
- Stellen Sie die Reizstrom zu Zuckungskraft optimieren. Um zu beginnen, stellen Sie den Ausgangsstrom auf der Stimulator auf einen niedrigen Betrag (zB 100 mA). Der Stimulator kann manuell oder von einem Computer läuft eine benutzerdefinierte LabVIEW-Programm ausgelöst werden. Elicit ein Zucken der Muskeln Larven mit einem Stromimpuls von 0,2 ms Dauer.
- Verwenden Sie ein Oszilloskop, um die Kraft Ausgang erfassen und messen die Spitze Zuckungskraft Verwendung des Oszilloskops Cursor. Erhöhen Sie den Stromvon 50 mA-Schritten und messen Sie den Gipfel Zuckungskraft an jedem aktuellen Niveau. Warten Sie 30 Sek. zwischen zuckt zur Ermüdung zu verhindern. Wie Reizstrom erhöht, Peak Zuckungskraft erhöht typischerweise zu einem Maximum und nimmt dann allmählich ab. Der Strom, bei dem die Larve erzeugt die größte Kraft ist die optimale Reizstrom. Stellen Sie die aktuelle Amplitude der optimalen Reizstrom.
- Mit dem XYZ Positionierung Gerät, muss die Länge der Larve (und damit Sarkomerlänge), um eine maximale Zuckungskraft entlocken. Wildtyp-Zebrafisch-Larven (3-7 dpf) erzeugen maximale Zuckungskraft bei Sarkomers Längen von 2,10 um oder 2,15 um. Jedoch kann die Sarkomerlänge bis 2,08 um eingestellt werden, um übermäßige Belastung auf die Larven zu verhindern.
- Elicit ein Zucken der Muskeln Larven. Verwenden Sie das Oszilloskop, um die Kraft Reaktion aufzeichnen und speichern den Datensatz für die spätere Analyse.
6. Messen Muskulatur Maße mit Larve bei Optimal Länge
- Bewegen Sie den Testgerät zurück an den Stereo-Mikroskop.
- Mit dem Okular Maßstab messen die Höhe der Muskulatur von der Seite betrachtet wird. Dann kümmert sich nicht um die Länge der Larve zu ändern, schwenken die Larve von 90 ° mit den Fadenschleife Schwänze um die Larve aus dem Boden zu sehen. Die Breite der Muskulatur von der Unterseite gesehen. Nehmen Sie die Messungen an einer anatomischen Landmarke (zB urogenitalen Öffnung) (Abbildung 4).
- Schneiden Sie die Naht mit einem Schleifen Mikroklinge die Larve aus der Prüfgeräte freizugeben.
Ergebnisse
Bei gesunden Wildtyp-Zebrafisch-Larven sollten die Muskelfasern parallel zueinander ohne große Lücken zwischen ihnen und haben offensichtlich Rillen (5A). Wildtyp-Zebrafisch-Larven, die nicht zeigen diese Merkmale oder mit offensichtlicher Schäden wie freistehende Fasern (5B), muss verworfen werden.
Eine repräsentative Darstellung von Peak Zuckungskraft gegenüber Reizstrom für eine einzelne Zebrafischlarve ist in Abbildung 6 dargestellt. Für Wildtyp-Zebrafisch-Larven zwischen 3-7 dpf, ist die optimale Reizstrom typischerweise zwischen 400-600 mA, mit 3 dpf Larven erfordert im Allgemeinen größer als 6-7 Reizstrom dpf Larven.
Die rohen Kraft Daten (gesammelt in Schritt 5.8) muss verarbeitet und analysiert werden mit Daten-Analyse-Software. Zuerst wird die Grundlinie der Kraft Aufzeichnung auf Null gesetzt. Zweitens wird die Ausgangsspannung des Kraftaufnehmers umgewandelt zu zwingen (mN) (siehe Herstellerangaben eine Kalibrationskurve für den Kraftaufnehmer zu erzeugen). Eine repräsentative Kraft Reaktion während einer maximalen Kontraktion Zucken einer einzigen Larve gesammelt wird in Abbildung 7 gezeigt. Datenanalyse-Software kann zur Spitzenkraft und andere Merkmale der Kraft Reaktion zu messen.
Eine repräsentative Gruppe von Spitzenkraft Daten von maximal zucken Kontraktionen wird in 8A gezeigt. Typische peak Zuckungskraft Werte für Wildtyp-Larven 3-7 dpf Bereich von 0,9 bis 1,7 mN, mit älteren Larven erzeugen mehr Kraft als jüngere Larven. Unterschiede in der Spitze Zuckungskraft kann durch normale Prozesse wie Wachstum und Entwicklung (Abbildung 8) oder krankhafte Prozesse wie Gen-Mutation-Pathologie 21,22.
Normalisierung durch Muskel Querschnittsfläche (CSA) kann verwendet werden, um den Grad der Unterschiede in Spitzenzeiten Zuckungskraft sind einfach aufgrund differe bestimmen nces in der Größe der Muskulatur 21,22. Muskel CSA geschätzt werden nach der Formel: CSA = π (A / 2) (B / 2), wobei A die Höhe der Muskulatur als von der Seite betrachtet, ist B die Breite der Muskulatur als sie von unten betrachtet, und einen elliptischen Querschnitt ausgegangen. Typische Werte für CSA Wildtyp-Larven 3-7 dpf Bereich von 0,027 bis 0,034 mm 2, mit 3-4 dpf Larven allgemein zeigt kleinere Werte CSA als 5-7 dpf Larven. Eine repräsentative Gruppe von normierten Spitzenkraft Daten von maximal zucken Kontraktionen wird in 8B gezeigt. Typische normierten Peak Zuckungskraft Werte für Wildtyp-Larven 3-7 dpf Bereich von 34 bis 51 mN / mm 2, mit 4-7 dpf Larven die allgemein größere Werte als 3 dpf Larven.

Abbildung 1. Fadenschleife. Pfeile zeigen auf die Fadenschleife Schwänze.

Abbildung 2. (A) Prüfgerät mit markierten Komponenten. (B) Close-up Blick auf den experimentellen Kammer. (A) Experimentelle Kammer mit transparentem Boden. (B) Kraftaufnehmer. (C) Länge Controller. (D) XYZ Positionierung Geräte. Die X-, Y-und Z-Achsen sind in der oberen rechten Ecke definiert. (E) Temperatur-Regelsystem Verwendung thermoelektrischen Modulen. Tubing nimmt weniger Wasser zur Kühlung von thermoelektrischen Modulen. (F) Edelstahl-Rohr an Wandler erzwingen. (G) Edelstahl-Rohr auf Länge Controller angeschlossen. (H) Thermometer Mikrosonde. (I) Platinum parallel Platte Elektroden, über die Länge der dieKammer. Platin-Platten sind 2,5 mm hoch und 0.255 mm dick.
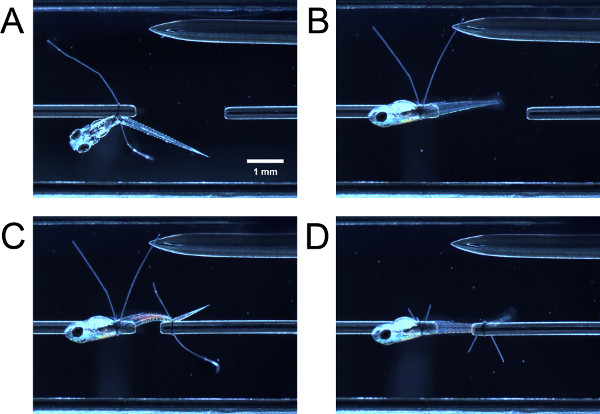
Abbildung 3. Binden Larve in experimentelle Kammer. (A) bei Larve auf vorderen Ende gebunden, aber noch nicht 90 ° schwenkbar. (B) Larve nach geschwenkten 90 °. (C) gebunden Larve auf an hinteren Ende, aber noch nicht geschwenkt. (D) Larve nach geschwenkten und Fadenschleife Schwänze werden abgeschnitten.
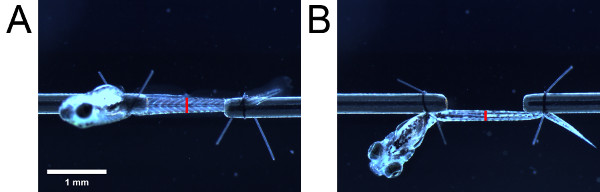
Abbildung 4. Messungen zur Querschnittsfläche Schätzung. Muskulatur wie aus dem (A) Seite gesehen und (B) Boden. Platzierung der roten Balken zeigen die Position der urogenitalen Öffnung. Die Länge der roten Balken geben die Höhe und Breite der Muskulatur, von der Seite und unten jeweils angesehen.
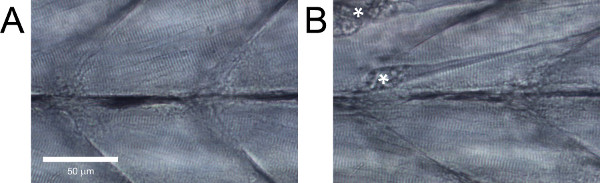
Abbildung 5. Seitliche Ansicht Zebrafischlarven Rumpfmuskulatur. (A) Gesundes Gewebe. (B) Tissue mit offensichtlichem Schaden. Kontrakturen aus Faser Abteilungen sind mit einem Stern markiert.
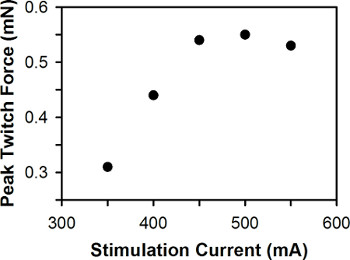
Abbildung 6. Repräsentative Grundstück von Peak Zuckungskraft gegenüber Reizstrom. Die optimale Reizstrom beträgt 500 mA.
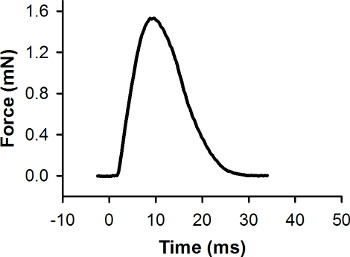
Abbildung 7. Repräsentative Kraft Rekord für eine einzelne Zuckung Kontraktion. Diese Kontraktion wurde mit einem Reizimpuls bei 0 ms ausgelöst. Die Spitzenkraft ist 1,56 mN.
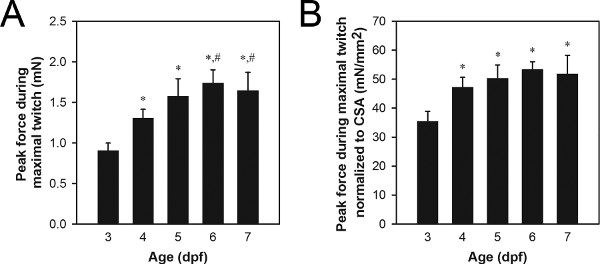
Abbildung 8. Repräsentative Kraftdaten 3-7 dpf Larven. (A) Spitzenkraft Daten von maximal zucken Kontraktionen. (B) Spitzenkraft Daten von maximal zucken Kontraktionen CSA normalisiert. Ältere Larven (6-7 dpf) gefüttert wurden Hatchfry Encapsulon Grade 0 mit Spirulina (Argent Laboratories) ab 5 dpf. Means + Standardabweichungen sind mit N = 5 in jeder Gruppe berichtet. Gruppen signifikant verschieden von 3 dpf Larven (*) und 4 dpf Larven (#) angegeben (ANOVA, P <0,05). Der deutliche Anstieg der normierten Kraft zwischen 3 und 4 dpf (B) zeigt einen Anstieg in der intrinsischen erzeugende Fähigkeit während dieser Zeit, während der Anstieg in Kraft, die zwischen 4 und 6-7 dpf (A) ist das Wachstum auf der Grundlage nicht zugeschrieben ändern 4-7 dpf in normalisierten Kraft.
Diskussion
Diese Methode misst Krafterzeugung während einer zuckenden Muskel Funktion in der Rumpfmuskulatur Zebrafischlarven beurteilen. Obwohl tetanische Kontraktionen können in Zebrafisch-Larven hervorgerufen werden (z. B. durch 200 Stimulationspulse / sec für eine Dauer von 0,2 sec), ist die maximale tetanische Kraft nur 10-15% größer als die maximale Zuckungskraft. Deshalb ist die Kraft, die während einer Zuckung erzeugt ein gewisses Maß an Kraft erzeugende Fähigkeit. Twitches werden über tetanische Kontraktionen bevorzugt, da zuckt weniger wahrscheinlich zu verursachen Rippen oder Abrutschen an den Naht Bindungen sind.
Um aussagekräftige Daten mit dieser Technik zu erzeugen, sollte maximal Zuckungskraft für jede Larve erreicht werden und die Variabilität zwischen den experimentellen Gruppen sollte minimiert werden. Mit diesen Zielen vor Augen, bieten wir die folgenden Vorschläge. Erstens, achten Sie bei der Bindung der Larve auf den Kraftaufnehmer und die Länge Controller Röhren. Wenn die Nahtschleifen sind zu fest angezogenviel, wird der Faden durch das Muskelgewebe zu schneiden. Wenn die Naht Schleifen nicht fest genug angezogen, wird die Kraft, die von den Larven erzeugt wird, nicht vollständig auf den Kraftaufnehmer übertragen. Beide Situationen, vor allem aber die letzteren, unterschätzen maximale Zuckungskraft. Zweitens kann, da die Prüfung mehrerer experimentellen Gruppen mehrere Stunden dauern (20-30 min / Larve), wechseln zwischen Gruppen, weil Larven werden weiterhin während der Testphase zu entwickeln.
Während einige der genannten Geräte ist wichtig für die Messung der maximalen Zuckungskraft (zB Kraftaufnehmer aktuellen Stimulator), sind andere Elemente nicht unbedingt notwendig. Das Video Sarkomerlänge System ist wünschenswert, aber nicht erforderlich. Alternativ kann eine Reihe von Zuckungen verwendet, um eine optimale Länge, wobei die Länge der Larve eingestellt, bis maximal Zuckungskraft erreicht wird, zu finden. Temperatur-Steuersystem ist auch nicht zwingend erforderlich. Temperaturregelung ist kritisch, wenn meaSuring zucken Kinetik, die sehr empfindlich auf Temperatur sind, während maximal Zuckungskraft ist nicht besonders empfindlich auf kleine Änderungen in der Temperatur und konnte bei Raumtemperatur gemessen werden. Beachten Sie, dass unabhängig von der Temperatur in der Kammer während der Kraftmessungen die Larven in der optimalen Wachstumstemperatur von 28,5 ° C aufrechterhalten 24 vor, um zu erzwingen Tests zur genauen Staging.
Die Larven werden in einer Lösung, die Tyrodes Tricaine getestet. Wir verwenden 0,02% (w / v) Tricaine, die Konzentration für Anästhesie 24 empfohlen, spontane Kontraktionen durch das Nervensystem hervorgerufen zu beseitigen und somit die Ermüdung während Kraft-Tests. Tricaine erleichtert auch die tie-on Schritt und reduziert die Gesamtkosten Testzeit. Allerdings beobachten wir, dass auch in der Tricaine Testlösung konsequent reduziert die maximale Zuckungskraft um ca. 30%. Ein ähnlicher Effekt ist auch in Kaulquappenschwanzes Muskel beobachtet worden, wo tricaine Kraft reduziert Generation nach neuromuskuläre Übertragung blockiert wurde, was darauf hindeutet, dass Tricaine eine direkte Wirkung auf Muskel-25 hat. Tricaine kann Muskelzelle Erregbarkeit indem Natriumleitfähigkeit durch die Zellmembran zu reduzieren, wie es in Nervenzellen 26 tut. Weitere Optionen zum Blockieren Aktivierung durch Motoneuronen sind d-Tubocurarin und α-Bungarotoxin aber im Gegensatz Tricaine sind diese Verbindungen nicht hautpermeable und muss direkt in den Kopf, Rückenmark, Herz oder 27 injiziert werden. Einzelne Forscher müssen beurteilen, ob Tricaine wünschenswert für ihre spezifische Anwendung ist. Wenn Tricaine in der Testing-Lösung enthalten ist, sollte die Konzentration im Einklang zwischen den Experimenten und Forscher sollten sicherstellen, dass die Wirkung der Tricaine nicht zwischen experimentellen Gruppen variieren.
Wir beschreiben diese Methode für Larven so jung wie 3 dpf und so alt wie die 7 dpf. Obwohl Muskelfasern scheinen fu seinnctional so früh wie 17 Stunden nach der Befruchtung, wenn spontane Bewegungen Schwanz 27, die kurze Länge des Schwanzes beginnen vor 3 dpf behindert binden die Larve der Prüfeinrichtungen. Wir in der Regel nicht testen Larve nach 7 dpf da viele Krankheiten Modelle nicht überleben viel länger als diese Zeit. Wird die Prüfung Larven über 5 dpf, sollte die Larven gefüttert werden. Wir haben beobachtet, dass Larven unfed kleineren Muskeln haben und erzeugen weniger maximale Zuckungskraft als fed Larven, wahrscheinlich aufgrund der abnehmenden Dottersack. So kann es wünschenswert sein, Larven zwischen 3-5 dpf testen, um die zusätzliche variable externe Zufuhr zu vermeiden.
Zusammenfassend beschreiben wir eine quantitative und zuverlässige Methode zur Messung von Kraft Generation während einer maximalen Kontraktion zucken Zebrafisch Larven Rumpfmuskulatur. Diese Methode kann verwendet werden, um die allgemeine Gesundheit der Zebrafisch Larven Muskel beurteilen und gezielt informiert über Muskelfunktion. Neben der Bereitstellung von Informationen über dieGröße der Kraft Generation kann diese Technik verwendet, um die Kinetik der Kraftentwicklung studieren oder angepasst, um Muskelermüdung 22 studieren werden. Obwohl wir diese Technik für den Einsatz mit dem Wildtyp-Larven zu beschreiben, kann diese Methode für genetisch veränderte oder für Larven Larven mit Medikamenten oder Giftstoffen behandelt werden, um Muskelerkrankung Modelle charakterisieren und bewerten Behandlungen oder die Entwicklung der Muskulatur, Muskel-Verletzungen, oder studieren Muskel-verwandten chemischen Toxizität.
Offenlegungen
Die Autoren erklären, dass sie keine finanziellen Interessen haben.
Danksagungen
Die Autoren danken Angela Busta für die Unterstützung bei Zebrafisch Tierhaltung. Diese Arbeit wurde von den National Institutes of Health (AG-020591 zum SVB und 1K08AR054835 zu JJD) unterstützt.
Materialien
| Name | Company | Catalog Number | Comments |
| REAGENTS | |||
| Tricaine powder | Sigma-Aldrich | A5040 | |
| Sodium chloride | Sigma-Aldrich | S7653 | |
| Potassium chloride | Sigma-Aldrich | P9541 | |
| Calcium chloride dihydrate | Sigma-Aldrich | 223506 | |
| Magnesium chloride hexahydrate | Sigma-Aldrich | M2670 | |
| Sodium phosphate monobasic | Sigma-Aldrich | S0751 | |
| Sodium bicarbonate | Sigma-Aldrich | S6297 | |
| Ethylenediaminetetraacetic acid disodium salt dihydrate | Sigma-Aldrich | E5134 | |
| EQUIPMENT | |||
| Nonsterile-suture | Ashaway Line Twine | S30002 | USP 10/0 monofilament nylon (3 ply) |
| Forceps | Fine Science Tools | 11251-20 | Dumont #5 |
| Spring scissors | Fine Science Tools | 15000-08 | Vannas |
| Stereo microscope | Leica Microsystems | MZ8 | Illuminated with Fostec EKE ACE I light source |
| Force transducer |  Aurora Scientific Aurora Scientific | 400A | |
| Length controller |  Aurora Scientific Aurora Scientific | 318B | |
| XYZ positioning devices | Parker Hannifin | 3936M | |
| Thermometer | Physitemp | BAT-12 | |
| Disposable transfer pipette | Fisher Scientific | 13-711-9AM | Cut end to widen opening and facilitate larva transfer |
| Petri dish | Fisher Scientific | 08-757-11YZ | |
| Glass pipette | Fisher Scientific | 13-678-8B | Cut end (and fire-polish) to widen opening and facilitate larva transfer |
| Inverted microscope | Carl Zeiss Microscopy | Axiovert 100 | |
| Water bath circulator | Neslab Instruments | RTE-111 | |
| Temperature controller | Alpha Omega Instruments | Series 800 | |
| Stimulator |  Aurora Scientific Aurora Scientific | 701C | High-power, follow stimulator |
| Video sarcomere length system |  Aurora Scientific Aurora Scientific | 900B-5A | |
| LabVIEW software | National Instruments | ||
| Oscilloscope | Nicolet Technologies | ACCURA 100 | |
| Microblade | Fine Science Tools | 10050-00 | |
| Microblade holder | Fine Science Tools | 10053-13 | |
| Data analysis software (Signo) | Alameda Applied Sciences | ||
Referenzen
- Bassett, D. I., Bryson-Richardson, R. J., Daggett, D. F., Gautier, P., Keenan, D. G., Currie, P. D. Dystrophin is required for the formation of stable muscle attachments in the zebrafish embryo. Development. 130 (23), 5851-5860 (2003).
- Nixon, S. J., Wegner, J., et al. Zebrafish as a model for caveolin-associated muscle disease; caveolin-3 is required for myofibril organization and muscle cell patterning. Hum. Mol. Genet. 14 (13), 1727-1743 (2005).
- Hall, T. E., Bryson-Richardson, R. J., et al. The zebrafish candyfloss mutant implicates extracellular matrix adhesion failure in laminin α2-deficient congenital muscular dystrophy. PNAS. 104 (17), 7092-7097 (2007).
- Hirata, H., Watanabe, T., et al. Zebrafish relatively relaxed mutants have a ryanodine receptor defect, show slow swimming and provide a model of multi-minicore disease. Development. 134, 2771-2781 (2007).
- Dowling, J. J., Vreede, A. P., et al. Loss of myotubularin function results in t-tubule disorganization in zebrafish and human myotubular myopathy. PLoS Genet. 5 (2), e1000372 (2009).
- Berger, J., Berger, S., Hall, T. E., Lieschke, G. J., Currie, P. D. Dystrophin-deficient zebrafish feature aspects of the Duchenne muscular dystrophy pathology. Neuromuscul. Disord. 20 (12), 826-832 (2010).
- Kawahara, G., Guyon, J. R., Nakamura, Y., Kunkel, L. M. Zebrafish models for human FKRP muscular dystrophies. Hum. Mol. Genet. 19 (4), 623-633 (2010).
- Wallace, L. M., Garwick, S. E., et al. DUX4, a candidate gene for facioscapulohumeral muscular dystrophy, causes p53-dependent myopathy in vivo. Ann. Neurol. 69, 540-552 (2011).
- Sztal, T. E., Sonntag, C., Hall, T. E., Currie, P. D. Epistatic dissection of laminin-receptor interactions in dystrophic zebrafish muscle. Hum. Mol. Genet. , (1093).
- Kawahara, G., Karpf, J. A., Myers, J. A., Alexander, M. S., Guyon, J. R., Kunkel, L. M. Drug screening in a zebrafish model of Duchenne muscular dystrophy. PNAS. 108 (13), 5331-5336 (2011).
- Berger, J., Berger, S., Jacoby, A. S., Wilton, S. D., Currie, P. D. Evaluation of exon-skipping strategies for Duchenne muscular dystrophy utilizing dystrophin-deficient zebrafish. J. Cell Mol. Med. 15 (12), 2643-2651 (2011).
- Seger, C., Hargrave, M., Wang, X., Chai, R. J., Elworthy, S., Ingham, P. W. Analysis of Pax7 expressing myogenic cells in zebrafish muscle development, injury, and models of disease. Dev. Dyn. 240, 2440-2451 (2011).
- Postel, R., Vakeel, P., Topczewski, J., Knöll, R., Bakkers, J. Zebrafish integrin-linked kinase is required in skeletal muscles for strengthening the integrin-ECM adhesion complex. Dev. Biol. 318 (1), 92-101 (2008).
- Zoeller, J. J., McQuillan, A., Whitelock, J., Ho, S. Y., Iozzo, R. V. A central function for perlecan in skeletal muscle and cardiovascular development. J. Cell Biol. 181 (2), 381-394 (2008).
- Kim, H. R., Ingham, P. W. The extracellular matrix protein TGFBI promotes myofibril bundling and muscle fibre growth in the zebrafish embryo. Dev. Dyn. 238, 56-65 (2009).
- Beqqali, A., Monshouwer-Kloots, J., et al. CHAP is a newly identified Z-disc protein essential for heart and skeletal muscle function. J. Cell Sci. 123 (7), 1141-1150 (2010).
- Huang, H., Huang, C., et al. Toxicity, uptake kinetics and behavior assessment in zebrafish embryos following exposure to perfluorooctanesulphonicacid (PFOS). Aquat. Toxicol. 98 (2), 139-147 (2010).
- Sylvain, N. J., Brewster, D. L., Ali, D. W. Zebrafish embryos exposed to alcohol undergo abnormal development of motor neurons and muscle fibers. Neurotoxicol. Teratol. 32 (4), 472-480 (2010).
- Chandrasekar, G., Arner, A., Kitambi, S. S., Dahlman-Wright, K., Andersson-Lendahl, M. Developmental toxicity of the environmental pollutant 4-nonylphenol in zebrafish. Neurotoxicol. Teratol. 33 (6), 752-764 (2011).
- Buss, R. R., Drapeau, P. Activation of embryonic red and white muscle fibers during fictive swimming in the developing zebrafish. J. Neurophysiol. 87 (3), 1244-1251 (2002).
- Telfer, W. R., Nelson, D. D., Waugh, T., Brooks, S. V., Dowling, J. J. neb: a zebrafish model of nemaline myopathy due to nebulin mutation. Dis Model Mech. 5, 389-396 (2012).
- Dowling, J. J., Arbogast, S., et al. Oxidative stress and successful antioxidant treatment in models of RYR1-related myopathy. Brain. 135 (4), 1115-1127 (2012).
- Dou, Y., Andersson-Lendahl, M., Arner, A. Structure and function of skeletal muscle in zebrafish early larvae. J. Gen. Physiol. 131, 445-453 (2008).
- Westerfield, M. . The zebrafish book: a guide for the laboratory use of zebrafish (Danio rerio). , (2000).
- Herr, V. D., Sonnenburg, D. C., Courogen, P. M., Fiamengo, S. A., Downes, H. Muscle weakness during tricaine anesthesia. Comp Biochem Physiol Part C. 110 (3), 289-296 (1995).
- Frazier, D. T., Narahashi, T. Tricaine (MS-222): effects of ionic conductances of squid axon membranes. Eur. J. Pharmacol. 33 (2), 313-317 (1975).
- Saint-Amant, L., Drapeau, P. Time course of the development of motor behaviors in the zebrafish embryo. J. Neurobiol. 37 (4), 622-632 (1998).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten