Method Article
Misura della forza durante la contrazione per valutare la funzione muscolare in larve Zebrafish
In questo articolo
Riepilogo
Misure di forza possono essere utilizzati per dimostrare i cambiamenti nella funzione muscolare a causa di sviluppo, infortunio, malattia, trattamento o tossicità chimica. In questo video, dimostriamo un metodo per misurare la forza durante una contrazione massimale di zebrafish muscolare tronco larvale.
Abstract
Larve di zebrafish fornire modelli di sviluppo muscolare, malattie muscolari e correlata muscolare tossicità chimica, ma gli studi relativi spesso mancano di misure funzionali di salute dei muscoli. In questo articolo il video, si dimostra un metodo per misurare la generazione di forza durante la contrazione dei muscoli del tronco zebrafish larvale. Misure di forza sono realizzate ponendo una larva anestetizzato in una camera riempita con una soluzione salina. L'estremità anteriore della larva è legato a un trasduttore di forza e l'estremità posteriore della larva è legato a un regolatore di lunghezza. Una contrazione contrazione isometrica è sollecitata da stimolazione del campo elettrico e la forza di reazione viene registrata per l'analisi. Generazione di forza durante la contrazione fornisce una misura della salute muscolare generale e specifico fornisce una misura della funzione muscolare. Sebbene si descrive questa tecnica per l'utilizzo con wild-type larve, questo metodo può essere utilizzato con larve geneticamente modificati o da larve trattate con farmaci o sostanze tossiche,per caratterizzare modelli di malattia del muscolo e valutare i trattamenti, o per studiare lo sviluppo muscolare, lesioni o tossicità chimica.
Introduzione
Giovane pesce zebra (Danio rerio) larve, 3-7 giorni dopo la fecondazione (DPF), sono sempre più riconosciuto come un organismo utile per la ricerca del muscolo scheletrico. Giovani larve sono utilizzati per modello di malattia muscolare umana 1-9, valutare i farmaci e strategie terapeutiche 10-11, lesioni muscolo studio 12, comprendere lo sviluppo muscolare 13-16, e indagare muscolare correlata tossicità chimica 17-19. Studi tipiche in queste aree esaminare il grado in cui muscolo sano è resa anomala da manipolazione genetica o l'esposizione a sostanze tossiche, e alcuni studi esaminare il grado in cui muscolare anormale risponde al trattamento. Fondamentale per il successo di questi studi è la capacità di valutare con precisione la salute dei muscoli.
Mentre ci sono una varietà di metodi disponibili per valutare la salute del muscolo in larve di pesce zebra, alcuni forniscono informazioni dirette sulla funzione muscolare. La salute dei muscoli è di solito valutata appearance, come valutato mediante colorazione istologica 6,8,11, immunoistochimica 9,15,16,18, microscopia ottica 3,13, microscopia elettronica 3,4,14,16 o birifrangenza 7,9,11, ma queste tecniche forniscono informazioni morfologiche solo. Tronco e spostamenti di coda e il nuoto di velocità 4,17 valutare la funzione motoria, ma queste non sono misure dirette della funzione muscolare in quanto riflettono anche l'input neurale, il metabolismo energetico, e di altri processi.
In contrasto, misurando generazione della forza durante la contrazione fornisce una valutazione diretta della funzione muscolare e rappresenta una misura di salute muscolare generale. Aggiunto vantaggi di questo approccio includono l'analisi dei dati semplice e risultati quantitativi. In questo articolo video, mettiamo a disposizione una procedura dettagliata per la misurazione della generazione di forza dai muscoli larvali, nella speranza che altri ricercatori useranno questo metodo per integrare le misure esistenti di salute dei muscoli nella loro ricerca.
L'obiettivo generale di questo metodo è quello di misurare la generazione di forza durante la contrazione dei muscoli del tronco zebrafish larvale. Per raggiungere questo obiettivo, una larva zebrafish è anestetizzato e posto in una camera riempita con una soluzione salina. L'estremità anteriore della larva è legato a un trasduttore di forza e l'estremità posteriore della larva è legato a un regolatore di lunghezza. Attivazione muscolare è compiuta stimolazione del campo elettrico, e la corrente di stimolazione e la lunghezza della larva vengono regolate per produrre forza massima contrazione. Una contrazione contrazione isometrica è suscitato e la risposta forza viene registrata per l'analisi.Per essere chiari, questa tecnica non misura le forze generate dai muscoli larvali durante il nuoto. Poiché entrambe le estremità della larva sono legate al materiale e poiché la larva rimane anestetizzato, non può avviare il movimento durante la prova. Inoltre, stimolazione del campo attiva tutte le fibre muscolari nello stesso tempo per indurre un bilcontrazione ateral, che non è quello che naturalmente si verifica 20. Pertanto, invece di misurare forze effettive generate durante il nuoto, questa tecnica determina la producibilità forza dei muscoli larvali.
Abbiamo utilizzato questa tecnica per dimostrare debolezza muscolare in un modello di zebrafish nemaline miopatia 21, nonché per valutare l'effetto del trattamento antiossidante sulla funzione muscolare in un modello di zebrafish malattia multi-minicore 22. Altri hanno usato una tecnica simile 23 per esaminare gli effetti di un inquinante ambientale sulla funzione muscolare 19.
Protocollo
Nota: tutte le procedure che coinvolgono zebrafish devono essere eseguite in conformità con le linee guida, i regolamenti e le agenzie di regolamentazione. Tutte le procedure di uso di animali illustrati in questo articolo sono stati approvati dalla University of Michigan Comitato per l'uso e la custodia degli animali (UCUCA).
1. Fai Loops Sutura
- Usare pinze per separare sutura non sterili (USP 10/0 monofilo di nylon, 3 strati) in tre filoni.
- Inizia a legare un doppio nodo alla marinara in uno dei filoni. Fermare prima di serrare il nodo completamente per fare un piccolo (~ 1 mm) anello anziché un nodo.
- Usare le forbici per tagliare l'eccesso di sutura dalle code di loop. Un esempio di un ciclo finito è mostrato in Figura 1.
- Posizionare il passante sul lato adesivo di un post-it per un uso successivo. I loop suture verranno utilizzati per tenere le larve in posizione durante test forza.
- Ripetere i passaggi 1,1-1,4 se necessario. Makposta due anelli di sutura per ogni larva che saranno testati.
2. Fai la verifica della soluzione
- Fai la soluzione Tyrodes con l'aggiunta di 7,977 g di cloruro di sodio, 0,373 g di cloruro di potassio, 0,265 g di cloruro di calcio diidrato, 0,102 g di magnesio cloruro esaidrato, 0,048 g di sodio fosfato monobasico, 1.000 g di bicarbonato di sodio, e 0,037 g etilendiaminotetracetico acido disodico diidrato sale a 1.000 ml di acqua purificata.
- Agitare la soluzione fino a quando i sali sono completamente sciolti. Questa soluzione può essere conservata per un mese a 4 ° C.
- Aggiungere 2,1 ml di 4 mg / ml tricaine, preparato secondo la Zebrafish Libro 24, a 47,9 ml di soluzione Tyrodes e mescolare. Proteggere la soluzione dalla luce depositandolo in una bottiglia di vetro scuro o in una bottiglia di vetro coperto con un foglio di alluminio. Questa soluzione deve essere conservato a temperatura ambiente e fatto fresco ogni giorno.
3. Tie Larva Aanesthetized in camera sperimentale
- Sistemare l'apparecchio di prova (figura 2) sul palcoscenico di un microscopio stereo.
- Collegare il trasduttore di forza e cavi regolatore di lunghezza per l'apparato di test. Accendere il trasduttore di forza. Accendere il regolatore di lunghezza in modo che rimanga rigido. (Nota:.. Controllore lunghezza fornisce la possibilità di allungare o accorciare una preparazione muscolare durante una contrazione Tuttavia, questa caratteristica del regolatore lunghezza non viene utilizzato nel metodo qui descritto Pertanto, il controllore lunghezza può essere pensato come un attacco rigido punto montato ad un sistema di posizionamento XYZ).
- Con una pipetta di trasferimento monouso, riempire la camera sperimentale con la soluzione di test.
- Usare pinze per prendere un anello di sutura da una delle code e appenderlo sul tubo trasduttore di forza. Appendere un secondo cappio di sutura sul tubo che collega il regolatore lunghezza. (Nota: afferrare un anello di sutura sulla parte curva può piegare la sutura e CauSE la rottura durante le fasi successive).
- Con una pipetta di trasferimento monouso, trasferire una larva di zebrafish per una piccola scatola di Petri riempite con soluzione di test. Attendere che l'anestetico nella soluzione di prova (tricaine) per entrare in vigore (~ 1 min). Con una pinza, spingere delicatamente la coda e verificare che la larva è anestetizzato da una mancanza di tatto evocato nuoto.
- Utilizzare una pipetta di vetro per trasferire la larva alla camera sperimentale.
- Dalla spingendo delicatamente la larva con pinza chiusa, guidare la porzione anteriore della larva attraverso l'anello di sutura sul tubo trasduttore di forza. Guidare la porzione anteriore della larva attraverso l'anello di sutura sul tubo. Afferrare entrambi code anello di sutura con una pinza e tirare contemporaneamente per stringere l'anello di sutura posteriore al sacco vitellino o di vescica natatoria (Figura 3A).
- Con una pinza, premuto uno coda anello di sutura e tirare, causando la larva di ruotare di 90 ° attorno al tubo finché il lato laterale della faccia larvas up (Figura 3B). Se il ciclo è stato tirato a sufficienza, ci sarà una certa resistenza alla trazione, la larva non dovrebbe ruotare facilmente. Se il ciclo è stato serrato troppo, la larva non ruotare attorno al tubo.
- Utilizzando il dispositivo di posizionamento XYZ collegato al controller lunghezza, spostare il tubo regolatore lunghezza lungo l'asse X (asse definizioni in Figura 2A) e sotto il tronco e la coda della larva. Lasciare spazio tra le estremità del tubo regolatore lunghezza e il tubo trasduttore di forza.
- Guidare il loop sutura sopra la coda della larva e stringere il cappio di sutura come precedentemente descritto (Figura 3C). Potrebbe essere necessario ruotare la parte posteriore della larva in modo che la parte laterale verso l'alto. Tagliare le code anello di sutura (Figura 3D).
4. Posizione Larva in camera sperimentale
- Spostare la larva di una distanza adeguata dal fondo della camera per garantire la larva will essere all'interno "distanza di lavoro" di un obiettivo microscopio rovesciato durante le fasi successive. Per fare questo, utilizzare i dispositivi di posizionamento XYZ per abbassare lentamente i tubi (con larva allegata) lungo l'asse Z finché i tubi tocchino appena il fondo della camera. Poi sollevare i tubi finché la larva è una distanza appropriata dalla parte inferiore della camera (~ 100 micron).
- Utilizzando il dispositivo di posizionamento XYZ collegato al controller lunghezza, regolare il tubo regolatore lunghezza lungo l'asse Y per allineare l'asse lungo della larva con l'asse longitudinale del tubo trasduttore di forza.
5. Forza Record Durante una contrazione contrazione massima
- Spostare il dispositivo di prova per la fase di un microscopio invertito.
- Regolare la temperatura della camera di un valore desiderato. Per iniziare, collegare la vasca circolatore acqua, termometro, e regolatore di temperatura all'apparecchio di prova. Accendere i componenti necessari e regolare l'impostazione del contr temperaturaoller finché il termometro riporta il valore desiderato. I dati contenuti in questo articolo sono stati raccolti a 25 ° C, ma le misure possono essere effettuate anche a temperatura ambiente oppure a 28.5 ° C.
- Collegare i cavi dal stimolatore per l'apparato di test. Attivare l'alimentazione per lo stimolatore, ma non stimolano la larva fino alla fase 5.6.
- Assicurarsi che la larva è parallela al fondo della camera. Attraverso un obiettivo 40X, visualizzare la porzione di larva tra le estremità dei tubi. Se parallelamente al fondo, entrambe le estremità della larva saranno a fuoco. Se necessario, regolare il tubo trasduttore di forza lungo l'asse Z fino a quando entrambe le estremità sono a fuoco.
- Verificare che la lunghezza della larva è inferiore ottimale. Accendere il sistema lunghezza sarcomero video e ruotare la videocamera tale che le striature sono paralleli ai lati del fotogramma video. Questo sistema controlla spaziatura striation analizzando le variazioni di intensità dei pixel lungo ciascuna fila orizzontale di pixel all'interno di una regione definita dall'utente di interesse(ROI). I risultati per tutte le righe all'interno del ROI vengono mediati e riportati con una frequenza equivalente al video frame-rate (≥ 80 sec-1). La spaziatura striation è utilizzato come indicatore di lunghezza sarcomero.
- Regolare il microscopio a concentrarsi sulle fibre periferiche e notare la lunghezza del sarcomero indicato. Se necessario, utilizzare il dispositivo di posizionamento XYZ collegato al controller di lunghezza per regolare la lunghezza della larva (asse X) fino a quando la lunghezza del sarcomero è ottimale (es. 1.90 micron).
- Regolare la corrente per ottimizzare la forza di contrazione stimolazione. Per iniziare, impostare la corrente sul stimolatore ad una grandezza bassa (ad esempio 100 mA). Lo stimolatore può essere attivato manualmente o da un computer che esegue un programma LabVIEW personalizzato. Suscitare una contrazione dei muscoli larvali con un impulso di corrente di 0.2 msec di durata.
- Utilizzare un oscilloscopio per registrare l'uscita forza e misurare la forza di contrazione di picco utilizzando i cursori dell'oscilloscopio. Aumentare la correntecon incrementi di 50 mA e misurare la forza di contrazione di picco per ogni livello attuale. Attendere 30 secondi tra strappi per evitare l'affaticamento. Con l'aumentare della corrente di stimolazione, forza di contrazione di picco aumenta tipicamente ad un massimo e poi diminuisce gradualmente. La corrente a cui la larva genera la forza più grande è la corrente di stimolazione ottimali. Impostare l'ampiezza della corrente per la corrente di stimolazione ottimali.
- Utilizzando il dispositivo di posizionamento XYZ, regolare la lunghezza della larva (e quindi, lunghezza sarcomero) in modo da ottenere la massima forza di contrazione. Wild-type larve di pesce zebra (3-7 dpf) generare la massima forza di strappo a lunghezze sarcomero di 2,10 micron e 2.15 micron. Tuttavia, la lunghezza sarcomero può essere impostato a 2.08 micron per evitare un eccessivo sovraccarico sulla larva.
- Suscitare una contrazione dei muscoli larvali. Utilizzare l'oscilloscopio per registrare la risposta di forza e di salvare il record per successive analisi.
6. Misurare muscolatura Dimensioni con Larva a Optimal Length
- Spostare il dispositivo di prova di nuovo al microscopio stereo.
- Usando la scala oculare, misurare l'altezza della muscolatura, come visto dal lato. Poi, facendo attenzione a non modificare la lunghezza della larva, girevole la larva di 90 ° utilizzando le code anello di sutura al fine di visualizzare la larva dal basso. Misurare la larghezza della muscolatura come visto dal basso. Prendere le misure secondo un punto di riferimento anatomico (ad esempio apertura urogenitale) (Figura 4).
- Tagliare gli anelli di sutura con una MicroBlade per rilasciare la larva dalle apparecchiature di prova.
Risultati
Nel sano selvaggio tipo zebrafish larve, le fibre muscolari dovrebbero essere parallele tra loro senza grandi spazi vuoti tra loro e hanno evidenti striature (Figura 5A). Wild-type larve di zebrafish che non presentano queste caratteristiche, o con danni evidenti come le fibre staccate (Figura 5B), deve essere eliminata.
Un grafico rappresentativo di forza contro twitch picco di corrente per una larva zebrafish stimolazione è mostrato in Figura 6. Per wild-type larve di zebrafish tra 3-7 dpf, la corrente di stimolazione ottimali è in genere tra 400-600 mA, con 3 dpf larve generalmente richiedono corrente di 6-7 dpf larve maggiore stimolazione.
I dati grezzi di forza (raccolti durante la fase 5.8) deve essere elaborati e analizzati con il software di analisi dei dati. Prima, la linea di base del record forza viene impostato a zero. Secondo, la tensione di uscita del trasduttore di forza è convertita alla forza (mN) (vedi istruzioni del produttore per generare una curva di calibrazione per il trasduttore di forza). Una risposta forza rappresentante raccolte durante una contrazione contrazione massima di una singola larva è mostrato in Figura 7. Software di analisi dati può essere utilizzato per misurare la forza di picco e altre caratteristiche della risposta di forza.
Una serie di dati rappresentativi forza di picco di contrazione contrazioni massimali è mostrato in Figura 8A. Contrazione di picco valori di forza tipici di wild-type 3-7 dpf gamma larve di 0,9-1,7 milioni di euro, con larve più vecchio generare più forza del più giovane larve. Differente sforzo contrazione di picco può essere dovuto a normali processi come la crescita e lo sviluppo (Figura 8) o processi anomale quali gene mutazione patologie legate 21,22.
Normalizzazione dopo muscolo area di sezione trasversale (CSA) può essere utilizzato per determinare il grado in cui le differenze vigenti contrazione di picco sono semplicemente a causa differe nces nella dimensione della muscolatura 21,22. CSA muscolare può essere stimata utilizzando la formula: CSA = π (A / 2) (B / 2), dove A è l'altezza della muscolatura, come visto dal lato, B è la larghezza della muscolatura come visto dal basso, e una sezione trasversale ellittica è assunto. Valori tipici per CSA wild-type 3-7 dpf gamma larve 0,027-0,034 mm 2, con 3-4 dpf larve generalmente mostrando valori CSA inferiori a 5-7 dpf larve. Un insieme rappresentativo di dati normalizzati forza di picco di contrazione contrazioni massimali è mostrato in Figura 8B. Contrazione di picco valori normalizzati tipici forza per wild-type 3-7 dpf gamma larve 34-51 mN / mm 2, con 4-7 dpf larve generalmente mostrando valori superiori a 3 dpf larve.

Figura 1. Anello di sutura. Frecce indicano le code anello di sutura.

Figura 2. (A) apparato di prova con i componenti etichettati. (B) Primo piano vista della camera sperimentale. (A) camera sperimentale con fondo trasparente. (B) trasduttore di forza. (C), regolatore di lunghezza. (D) dispositivi di posizionamento XYZ. La X, Y e Z sono definiti in alto a destra. (E) sistema di controllo della temperatura che utilizza moduli termoelettrici. Tubi accomoda flusso d'acqua per il raffreddamento dei moduli termoelettrici. (F) Tubo di acciaio inox collegato al trasduttore di forza. (G) in tubo di acciaio inox collegato al regolatore di lunghezza. (H) Termometro microsonda. (I) di platino paralleli elettrodi a piastra, che coprono la lunghezza del glida camera. Piastre di platino sono il 2,5 mm di altezza e di spessore 0,255 millimetri.
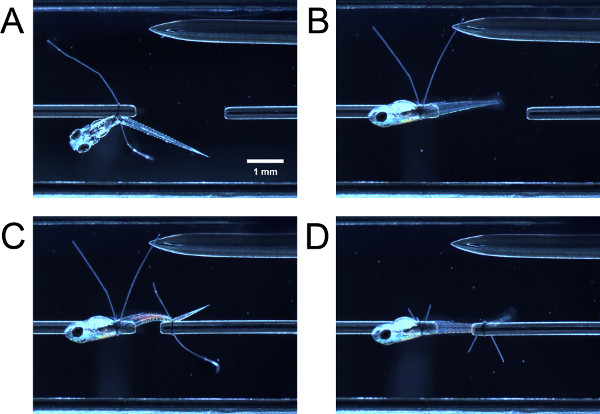
Figura 3. Tying larva in camera sperimentale. (A) Larva legato a alla estremità anteriore, ma non ancora ruotato di 90 °. (B) Larva dopo aver ruotato di 90 °. (C) Larva legata su alla fine posteriore, ma non ancora ruotato. (D) Larva dopo code anello ribaltati e sutura vengono eliminati.
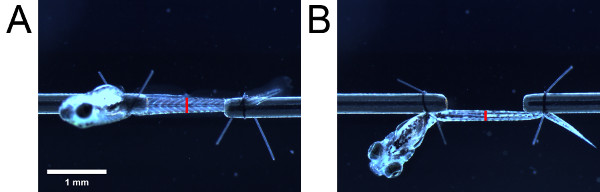
Figura 4. Misure per l'area della sezione trasversale di stima. Muscolatura quando visto da (A) lato e (B) fondo. Posizionamento delle barre rosse indicano la posizione di apertura urogenitale. La lunghezza delle barre rosse indicano l'altezza e la larghezza della muscolatura come visto dal lato inferiore e rispettivamente.
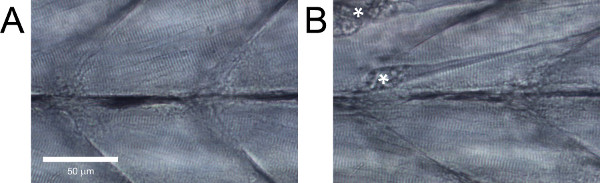
Figura 5. Vista laterale di zebrafish muscolatura del tronco larve. (A) del tessuto sano. (B) Tessuto con danni evidenti. Contratture derivanti da distacchi di fibra sono contrassegnati con un asterisco.
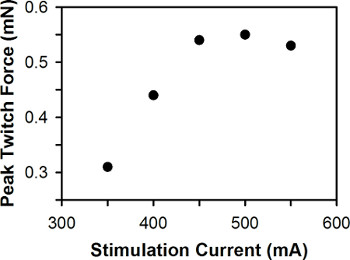
Figura 6. Trama Rappresentante della forza contrazione di picco contro corrente di stimolazione. La corrente di stimolazione ottimale è di 500 mA.
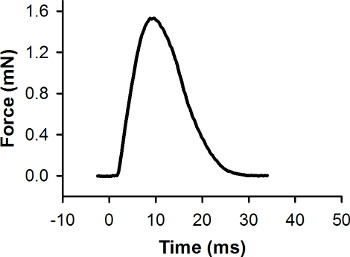
Figura 7. Record di forza di riferimento per una singola contrazione contrazione. Tale contrazione è stata evidenziata con un impulso di stimolo a 0 msec. La forza di picco è 1,56 milioni di euro.
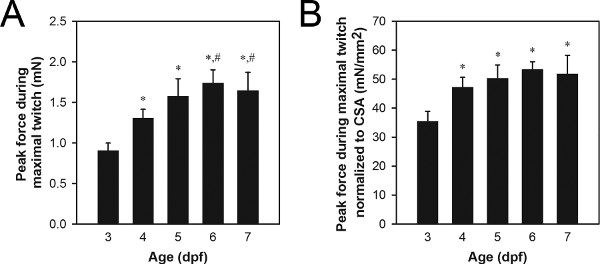
Figura 8. Dati di forza di riferimento 3-7 dpf larve. (A) di picco dati della forza di contrazione contrazioni massimali. (B) i dati di picco della forza di contrazione contrazione massime normalizzate a CSA. Larve più vecchio (6-7 dpf) erano alimentati Hatchfry Encapsulon Grado 0 con Spirulina (Argent Laboratories) a partire dal 5 dpf. Mezzi + deviazioni standard sono segnalati con N = 5 di ogni gruppo. Gruppi significativamente diversi da 3 dpf larve (*) e 4 dpf larve (#) sono indicate (ANOVA, P <0.05). Il significativo aumento della forza normalizzato compreso tra 3 e 4 dpf (B) indica un aumento della forza generatrice intrinseca capacità durante questo periodo di tempo, mentre l'aumento di forza tra 4 e 6-7 dpf (A) è attribuito a crescita basata su nessuna cambiare dal 4 al 7 dpf vigente normalizzato.
Discussione
Questo metodo misura la generazione di forza nel corso di una contrazione per valutare la funzione muscolare nei muscoli del tronco di larve di zebrafish. Sebbene contrazione tetanica possono essere elicitati larve zebrafish (ad esempio 200 impulsi di stimolazione / sec per una durata di 0,2 sec), la massima forza tetanica è solo del 10-15% maggiore della forza massima contrazione. Pertanto, la forza generata durante un tic è una misura ragionevole di producibilità forza. Twitches sono da preferire rispetto contrazioni tetaniche perché contrazioni sono meno probabilità di provocare lo strappo e lo scivolamento ai legami di sutura.
Al fine di generare dati significativi con questa tecnica, forza massima contrazione dovrebbe essere raggiunto per ciascuna larva e la variabilità tra gruppi sperimentali dovrebbe essere minimizzato. Con questi obiettivi in mente, offriamo i seguenti suggerimenti. In primo luogo, fare attenzione a quando la vendita abbinata la larva per il trasduttore di forza ed i tubi del regolatore di lunghezza. Se gli anelli di sutura vengono serrate troppomolto, la sutura taglierà il tessuto muscolare. Se i loop sutura non sono strette abbastanza, la forza generata dalla larva non sarà pienamente trasmesso al trasduttore di forza. Entrambe le situazioni, ma soprattutto quest'ultimo, sottovalutano la massima forza di contrazione. In secondo luogo, dal momento che test più gruppi sperimentali può richiedere diverse ore (20-30 min / larva), si alternano tra i gruppi, perché le larve continuerà a sviluppare durante il periodo di prova.
Mentre una parte del materiale citato è essenziale per la misura della massima forza di contrazione (ad esempio trasduttore di forza, stimolatore di corrente), le altre voci non sono assolutamente necessari. Il sistema lunghezza sarcomero video è auspicabile ma non obbligatorio. Come alternativa, una serie di contrazioni può essere utilizzato per trovare lunghezza ottimale, durante la quale la lunghezza della larva viene regolata fino forza massima contrazione è raggiunto. Una regolazione della temperatura non è assolutamente necessario. Il controllo della temperatura è fondamentale quando meaSuring cinetica a contrazione, che sono molto sensibili alla temperatura, mentre la massima forza di strappo non è particolarmente sensibile a piccole variazioni di temperatura e potrebbe essere misurata a temperatura ambiente. Si noti che, indipendentemente dalla temperatura nella camera durante la prova forza, le larve dovrebbe essere mantenuta alla temperatura di crescita ottimale di 28,5 ° C 24 prima costringere test per la stadiazione accurata.
Le larve sono testati in una soluzione contenente Tyrodes tricaine. Usiamo 0,02% (w / v) tricaine, la concentrazione raccomandata per l'anestesia 24, per eliminare contrazioni spontanee evocati dal sistema nervoso e quindi prevenire l'affaticamento durante il test forza. Tricaine facilita anche il tie-in step e riduce il tempo di prova generale. Tuttavia, si osserva che anche tricaine nella soluzione di test costantemente riduce la forza massima di contrazione di circa il 30%. Un effetto simile è stato osservato anche in girino muscolo coda, dove tricaine ridotta generazione di forza dopo la trasmissione neuromuscolare è stata bloccata, il che suggerisce che tricaine ha un effetto diretto sul muscolo 25. Tricaine può ridurre l'eccitabilità delle cellule muscolari riducendo conduttanza sodio attraverso la membrana cellulare, come avviene nelle cellule nervose 26. Altre opzioni per il blocco di attivazione di motoneuroni sono d-tubocurarina e α-bungarotossina ma, a differenza di tricaine, questi composti non sono pelle-permeabili e devono essere iniettati direttamente nella testa, il midollo spinale, o di cuore 27. Investigatori individuali dovranno valutare se tricaine è auspicabile per l'applicazione specifica. Se tricaine è inclusa nella soluzione di prova, la concentrazione dovrebbe essere coerente tra esperimenti e ricercatori devono verificare che l'effetto del tricaine non varia tra i gruppi sperimentali.
Descriviamo questo metodo per le larve di appena 3 dpf e vecchio come 7 dpf. Sebbene le fibre muscolari appaiono functional già 17 ore dopo la fecondazione, quando i movimenti spontanei di coda iniziano 27, la ridotta lunghezza della coda prima di 3 dpf ostacola legando la larva per le apparecchiature di prova. Noi di solito non testiamo larva dopo 7 dpf da molti modelli di malattia non sopravvivono molto più a lungo questo momento. Se testare larve oltre 5 dpf, le larve dovrebbe essere alimentato. Abbiamo osservato che le larve a digiuno hanno muscoli più piccoli e generare meno forza massima di contrazione rispetto nutrito larve, probabilmente a causa della diminuzione sacco vitellino. Così può essere desiderabile per testare larve tra 3-5 dpf, per evitare la variabile aggiuntiva di alimentazione esterna.
In sintesi, si descrive un metodo quantitativo e affidabile per misurare la generazione di forza nel corso di una contrazione contrazione massima dei muscoli del tronco zebrafish larvale. Questo metodo può essere utilizzato per valutare la salute generale del muscolo larvale zebrafish e specificamente fornisce informazioni sulla funzione muscolare. Oltre a fornire informazioni sullagrandezza della generazione della forza, questa tecnica può essere usata per studiare la cinetica di generazione di forza o essere adattato per studiare l'affaticamento muscolare 22. Sebbene si descrive questa tecnica per l'utilizzo con wild-type larve, questo metodo può essere utilizzato per larve geneticamente modificata o per larve trattate con farmaci o sostanze tossiche, per caratterizzare modelli di malattie muscolari e valutare i trattamenti, o per studiare sviluppo muscolare, lesioni muscolari, o correlata muscolo tossicità chimica.
Divulgazioni
Gli autori dichiarano di non avere interessi finanziari in competizione.
Riconoscimenti
Gli autori ringraziano Angela Busta per l'assistenza con zebrafish allevamento. Questo lavoro è stato sostenuto dal National Institutes of Health (AG-020.591 a SVB e 1K08AR054835 a JJD).
Materiali
| Name | Company | Catalog Number | Comments |
| REAGENTS | |||
| Tricaine powder | Sigma-Aldrich | A5040 | |
| Sodium chloride | Sigma-Aldrich | S7653 | |
| Potassium chloride | Sigma-Aldrich | P9541 | |
| Calcium chloride dihydrate | Sigma-Aldrich | 223506 | |
| Magnesium chloride hexahydrate | Sigma-Aldrich | M2670 | |
| Sodium phosphate monobasic | Sigma-Aldrich | S0751 | |
| Sodium bicarbonate | Sigma-Aldrich | S6297 | |
| Ethylenediaminetetraacetic acid disodium salt dihydrate | Sigma-Aldrich | E5134 | |
| EQUIPMENT | |||
| Nonsterile-suture | Ashaway Line Twine | S30002 | USP 10/0 monofilament nylon (3 ply) |
| Forceps | Fine Science Tools | 11251-20 | Dumont #5 |
| Spring scissors | Fine Science Tools | 15000-08 | Vannas |
| Stereo microscope | Leica Microsystems | MZ8 | Illuminated with Fostec EKE ACE I light source |
| Force transducer |  Aurora Scientific Aurora Scientific | 400A | |
| Length controller |  Aurora Scientific Aurora Scientific | 318B | |
| XYZ positioning devices | Parker Hannifin | 3936M | |
| Thermometer | Physitemp | BAT-12 | |
| Disposable transfer pipette | Fisher Scientific | 13-711-9AM | Cut end to widen opening and facilitate larva transfer |
| Petri dish | Fisher Scientific | 08-757-11YZ | |
| Glass pipette | Fisher Scientific | 13-678-8B | Cut end (and fire-polish) to widen opening and facilitate larva transfer |
| Inverted microscope | Carl Zeiss Microscopy | Axiovert 100 | |
| Water bath circulator | Neslab Instruments | RTE-111 | |
| Temperature controller | Alpha Omega Instruments | Series 800 | |
| Stimulator |  Aurora Scientific Aurora Scientific | 701C | High-power, follow stimulator |
| Video sarcomere length system |  Aurora Scientific Aurora Scientific | 900B-5A | |
| LabVIEW software | National Instruments | ||
| Oscilloscope | Nicolet Technologies | ACCURA 100 | |
| Microblade | Fine Science Tools | 10050-00 | |
| Microblade holder | Fine Science Tools | 10053-13 | |
| Data analysis software (Signo) | Alameda Applied Sciences | ||
Riferimenti
- Bassett, D. I., Bryson-Richardson, R. J., Daggett, D. F., Gautier, P., Keenan, D. G., Currie, P. D. Dystrophin is required for the formation of stable muscle attachments in the zebrafish embryo. Development. 130 (23), 5851-5860 (2003).
- Nixon, S. J., Wegner, J., et al. Zebrafish as a model for caveolin-associated muscle disease; caveolin-3 is required for myofibril organization and muscle cell patterning. Hum. Mol. Genet. 14 (13), 1727-1743 (2005).
- Hall, T. E., Bryson-Richardson, R. J., et al. The zebrafish candyfloss mutant implicates extracellular matrix adhesion failure in laminin α2-deficient congenital muscular dystrophy. PNAS. 104 (17), 7092-7097 (2007).
- Hirata, H., Watanabe, T., et al. Zebrafish relatively relaxed mutants have a ryanodine receptor defect, show slow swimming and provide a model of multi-minicore disease. Development. 134, 2771-2781 (2007).
- Dowling, J. J., Vreede, A. P., et al. Loss of myotubularin function results in t-tubule disorganization in zebrafish and human myotubular myopathy. PLoS Genet. 5 (2), e1000372 (2009).
- Berger, J., Berger, S., Hall, T. E., Lieschke, G. J., Currie, P. D. Dystrophin-deficient zebrafish feature aspects of the Duchenne muscular dystrophy pathology. Neuromuscul. Disord. 20 (12), 826-832 (2010).
- Kawahara, G., Guyon, J. R., Nakamura, Y., Kunkel, L. M. Zebrafish models for human FKRP muscular dystrophies. Hum. Mol. Genet. 19 (4), 623-633 (2010).
- Wallace, L. M., Garwick, S. E., et al. DUX4, a candidate gene for facioscapulohumeral muscular dystrophy, causes p53-dependent myopathy in vivo. Ann. Neurol. 69, 540-552 (2011).
- Sztal, T. E., Sonntag, C., Hall, T. E., Currie, P. D. Epistatic dissection of laminin-receptor interactions in dystrophic zebrafish muscle. Hum. Mol. Genet. , (1093).
- Kawahara, G., Karpf, J. A., Myers, J. A., Alexander, M. S., Guyon, J. R., Kunkel, L. M. Drug screening in a zebrafish model of Duchenne muscular dystrophy. PNAS. 108 (13), 5331-5336 (2011).
- Berger, J., Berger, S., Jacoby, A. S., Wilton, S. D., Currie, P. D. Evaluation of exon-skipping strategies for Duchenne muscular dystrophy utilizing dystrophin-deficient zebrafish. J. Cell Mol. Med. 15 (12), 2643-2651 (2011).
- Seger, C., Hargrave, M., Wang, X., Chai, R. J., Elworthy, S., Ingham, P. W. Analysis of Pax7 expressing myogenic cells in zebrafish muscle development, injury, and models of disease. Dev. Dyn. 240, 2440-2451 (2011).
- Postel, R., Vakeel, P., Topczewski, J., Knöll, R., Bakkers, J. Zebrafish integrin-linked kinase is required in skeletal muscles for strengthening the integrin-ECM adhesion complex. Dev. Biol. 318 (1), 92-101 (2008).
- Zoeller, J. J., McQuillan, A., Whitelock, J., Ho, S. Y., Iozzo, R. V. A central function for perlecan in skeletal muscle and cardiovascular development. J. Cell Biol. 181 (2), 381-394 (2008).
- Kim, H. R., Ingham, P. W. The extracellular matrix protein TGFBI promotes myofibril bundling and muscle fibre growth in the zebrafish embryo. Dev. Dyn. 238, 56-65 (2009).
- Beqqali, A., Monshouwer-Kloots, J., et al. CHAP is a newly identified Z-disc protein essential for heart and skeletal muscle function. J. Cell Sci. 123 (7), 1141-1150 (2010).
- Huang, H., Huang, C., et al. Toxicity, uptake kinetics and behavior assessment in zebrafish embryos following exposure to perfluorooctanesulphonicacid (PFOS). Aquat. Toxicol. 98 (2), 139-147 (2010).
- Sylvain, N. J., Brewster, D. L., Ali, D. W. Zebrafish embryos exposed to alcohol undergo abnormal development of motor neurons and muscle fibers. Neurotoxicol. Teratol. 32 (4), 472-480 (2010).
- Chandrasekar, G., Arner, A., Kitambi, S. S., Dahlman-Wright, K., Andersson-Lendahl, M. Developmental toxicity of the environmental pollutant 4-nonylphenol in zebrafish. Neurotoxicol. Teratol. 33 (6), 752-764 (2011).
- Buss, R. R., Drapeau, P. Activation of embryonic red and white muscle fibers during fictive swimming in the developing zebrafish. J. Neurophysiol. 87 (3), 1244-1251 (2002).
- Telfer, W. R., Nelson, D. D., Waugh, T., Brooks, S. V., Dowling, J. J. neb: a zebrafish model of nemaline myopathy due to nebulin mutation. Dis Model Mech. 5, 389-396 (2012).
- Dowling, J. J., Arbogast, S., et al. Oxidative stress and successful antioxidant treatment in models of RYR1-related myopathy. Brain. 135 (4), 1115-1127 (2012).
- Dou, Y., Andersson-Lendahl, M., Arner, A. Structure and function of skeletal muscle in zebrafish early larvae. J. Gen. Physiol. 131, 445-453 (2008).
- Westerfield, M. . The zebrafish book: a guide for the laboratory use of zebrafish (Danio rerio). , (2000).
- Herr, V. D., Sonnenburg, D. C., Courogen, P. M., Fiamengo, S. A., Downes, H. Muscle weakness during tricaine anesthesia. Comp Biochem Physiol Part C. 110 (3), 289-296 (1995).
- Frazier, D. T., Narahashi, T. Tricaine (MS-222): effects of ionic conductances of squid axon membranes. Eur. J. Pharmacol. 33 (2), 313-317 (1975).
- Saint-Amant, L., Drapeau, P. Time course of the development of motor behaviors in the zebrafish embryo. J. Neurobiol. 37 (4), 622-632 (1998).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon