Method Article
ゼブラフィッシュ幼生における筋機能を評価するために、収縮時の力測定
要約
力の測定は、開発、傷害、疾病、治療または化学毒性による筋機能の変化を示すために使用することができる。このビデオでは、我々は、ゼブラフィッシュ幼生体幹筋の最大収縮時の力を測定する方法を示しています。
要約
ゼブラフィッシュの幼虫は筋肉の発達、筋肉疾患、筋肉関連の化学毒性のモデルを提供しますが、関連する研究は、多くの場合、筋肉の健康の機能的な措置を欠いている。このビデオの記事では、我々はゼブラフィッシュ幼生体幹筋の収縮時に力発生を測定する方法を示しています。力の測定は、塩溶液で満たされたチャンバー内に麻酔をかけ幼虫を置くことによって達成される。幼虫の前端は、力変換器に接続されており、幼虫の後端は、長さ·コントローラーに接続されています。等尺性単収縮は、電場刺激によって誘発され、力応答を分析のために記録される。収縮時の力発生は、全体的な筋肉の健康の尺度を提供し、特に筋機能の尺度を提供します。我々は、野生型幼虫で使用するために、この手法を説明したが、この方法は、遺伝子的に修飾された幼虫、または薬物または毒物で処理した幼虫で使用することができる筋肉の疾患モデルを特徴付けるとトリートメントを評価したり、筋肉の発達、けが、または化学毒性を研究するために。
概要
ヤングゼブラフィッシュ( ゼブラフィッシュ )の幼虫、3-7日後に受精(DPF)は、ますます骨格筋研究のために有用な生物として認識されている。若い幼虫は、研究筋肉損傷12を薬や治療戦略10-11を評価し、モデルの人間の筋肉の疾患1-9に使用されている、筋肉の発達13-16を理解し、筋肉関連の化学毒性17-19を調査。これらの分野における代表的な研究では、健康的な筋肉が遺伝子操作や毒物への曝露によって異常なレンダリングされる度合いを調べ、いくつかの研究では、異常な筋肉が治療に反応する程度を調べます。これらの研究の成功に不可欠な、正確に筋肉の状態を評価する機能です。
ゼブラフィッシュ幼生の筋肉の状態を評価するために使用できるさまざまな方法がありますが、いくつかは、筋機能に関する直接的な情報を提供します。筋肉の健康は通常appearancによって評価されとして9,15,16,18を免疫組織染色6,8,11、、光学顕微鏡3,13、電子顕微鏡3,4,14,16、または複屈折7,9,11によって評価電子、しかし、これらの技術は提供する形態学的情報のみ。トランクとテール変位と遊泳速度4,17は運動機能を評価しますが、彼 らはまた、神経入力、エネルギー代謝、およびその他のプロセスを反映しているので、これらは、筋機能の直接的な対策ではありません。
対照的に、収縮時力発生を測定する筋肉機能の直接評価を提供し、全体的な筋肉の正常性の尺度を表す。このアプローチの利点は、追加された簡単なデータ分析と定量的な結果が含まれています。このビデオの記事では、我々はより多くの研究者が研究に筋肉の健康の既存の施策を補完するために、このメソッドを使用することを願って、幼虫の筋肉による力発生を測定するための詳細な手順を提供します。
この方法の全体的な目標は、ゼブラフィッシュ幼生体幹筋肉の収縮時の力の生成を測定することである。この目標を達成するために、ゼブラフィッシュの幼虫を麻酔し、食塩水で満たされたチャンバーに入れている。幼虫の前端は、力変換器に接続されており、幼虫の後端は、長さ·コントローラーに接続されています。筋肉の活性化は、電場刺激することによって達成され、刺激電流と幼虫の長さは、最大収縮力を生成するように調整される。等尺性単収縮が誘発され、力応答の分析のために記録される。明確にするために、この手法は、水泳中に幼虫の筋肉によって生成された力を測定していません。幼虫の両端には、機器に接続されており、幼虫は麻酔ままなので、それがテスト中に運動を開始することはできませんので。また、電界刺激億を誘導するために同時にすべての筋線維を活性化する当然20を発生するものではないateral収縮、。したがって、むしろ水泳中に生成された実際の力を測定するよりも、この技術は幼虫の筋肉の力発生機能を決定します。
我々は、マルチminicore疾患22のゼブラフィッシュモデルにおける筋肉の機能に酸化防止剤治療の効果を評価するために、並びに、ネマリンミオパチー21のゼブラフィッシュモデルにおける筋力低下を示すために、この技術を使用している。その他筋機能19環境汚染物質の影響を調べるために同様の手法23を使用している。
プロトコル
注:ゼブラフィッシュを含むすべての手順は、関連ガイドライン、規制、規制当局に従って行われるべきである。この記事で示されているすべての動物の使用手順は、動物の使用とケアに関するミシガン大学委員会(UCUCA)によって承認された。
1。縫合糸ループを作る
- 3本鎖に非滅菌縫合糸(USP 10/0モノフィラメントナイロン、3プライ)を分離するためにピンセットを使用してください。
- ストランドのいずれかでダブルオーバーハンドノットを結ぶために始める。代わりに結び目の小さい(〜直径1mm)ループを作る完全に結び目を締める前に停止します。
- ループの尾から余分な縫合糸をカットするはさみを使用します。完成したループの例を図1に示されている。
- それはポスト後で使用するために注意してくださいの粘着面上にループを配置します。縫合糸ループは、力試験中に適所に幼虫を保持するために使用される。
- 必要に応じて手順1.1から1.4を繰り返します。マックテストされる各幼虫の電子2縫合糸ループ。
2。テストソリューションを作る
- 1,000 mlに7.977グラムの塩化ナトリウム、0.373グラム塩化カリウム、0.265グラムの塩化カルシウム二水和物、0.102グラムの塩化マグネシウム六水和物、0.048グラム一塩基性リン酸ナトリウム、1.000グラムの重炭酸ナトリウム、および0.037グラムエチレンジアミン四酢酸二ナトリウム塩二水和物を添加してタイロード溶液を作る精製水。
- 塩が完全に溶解するまで溶液をかき混ぜる。この溶液を4℃で一ヶ月保存することができる
- 47.9ミリリットルのタイロード液とミックスに4 mg / mlのtricaineの2.1ミリリットル、ゼブラブック24に従って調製し、追加します。暗いガラス瓶やアルミ箔で覆われたガラスの瓶の中に格納することによって、光からの溶液を保護する。この溶液を室温で保存し、毎日新鮮なされるべきである。
3。実験チャンバーにAanesthetized幼虫を結ぶ
- <李は>実体顕微鏡のステージ上に試験装置( 図2)を配置します。
- 試験装置に力変換器と長コントローラケーブルを接続します。力変換器の電源をオンにします。それはリジッド残るように、長さ、コントローラの電源を入れます。 ( 注:長さコントローラは収縮時筋標本を拡大または短縮する能力を提供するが、長さコントローラのこの機能は本明細書に記載された方法で使用されていないため、長制御部は、剛性の添付ファイルとして考えることができる。。点)XYZ位置決めシステムに取り付けられている。
- 使い捨てトランスファーピペットで、試験溶液を用いた実験室を埋める。
- 尾のいずれかの方法で縫合糸ループをピックアップし、力変換器のチューブの上にハングアップする鉗子を使用してください。長コントローラに接続されているチューブに第2の縫合糸ループを掛ける。 ( 注:湾曲部に縫合糸ループを把持すると、縫合糸とCAUをキンクすることができますそれは)は、後続のステップの間に壊れるに知ら。
- 使い捨てトランスファーピペットで、試験溶液で満たさ小さなペトリ皿にゼブラフィッシュ幼虫を移す。効果(〜1分)を取るために試験溶液中の麻酔薬(tricaine)を待ちます。鉗子で、そっと尻尾を微調整し、幼虫は、タッチ誘発水泳の不足により麻酔であることを確認します。
- 実験室に幼虫を転送するためにガラスピペットを使用してください。
- そっと閉じたピンセットで幼虫をナッジすることで、力変換器チューブに縫合糸ループを介して幼虫の前方部分を導く。チューブ上の縫合糸ループを介して幼虫の前方部分を導く。鉗子で縫合糸ループの尾の両方をつかみ、卵黄嚢やswimbladder( 図3A)の後方に縫合糸ループを強化すると同時に、それらを引き出します。
- 鉗子で、幼虫は幼虫の顔の側面まで、チューブの周りに90°旋回させ、つの縫合糸ループテールとプルを開催次第( 図3B)。ループが十分に締め付けられていた場合は、プルに多少の抵抗があるだろう、幼虫は簡単に旋回するべきではありません。ループを締めつけていた場合、幼虫は管の周りに旋回しません。
- 長コントローラに接続されたXYZ位置決め装置を使用して、X軸( 図2Aにおける軸の定義)に沿って幼虫の胴と尾の下の長さコントローラ管を移動します。長コントローラ管と力変換器管の両端の間にスペースを入れてください。
- 幼虫の尾以上縫合糸ループを導き、前述したように( 図3C)縫合糸ループを締めます。側面が上を向くようにして、幼虫の後部に旋回する必要があるかもしれません。縫合糸ループの尾( 図3D)をトリミングします。
4。実験所における位置幼虫
- 幼虫wを確実にするために、チャンバー下部から適切な距離に幼虫を移動病気で後続のステップの間に倒立顕微鏡対物レンズの "作動距離"内にある。これを達成するために、管はただチャンバの底部に接触するまで、徐々にZ軸に沿ってチューブ(添付の幼虫で)低下させるXYZ位置決め装置を使用する。幼虫は、チャンバ底(〜100μm)のから適切な距離になるまで続いて、チューブを引き上げる。
- 長さコントローラに接続さXYZ位置決め装置を用いて、力変換器管の長軸との幼虫の長軸を整列させるY軸に沿って長さコントローラチューブを調整する。
5。最大単収縮中に記録フォース
- 倒立顕微鏡のステージに試験装置を移動します。
- 所望の値にチャンバ温度を調整します。開始するには、試験装置に水浴循環装置、温度計、温度制御装置を接続する。必要なコンポーネントの電源を入れ、温度CONTR上の設定を調整温度計までoller所望の値を報告します。この記事に含まれるデータは、25°Cで収集されたが、測定も室温でまたは28.5で行うことができる℃の
- 刺激から試験装置にケーブルを接続します。刺激装置の電源をオンにしますが、ステップ5.6になるまで幼虫を刺激しない。
- 幼虫は、チャンバ底に平行であることを確認してください。 40X客観通じ、管の端間の幼虫の一部を表示します。底部に平行な場合には、幼虫の両端が焦点になります。必要に応じて両端が焦点になるまで、Z軸に沿って力変換器チューブを調整する。
- 幼虫の長さが最適よりも短くなっていることを確認します。ビデオサルコメア長システムの電源をオンにし、条痕は、ビデオフレームの側面と平行になるように、ビデオカメラを回転させます。このシステムは、近隣のユーザ定義領域内の各画素の水平方向の列に沿って画素の強度の変化を解析することにより、ストライエーションの間隔を監視する(ROI)。 ROI内のすべての行の結果を平均し、ビデオフレームレート(≥80秒-1)に相当する周波数で報告されている。ストライエーションの間隔は、筋節の長さの指標として用いられる。
- 周辺の繊維に焦点を当て、指示されたサルコメア長さを注意する顕微鏡を調整します。必要であれば、筋節の長さ( 例えば 、1.90ミクロン)最適未満になるまで幼虫の長さを調整する長さコントローラ(X軸)に取り付けられたXYZ位置決め装置を使用する。
- 収縮力を最適化する電流刺激を調整します。開始するには、低振幅( 例えば 100ミリアンペア)に刺激に出力電流を設定します。刺激器は、手動またはカスタムLabVIEWプログラムを実行するコンピュータによってトリガすることができる。持続期間は0.2ミリ秒のパルス電流と幼虫の筋肉のけいれんを引き出す。
- 力出力を記録して、オシロスコープのカーソルを使用してピーク収縮力を測定するためにオシロスコープを使用してください。電流を増加50ミリアンペアの単位で、それぞれの現在のレベルのピーク収縮力を測定する。疲労を防ぐために、けいれんの間30秒待ちます。刺激電流が増加するにつれ、ピーク収縮力は、典型的には最大値まで増加し、その後徐々に減少する。幼虫が最大の力を発生する電流は、最適な刺激電流である。最適な刺激電流に電流振幅を設定します。
- XYZ位置決め装置を用いて、最大の収縮力を誘発するために、幼虫(従って、筋節の長さ)の長さを調整する。野生型のゼブラフィッシュの幼虫(3-7 DPF)が2.10μm以上2.15ミクロンのサルコメア長で最大収縮力を発生。しかしながら、筋節長さが幼虫に過剰な歪みを回避するために、2.08ミクロンに設定することができる。
- 幼虫の筋肉の収縮を引き出す。力応答を記録し、その後の分析のための記録を保存するためにオシロスコープを使用してください。
6。最適な長さで幼虫と筋肉組織寸法を測る
- ステレオ顕微鏡に戻って試験装置を移動します。
- 側面から見た接眼スケールを用い、筋肉の高さを測定する。その後、幼虫の長さを変更しないように注意を取ることは、下から幼虫を表示するために縫合糸ループの尾を使用して90°幼虫を旋回。下から見た筋肉の幅を測定します。解剖学的ランドマーク( 例えば生殖器の開口部)( 図4)での測定を行う。
- 試験装置から幼虫を解放するためにマイクロブレードと縫合糸ループをカットします。
結果
健康な野生型ゼブラフィッシュの幼虫では、筋線維は、それらの間に大きな隙間なく互いに平行であると明らかに条痕を( 図5A)が必要です。破棄されるべきである、またはそのような一戸建て繊維( 図5B)のような明らかな損傷で、これらの特徴を示さない野生型のゼブラフィッシュの幼虫。
単一ゼブラフィッシュの幼虫のためのピーク電流収縮力に対する刺激の代表的なプロットを図6に示す。 3-7 DPFの間に、野生型ゼブラフィッシュの幼虫のために、最適な刺激電流は3 DPFの幼虫は一般に6-7 DPFの幼虫よりも大きな電流刺激を必要とすると、一般的にmAの400-600の間にある。
生力データ(ステップ5.8の間に収集された)データ解析ソフトウェアを用いて処理し、分析しなければならない。まず、力レコードのベースラインはゼロに設定される。第二に、力変換器の出力電圧は、力(mまで変換されるN)(ロードセルの検量線を生成するために製造業者の取扱説明書を参照)。単一の幼虫の最大単収縮中に収集された代表的な力応答は、 図7に示されている。データ解析ソフトウェアは、力応答のピーク力および他の特徴を測定するために使用することができる。
最大筋の収縮からのピーク力データの代表的セットは、 図8Aに示されている。年上の幼虫は若い幼虫よりも力を発生させると0.9〜1.7 MNに野生型3-7 DPFの幼虫の範囲の典型的なピーク収縮力値。ピーク収縮力の違いは成長と発展( 図8)、またはそのような病理21,22遺伝子変異に関連するような異常のプロセスのような通常のプロセスに起因することができます。
筋断面積(CSA)による正規化がピーク収縮力の違いは、単にのdiffereことになっている程度を決定することができる筋肉21,22のサイズのNCES。 CSA =π(/ 2)(B / 2)、底部から見た側から見た筋肉の高さであり、Bは、筋肉の幅である:筋CSAは次式を用いて推定することができると楕円形の断面が想定されます。 3-4 DPFの幼虫は一般に5-7 DPFの幼虫より小さいCSA値を示すとの0.027から0.034ミリメートル2〜野生型3-7 DPFの幼虫の範囲、の典型的なCSA値。最大筋の収縮からの正規化ピーク力データの代表的セットは、 図8Bに示されている。 4-7 DPFの幼虫は一般に3 DPFの幼虫よりも大きい値を示したと34から51 MN / mmの2〜野生型3-7 DPFの幼虫の範囲の典型的な正規化されたピークの収縮力値。

図1。縫合糸ループ。縫合糸ループの尾に矢印ポイント。

図2。ラベルされたコンポーネントを持つ(A)試験装置。実験室の(B)のクローズアップビュー。透明な底の(a)は実験室。(b)の力変換器(C)長さ·コントローラ。(d)の XYZ位置決め装置。 X、Y、およびZ軸は右上隅に定義されている。熱電モジュールを利用して(e)の温度制御システム。チューブは、熱電モジュールの冷却水の流れを収容する。(f)のステンレス鋼の管は、変換器を強制的に取り付けられている。(g)のステンレス鋼チューブの長さがコントローラに接続されている。(h)に温度計マイクロ。(i)はプラチナ平行平板電極の長さに及ぶザ室。プラチナプレートは、高2.5ミリメートル、厚さ0.255ミリメートルです。
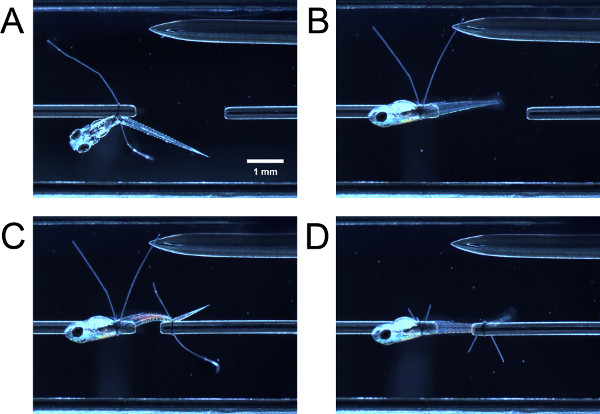
図3。実験室に幼虫を結ぶ。前方終わりには縛られませんまだ90°旋回()幼虫が。旋回90°後(B)の幼虫。(C)幼虫は、後端にに縛らまだ旋回しない。(D)幼虫の後旋回と縫合糸ループ尾がトリミングされています。
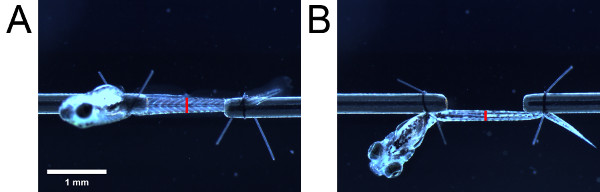
図4。断面積の推定のための測定。筋肉組織()側および(B)から見たボトム。赤いバーの配置は、泌尿生殖器の開口部の位置を示す。赤いバーの長さは、それぞれ側面図および底面から見た筋肉の高さと幅を示している。
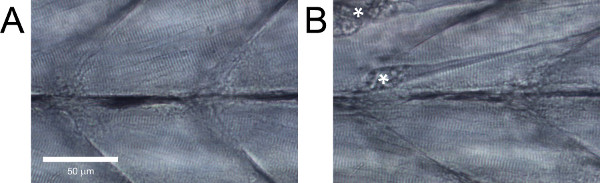
図5。ゼブラフィッシュ幼生トランク筋肉組織の側面図。明らかにダメージがある(A)健康な組織。(B)組織。繊維分遣起因する拘縮はアスタリスクでマークされています。
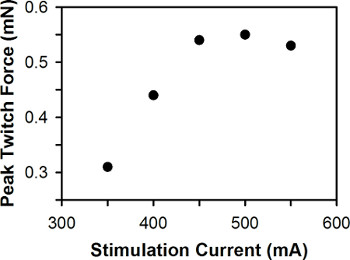
図6。ピーク収縮力に対する刺激電流の代表的なプロットは。最適な刺激電流は、500 mAです。
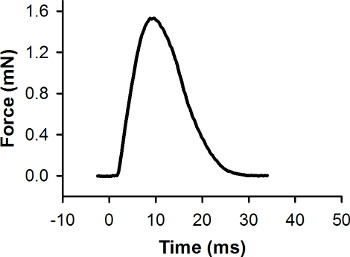
図7。単一の単収縮のための代表的な力レコード。この収縮は0ミリ秒で刺激パルスで誘発された。ピーク力は1.56 MNです。
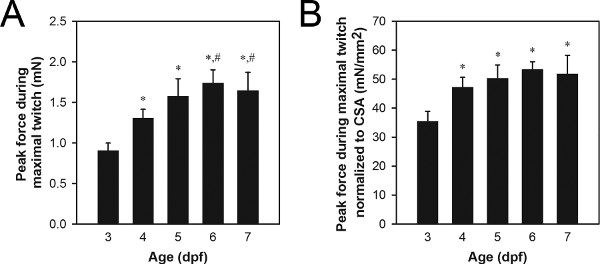
図8。 3-7 DPFの幼虫から描写力のデータ()の最大筋収縮力のピークデータ。CSAに正規化最大筋収縮から(B)ピーク力のデータ。年上の幼虫(6-7 DPF)が5 DPFから始まるスピルリナを与えHatchfry Encapsulonグレード0(アージェントラボラトリーズ)であった。手段は、+標準偏差は、各グループ内でN = 5で報告されている。 3 DPFの幼虫(*)および4 DPFの幼虫(#)と有意に異なる基(ANOVA、P <0.05示されている)。図4及び6-7 DPF(A)との間の力の増加がないにしていなかっ成長に起因しているのに対し、図3及び図4 DPF(B)との間の正規化された力の有意な増加は、この期間中に本質的な力発生能力の増加を示す正規化された力の4〜7 DPFから変更。
ディスカッション
この方法では、ゼブラフィッシュの幼虫の体幹筋の筋機能を評価するために収縮時に力発生を測定します。強直収縮がゼブラフィッシュ幼生(0.2秒の期間200刺激パルス/秒によって)に誘発することができますが、最大の強縮力は最大収縮力よりも10〜15%大きい。したがって、単収縮時に発生する力は、能力を発生させる力の合理的な尺度である。けいれんは、リッピングや縫合の絆で滑りが発生する可能性が低いので、けいれんをテタヌス収縮よりも好ましい。
この手法の意味のあるデータを生成するために、最大の収縮力が各幼虫に対して達成すべきであると実験群との間のばらつきが最小化されるべきである。念頭に置いてこれらの目標により、我々は次の提案を提供しています。力変換器と長コントローラチューブに幼虫を結ぶときに最初に、世話をする。縫合糸ループがあまりに締められている場合あまり、縫合糸は、筋肉組織を切断します。縫合糸ループが十分に締め付けられていない場合には、幼虫が発生する力は完全に力変換器に伝達されない。両方の状況が、特に後者は、最大収縮力を過小評価する。幼虫は、テスト期間中に開発していきますので、第二に、複数の実験群のテスト以来、グループ間で交互に数時間(20〜30分/幼虫)、取ることができます。
前述の機器の一部が最大収縮力の測定( 例えば力変換器、現在の刺激)のために不可欠である一方、他の項目は絶対に必要ではありません。ビデオサルコメア長システムが望ましいが、必須ではありません。代替として、痙攣一連の最大収縮力が達成されるまで、幼虫の長さを調整する時に最適な長さを見つけるために使用することができる。温度制御システムは、必ずしも必要ではない。時測定温度制御が重要である最大収縮力は温度の小さな変化に特に敏感ではなく、室温で測定することができるのに対し、温度に非常に敏感であるジューリング収縮動態、。かかわらず、室内の温度の力試験中、幼虫の前に正確なステージングのテストを強制的に28.5°C 24の最適な成長温度に維持されなければならないことに留意されたい。
幼虫tricaineを含むタイロード溶液中でテストされます。私たちは神経系により誘発される自発的な収縮をなくすため、力のテスト中に疲労を防止するために、(w / v)のtricaine、麻酔24に推奨濃度は0.02%を使用しています。 Tricaineはまた、タイでのステップを容易にし、全体的なテスト時間を短縮します。しかし、我々は、試験溶液中にtricaineを含むことは常に約30%の最大収縮力を減少させることを観察する。同様の効果がtricaiここで、オタマジャクシ尾筋で観察されている神経筋伝達が遮断された後にneがtricaine 25が筋肉に直接影響を有することを示唆して、力発生を減少させた。それは神経細胞26の場合と同様にTricaineは、細胞膜を横切っナトリウムコンダクタンスを減少させることによって筋細胞の興奮性を低減することができる。運動ニューロンによる活性化を阻止するためのその他のオプションは、D-ツボクラリン及びα-ブンガロトキシンですが、tricaineとは異なり、これらの化合物は、皮膚浸透性ではなく、頭部、脊髄、心臓27に直接注入しなければなりません。個々の研究者はtricaineが彼らの特定のアプリケーションのために望ましいかどうかを評価する必要があるでしょう。 tricaineがテストソリューションに含まれている場合tricaineの効果が実験群間で変化しないことを確認する必要があり、濃度が実験や研究者の間で一貫している必要があります。
我々は3 DPFとして若く7 DPFと同じくらい古いように幼虫のためにこの方法を説明する。筋線維は、カンフーのように見えますが3 DPFは、テスト機器に幼虫を結ぶ妨げ前に自発テールの動きが27、尾の短い長さを開始17時間後の受精、早けれnctional。多くの疾患モデルは、この時間よりもはるかに長く生きていけないので、我々は一般的に7 DPF後に幼虫のテストは行わないでください。 5 DPF超え幼虫をテストする場合は、幼虫を供給すべきである。私たちは、未吸血幼虫が減少卵黄嚢が原因そう、小さい筋肉を持って飼育幼虫未満最大収縮力を発生することを観察した。したがって、外部給電の追加変数を避けるために、DPF 3-5間の幼虫をテストすることが望ましい場合がある。
要約すると、我々は、ゼブラフィッシュ幼虫の体幹筋肉の最大単収縮時の力の生成を測定するための定量的かつ信頼性のある方法が記載されている。この方法は、ゼブラフィッシュ幼生筋肉の全体的な健康状態を評価するために使用され、特に筋肉の機能に関する情報を提供することができます。についての情報を提供することに加えて力発生の大きさは、この技術は、力発生の動態を研究するために、または筋肉疲労22を研究するために適合させることに使用することができる。我々は、野生型幼虫で使用するためにこの技術を説明するが、この方法は、筋肉損傷は、筋疾患モデルを特徴付けるや治療を評価する、または筋肉の発達を研究するために、遺伝的に改変された幼虫又は薬物または毒物で処理した幼虫のために使用することができる、または筋肉関連の化学毒性。
開示事項
著者は、彼らが競合する経済的利益を持っていないことを宣言します。
謝辞
著者らは、ゼブラフィッシュの飼育の支援のためにアンジェラバスタに感謝します。この作品は、国立衛生研究所(AG-020591へSVBとJJDに1K08AR054835)によってサポートされていました。
資料
| Name | Company | Catalog Number | Comments |
| REAGENTS | |||
| Tricaine powder | Sigma-Aldrich | A5040 | |
| Sodium chloride | Sigma-Aldrich | S7653 | |
| Potassium chloride | Sigma-Aldrich | P9541 | |
| Calcium chloride dihydrate | Sigma-Aldrich | 223506 | |
| Magnesium chloride hexahydrate | Sigma-Aldrich | M2670 | |
| Sodium phosphate monobasic | Sigma-Aldrich | S0751 | |
| Sodium bicarbonate | Sigma-Aldrich | S6297 | |
| Ethylenediaminetetraacetic acid disodium salt dihydrate | Sigma-Aldrich | E5134 | |
| EQUIPMENT | |||
| Nonsterile-suture | Ashaway Line Twine | S30002 | USP 10/0 monofilament nylon (3 ply) |
| Forceps | Fine Science Tools | 11251-20 | Dumont #5 |
| Spring scissors | Fine Science Tools | 15000-08 | Vannas |
| Stereo microscope | Leica Microsystems | MZ8 | Illuminated with Fostec EKE ACE I light source |
| Force transducer |  Aurora Scientific Aurora Scientific | 400A | |
| Length controller |  Aurora Scientific Aurora Scientific | 318B | |
| XYZ positioning devices | Parker Hannifin | 3936M | |
| Thermometer | Physitemp | BAT-12 | |
| Disposable transfer pipette | Fisher Scientific | 13-711-9AM | Cut end to widen opening and facilitate larva transfer |
| Petri dish | Fisher Scientific | 08-757-11YZ | |
| Glass pipette | Fisher Scientific | 13-678-8B | Cut end (and fire-polish) to widen opening and facilitate larva transfer |
| Inverted microscope | Carl Zeiss Microscopy | Axiovert 100 | |
| Water bath circulator | Neslab Instruments | RTE-111 | |
| Temperature controller | Alpha Omega Instruments | Series 800 | |
| Stimulator |  Aurora Scientific Aurora Scientific | 701C | High-power, follow stimulator |
| Video sarcomere length system |  Aurora Scientific Aurora Scientific | 900B-5A | |
| LabVIEW software | National Instruments | ||
| Oscilloscope | Nicolet Technologies | ACCURA 100 | |
| Microblade | Fine Science Tools | 10050-00 | |
| Microblade holder | Fine Science Tools | 10053-13 | |
| Data analysis software (Signo) | Alameda Applied Sciences | ||
参考文献
- Bassett, D. I., Bryson-Richardson, R. J., Daggett, D. F., Gautier, P., Keenan, D. G., Currie, P. D. Dystrophin is required for the formation of stable muscle attachments in the zebrafish embryo. Development. 130 (23), 5851-5860 (2003).
- Nixon, S. J., Wegner, J., et al. Zebrafish as a model for caveolin-associated muscle disease; caveolin-3 is required for myofibril organization and muscle cell patterning. Hum. Mol. Genet. 14 (13), 1727-1743 (2005).
- Hall, T. E., Bryson-Richardson, R. J., et al. The zebrafish candyfloss mutant implicates extracellular matrix adhesion failure in laminin α2-deficient congenital muscular dystrophy. PNAS. 104 (17), 7092-7097 (2007).
- Hirata, H., Watanabe, T., et al. Zebrafish relatively relaxed mutants have a ryanodine receptor defect, show slow swimming and provide a model of multi-minicore disease. Development. 134, 2771-2781 (2007).
- Dowling, J. J., Vreede, A. P., et al. Loss of myotubularin function results in t-tubule disorganization in zebrafish and human myotubular myopathy. PLoS Genet. 5 (2), e1000372 (2009).
- Berger, J., Berger, S., Hall, T. E., Lieschke, G. J., Currie, P. D. Dystrophin-deficient zebrafish feature aspects of the Duchenne muscular dystrophy pathology. Neuromuscul. Disord. 20 (12), 826-832 (2010).
- Kawahara, G., Guyon, J. R., Nakamura, Y., Kunkel, L. M. Zebrafish models for human FKRP muscular dystrophies. Hum. Mol. Genet. 19 (4), 623-633 (2010).
- Wallace, L. M., Garwick, S. E., et al. DUX4, a candidate gene for facioscapulohumeral muscular dystrophy, causes p53-dependent myopathy in vivo. Ann. Neurol. 69, 540-552 (2011).
- Sztal, T. E., Sonntag, C., Hall, T. E., Currie, P. D. Epistatic dissection of laminin-receptor interactions in dystrophic zebrafish muscle. Hum. Mol. Genet. , (1093).
- Kawahara, G., Karpf, J. A., Myers, J. A., Alexander, M. S., Guyon, J. R., Kunkel, L. M. Drug screening in a zebrafish model of Duchenne muscular dystrophy. PNAS. 108 (13), 5331-5336 (2011).
- Berger, J., Berger, S., Jacoby, A. S., Wilton, S. D., Currie, P. D. Evaluation of exon-skipping strategies for Duchenne muscular dystrophy utilizing dystrophin-deficient zebrafish. J. Cell Mol. Med. 15 (12), 2643-2651 (2011).
- Seger, C., Hargrave, M., Wang, X., Chai, R. J., Elworthy, S., Ingham, P. W. Analysis of Pax7 expressing myogenic cells in zebrafish muscle development, injury, and models of disease. Dev. Dyn. 240, 2440-2451 (2011).
- Postel, R., Vakeel, P., Topczewski, J., Knöll, R., Bakkers, J. Zebrafish integrin-linked kinase is required in skeletal muscles for strengthening the integrin-ECM adhesion complex. Dev. Biol. 318 (1), 92-101 (2008).
- Zoeller, J. J., McQuillan, A., Whitelock, J., Ho, S. Y., Iozzo, R. V. A central function for perlecan in skeletal muscle and cardiovascular development. J. Cell Biol. 181 (2), 381-394 (2008).
- Kim, H. R., Ingham, P. W. The extracellular matrix protein TGFBI promotes myofibril bundling and muscle fibre growth in the zebrafish embryo. Dev. Dyn. 238, 56-65 (2009).
- Beqqali, A., Monshouwer-Kloots, J., et al. CHAP is a newly identified Z-disc protein essential for heart and skeletal muscle function. J. Cell Sci. 123 (7), 1141-1150 (2010).
- Huang, H., Huang, C., et al. Toxicity, uptake kinetics and behavior assessment in zebrafish embryos following exposure to perfluorooctanesulphonicacid (PFOS). Aquat. Toxicol. 98 (2), 139-147 (2010).
- Sylvain, N. J., Brewster, D. L., Ali, D. W. Zebrafish embryos exposed to alcohol undergo abnormal development of motor neurons and muscle fibers. Neurotoxicol. Teratol. 32 (4), 472-480 (2010).
- Chandrasekar, G., Arner, A., Kitambi, S. S., Dahlman-Wright, K., Andersson-Lendahl, M. Developmental toxicity of the environmental pollutant 4-nonylphenol in zebrafish. Neurotoxicol. Teratol. 33 (6), 752-764 (2011).
- Buss, R. R., Drapeau, P. Activation of embryonic red and white muscle fibers during fictive swimming in the developing zebrafish. J. Neurophysiol. 87 (3), 1244-1251 (2002).
- Telfer, W. R., Nelson, D. D., Waugh, T., Brooks, S. V., Dowling, J. J. neb: a zebrafish model of nemaline myopathy due to nebulin mutation. Dis Model Mech. 5, 389-396 (2012).
- Dowling, J. J., Arbogast, S., et al. Oxidative stress and successful antioxidant treatment in models of RYR1-related myopathy. Brain. 135 (4), 1115-1127 (2012).
- Dou, Y., Andersson-Lendahl, M., Arner, A. Structure and function of skeletal muscle in zebrafish early larvae. J. Gen. Physiol. 131, 445-453 (2008).
- Westerfield, M. . The zebrafish book: a guide for the laboratory use of zebrafish (Danio rerio). , (2000).
- Herr, V. D., Sonnenburg, D. C., Courogen, P. M., Fiamengo, S. A., Downes, H. Muscle weakness during tricaine anesthesia. Comp Biochem Physiol Part C. 110 (3), 289-296 (1995).
- Frazier, D. T., Narahashi, T. Tricaine (MS-222): effects of ionic conductances of squid axon membranes. Eur. J. Pharmacol. 33 (2), 313-317 (1975).
- Saint-Amant, L., Drapeau, P. Time course of the development of motor behaviors in the zebrafish embryo. J. Neurobiol. 37 (4), 622-632 (1998).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved