Method Article
Измерение силы при сжатии для оценки функции мышц в личинки данио
В этой статье
Резюме
Силы измерения можно использовать для демонстрации изменения в мышечной функции в связи с развитием, травмы, болезни, лечение или химической токсичности. В этом видео, мы демонстрируем метод измерения силы во время максимального сокращения данио личиночные мышцы туловища.
Аннотация
Личинки данио предоставить модели развития мышц, мышц и мышечных заболеваний связанных химической токсичности, но соответствующих исследований часто не хватает функциональной меры мышечного здоровья. В этом видео статье мы демонстрируем метод измерения силы поколения при сокращении мышц личиночной данио ствола. Силы измерения достигнуто путем размещения под наркозом личинка в камеру, заполненную раствором соли. Передний конец тела личинки связана с датчиком силы и задний конец личинки связана с длиной контроллера. Изометрическое сокращение дергаться это вызвало путем электрической стимуляции поля и сил реагирования записывается для анализа. Формирование сил во время сокращения позволяет определить общее состояние здоровья мышц и, в частности обеспечивает измерение мышечной функции. Хотя мы опишем эту технику для использования с диким типом личинки, этот способ может быть использован с генетически модифицированной личинок или личинок лечить с помощью препаратов или токсических веществ,Для характеристики моделей мышечных заболеваний и оценку лечения, или для изучения развития мышц, травмы или химической токсичности.
Введение
Молодые данио (Danio рерио) личинки, 3-7 дней после оплодотворения (DPF), получают все большее признание в качестве полезного для организма исследований скелетных мышц. Молодые личинки используются для моделирования человеческих заболеваний мышц 1-9, оценивать лекарственных препаратов и терапевтических стратегий 10-11, кабинет 12 мышечных травм, понять развитие мышц 13-16, а также расследовать мышц связанных химической токсичности 17-19. Типичные исследования в этих областях исследовать степень, до которой здоровых мышц отображается ненормальное генетической манипуляции или воздействие токсикантов, а некоторые исследования исследовать степень, до которой аномальный мышца реагирует на лечение. Важнейшее значение для успеха этих исследований является возможность точно оценить мышцы здоровья.
Хотя существуют различные методы для оценки здоровья в мышцах личинки данио, только немногие имеют прямую информацию о функции мышц. Мышцы здоровья, как правило, оцениваются appearancе, по оценке гистологического окрашивания 6,8,11, иммунным 9,15,16,18, 3,13 световой микроскопии, электронной микроскопии 3,4,14,16 или двулучепреломления 7,9,11, но эти методы обеспечивают морфологической информации. Туловища и хвоста перемещений и скорости плавания 4,17 оценить двигательную функцию, но они не являются прямыми мерами функции мышц, так как они также отражают нервный входной сигнал, энергетический обмен, и другие процессы.
В противоположность этому, измерение генерации силы при сжатии обеспечивает прямой оценки мышечной функции и представляет собой меру общего состояния здоровья мышц. Дополнительные преимущества этого подхода включают непосредственный анализ данных и количественных результатов. В этом видео статье, мы предоставляем подробную процедуру для измерения силы поколения личиночной мышц, в надежде, что больше исследователей будет использовать этот метод в дополнение к существующим мерам мышечного здоровья в своих исследованиях.
Общая цель этого метода заключается в измерении силы поколения при сокращении мышц личиночной данио ствола. Для достижения этой цели, личинки данио находится под наркозом, и помещают в камеру, наполненную раствором соли. Передний конец тела личинки связана с датчиком силы и задний конец личинки связана с длиной контроллера. Мышцы активации осуществляется электрическое стимулирование поле и ток возбуждения и длины личинки корректируются, чтобы достичь максимальной силы сокращений. Изометрическое сокращение дергаться это вызвало и Силах реагирования записывается для анализа.Чтобы было ясно, этот метод не измеряет сил, возникающих при личиночной мышц во время плавания. Поскольку оба конца личинки привязаны к оборудованию и потому, что личинка остается под наркозом, он не может начать движение во время тестирования. Кроме того, поле стимуляция активирует все мышечных волокон, в то же время, чтобы вызвать млрд.ateral сокращения, которые не то, что естественно происходит 20. Поэтому вместо того, измерения фактически сил, возникающих во время плавания, этот метод определяет возможность генерирования силы личиночной мышц.
Мы использовали эту технику, чтобы продемонстрировать слабость мышц в данио модель немалиновой миопатия 21, а также для оценки влияния антиоксидантов на лечении мышечной функции в данио модель мульти-MiniCore болезни 22. Другие использовали подобную технику 23 по изучению влияния загрязнителя окружающей среды на мышечную функцию 19.
протокол
Примечание: все процедуры, связанные с данио должны быть выполнены в соответствии с действующими руководящими принципами, правилами и регулирующими органами. Все животные использование процедуры, показанные в этой статье, были одобрены Университета Мичигана Комитета по использованию и уходу за животными (UCUCA).
1. Сделать шовные петли
- Используйте пинцет, чтобы отделить нестерильные шовные (USP 10/0 моноволокна нейлона, 3-слойные) в трех нитей.
- Начать завязать двойной узел сверху в одной из нитей. Стоп, прежде чем затягивать узел полностью, чтобы сделать небольшой (~ 1 мм в диаметре) цикла, а не узел.
- Используйте ножницы, чтобы вырезать избыточное шва от петли хвосты. Пример готовой петли показан на рисунке 1.
- Поместите петлю на липкую сторону пост это к сведению для дальнейшего использования. Шовные петли будут использоваться для хранения личинок на месте во время тестирования силы.
- Повторите шаги 1.1-1.4 по мере необходимости. Makэлектронной два шва петли для каждой личинки, которые будут проверены.
2. Решение сделать тестирование
- Сделать Tyrodes раствора добавлением 7,977 г хлорида натрия, 0,373 г хлорида калия, 0,265 г дигидрата хлорида кальция, магния 0,102 г гексагидрата хлорида, 0,048 г одноосновного фосфата натрия, 1,000 г бикарбоната натрия и 0,037 г этилендиаминтетрауксусной кислоты дигидрат динатриевой соли на 1000 мл очищенной воды.
- Раствор перемешивают, пока соль полностью не растворится. Этот раствор можно хранить в течение месяца при 4 ° С.
- Добавить 2,1 мл 4 мг / мл Tricaine, подготовленный согласно Книге данио рерио 24, до 47,9 мл Tyrodes решения и перемешать. Защитить это решение от света, сохраняя его в темной стеклянной бутылке или в стеклянную бутылку, покрытую алюминиевой фольгой. Это решение следует хранить при комнатной температуре и предложат свежую.
3. Свяжите Aanesthetized Личинка в экспериментальной камере
- Место испытательной установки (рис. 2) на сцене стерео микроскоп.
- Подключить преобразователь силы и длины кабелей контроллера устройства для тестирования. Включите датчик силы. Включите длины импульса, чтобы она оставалась жесткой. (Примечание:.. Длина контроллер обеспечивает возможность растягиваться или сократить мышечного препарата в течение сжатие Однако, эта функция длины контроллер не используется в описанном здесь способе Поэтому длина контроллер можно рассматривать как жесткое крепление точка установлена на системы позиционирования XYZ).
- С одноразовой пипетки передачи, заполните экспериментальной камере с тестированием решения.
- Используйте пинцет, чтобы забрать шва петли одним из хвостов и повесить его на трубку преобразователя силы. Повесить вторую петлю шва на трубе прикреплен к длине контроллера. (Примечание: Захват шовные петли на изогнутой части может перегибать шва и КауSE к поломке во время последующих шагов).
- С одноразовой пипетки передачи, передачи личинки данио в небольшую чашку Петри с тестированием решения. Подождите, пока анестетик в тестировании решения (Tricaine) вступили в силу (~ 1 мин). Пинцетом, осторожно подтолкнуть хвост и убедиться, что личинки под наркозом из-за отсутствия сенсорного вызвали плавание.
- Используйте стеклянную пипетку передать личинке экспериментальной камере.
- По мягко подталкивая личинка с закрытыми щипцами, руководство передняя часть личинки через петлю шва на трубе датчик силы. Руководство передняя часть личинки через петлю шва на трубе. Возьмитесь за обе петли хвосты шва пинцетом и вытащить их одновременно, чтобы затянуть петлю шва кзади от желтка или плавательного пузыря (рис. 3А).
- С щипцы, держать одну петлю шва хвост и тянуть, в результате чего личинка не поворачиваться на 90 ° вокруг трубы до боковой стороны личинки лицас до (рис. 3В). Если петля затянулась достаточно, будет некоторое сопротивление к напряжению; личинка не должен сразу же повернуться легко. Если петля затянулась слишком много, личинка поворачивается не вокруг трубки.
- Использование устройства позиционирования XYZ прикреплены к длине контроллер, перемещать трубку длиной контроллер вдоль оси Х (ось определения на фиг.2А), и в соответствии с туловища и хвоста личинки. Свободное пространство между концами трубки контроллер длины и трубки датчика силы.
- Руководство шва петлю на хвосте личинки и затяните петлю шва, как описано ранее (рис. 3в). Возможно, вам придется повернуть задней части личинки так, чтобы боковой стороной вверх. Обрежьте нить петли хвосты (рис. 3D).
4. Позиция Личинка в экспериментальной камере
- Переместить личинке соответствующем расстоянии от основания камеры для обеспечения личинки Wплохо быть в "рабочее расстояние" инверсной объектив микроскопа во время последующих шагов. Чтобы достичь этого, использование устройств XYZ позиционирование медленно снизить труб (с прикрепленными личинка) вдоль Z-оси, пока трубы просто прикоснуться к нижней части камеры. Затем поднимите трубы, пока личинки не соответствующем расстоянии от дна камеры (~ 100 мкм).
- Использование устройства позиционирования XYZ прикреплены к длине контроллер регулировки длины трубки контроллер вдоль оси ординат, чтобы выровнять длинной оси личинки с длинной оси трубки преобразователь силы.
5. Запись силы во время максимального сокращения Twitch
- Перемещение устройства для тестирования на стадию инвертированного микроскопа.
- Отрегулируйте температуру в камере до нужного значения. Для начала подключения циркуляционный водяной бане, термометр и регулятор температуры в испытательной аппаратуры. Включите необходимые компоненты и настройки параметров от температуры контрOller до термометр сообщает желаемого значения. Данные, содержащиеся в этой статье, были собраны в 25 ° C, но измерения также могут быть сделаны при комнатной температуре на 28,5 ° C.
- Подключите кабели от стимулятора к тестированию аппарата. Включите питание на стимулятор, но никогда не стимулируют личинки до шага 5.6.
- Убедитесь, что личинки параллельна нижней камере. Через объектив 40Х, просматривать часть личинка между концами труб. Если параллельно дну, оба конца личинки будут в фокусе. Если необходимо, выберите трубку датчика силы вдоль оси Z, пока оба конца находятся в фокусе.
- Убедитесь, что личинки длиной короче оптимальной. Включите длина системы саркомера видео и вращать видеокамеру таким образом, что страты параллельны сторонам кадра. Эта система контролирует полосатость интервал путем анализа изменений интенсивности пикселей на каждой горизонтальной строки пикселей в пределах определенного пользователем интерес области(ROI). Результаты для всех строк в ROI усредняются и сообщил с частотой эквивалентно видео частотой кадров (≥ 80 с -1). Полосатость интервал используется как индикатор длины саркомера.
- Настройте микроскоп, чтобы сосредоточиться на периферийных волокон и обратите внимание на указанные длины саркомера. При необходимости, использовать устройство позиционирования XYZ прикреплены к длине контроллер для регулировки длины личинки (по оси Х), пока саркомера длина меньше оптимальной (например, 1,90 мкм).
- Отрегулируйте ток стимуляции для оптимизации силы сокращений. Для начала установить выходной ток на стимулятор низкую величину (например, 100 мА). Стимулятор можно запустить вручную или с помощью компьютера под управлением пользовательской программы LabVIEW. Вызвать подергивание мышц с личиночной импульса тока 0,2 мс по продолжительности.
- Используйте осциллограф для записи выходной силы и измерение пиковой силы сокращений использованием курсоров осциллографа. Увеличить токна 50 мА и шагом измерение пиковой силы сокращений на каждом текущем уровне. Подождите 30 секунд между дергается, чтобы предотвратить усталость. В качестве стимулирующего тока увеличивается, пик силы сокращений обычно возрастает до максимума, а затем постепенно уменьшается. Тока, при котором личинка генерирует наибольшей силой является оптимальной текущей стимуляции. Установите амплитуды тока к оптимальной текущей стимуляции.
- Использование устройства XYZ позиционирования, регулировать длину личинка (и, следовательно, длина саркомера) для того, чтобы вызвать максимальное силы сокращений. Дикого типа личинки данио (3-7 DPF) получения максимальной силы сокращений при длине саркомера 2,10 мкм или 2,15 мкм. Тем не менее, саркомера длина может быть установлена на 2,08 мкм, чтобы избежать избыточной нагрузки на личинку.
- Вызвать подергивание личиночной мышц. Используйте осциллограф для записи силы реагирования и сохранить запись для последующего анализа.
6. Измерьте размеры мускулатуры с Личинка на оптимальную длину
- Переместить тестирования аппарата обратно в стерео микроскопа.
- Используя окуляр масштабе, измерить высоту мускулатуру, если смотреть со стороны. Затем, стараясь не изменить Длина личинки, поворотная личинка на 90 °, используя хвосты шва петли для просмотра личинку снизу. Измерьте ширину мускулатуры, если смотреть снизу. Возьмите измерений на анатомические ориентира (например, урогенитальные открытия) (рис. 4).
- Разрежьте шва петли с MicroBlade выпустить личинку от испытательного оборудования.
Результаты
У здоровых дикого типа личинки данио, мышечные волокна должны быть параллельны друг другу без больших зазоров между ними и имеют очевидные страты (фиг.5А). Дикого типа личинки данио, которые не проявляют эти функции, или с явными повреждений, таких как отдельный волокон (рис. 5В), должны быть отброшены.
Представитель участок пика силы сокращений по сравнению с текущей стимуляции для одной личинки данио показано на рисунке 6. Для дикого типа личинки данио 3-7 денье, оптимальный ток стимуляции обычно находится в пределах 400-600 мА, с 3 денье личинки обычно требует большего тока, чем стимуляция 6-7 личинок денье.
Необработанные данные силы (собранных на стадии 5.8) должно быть обработано и проанализировано с помощью программного обеспечения анализа данных. Во-первых, базовая сила записи устанавливается в ноль. Во-вторых, выходное напряжение датчика силы преобразуется в силу (мN) (см. инструкции производителя для создания калибровочной кривой для датчика силы). Ответ представителя сил собранные во время максимального сокращения подергивание одной личинки показано на рисунке 7. Анализ данных программное обеспечение может быть использовано для измерения пиковое усилие и другие особенности сила реакции.
Репрезентативный набор данных пика силы от максимального сокращения дергаться показан на рисунке 8А. Типичные пик силы сокращений значения для дикого типа 3-7 DPF личинки диапазоне от 0,9 до 1,7 млн., личинки старших производя больше силы, чем более молодые личинки. Различия в пике силы сокращений может быть связано с нормальным процессам, как рост и развитие (рис. 8) или аномальные процессы, такие как генная мутация связанных патологии 21,22.
Нормализация мышечными площадь поперечного сечения (CSA) может использоваться, чтобы определить, в какой степени различия в пике силы сокращений просто из-за Differe NCES в размере 21,22 мускулатуры. Мышцы CSA может быть оценена с использованием формулы: CSA = π (A / 2) (B / 2), где А представляет собой высоту мускулатуры, если смотреть со стороны, В представляет собой ширину мускулатуры, если смотреть снизу, и эллиптическое поперечное сечение предполагается. Типичные значения CSA для дикого типа 3-7 DPF личинки диапазоне от 0,027 до 0,034 мм 2, с 3-4 личинок DPF обычно выступающий меньшие значения, чем CSA 5-7 личинок DPF. Представитель множество нормированных данных пика силы от максимальной сокращений дергаться показан на рисунке 8Б. Типичные нормированный пик силы сокращений значения для дикого типа 3-7 денье личинки диапазоне от 34 до 51 мН / мм 2, с 4-7 денье личинки обычно показывает большие значения, чем 3 денье личинок.

Рисунок 1. Шовные петли. Стрелки указывают на хвосты шва петли.

Рисунок 2. (А) Тестирование аппарата с мечеными компонентами. (B) крупным планом вид на экспериментальной камере. (А) Экспериментальная камера с прозрачным дном. (Б) Датчик силы. (C) Длина контроллера. (D) XYZ устройств позиционирования. X, Y и Z. определены в верхнем правом углу. (Е) Система контроля температуры использованием термоэлектрических модулей. Трубки вмещает воды для охлаждения термоэлектрических модулей. (F) Труба из нержавеющей стали придает датчик силы. (G) трубки из нержавеющей стали придает длины импульса. (Ч) Термометр микрозонде. (I) Платиновый параллельных пластинчатых электродов, охватывающий длинакамеры. Платиновые пластины 2,5 мм и 0,255 мм.
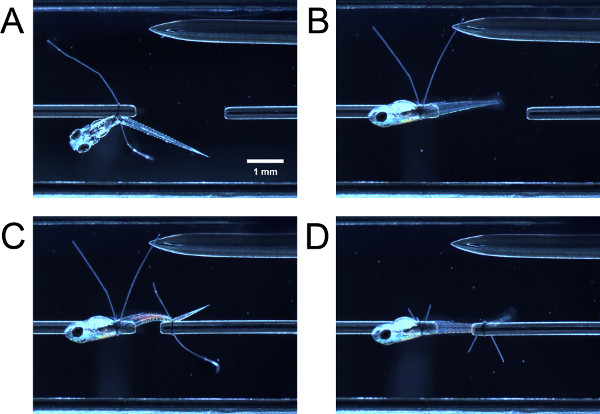
Рисунок 3. Связывание личинки в экспериментальной камере. (A) Личинка привязали на переднем конце, но еще не поворачивается на 90 °. (B) Личинка после повернутой на 90 °. (C) Личинка привязали к заднему концу, но еще не поворачивается. (D) Личинка после повернутой и шовные хвосты петли обрезаются.
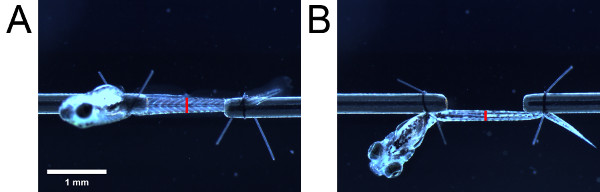
Рисунок 4. Измерения на площадь поперечного сечения оценку. Мускулатуры, если смотреть с (А) и боковой (B) дно. Размещение красной полосы указывают расположение мочеполовой открытия. Длина красной полосы указывают ширину и высоту мускулатуры, если смотреть сбоку и снизу соответственно.
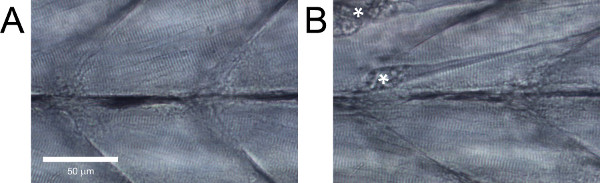
Рисунок 5. Боковой вид рыбок данио мускулатуры стволе личинок. (A) здоровых тканей. (B) Ткань с явным повреждениям. Контрактуры в результате волокна отряды помечены звездочкой.
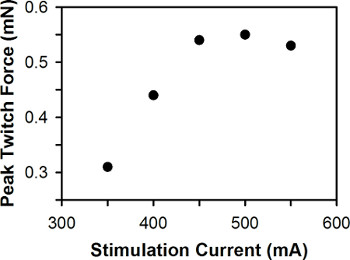
Рисунок 6. Представитель участок пика силы сокращений против стимуляции током. Оптимального текущего стимуляции составляет 500 мА.
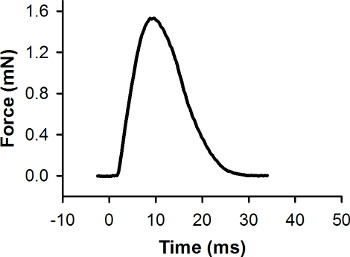
Рисунок 7. Представитель сил рекорд по отдельным сокращением дергаться. Это сокращение было выявляется с помощью стимулов импульса на 0 мс. Пик сила 1,56 мН.
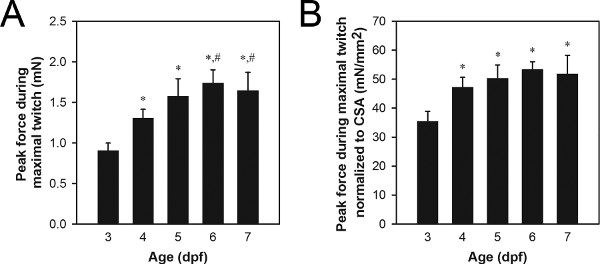
Рисунок 8. Представитель данные силу с 3-7 DPF личинок. (A) Максимальное усилие данных из максимального сокращения дергаться. (B) Максимальное усилие данных из максимального сокращения дергаться нормированы на CSA. Старые личинки (6-7 DPF) кормили Hatchfry Encapsulon класса 0 с Спирулина (Argent Laboratories), начиная с 5 DPF. Средство + стандартное отклонение сообщается с N = 5 в каждой группе. Группы значительно отличается от 3 денье личинки (*) и 4 денье личинки (#) указаны (ANOVA, р <0,05). Значительное увеличение нормированной силы между 3 и 4 денье (B) указывает на увеличение внутренней силы, создаваемой возможность в течение этого периода времени, в то время как увеличение силы между 4 и 6-7 денье (A) связан с ростом не на основе не изменения с 4 на 7 DPF в нормализованной силы.
Обсуждение
Этот метод мер по формированию сил во время дергаться для оценки функции мышц в багажник мышцы личинки данио. Хотя тетаническое сокращения могут быть выявлены в личинки данио (например, путем стимуляции 200 имп / сек в течение от 0,2 сек), то максимальное усилие тетаническое только на 10-15% больше, чем максимальное силы сокращений. Таким образом, сила, создаваемая во время дергаться является разумной мерой силы возможностью генерации. Twitches предпочтительнее тетаническое сокращений, потому что дергается, менее вероятно, чтобы вызвать разрыв или соскальзывание на шовный связей.
Для того, чтобы генерировать значимые данные с этой техникой, максимальная силы сокращений должна быть достигнута для каждой личинки и изменчивости между экспериментальными группами должны быть минимизированы. С учетом этих целей, мы предлагаем следующие предложения. Во-первых, будьте внимательны, когда личинка связывая с преобразователем силы и длины труб контроллера. Если шовные петли затянуты слишкоммного, шовный будет прорезать мышечной ткани. Если шовные петли не затянут достаточно, усилие, создаваемое личинки не будет полностью передается на датчик силы. Обе ситуации, но особенно последнего, недооценивать максимальной силы сокращений. Во-вторых, поскольку тестирования нескольких экспериментальных группах может занять несколько часов (20-30 мин / личинка), чередуются между группами, потому что личинки продолжают развиваться в течение периода тестирования.
Хотя некоторые из указанных приборов необходимо для измерения максимальной силы сокращений (например, датчик силы, текущие стимулятор), другие предметы не являются абсолютно необходимыми. Продолжительность ролика саркомер системы желательна, но не обязательна. В качестве альтернативы, серии подергивания может быть использован, чтобы найти оптимальную продолжительность, в течение которой Длина личинки доводили до максимальной силы сокращений не будет достигнута. Система контроля температуры также не является абсолютно необходимым. Контроль температуры очень важно при измеренияхSuring подергивание кинетика, которые очень чувствительны к температуре, тогда как максимальный силы сокращений не особенно чувствительны к небольшим изменениям температуры и может быть измерено при комнатной температуре. Следует отметить, что независимо от температуры в камере во время тестирования силы, личинки должны быть сохранены при оптимальной температуре роста 28,5 ° C до 24, чтобы заставить тестирования для точного определения стадии.
Личинки испытывают в растворе, содержащем Tyrodes Tricaine. Мы используем 0,02% (вес / объем) Tricaine, концентрации, рекомендованной для анестезии 24, для устранения спонтанных сокращений вызванные нервной системы и таким образом предотвратить усталость во время сила тестирования. Tricaine также облегчает тай-на шаг и уменьшает общее время тестирования. Тем не менее, заметим, что в том числе Tricaine в тестировании решений последовательно снижает максимальную силы сокращений примерно на 30%. Аналогичный эффект наблюдается и в мышцах хвоста головастика, где tricaiNE уменьшена сила поколения после нервно-мышечной передачи был заблокирован, предполагая, что Tricaine имеет прямое влияние на мышцы 25. Tricaine может уменьшить возбудимость мышечных клеток путем снижения натрия проводимость через клеточную мембрану, как это происходит в нервных клетках 26. Другие варианты для блокирования активации мотонейронов являются D-тубокурарина и α-бунгаротоксина но, в отличие Tricaine, эти соединения не являются кожу проницаемой и должны быть введены непосредственно в головной, спинной мозг, или сердце 27. Отдельных исследователей нужно будет оценить, является ли или нет Tricaine желательно для их конкретного применения. Если Tricaine входит в тестировании растворе концентрацию должны быть согласованы между экспериментами и исследователи должны проверить, что эффект Tricaine не изменяется между экспериментальными группами.
Опишем этот метод для личинок в возрасте 3 и DPF же стара, как 7 DPF. Хотя мышечных волокон кажутся фуnctional уже в 17 часов после оплодотворения, когда спонтанных движений хвоста начинают 27, короткая длина хвоста до 3 DPF мешает связывая личинке тестирования оборудования. Как правило, мы не испытываем личинки после 7 DPF, так как многие модели болезни не выживают гораздо дольше, чем на этот раз. Если тестирование личинки за пределы 5 DPF, личинки должны питаться. Мы заметили, что голодные личинки имеют меньшие мышцы и выделяют меньше максимальной силы сокращений, чем кормят личинок, вероятно, связано с уменьшением желточного мешка. Таким образом, может быть желательно для проверки личинок между 3-5 денье, чтобы избежать дополнительной переменной внешнего питания.
Таким образом, мы описываем количественных и надежный метод измерения силы поколения во время максимального сокращения подергивание мышц личиночной данио ствола. Этот метод может быть использован для оценки общего состояния здоровья рыбок данио личиночной мышц и, в частности предоставляет информацию о функции мышц. В дополнение к предоставлению информации оВеличина силы поколения, этот метод может быть использован для изучения кинетики формирования сил или адаптировать для изучения мышечной усталости 22. Хотя мы опишем эту технику для использования с диким типом личинки, этот способ может быть использован для генетически модифицированных личинок или личинок лечить с помощью препаратов или токсических веществ, охарактеризовать модели мышечных заболеваний и оценки лечения, или для изучения развития мышц, мышечную травму или мышцы связанных химической токсичности.
Раскрытие информации
Авторы заявляют, что у них нет конкурирующих финансовых интересов.
Благодарности
Авторы благодарят Ангела Busta за помощь данио хозяйства. Работа выполнена при поддержке Национального института здоровья (AG-020591 в СВБ и 1K08AR054835 к JJD).
Материалы
| Name | Company | Catalog Number | Comments |
| REAGENTS | |||
| Tricaine powder | Sigma-Aldrich | A5040 | |
| Sodium chloride | Sigma-Aldrich | S7653 | |
| Potassium chloride | Sigma-Aldrich | P9541 | |
| Calcium chloride dihydrate | Sigma-Aldrich | 223506 | |
| Magnesium chloride hexahydrate | Sigma-Aldrich | M2670 | |
| Sodium phosphate monobasic | Sigma-Aldrich | S0751 | |
| Sodium bicarbonate | Sigma-Aldrich | S6297 | |
| Ethylenediaminetetraacetic acid disodium salt dihydrate | Sigma-Aldrich | E5134 | |
| EQUIPMENT | |||
| Nonsterile-suture | Ashaway Line Twine | S30002 | USP 10/0 monofilament nylon (3 ply) |
| Forceps | Fine Science Tools | 11251-20 | Dumont #5 |
| Spring scissors | Fine Science Tools | 15000-08 | Vannas |
| Stereo microscope | Leica Microsystems | MZ8 | Illuminated with Fostec EKE ACE I light source |
| Force transducer |  Aurora Scientific Aurora Scientific | 400A | |
| Length controller |  Aurora Scientific Aurora Scientific | 318B | |
| XYZ positioning devices | Parker Hannifin | 3936M | |
| Thermometer | Physitemp | BAT-12 | |
| Disposable transfer pipette | Fisher Scientific | 13-711-9AM | Cut end to widen opening and facilitate larva transfer |
| Petri dish | Fisher Scientific | 08-757-11YZ | |
| Glass pipette | Fisher Scientific | 13-678-8B | Cut end (and fire-polish) to widen opening and facilitate larva transfer |
| Inverted microscope | Carl Zeiss Microscopy | Axiovert 100 | |
| Water bath circulator | Neslab Instruments | RTE-111 | |
| Temperature controller | Alpha Omega Instruments | Series 800 | |
| Stimulator |  Aurora Scientific Aurora Scientific | 701C | High-power, follow stimulator |
| Video sarcomere length system |  Aurora Scientific Aurora Scientific | 900B-5A | |
| LabVIEW software | National Instruments | ||
| Oscilloscope | Nicolet Technologies | ACCURA 100 | |
| Microblade | Fine Science Tools | 10050-00 | |
| Microblade holder | Fine Science Tools | 10053-13 | |
| Data analysis software (Signo) | Alameda Applied Sciences | ||
Ссылки
- Bassett, D. I., Bryson-Richardson, R. J., Daggett, D. F., Gautier, P., Keenan, D. G., Currie, P. D. Dystrophin is required for the formation of stable muscle attachments in the zebrafish embryo. Development. 130 (23), 5851-5860 (2003).
- Nixon, S. J., Wegner, J., et al. Zebrafish as a model for caveolin-associated muscle disease; caveolin-3 is required for myofibril organization and muscle cell patterning. Hum. Mol. Genet. 14 (13), 1727-1743 (2005).
- Hall, T. E., Bryson-Richardson, R. J., et al. The zebrafish candyfloss mutant implicates extracellular matrix adhesion failure in laminin α2-deficient congenital muscular dystrophy. PNAS. 104 (17), 7092-7097 (2007).
- Hirata, H., Watanabe, T., et al. Zebrafish relatively relaxed mutants have a ryanodine receptor defect, show slow swimming and provide a model of multi-minicore disease. Development. 134, 2771-2781 (2007).
- Dowling, J. J., Vreede, A. P., et al. Loss of myotubularin function results in t-tubule disorganization in zebrafish and human myotubular myopathy. PLoS Genet. 5 (2), e1000372 (2009).
- Berger, J., Berger, S., Hall, T. E., Lieschke, G. J., Currie, P. D. Dystrophin-deficient zebrafish feature aspects of the Duchenne muscular dystrophy pathology. Neuromuscul. Disord. 20 (12), 826-832 (2010).
- Kawahara, G., Guyon, J. R., Nakamura, Y., Kunkel, L. M. Zebrafish models for human FKRP muscular dystrophies. Hum. Mol. Genet. 19 (4), 623-633 (2010).
- Wallace, L. M., Garwick, S. E., et al. DUX4, a candidate gene for facioscapulohumeral muscular dystrophy, causes p53-dependent myopathy in vivo. Ann. Neurol. 69, 540-552 (2011).
- Sztal, T. E., Sonntag, C., Hall, T. E., Currie, P. D. Epistatic dissection of laminin-receptor interactions in dystrophic zebrafish muscle. Hum. Mol. Genet. , (1093).
- Kawahara, G., Karpf, J. A., Myers, J. A., Alexander, M. S., Guyon, J. R., Kunkel, L. M. Drug screening in a zebrafish model of Duchenne muscular dystrophy. PNAS. 108 (13), 5331-5336 (2011).
- Berger, J., Berger, S., Jacoby, A. S., Wilton, S. D., Currie, P. D. Evaluation of exon-skipping strategies for Duchenne muscular dystrophy utilizing dystrophin-deficient zebrafish. J. Cell Mol. Med. 15 (12), 2643-2651 (2011).
- Seger, C., Hargrave, M., Wang, X., Chai, R. J., Elworthy, S., Ingham, P. W. Analysis of Pax7 expressing myogenic cells in zebrafish muscle development, injury, and models of disease. Dev. Dyn. 240, 2440-2451 (2011).
- Postel, R., Vakeel, P., Topczewski, J., Knöll, R., Bakkers, J. Zebrafish integrin-linked kinase is required in skeletal muscles for strengthening the integrin-ECM adhesion complex. Dev. Biol. 318 (1), 92-101 (2008).
- Zoeller, J. J., McQuillan, A., Whitelock, J., Ho, S. Y., Iozzo, R. V. A central function for perlecan in skeletal muscle and cardiovascular development. J. Cell Biol. 181 (2), 381-394 (2008).
- Kim, H. R., Ingham, P. W. The extracellular matrix protein TGFBI promotes myofibril bundling and muscle fibre growth in the zebrafish embryo. Dev. Dyn. 238, 56-65 (2009).
- Beqqali, A., Monshouwer-Kloots, J., et al. CHAP is a newly identified Z-disc protein essential for heart and skeletal muscle function. J. Cell Sci. 123 (7), 1141-1150 (2010).
- Huang, H., Huang, C., et al. Toxicity, uptake kinetics and behavior assessment in zebrafish embryos following exposure to perfluorooctanesulphonicacid (PFOS). Aquat. Toxicol. 98 (2), 139-147 (2010).
- Sylvain, N. J., Brewster, D. L., Ali, D. W. Zebrafish embryos exposed to alcohol undergo abnormal development of motor neurons and muscle fibers. Neurotoxicol. Teratol. 32 (4), 472-480 (2010).
- Chandrasekar, G., Arner, A., Kitambi, S. S., Dahlman-Wright, K., Andersson-Lendahl, M. Developmental toxicity of the environmental pollutant 4-nonylphenol in zebrafish. Neurotoxicol. Teratol. 33 (6), 752-764 (2011).
- Buss, R. R., Drapeau, P. Activation of embryonic red and white muscle fibers during fictive swimming in the developing zebrafish. J. Neurophysiol. 87 (3), 1244-1251 (2002).
- Telfer, W. R., Nelson, D. D., Waugh, T., Brooks, S. V., Dowling, J. J. neb: a zebrafish model of nemaline myopathy due to nebulin mutation. Dis Model Mech. 5, 389-396 (2012).
- Dowling, J. J., Arbogast, S., et al. Oxidative stress and successful antioxidant treatment in models of RYR1-related myopathy. Brain. 135 (4), 1115-1127 (2012).
- Dou, Y., Andersson-Lendahl, M., Arner, A. Structure and function of skeletal muscle in zebrafish early larvae. J. Gen. Physiol. 131, 445-453 (2008).
- Westerfield, M. . The zebrafish book: a guide for the laboratory use of zebrafish (Danio rerio). , (2000).
- Herr, V. D., Sonnenburg, D. C., Courogen, P. M., Fiamengo, S. A., Downes, H. Muscle weakness during tricaine anesthesia. Comp Biochem Physiol Part C. 110 (3), 289-296 (1995).
- Frazier, D. T., Narahashi, T. Tricaine (MS-222): effects of ionic conductances of squid axon membranes. Eur. J. Pharmacol. 33 (2), 313-317 (1975).
- Saint-Amant, L., Drapeau, P. Time course of the development of motor behaviors in the zebrafish embryo. J. Neurobiol. 37 (4), 622-632 (1998).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены