Method Article
Mesure de la force lors de la contraction d'évaluer la fonction musculaire en poisson zèbre
Dans cet article
Résumé
mesures de force peuvent être utilisés pour démontrer les changements de la fonction musculaire en raison du développement, les blessures, la maladie, le traitement ou la toxicité chimique. Dans cette vidéo, nous démontrons une méthode pour mesurer la force lors d'une contraction maximale du poisson zèbre muscles du tronc larvaire.
Résumé
Les larves de poisson zèbre fournir des modèles de développement musculaire, maladie du muscle et le muscle lié toxicité chimique, mais des études liées manquent souvent de mesures fonctionnelles de la santé des muscles. Dans cet article, vidéo, nous démontrons une méthode pour mesurer la génération de force lors de la contraction du poisson zèbre muscles du tronc larvaire. mesures de force sont réalisés en plaçant une larve anesthésiés dans une chambre remplie d'une solution de sel. L'extrémité antérieure de la larve est reliée à un transducteur de force et l'extrémité postérieure de la larve est reliée à un contrôleur de longueur. Une contraction isométrique contraction est provoquée par une stimulation de champ électrique et de la réponse de force est enregistré pour l'analyse. La génération de forces lors de la contraction fournit une mesure de la santé musculaire globale et prévoit expressément une mesure de la fonction musculaire. Bien que nous décrivons cette technique pour une utilisation avec des larves de type sauvage, cette méthode peut être utilisée avec des larves génétiquement modifiés ou des larves traitées avec des médicaments ou des produits toxiques,pour caractériser des modèles de maladies musculaires et évaluer les traitements, ou pour étudier le développement des muscles, des blessures ou la toxicité chimique.
Introduction
Poisson zèbre (Danio rerio) Les jeunes larves, 3-7 jours post-fécondation (DPF), sont de plus en plus reconnue comme un organisme utile pour la recherche sur le muscle squelettique. Les jeunes larves sont utilisés pour modéliser la maladie du muscle humain 1-9, évaluer les médicaments et les stratégies thérapeutiques 10-11, lésion musculaire de l'étude 12, 13-16 comprendre développement musculaire, et d'enquêter sur les muscles liés à la toxicité chimique 17-19. Études classiques dans ces domaines examiner la mesure dans laquelle le muscle sain est rendue anormale par manipulation génétique ou l'exposition à des substances toxiques, et certaines études examinent la mesure dans laquelle musculaire anormale réagit au traitement. Essentiel à la réussite de ces études est la capacité d'évaluer avec exactitude la santé des muscles.
Bien qu'il existe une variété de méthodes disponibles pour évaluer la santé des muscles chez les larves de poisson zèbre, peu fournir des informations directes sur la fonction musculaire. santé musculaire est généralement évaluée par appearance, évaluée par coloration histologique 6,8,11, immunologique 9,15,16,18, la microscopie optique 3,13, la microscopie électronique 3,4,14,16 ou biréfringence 7,9,11, mais ces techniques permettent des informations morphologiques seulement. Le tronc et les déplacements de la queue et la vitesse de nage 4,17 évaluer la fonction motrice, mais ce ne sont pas des mesures directes de la fonction musculaire, car ils reflètent également l'entrée de neurones, le métabolisme de l'énergie et d'autres processus.
En revanche, la mesure de génération de force lors de la contraction fournit une évaluation directe de la fonction musculaire et représente une mesure de la santé musculaire globale. Autres avantages de cette approche comprennent l'analyse des données simple et les résultats quantitatifs. Dans cet article, vidéo, nous proposons une procédure détaillée pour mesurer la génération de la force par les muscles larvaires, dans l'espoir que davantage de chercheurs vont utiliser cette méthode pour compléter les mesures existantes de la santé des muscles dans leurs recherches.
L'objectif global de cette méthode consiste à mesurer la génération de la force lors de la contraction du poisson zèbre muscles du tronc larvaire. Pour atteindre cet objectif, une larve de poisson-zèbre est anesthésié et placé dans une chambre remplie d'une solution saline. L'extrémité antérieure de la larve est reliée à un transducteur de force et l'extrémité postérieure de la larve est reliée à un contrôleur de longueur. activation musculaire est réalisé par stimulation de champ électrique, et le courant de stimulation et la longueur de la chenille sont ajustés pour produire la force de contraction maximale. Une contraction isométrique contraction est provoquée et de la réponse de force est enregistré pour l'analyse.Pour être clair, cette technique ne permet pas de mesurer les forces générées par les muscles des larves au cours de natation. Parce que les deux extrémités de la larve sont liés à l'équipement et parce que la larve reste anesthésié, il ne peut pas initier le mouvement pendant l'essai. De plus, la stimulation de champ active toutes les fibres du muscle à la fois pour induire un bilateral contraction, ce qui n'est pas ce qui se produit naturellement 20. Par conséquent, plutôt que de mesurer les forces réelles générées pendant la baignade, cette technique détermine la capacité de production de la force des muscles larvaires.
Nous avons utilisé cette technique pour démontrer la faiblesse musculaire dans un modèle de poisson zèbre de nemaline myopathie 21, ainsi que d'évaluer l'effet du traitement anti-oxydant sur la fonction musculaire dans un modèle de poisson zèbre de maladie multi-minicore 22. D'autres ont utilisé une technique similaire 23 pour examiner les effets d'un polluant de l'environnement sur la fonction musculaire 19.
Protocole
Note: toutes les procédures impliquant le poisson zèbre doivent être effectuées conformément aux directives, règlements, et les organismes de réglementation. Toutes les procédures d'utilisation des animaux présentés dans cet article ont été approuvées par l'Université du Michigan Comité sur l'utilisation et l'entretien des animaux (UCUCA).
1. Faire des boucles de suture
- Utilisez une pince pour séparer suture non stérile (USP 10/0 monofilament de nylon 3 plis) en trois volets.
- Commencez à faire un double nœud dans l'un des brins. Arrêtez avant de serrer le noeud complètement de faire une petite boucle (~ 1 mm de diamètre) au lieu d'un noeud.
- Utilisez des ciseaux pour couper l'excès suture de la queue de boucle. Un exemple d'une boucle finie est illustré à la figure 1.
- Placez la boucle sur le côté collant d'un Post-it pour une utilisation ultérieure. Les boucles de suture seront utilisés pour contenir les larves en place au cours des essais vigueur.
- Répétez les étapes 1.1-1.4 si nécessaire. Make deux boucles de suture pour chaque larve qui sera testé.
2. Assurez solution de test
- Ajouter une solution de Tyrode en ajoutant 7,977 g de chlorure de sodium, 0,373 g de chlorure de potassium, 0,265 g de dihydrate de chlorure de calcium, 0,102 g de chlorure de magnésium hexahydraté, 0,048 g de phosphate de sodium monobasique, 1,000 g de bicarbonate de sodium et 0,037 g acide éthylènediaminetétraacétique sel disodique dihydraté de 1000 ml d' de l'eau purifiée.
- Agiter la solution jusqu'à ce que les sels sont complètement dissous. Cette solution peut être conservée pendant un mois à 4 ° C.
- Ajouter 2,1 ml de 4 mg / ml tricaïne, préparé selon le poisson zèbre Livre 24, à 47,9 solution Tyrodes ml et mélanger. Protéger cette solution de la lumière en les stockant dans une bouteille en verre sombre ou dans une bouteille de verre recouverte d'une feuille d'aluminium. Cette solution doit être conservé à température ambiante et fait frais chaque jour.
3. Attachez Larve Aanesthetized en chambre expérimentale
- Placez l'appareil de test (Figure 2) sur la scène d'un microscope stéréo.
- Connecter le transducteur de force et de câbles de commande de la longueur de l'appareil de test. Mettez le capteur de force. Allumez le contrôleur de longueur de sorte qu'il demeure rigide. (Note:.. Le contrôleur de longueur permet d'étirer ou de raccourcir une préparation musculaire lors d'une contraction Toutefois, cette fonctionnalité du contrôleur de longueur n'est pas utilisé dans le procédé décrit ici conséquent, le contrôleur de longueur peut être considéré comme une fixation rigide Point monté sur un système de positionnement XYZ).
- Avec une pipette de transfert jetable, remplir la chambre expérimentale avec une solution de test.
- Utilisez une pince pour ramasser une boucle de suture par l'une des queues et l'accrocher sur le tube de capteur de force. Accrocher une seconde boucle de fil de suture sur le tube fixé au dispositif de commande de longueur. (Note: saisir une boucle de suture sur la partie incurvée peut plier la suture et CauSE se casser lors des étapes ultérieures).
- Avec une pipette de transfert jetable, transférer une larve de poisson zèbre à une petite boîte de Pétri remplie de solution d'essai. Attendez que l'anesthésique dans la solution d'essai (tricaïne) pour prendre effet (~ 1 min). Avec une pince, pousser doucement la queue et vérifiez que la larve est anesthésié par un manque de contact évoquée par la natation.
- Utilisation d'une pipette en verre pour transférer la larve de la chambre expérimentale.
- En poussant doucement la larve fermés avec une pince, d'orienter la partie antérieure de la larve à travers la boucle de suture sur le tube de capteur de force. Guide de la partie antérieure de la larve à travers la boucle de suture sur le tube. Saisissez les deux queues de boucle de suture avec une pince et tirez-les simultanément pour serrer la boucle de suture postérieure à la vésicule ombilicale ou vessie natatoire (figure 3A).
- Avec une pince, prise une queue de boucle de suture et de tirer, ce qui provoque la larve de pivoter de 90 ° autour du tube jusqu'à ce que le côté latéral de la face de la larves vers le haut (figure 3B). Si la boucle a été assez serré, il y aura une certaine résistance à la traction, la larve ne doit pas pivoter facilement. Si la boucle est trop serré, la larve ne sera pas pivoter autour du tube.
- Utilisation du dispositif de positionnement XYZ fixé au dispositif de commande de longueur, déplacer le tube de commande de la longueur le long de l'axe des X (axe Description de la figure 2A) et sous le tronc et de la queue de la larve. Laisser un espace entre les extrémités du tube de commande de longueur et le tube de capteur de force.
- Guide de la boucle de suture sur la queue de la larve et serrer la boucle de suture tel que décrit précédemment (figure 3C). Vous pouvez avoir besoin de faire pivoter la partie postérieure de la larve de sorte que le côté latéral vers le haut. Couper les queues de boucle de suture (figure 3D).
4. Larve de position en chambre expérimentale
- Déplacer la larve à une distance appropriée de la partie inférieure de la chambre pour assurer le poids des larvesmal-être au sein de "travail à distance" d'un objectif de microscope inversé au cours des étapes ultérieures. Pour ce faire, utiliser les dispositifs de positionnement XYZ pour réduire lentement les tubes (avec larve ci-joint) le long de l'axe Z jusqu'à ce que les tubes juste toucher le fond de la chambre. Ensuite, soulever les tubes jusqu'à ce que la chenille est une distance appropriée de la partie inférieure de chambre (~ 100 pm).
- Utilisation du dispositif de positionnement XYZ fixé au dispositif de commande de longueur, régler le tube de commande de la longueur le long de l'axe Y pour aligner l'axe longitudinal de la chenille, l'axe longitudinal du tube de capteur de force.
5. Force enregistrement pendant une contraction de Twitch maximale
- Déplacer l'appareil de test à la platine d'un microscope inversé.
- Ajuster la température de la chambre à une valeur souhaitée. Pour commencer, connectez le circulateur d'eau de bain, d'un thermomètre et un contrôleur de température de l'appareil de test. Allumez les composants nécessaires et ajuster le réglage du régulateur de tempoller jusqu'à ce que le thermomètre indique la valeur souhaitée. Les données figurant dans cet article ont été recueillies à 25 ° C, mais des mesures peuvent également être effectués à température ambiante ou à 28,5 ° C.
- Connecter les câbles à partir du stimulateur à l'appareil de test. Tournez sur la puissance au stimulateur mais ne stimulent pas la larve jusqu'à l'étape 5.6.
- Assurez-vous que la larve est parallèle au fond de la chambre. Grâce à un objectif 40X, voir la partie de la larve entre les extrémités des tubes. Si parallèle au fond, les deux extrémités de la chenille sera au point. Si nécessaire, ajuster le tube du transducteur de force le long de l'axe Z jusqu'à ce que les deux extrémités sont au point.
- Vérifiez que la longueur de la larve est plus courte que optimale. Allumer le système longueur du sarcomère vidéo et de faire tourner la caméra vidéo de telle sorte que les stries sont parallèles aux côtés de l'image vidéo. Ce système surveille l'espacement des stries en analysant les variations de l'intensité de pixel le long de chaque rangée horizontale de pixels dans une région définie par l'utilisateur d'intérêt(ROI). Les résultats de toutes les lignes au sein du ROI sont des moyennes et rapportés avec une fréquence équivalente à la vidéo frame-rate (≥ 80 sec -1). L'espacement des stries est utilisé comme un indicateur de la longueur des sarcomères.
- Régler le microscope à se concentrer sur les fibres périphériques et noter la longueur de sarcomère indiqué. Si nécessaire, utilisez le dispositif de positionnement XYZ connecté au contrôleur de longueur pour ajuster la longueur de la larve (axe X) jusqu'à ce que la longueur des sarcomères n'est pas optimal (par exemple, 1,90 um).
- Régler le courant d'optimiser la force de la secousse stimulation. Pour commencer, réglez le courant sur le stimulateur à un faible ampleur (par exemple 100 mA). Le stimulateur peut être déclenché manuellement ou par un ordinateur exécutant un programme LabVIEW personnalisé. Susciter une contraction des muscles des larves avec une impulsion de courant de 0,2 msec dans la durée.
- Utiliser un oscilloscope pour enregistrer la sortie de force et de mesurer la force de contraction de pointe à l'aide des curseurs de l'oscilloscope. Augmenter le courantpar incréments de 50 mA et mesurer la force de contraction maximale à chaque niveau actuel. Attendre 30 secondes entre les contractions pour éviter la fatigue. Comme les augmentations actuelles de stimulation, la force de contraction de pointe augmente généralement à un maximum puis diminue progressivement. Le courant au cours de laquelle la larve génère la plus grande force est le courant de stimulation optimale. Réglez l'amplitude du courant pour le courant de stimulation optimal.
- En utilisant le dispositif de positionnement XYZ, ajuster la longueur de la larve (et donc, la longueur des sarcomères) afin d'obtenir la force de contraction maximale. Les larves de poisson zèbre de type sauvage (3-7 DPF) générer une force de contraction maximale à des longueurs sarcomériques de 2,10 um um ou 2.15. Toutefois, la longueur des sarcomères peut être réglé à 2,08 um pour éviter une pression excessive sur la larve.
- Susciter une contraction des muscles larvaires. Utilisez l'oscilloscope pour enregistrer la réponse de la force et sauvegarder l'enregistrement pour une analyse ultérieure.
6. Mesurer musculature Dimensions avec Larve chez Optimal Longueur
- Déplacer l'appareil de test de retour à la loupe binoculaire.
- En utilisant l'échelle de l'oculaire, mesurer la hauteur de la musculature tel que vu depuis le côté. Puis, en prenant soin de ne pas modifier la longueur de la larve, la larve pivoter de 90 ° en utilisant les queues de boucle de suture afin de voir la larve du fond. Mesurer la largeur de la musculature telle que vue par le bas. Prendre les mesures à un repère anatomique (par exemple, ouverture urogénitale) (figure 4).
- Couper les boucles de suture avec une microlame pour libérer la larve de l'équipement d'essai.
Résultats
Chez les larves de poisson zèbre sauvage en bonne santé, les fibres musculaires doivent être parallèles les uns aux autres sans grands écarts entre eux et des stries évidentes (figure 5A). Les larves de poisson zèbre sauvage qui ne présentent pas ces caractéristiques, ou avec des dommages évidents tels que les fibres individuelles (figure 5B), doit être jeté.
Un graphique représentatif de la force de contraction maximale en fonction du courant pour une seule larve de poisson zèbre stimulation est illustré à la figure 6. Pour les larves de poisson zèbre sauvage entre 3-7 DPF, le courant de stimulation optimal se situe généralement entre 400-600 mA, avec 3 DPF larves nécessitant généralement plus courant que les larves de DPF 6-7 stimulation.
Les données sur la population premières (recueillies lors de l'étape 5.8) doit être traitées et analysées avec le logiciel d'analyse de données. Tout d'abord, la ligne de base de l'enregistrement de force est fixé à zéro. En second lieu, la tension de sortie du capteur de force est converti à la force (mN) (voir les instructions du fabricant pour générer une courbe d'étalonnage pour le capteur de force). Une réponse de la force de représentant recueillies au cours d'une contraction de contraction maximale d'une seule larve est illustré à la figure 7. Logiciel d'analyse de données peut être utilisée pour mesurer la force maximale et d'autres caractéristiques de la réponse de la force.
Un ensemble représentatif de données de force maximale de contraction contraction maximale est illustré à la figure 8A. Valeurs de force de contraction de pointe typiques pour DPF gamme de type sauvage 3-7 larves de 0,9 à 1,7 mN, avec les larves plus âgées générer plus de force que les larves plus jeunes. Les différences dans la force de contraction de pointe peuvent être dus à des processus normaux tels que la croissance et le développement (figure 8) ou des procédés anormaux comme gène pathologie liée à une mutation 21,22.
La normalisation par section musculaire (CSA) peut être utilisé pour déterminer la mesure dans laquelle les différences de force de contraction de pointe sont simplement dues à différe nces de la taille de la musculature 21,22. CSA musculaire peut être estimée en utilisant la formule: CSA = π (A / 2) (B / 2), où A est la hauteur de la musculature, vu de côté, B est la largeur de la musculature, vu du bas, et une section transversale elliptique est utilisé. Les valeurs de l'ASC typiques pour DPF gamme de type sauvage 3-7 larves de 0,027 à 0,034 mm 2, avec des larves de DPF 3-4 montrant généralement des valeurs de l'ASC inférieures à 5-7 larves DPF. Un ensemble représentatif de données sur la population pic normalisé de contractions musculaires à contraction maximale est montrée sur la figure 8B. Les valeurs typiques normalisées de pointe de contraction de force pour DPF gamme de type sauvage 3-7 larves de 34 à 51 mN / mm 2, avec 4-7 dpf larves montrant généralement des valeurs supérieures à 3 DPF larves.

Figure 1. boucle de suture. flèches pointent vers les queues de boucle de suture.

Figure 2. Appareil (A) d'essai avec des composants marqués. (B) vue close-up de la chambre expérimentale. (A) chambre expérimentale avec un fond transparent. (B) capteur de force. (C) contrôleur de longueur. (D) les dispositifs de positionnement XYZ. Le X, Y, et Z sont définis dans le coin supérieur droit. (E) Système de contrôle de la température en utilisant des modules thermoélectriques. Tubing accueille le débit d'eau pour le refroidissement des modules thermoélectriques. (F) tube en acier inoxydable fixé au capteur de force. (G) tube en acier inoxydable fixé au contrôleur de longueur. (H) microsonde de thermomètre. (I) Platinum électrodes à plaques parallèles, s'étendant sur la longueur de lechambre. plaques de platine sont de 2,5 mm et 0.255 mm d'épaisseur.
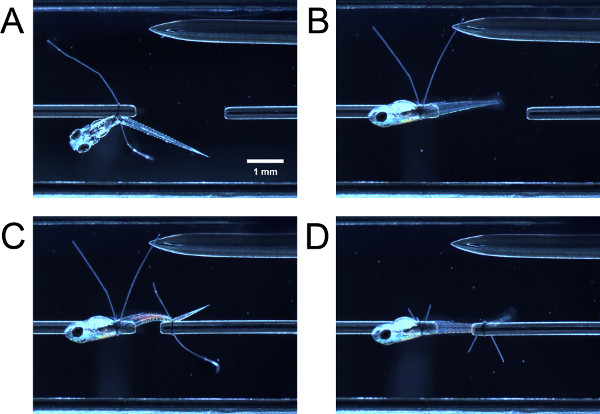
Figure 3. Lier larve dans la chambre expérimentale. (A) Larve attaché sur au extrémité antérieure, mais pas encore pivoté de 90 °. (B) Larve après pivoté de 90 °. (C) Larve attaché sur au extrémité postérieure mais pas encore basculé. (D) Larve après queues de boucle rotulées et suture sont coupés.
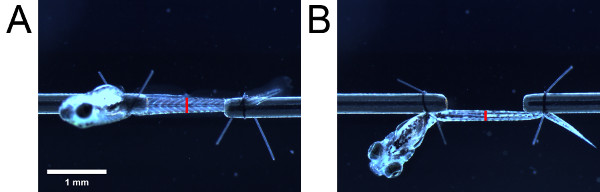
Figure 4. Mesures pour l'estimation de la section transversale. Musculature vu de l'(A) côté et (B) fond. Placement des barres rouges indiquent l'emplacement de l'ouverture urogénital. La longueur des barres rouges indiquent la hauteur et la largeur de la musculature vu depuis respectivement le côté et en bas.
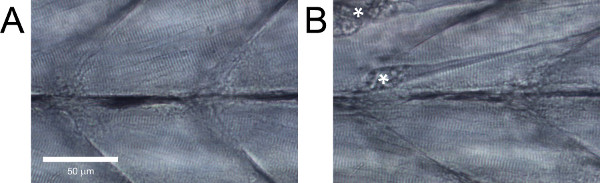
Figure 5. Vue latérale du poisson zèbre larves tronc musculature. (A). (B) des tissus des tissus sains avec des dommages évidents. Contractures résultant de détachements de fibres sont marquées par des astérisques.
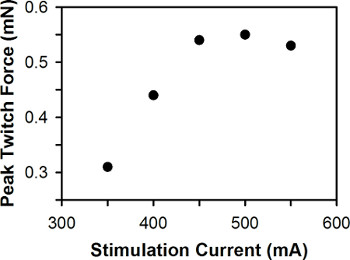
Figure 6. Graphique représentatif de la force de contraction de pointe par rapport à la stimulation Le courant de stimulation optimal actuel. Est de 500 mA.
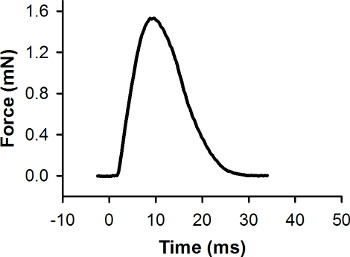
Figure 7. enregistrement de la force de représentant pour une seule contraction de la secousse. Cette contraction a été provoquée par une impulsion de stimulation à 0 ms. La force maximale est de 1,56 mn.
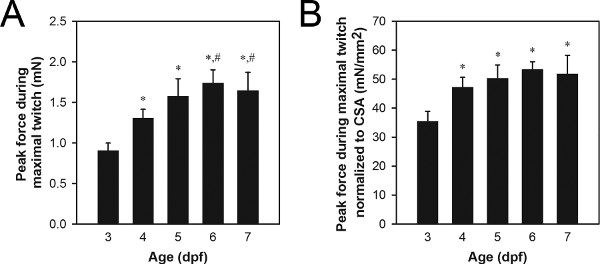
Figure 8. Données sur la population représentatifs 3-7 dpf larves. (A) Les données de force maximale de contraction contraction maximale. (B) Les données de force maximale de contraction contractions maximales normalisées au CSA. Les larves plus âgées (6-7 DPF) ont été nourris Hatchfry Encapsulon Grade 0 avec spiruline (Argent Laboratories) à partir du 5 DPF. Moyens + écarts-types sont présentés avec N = 5 dans chaque groupe. Groupes significativement différents de 3 larves de DPF (*) et 4 larves de DPF (#) sont indiquées (ANOVA, P <0,05). L'augmentation significative de la force normalisée comprise entre 3 et 4 DPF (B) indique une augmentation de la capacité de génération de force intrinsèque au cours de cette période, tandis que l'augmentation de la force entre 4 et 6-7 DPF (A) est attribuable à une croissance fondée sur aucune changer du 4 au 7 DPF en vigueur normalisée.
Discussion
Cette méthode mesure la génération de la force lors d'une contraction pour évaluer la fonction musculaire dans les muscles du tronc de larves de poisson zèbre. Bien contractions tétaniques peuvent être provoqués chez les larves de poisson zèbre (de par exemple 200 impulsions de stimulation / s pour une durée de 0,2 s), la force tétanique maximale n'est que de 10-15% supérieure à la force de contraction maximale. Par conséquent, la force générée lors d'une contraction est une mesure raisonnable de la capacité de production de force. Twitches sont préférés aux contractions tétaniques parce tics sont moins susceptibles de provoquer de déchirure ou de glisser sur les liens de suture.
Afin de générer des données significatives avec cette technique, la force de contraction maximale doit être réalisé pour chaque larve et la variabilité entre les groupes expérimentaux doit être minimisée. Avec ces objectifs à l'esprit, nous offrons les suggestions suivantes. Tout d'abord, prendre soin lors de l'amarrage de la larve au capteur de force et les tubes de contrôleur de longueur. Si les boucles de suture sont serrés tropbien, le fil de suture se couper à travers le tissu musculaire. Si les boucles de suture ne sont pas suffisamment serrées, la force générée par la chenille ne sera pas entièrement transmis au transducteur de force. Les deux situations, mais surtout le dernier, sous-estiment la force de contraction maximale. Deuxièmement, depuis tester plusieurs groupes expérimentaux peuvent prendre plusieurs heures (20-30 min / larve), alternent entre les groupes parce que les larves continuera à se développer au cours de la période d'essai.
Alors que certains de l'équipement mentionné est essentiel pour la mesure de la force de contraction maximale (par exemple capteur de force, stimulateur à courant), les autres éléments ne sont pas absolument nécessaires. Le système de longueur de sarcomère vidéo est souhaitable mais pas obligatoire. Comme alternative, une série de secousses peut être utilisé pour trouver la longueur optimale, au cours de laquelle la longueur de la larve est ajusté jusqu'à ce que la force de contraction maximale est atteinte. Un système de contrôle de la température n'est également pas absolument nécessaire. Contrôle de la température est critique quand meaSüring cinétique de contraction, qui sont très sensibles à la température, tandis que la force de contraction maximale n'est pas particulièrement sensible aux petites variations de température et peut être mesurée à la température ambiante. A noter que quelle que soit la température dans la chambre au cours des essais de la force, les larves doit être maintenu à la température optimale de croissance de 28,5 ° C 24 avant de forcer l'essai pour déterminer le stade précis.
Les larves sont testés dans une solution de Tyrode contenant tricaïne. Nous utilisons 0,02% (p / v) tricaïne, la concentration recommandée pour l'anesthésie 24, pour éliminer les contractions spontanées suscitées par le système nerveux et donc éviter la fatigue lors des tests de force. Tricaine facilite également l'étape tie-on et réduit le temps global de test. Cependant, nous observons que tricaïne y compris dans la solution de test réduit systématiquement la force de contraction maximale d'environ 30%. Un effet similaire a également été observée dans les muscles de la queue de têtard, où tricaine réduit génération de force après la transmission neuromusculaire a été bloqué, ce qui suggère que tricaïne a un effet direct sur le muscle 25. Tricaine peut réduire l'excitabilité des cellules musculaires, en réduisant la conductance de sodium à travers la membrane des cellules, comme c'est le cas dans les cellules nerveuses 26. D'autres options pour bloquer l'activation par motoneurones sont d-tubocurarine et α-bungarotoxine mais, contrairement tricaïne, ces composés ne sont pas la peau perméable et doivent être injectés directement dans la tête, la moelle épinière ou du cœur 27. Chercheurs individuels devront évaluer si oui ou non tricaïne est souhaitable pour leur application spécifique. Si tricaïne est inclus dans la solution d'essai, la concentration doit être cohérente entre les expériences et les chercheurs doivent vérifier que l'effet de la tricaïne ne varie pas entre les groupes expérimentaux.
Nous décrivons cette méthode pour les larves dès l'âge de 3 dpf et aussi vieux que 7 DPF. Bien que les fibres musculaires semblent être functional dès 17 heures après la fécondation, lorsque les mouvements de la queue spontanés commencent 27, la faible longueur de la queue avant le 3 DPF entrave lier la larve à l'équipement d'essai. Nous n'avons généralement pas testé larve après 7 DPF puisque de nombreux modèles de maladies ne survivent beaucoup plus longtemps que ce temps. Si vous testez les larves au-delà de 5 DPF, les larves doivent être nourris. Nous avons observé que les larves ont jeun petits muscles et générer de la force de contraction maximale inférieure de larves nourries, probablement en raison de la diminution vésicule ombilicale. Ainsi, il peut être souhaitable de tester les larves entre 3-5 DPF, afin d'éviter la variable supplémentaire de l'alimentation externe.
En résumé, nous décrivons une méthode quantitative et fiable pour mesurer la génération de la force lors d'une contraction de la secousse maximale de poisson zèbre muscles du tronc larvaire. Cette méthode peut être utilisée pour évaluer la santé globale des muscles des larves de poisson zèbre et prévoit notamment des informations sur la fonction musculaire. En plus de fournir des informations sur leampleur de génération de force, cette technique peut être utilisée pour étudier la cinétique de génération de force ou être adaptée pour étudier la fatigue musculaire 22. Bien que nous décrivons cette technique pour une utilisation avec des larves de type sauvage, cette méthode peut être utilisée pour les larves génétiquement modifiés ou de larves traitées avec des médicaments ou des produits toxiques, de caractériser des modèles de maladies musculaires et évaluer les traitements, ou pour étudier le développement musculaire, une lésion musculaire, ou musculaire liée à la toxicité chimique.
Déclarations de divulgation
Les auteurs déclarent qu'ils n'ont aucun intérêt financier concurrents.
Remerciements
Les auteurs tiennent à remercier Angela Busta de l'aide pour le poisson-zèbre élevage. Ce travail a été soutenu par le National Institutes of Health (AG-020591 à SVB et 1K08AR054835 à JJD).
matériels
| Name | Company | Catalog Number | Comments |
| REAGENTS | |||
| Tricaine powder | Sigma-Aldrich | A5040 | |
| Sodium chloride | Sigma-Aldrich | S7653 | |
| Potassium chloride | Sigma-Aldrich | P9541 | |
| Calcium chloride dihydrate | Sigma-Aldrich | 223506 | |
| Magnesium chloride hexahydrate | Sigma-Aldrich | M2670 | |
| Sodium phosphate monobasic | Sigma-Aldrich | S0751 | |
| Sodium bicarbonate | Sigma-Aldrich | S6297 | |
| Ethylenediaminetetraacetic acid disodium salt dihydrate | Sigma-Aldrich | E5134 | |
| EQUIPMENT | |||
| Nonsterile-suture | Ashaway Line Twine | S30002 | USP 10/0 monofilament nylon (3 ply) |
| Forceps | Fine Science Tools | 11251-20 | Dumont #5 |
| Spring scissors | Fine Science Tools | 15000-08 | Vannas |
| Stereo microscope | Leica Microsystems | MZ8 | Illuminated with Fostec EKE ACE I light source |
| Force transducer |  Aurora Scientific Aurora Scientific | 400A | |
| Length controller |  Aurora Scientific Aurora Scientific | 318B | |
| XYZ positioning devices | Parker Hannifin | 3936M | |
| Thermometer | Physitemp | BAT-12 | |
| Disposable transfer pipette | Fisher Scientific | 13-711-9AM | Cut end to widen opening and facilitate larva transfer |
| Petri dish | Fisher Scientific | 08-757-11YZ | |
| Glass pipette | Fisher Scientific | 13-678-8B | Cut end (and fire-polish) to widen opening and facilitate larva transfer |
| Inverted microscope | Carl Zeiss Microscopy | Axiovert 100 | |
| Water bath circulator | Neslab Instruments | RTE-111 | |
| Temperature controller | Alpha Omega Instruments | Series 800 | |
| Stimulator |  Aurora Scientific Aurora Scientific | 701C | High-power, follow stimulator |
| Video sarcomere length system |  Aurora Scientific Aurora Scientific | 900B-5A | |
| LabVIEW software | National Instruments | ||
| Oscilloscope | Nicolet Technologies | ACCURA 100 | |
| Microblade | Fine Science Tools | 10050-00 | |
| Microblade holder | Fine Science Tools | 10053-13 | |
| Data analysis software (Signo) | Alameda Applied Sciences | ||
Références
- Bassett, D. I., Bryson-Richardson, R. J., Daggett, D. F., Gautier, P., Keenan, D. G., Currie, P. D. Dystrophin is required for the formation of stable muscle attachments in the zebrafish embryo. Development. 130 (23), 5851-5860 (2003).
- Nixon, S. J., Wegner, J., et al. Zebrafish as a model for caveolin-associated muscle disease; caveolin-3 is required for myofibril organization and muscle cell patterning. Hum. Mol. Genet. 14 (13), 1727-1743 (2005).
- Hall, T. E., Bryson-Richardson, R. J., et al. The zebrafish candyfloss mutant implicates extracellular matrix adhesion failure in laminin α2-deficient congenital muscular dystrophy. PNAS. 104 (17), 7092-7097 (2007).
- Hirata, H., Watanabe, T., et al. Zebrafish relatively relaxed mutants have a ryanodine receptor defect, show slow swimming and provide a model of multi-minicore disease. Development. 134, 2771-2781 (2007).
- Dowling, J. J., Vreede, A. P., et al. Loss of myotubularin function results in t-tubule disorganization in zebrafish and human myotubular myopathy. PLoS Genet. 5 (2), e1000372 (2009).
- Berger, J., Berger, S., Hall, T. E., Lieschke, G. J., Currie, P. D. Dystrophin-deficient zebrafish feature aspects of the Duchenne muscular dystrophy pathology. Neuromuscul. Disord. 20 (12), 826-832 (2010).
- Kawahara, G., Guyon, J. R., Nakamura, Y., Kunkel, L. M. Zebrafish models for human FKRP muscular dystrophies. Hum. Mol. Genet. 19 (4), 623-633 (2010).
- Wallace, L. M., Garwick, S. E., et al. DUX4, a candidate gene for facioscapulohumeral muscular dystrophy, causes p53-dependent myopathy in vivo. Ann. Neurol. 69, 540-552 (2011).
- Sztal, T. E., Sonntag, C., Hall, T. E., Currie, P. D. Epistatic dissection of laminin-receptor interactions in dystrophic zebrafish muscle. Hum. Mol. Genet. , (1093).
- Kawahara, G., Karpf, J. A., Myers, J. A., Alexander, M. S., Guyon, J. R., Kunkel, L. M. Drug screening in a zebrafish model of Duchenne muscular dystrophy. PNAS. 108 (13), 5331-5336 (2011).
- Berger, J., Berger, S., Jacoby, A. S., Wilton, S. D., Currie, P. D. Evaluation of exon-skipping strategies for Duchenne muscular dystrophy utilizing dystrophin-deficient zebrafish. J. Cell Mol. Med. 15 (12), 2643-2651 (2011).
- Seger, C., Hargrave, M., Wang, X., Chai, R. J., Elworthy, S., Ingham, P. W. Analysis of Pax7 expressing myogenic cells in zebrafish muscle development, injury, and models of disease. Dev. Dyn. 240, 2440-2451 (2011).
- Postel, R., Vakeel, P., Topczewski, J., Knöll, R., Bakkers, J. Zebrafish integrin-linked kinase is required in skeletal muscles for strengthening the integrin-ECM adhesion complex. Dev. Biol. 318 (1), 92-101 (2008).
- Zoeller, J. J., McQuillan, A., Whitelock, J., Ho, S. Y., Iozzo, R. V. A central function for perlecan in skeletal muscle and cardiovascular development. J. Cell Biol. 181 (2), 381-394 (2008).
- Kim, H. R., Ingham, P. W. The extracellular matrix protein TGFBI promotes myofibril bundling and muscle fibre growth in the zebrafish embryo. Dev. Dyn. 238, 56-65 (2009).
- Beqqali, A., Monshouwer-Kloots, J., et al. CHAP is a newly identified Z-disc protein essential for heart and skeletal muscle function. J. Cell Sci. 123 (7), 1141-1150 (2010).
- Huang, H., Huang, C., et al. Toxicity, uptake kinetics and behavior assessment in zebrafish embryos following exposure to perfluorooctanesulphonicacid (PFOS). Aquat. Toxicol. 98 (2), 139-147 (2010).
- Sylvain, N. J., Brewster, D. L., Ali, D. W. Zebrafish embryos exposed to alcohol undergo abnormal development of motor neurons and muscle fibers. Neurotoxicol. Teratol. 32 (4), 472-480 (2010).
- Chandrasekar, G., Arner, A., Kitambi, S. S., Dahlman-Wright, K., Andersson-Lendahl, M. Developmental toxicity of the environmental pollutant 4-nonylphenol in zebrafish. Neurotoxicol. Teratol. 33 (6), 752-764 (2011).
- Buss, R. R., Drapeau, P. Activation of embryonic red and white muscle fibers during fictive swimming in the developing zebrafish. J. Neurophysiol. 87 (3), 1244-1251 (2002).
- Telfer, W. R., Nelson, D. D., Waugh, T., Brooks, S. V., Dowling, J. J. neb: a zebrafish model of nemaline myopathy due to nebulin mutation. Dis Model Mech. 5, 389-396 (2012).
- Dowling, J. J., Arbogast, S., et al. Oxidative stress and successful antioxidant treatment in models of RYR1-related myopathy. Brain. 135 (4), 1115-1127 (2012).
- Dou, Y., Andersson-Lendahl, M., Arner, A. Structure and function of skeletal muscle in zebrafish early larvae. J. Gen. Physiol. 131, 445-453 (2008).
- Westerfield, M. . The zebrafish book: a guide for the laboratory use of zebrafish (Danio rerio). , (2000).
- Herr, V. D., Sonnenburg, D. C., Courogen, P. M., Fiamengo, S. A., Downes, H. Muscle weakness during tricaine anesthesia. Comp Biochem Physiol Part C. 110 (3), 289-296 (1995).
- Frazier, D. T., Narahashi, T. Tricaine (MS-222): effects of ionic conductances of squid axon membranes. Eur. J. Pharmacol. 33 (2), 313-317 (1975).
- Saint-Amant, L., Drapeau, P. Time course of the development of motor behaviors in the zebrafish embryo. J. Neurobiol. 37 (4), 622-632 (1998).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon