需要订阅 JoVE 才能查看此. 登录或开始免费试用。
Method Article
在生理体外模型和病理血流应用的血管细胞重塑调查
摘要
该协议将复制的生理或病理血流体外在确定疾病的病理细胞应答提供帮助。通过引入压力衰减室血液泵的下游,穿过脉管的血流,可以概括和强加于血管内皮或模拟物共培养的单层。
摘要
血管疾病是死亡的在美国的常见原因。在此,我们提出了一个方法来检查血流动力学的走向血管疾病病理的贡献。不健康的动脉壁硬化,疤痕,或局部狭窄可能都会影响流体流速,和脉动流的幅度,或搏动指数经常存在。各种流动条件复制是调谐流压力衰减室血液泵的下游的结果。一个封闭的流动系统内的空气的引入允许一个可压缩的介质以吸收来自泵脉动压力,因此改变搏动指数。本文所描述的方法被简单地再现,具有高度可控输入,和容易测量的结果。某些局限性是复杂的生理脉冲波形,这是只能由系统近似的娱乐。内皮细胞,平滑肌细胞和成纤维细胞都受血液流动THRough动脉。血流的动态分量由心输出量和动脉壁顺应性来确定。血管细胞机械性传导流动动力学的可触发的细胞因子释放和动脉内的细胞类型之间的串扰。血管细胞的共培养是在血管壁和机械信令血管反应的更精确的图像反射的细胞 - 细胞相互作用。流动动力学,包括细胞响应于流的动态和平均值(或稳定)成分的贡献,因此,在确定疾病的病理和治疗疗效的重要指标。通过引入体外共培养模型和压力阻尼产生模拟心输出量的血泵的下游,各种动脉疾病的病理可以进行调查。
引言
发病率心血管疾病是最大的,在美国,与不健康的血管多所致。健康的动脉包括弹力组织,软腔表面涂有内皮细胞(EC)单层。动脉血流可被建模为具有正的平均流量的振荡波函数。搏动指数(PI)是振荡幅度的商和平均流量(PI =(最大-最小)/平均 ),1和是仿照在体外用可变血管弹性2动脉弹性的存储流量的重要。能量心脏收缩,在收缩压扩张,并起着调节血液流量PI一个显著的作用。因为心脏保持一致,脉动,体积流量,动脉扩张增加截面积,通过减小流速,剪切应力,和PI增强流动稳定性。通常情况下,不健康的动脉目前变化的弹性或遵医嘱,显示从血管重建,疤痕组织或钙化3,4加强。此外,其它血管病症,例如新生内膜增生(NIH),5瘤和高血压6和血管纤维变性4,可收缩血管直径。然而,目前的药物治疗和血管疾病的治疗设备常常忽视在血管疾病血管壁顺应性或血流动力学这常常通过改变容器的形态和性质复杂的重要性。无论是球囊成形术还是支架回答壁弹性7的并发症。因此, 在体外模拟血液流动的动脉疾病和治疗导致在调查疾病病理和治疗疗效未来重要的。在此,我们描述了复制的生理和病理血流设计为确定在血管疾病病理学细胞应答的方法奥希斯。流体流动引起的剪切应力在血管壁,这是在容器健康的重要机械信号,影响脉管系统中的所有单元。在血管内皮细胞的流体剪切几个机械传感器已经确定,包括在最近的研究内皮mechanosensing 8所示初级纤毛。内皮细胞的活性和形态受流速,方向和搏动。此外,平滑肌细胞(SMC)迁移可能会受到低流速的机械性信号,以通过间质液9,并且也可以是通过从内皮细胞的旁分泌信号通过其响应于流动并通过细胞因子机械性转导流信号的发布10。平均剪切,PI和旁分泌信号的"剂量"的依赖也可以是相互依赖的。为此,血管细胞响应于流体剪切具有变化"给药"的判断中单层培养或共培养体外可以提供机械的见解血管重构,改善疾病和治疗的预测。在这个实验中使用的流动系统包括一个血泵,上游流动阻尼空气存贮器,只有实验装置,下游细胞培养,平行板流动室,及媒体储存器过程中使用的下游流量计。血管流动变量的控制,如平均流动速率,每分钟节拍和PI可以通过控制流率,脉冲频率,和引进了压力阻尼来实现。脉动血泵可具有可变行程位移,在受控冲程频率,直接涉及到平均体积流速,和脉冲频率。流电路内的空气存贮器的引入允许压力阻尼,减小流量振荡幅度。媒体是不可压缩的流体,而衰减室内的空气是可压缩的,从而使过量的压力从流波是通过空气压缩吸收。空气介质的比例可超过多少阻尼发生控制权。定制细胞培养流动腔75毫米,长50毫米,宽是由丙烯酸创建。流进入通过入口端口和膨胀通过进气歧管,提供穿过流动腔室的全部一致的流动。类似的流动和结构存在于室出口。将细胞接种于官能幻灯片,并随后附连到流动室。这使得大量人口,在研究之后很容易地检索。共培养实验可以使用多孔聚碳酸酯膜,以消除培养物之间的细胞 - 细胞接触,同时允许细胞因子/流传输。这一系统先前已经用于模拟高PI流动及其对内皮细胞单层培养和EC / SMC共培养1,10的效果,来研究细胞反应病理高PI疾病。通过描述来模拟这些流动CON协议ditions,我们希望能帮助他人确定流量信号的贡献细胞反应。
Access restricted. Please log in or start a trial to view this content.
研究方案
1.硅烷化和幻灯片的生物分子官能或聚碳酸酯膜
注意:许多本协议中的化学品和解决方案具有高蒸发率(乙醇(乙醇), 丙酮等)。其他措施带来长时间的保温时间为低蒸发率。石蜡膜,建议以密封容器。注意:多数的化学物质(包括:硫酸,丙酮,(3-氨基丙基)三乙氧基硅烷,戊二醛,乙醇)被认为是有害,或挥发性。请各材料进行适当的储存,处理和处置,然后再使用材料安全数据表(MSDS)。
- 放置新载玻片测量75毫米乘50毫米×1毫米,在清洁,玻璃载片染色皿不考虑方向,确保充分浸没。使用容器步骤1.1-1.12。
注意:对于共培养,包括聚碳酸酯(PC)膜用0.4微米孔径,切成75毫米尺寸50毫米,对于所有后续STEPS的PC功能化和EC播种。 - 沉浸在幻灯片硫酸(20%),O / N。
注意:请MSDS使用前硫酸。 - 浸渍在去离子水(DI)中5分钟,3次,每次改变的DI洗滑动。
- 沉浸滑动在丙酮中30分钟。
注意:请MSDS使用前丙酮。 - 6%(3-氨基丙基)三乙氧基硅烷/丙酮溶液O / N沉浸幻灯片。
注意:请咨询MSDS为(3-氨基丙基)三乙氧基硅烷和丙酮后再使用。 - 沉浸滑动丙酮5分钟,3次,每次改变丙酮。
注意:请MSDS使用前丙酮。 - 通过浸入DI 5分钟,3次,每次改变的DI洗滑动。
- 沉浸在滑1.5%的戊二醛/ DI溶液60分钟。
注意:请MSDS使用前戊二醛。 - 通过浸入DI 5分钟,2次,每次改变的DI洗滑动。
- 滑入到位s转换70%乙醇(EtOH)在无菌的,层流罩30分钟。
- 除去乙醇并允许剩余的残余物蒸发。沉浸在无菌DI和漏幻灯片,以补充水分的幻灯片。
注意:幻灯片或PC膜可被密封在玻璃载片支架,并储存在4℃下最多一周。在使用时用于细胞培养,重复步骤1.10和1.11。 - 从滑动架中取出幻灯片,并将其放置到100毫米通过在层流罩100mm见方培养皿。
注意:此容器将被用于所有剩余的步骤。- 准备幻灯片或PC内皮细胞接种于单一实验。
- 涂层的官能滑动或PC(步骤1.11)与1ml纤连蛋白溶液(25微克/毫升),在一侧,覆盖暴露于细胞培养容器的大致区域。
- 孵育载玻片或PC在无菌恒温箱设定在37℃下1-2小时。
- 温育后,用GLA吸出剩余的溶液分类吸气吸管连接到真空。
注意:幻灯片现在可存储的O / N,在4℃以备后用。
- 按照1.12.2步骤只为编制EC / SMC共培养。制备和种子平滑肌细胞(SMC)的培养用于共培养实验。
- 地方硅胶垫片在滑动(步骤1.11),用75毫米尺寸50毫米外径,50毫米乘30毫米内径,0.5毫米的厚度,和穿孔其与流室真空对齐的顶部。
- 制备1 ml的SMC在10%FBS / DMEM中悬浮。中和2毫克/毫升的胶原I型的1毫升溶液用7% 碳酸氢钠和0.1M NaOH溶液至pH 7.4,并用的SMC悬浮为2×10 6细胞/ ml的终细胞密度混合。
- 传播的SMC溶液内垫圈孵育载玻片在37℃和5%CO 2的30分钟。
- 温育后,覆盖用25ml 0.1%胎牛血清(FBS)的混合在Dulbecco氏滑动改性的Eagle培养基(DMEM)中72小时。
- 准备幻灯片或PC内皮细胞接种于单一实验。
- 在载玻片/聚碳酸酯膜培养内皮细胞(ECS)。
- 种子1毫升的EC在10%FBS / DMEM中,具有6.0×10 5个细胞/ ml的初始浓度,在玻璃载玻片或聚碳酸酯膜的纤连蛋白的表面。
- 在37℃,5%CO 2孵育细胞在培养箱,和10%FBS 120分钟。
- 含有细胞用另外的10%FBS / DMEM中,并置于培养箱中37℃盖玻片,5%的CO 2 O / N,直到70%-80%汇合。
2.确定流体粘度和体积流量
注意:旋转粘度计是敏感的设备,和粘度计的用户手册应校准,回零,或执行测量之前进行协商。
- 确定从文献实验的有针对性的脉管系统的所需的流体剪切(τ)。
- 测量电ë1%FBS / DMEM中粘度(μ),使用旋转粘度计。
- 确定所需体积流率(Q)从泊肃叶等式:
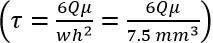 ,
,
其中τ=流体剪切,μ=粘度,Q =体积。流速,瓦特=腔宽度,和h =腔室高度)。 - 设置泵流衍生的在步骤2.3率,以及使用在所有后续步骤。
3.测定搏动指数
注:在系统中的所有连接口应当与适当大小的锁紧环到倒钩,或阴路厄到倒钩的连接进行连接。连接PVC管然后可以连接到倒钩接头,和电路完成。
- 连接流动回路与图2中,与消音腔( 图3)和超声波流量计在正确流动方向。
注意:超声波流量计是一个敏感的设备,和用户手册使用前应进行协商。 - 填写流电路及水库去离子水,确保水库出口管(泵)内的水库容积被淹没。使用流量计形象化流量波形。
- 上的阻尼腔室打开的空气释放阀,以改变流体/空气体积比。在不同的流体水平间隔关闭空气释放阀,并计算搏动指数 (PI =(V最大- V MIN)/ V 平均数 )通过使用流波形的峰值(V最大),槽(V MIN),和平均(Ⅴ 平均数 )。在笔记本记录的PI值。
- 标记得到的流体水平和PI的阻尼室,使用毡尖,永久墨水笔供将来使用。确定从病理学文献11所希望PI水平。
- 硅管Formation-可选,控制搏动更先进的方法
- 混合不同比例的有机硅弹性体基料和固化剂(例如,一个浮雕电子对交联剂比率为10:1到36:1),用于改变定向的弹性模量,如先前所示2
- 制造硅氧烷管通过反复浸渍固化过程中,简要地浸渍钢性插管(14 G)的成硅氧烷预聚物混合物与预定基站至交联剂比率。
- 将预聚物涂覆套管插入的炉中在60℃下4小时,以固化聚合物涂层上的套管,开关在固化过程的中间的方向。
- 重复该浸渍过程用相同的硅氧烷弹性体混合物中,并放回到在烤箱额外的4小时,这导致在〜0.3毫米厚的管中。
- 从不锈钢套管除去超薄硅树脂管。
- 连接管流电路代替消音腔,和测试的PI的每个如在3.3。
4.泵灭菌
- 浸入流室(图2),PVC管,和垫片在10%过氧化氢 (H 2 O 2)。第4步之前,用无菌DI清洗。
- 将血泵上的备用孵化器架。
注意:孵化货架应该是不锈钢,并能够支持整个流动回路的重量。 - 通过确保储器出口管(泵)内储存体积浸没填充流动回路和水库,用10% 的 H 2 O 2。循环的 H 2 O 2的通过电路抽20分钟,在层流罩与UV光。
- 抽吸所有的 H 2 O 2的从油管,并通过流动回路泵送冲洗用无菌PBS。
5.流室组件
注:流动室是由丙烯酸系,定制板的,具有真空口和入口和出口流通口( 参见图2)。商会大会由放置流室和垫圈上的文化滑梯顶部,亲perly对准,并且在下面描述。
- 热身1%FBS / DMEM在37℃水浴并准备流室。
- 就拿EC滑出媒体(从步骤1.13),最上面的单元格方和地方垫片。
- (可选)以PC膜介质用完(从步骤1.13),最上面的单元格方和地方垫片。将与种子SMC(步骤1.12.2)的PC膜下共培养幻灯片。
- 对准流动室与所述垫圈上的孔(图2)的真空通道。
- 附真空管到真空端口(图2)确保没有媒体泄漏到真空中。
- 载玻片和钳位流室组件与弹簧夹具,一个在流室的每一侧( 图2和5)下方的地方的聚碳酸酯板。
- 在37℃的地方流动系统在培养箱和5%的CO 2,并通过从填充的储存泵送在低搏动填充电路的介质。保持这个流4小时的预处理单元。
- 调整所需的时间在阻尼室明显PI级液量,和文化。
Access restricted. Please log in or start a trial to view this content.
结果
的流动条件是维持依赖于所述流动回路(图1)的正确装配。管直径是一个重要的选择在装配,具有较大直径减少前和培养室后的流动阻力和随后的压降。为了确保预期的压力和流速,实验目的管前组装系统,流量计。培养室的真空通道(图2),以在硅垫片(未示出)的穿孔对齐,保持流动回路内密封。为了确保密封,弹簧夹具可以用来施加在垫圈额外的压力。载玻片应?...
Access restricted. Please log in or start a trial to view this content.
讨论
这个协议描述再现体外脉动流的方法,并且可以是在确定的流动条件对疾病的病理学贡献器乐第一步。使用此协议之前的研究已经发现,流动条件。此外有助于血管炎症反应。1,10,此协议的目的是为有经验的实验室。正因为如此,无论是在深度流体力学,也不生化分析在本文中描述。对于更高级的流体动力学,1和先进的技术,参考文献2中临界流体下剪切?...
Access restricted. Please log in or start a trial to view this content.
披露声明
作者什么都没有透露。
致谢
作者要感谢的资金来源,包括AHA(13GRNT16990019到WT)和NHLBI(HL097246和HL119371到WT)。
Access restricted. Please log in or start a trial to view this content.
材料
| Name | Company | Catalog Number | Comments |
| Acetone | Sigma-Aldrich | 34850 | |
| Sulfuric Acid | Sigma-Aldrich | 320501 | |
| (3-Aminopropyl)triethoxysilane | Sigma-Aldrich | 440140 | |
| Glutaraldehyde Solution | Sigma-Aldrich | G5882 | |
| Ethanol | Sigma-Aldrich | 459844 | |
| Glass Slide (70 mm x 50 mm) | Sigma-Aldrich | CLS294775X50 | |
| Polycarbonate Membrane | Millipore Corp. | HTTP09030 | |
| Silicone Gasket | Grace Bio-Labs | RD 475464 | |
| Fibronectin (25 μg/ml) | Sigma-Aldrich | F1141 | |
| Collagen Type-I | Sigma-Aldrich | C3867 | |
| NaHCO3 | Fluka | 36486 | |
| NaOH | Sigma-Aldrich | S5881 | |
| Damping Chamber | This chamber is custom made, and may be requested using the engineering drawing of Figure 3. | ||
| Blood Pump | Harvard Apparatus | 529552 | |
| Poly-Vinyl Carbonate Tubing | US Plastic | 65066, 65063, 65062 | Various sizes may be required |
| Luer Connections | Nordson Medical | Various | Various sizes will be required, and a number of parts should be purchased for replacement use. |
| Culture Chamber | Machined in-house | Custom | Acrylic may be purchased in sheets and machined for intended use. The engineering drawing shown in Figure 2 may be used to recreate this chamber. |
| Square Petri Dish | Cole-Parmer | EW-14007-10 | |
| Glass Slide Holder | Capitol Scientific | WHE-900303 | |
| Fetal Bovine Serum | Mediatech, Inc. | 35-010-CV | |
| Dulbecco's Modified Eagle Medium | Mediatech, Inc. | 10-013-CV | |
| Flow Meter | Sonotec, GmbH | Sonoflow co.55/060 | |
| Sylgard Elastomer Kit | Sigma-Aldrich | 761036-5EA | |
| 14 G Steel Cannula | General Laboratory Supply | S8365-1 |
参考文献
- Scott-Drechsel, D., Su, Z., Hunter, K., Li, M., Shandas, R., Tan, W. A new flow co-culture system for studying mechanobiology effects of pulse flow waves. Cytotechnology. 64 (6), 649-666 (2012).
- Tan, Y., et al. Stiffening-Induced High Pulsatility Flow Activates Endothelial Inflammation via a TLR2/NF-κB Pathway. PLoS ONE. 9 (7), e102195(2014).
- Wexler, L., et al. Coronary Artery Calcification: Pathophysiology, Epidemiology, Imaging Methods, and Clinical Implications A Statement for Health Professionals From the American Heart Association. Circulation. 94 (5), 1175-1192 (1996).
- Lan, T. -H., Huang, X. -Q., Tan, H. -M. Vascular fibrosis in atherosclerosis. Cardiovasc Pathol. 22 (5), 401-407 (2013).
- Lee, C. H., et al. Promoting endothelial recovery and reducing neointimal hyperplasia using sequential-like release of acetylsalicylic acid and paclitaxel-loaded biodegradable stents. Int J Nanomedicine. 9, 4117-4133 (2014).
- Intengan, H. D., Schiffrin, E. L. Vascular Remodeling in Hypertension Roles of Apoptosis Inflammation, and Fibrosis. Hypertension. 38 (3), 581-587 (2001).
- Greil, O., et al. Changes in carotid artery flow velocities after stent implantation: a fluid dynamics study with laser Doppler anemometry. J Endovasc Ther. 10 (2), 275-284 (2003).
- Egorova, A. D., van der Heiden, K., Poelmann, R. E., Hierck, B. P. Primary cilia as biomechanical sensors in regulating endothelial function. Differentiation. 83 (2), S56-S61 (2012).
- Liu, S. Q., Goldman, J. Role of blood shear stress in the regulation of vascular smooth muscle cell migration. IEEE T Bio-Med Eng. 48 (4), 474-483 (2001).
- Scott, D., Tan, Y., Shandas, R., Stenmark, K. R., Tan, W. High pulsatility flow stimulates smooth muscle cell hypertrophy and contractile protein expression. AJP: Lung C. 304 (1), L70-L81 (2013).
- Panaritis, V., et al. Pulsatility Index of Temporal and Renal Arteries as an Early Finding of Arteriopathy in Diabetic Patients. Ann Vasc Surg. 19 (1), 80-83 (2005).
- Miao, H., et al. Effects of Flow Patterns on the Localization and Expression of VE-Cadherin at Vascular Endothelial Cell Junctions: In vivo and in vitro Investigations. J Vasc Res. 42 (1), 77-89 (2005).
Access restricted. Please log in or start a trial to view this content.
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。