A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
في المختبر نموذج الفسيولوجية والمرضية تدفق الدم مع التطبيق على التحقيقات الأوعية الدموية إعادة عرض خلية
In This Article
Summary
هذا البروتوكول يعيد الفسيولوجية أو المرضية تدفق الدم في المختبر للمساعدة في تحديد استجابة الخلايا في أمراض المرض. عن طريق إدخال ضغط التخميد غرفة المصب مضخة الدم، وتدفق الدم عبر الأوعية الدموية ويمكن تلخيصها وفرضت على أحادي الطبقة من بطانة الأوعية الدموية أو المحاكاة ثقافة مشتركة.
Abstract
أمراض الأوعية الدموية هو سبب شائع للوفاة في الولايات المتحدة. هنا، فإننا نقدم وسيلة لدراسة مساهمة ديناميكية تدفق نحو الأمراض أمراض الأوعية الدموية. الشرايين غير صحية غالبا ما تكون موجودة مع تشنج الجدار، تندب، أو تضيق جزئي والتي قد تؤثر على جميع معدلات تدفق السوائل، وحجم تدفق نابض، أو مؤشر pulsatility. تكرار ظروف تدفق مختلف هو نتيجة لضبط ضغط تدفق التخميد غرفة المصب مضخة الدم. إدخال الهواء داخل نظام تدفق مغلقة تسمح وسيلة للانضغاط على امتصاص ضغط نابض من المضخة، وبالتالي تختلف مؤشر pulsatility. الطريقة الموضحة في هذه الوثيقة ويرد بكل بساطة، مع إدخال السيطرة عليها إلى حد كبير، ونتائج قابلة للقياس بسهولة. بعض القيود هي الترفيه من التعقيد الفسيولوجية الموجي النبض، والذي يقترب فقط من قبل النظام. تتأثر الخلايا البطانية، وخلايا العضلات الملساء، والخلايا الليفية من قبل عبتي تدفق الدمough الشريان. يتم تحديد العنصر الديناميكي لتدفق الدم عن طريق الانتاج وجدران الشرايين القلبية الامتثال. الأوعية الدموية خلية والميكانيكية تنبيغ ديناميكية تدفق قد تؤدي إلى إطلاق سراح خلوى وعبر الحديث بين أنواع الخلايا داخل الشريان. شارك في ثقافة من خلايا الأوعية الدموية هي صورة تعكس أكثر دقة التفاعل خلية خلية على جدار الأوعية الدموية والأوعية الدموية استجابة لإشارات الميكانيكية. مساهمة ديناميكية تدفق، بما في ذلك استجابة الخلية إلى عناصر دينامية ويعني (أو ثابتة) من التدفق، وبالتالي فهو مقياس مهم في تحديد علم الأمراض وفعالية العلاج. من خلال إدخال في المختبر نموذج التعاون ثقافة وضغط التخميد المصب من ضخ الدم الذي ينتج النتاج القلبي محاكاة، قد يتم التحقيق مختلف الأمراض مرض الشرايين.
Introduction
معدلات الإصابة بالأمراض لأمراض القلب والشرايين هي الأكبر في أميركا، مع ما يترتب على كثير من الأوعية الدموية غير صحية. تتكون الشرايين سليمة من الأنسجة المرنة، مع سطح اللمعية الناعمة المغلفة مع خلية البطانية (EC) أحادي الطبقة. قد تكون على غرار تدفق الدم باعتبارها وظيفة موجة تتأرجح مع معدل تدفق متوسط إيجابي. مؤشر pulsatility (PI) هو حاصل من حجم التذبذب ويعني تدفق (PI = (ماكس - مين) / متوسط) (1)، وقد غرار في المختبر مع مرونة الأوعية متغير 2 الشرياني مرونة مهمة في تخزين التدفق. الطاقة من انقباضات القلب، معلقا تحت ضغط الانقباضي، وتلعب دورا هاما في تحوير PI تدفق الدم. لأن يحافظ على قلب ثابت، نابض، التدفق الحجمي، وتوسيع الشرايين ويزيد من مساحة العابرة للقطاعات، وتعزيز الاستقرار عن طريق الحد من تدفق سرعة تدفق، إجهاد القص، وPI. في كثير من الأحيان، والتغيرات الشرايين غير الصحية الحالية للمرونةأو الامتثال، وعرض تشنج من إعادة الأوعية الدموية، وندبا أو تكلس 3، 4. بالإضافة إلى ذلك، واضطرابات الأوعية الدموية الأخرى، مثل تضخم neointimal (NIH)، 5 تمدد الأوعية الدموية وارتفاع ضغط الدم وتليف الأوعية الدموية 6 4، قد انقباض قطر السفينة. ومع ذلك، العلاج من تعاطي المخدرات الحالية ومعالجة الجهاز من أمراض الأوعية الدموية في كثير من الأحيان يتجاهلون أهمية الامتثال جدار الوعاء الدموي أو تدفق الدم ديناميكية في أمراض الأوعية الدموية التي كثيرا ما تتسبب بتغيرات في التشكل السفينة والممتلكات. لا قسطرة البالون ولا الدعامات لرد على مضاعفات جدار مرونة 7. لذلك، في المختبر نمذجة تدفق الدم الناتج عن أمراض الشرايين وعلاجات مهمة في التحقيق في الأمراض المرض وفعالية في المستقبل من العلاج. هنا، نحن تصف طريقة تكرار الفسيولوجية والمرضية تدفق الدم تهدف إلى تحديد استجابة الخلايا في pathol أمراض الأوعية الدمويةogies. يسبب تدفق السوائل إجهاد القص في جدار الوعاء الدموي، وهي إشارة الميكانيكية الهامة في مجال الصحة السفينة، مما يؤثر على كل الخلايا داخل الأوعية الدموية. وقد تم تحديد عدد من أجهزة الاستشعار الميكانيكية على بطانة الأوعية الدموية للالقص السوائل، بما في ذلك هدب الأساسي هو مبين في الدراسات الحديثة عن البطانية mechanosensing 8. تتأثر نشاط الخلايا البطانية والتشكل من خلال سرعة تدفق والتوجيه، وpulsatility. بالإضافة إلى ذلك، يمكن أن تتأثر خلايا العضلات الملساء (SMC) الهجرة عن طريق الاشارات والميكانيكية من انخفاض سرعة تدفق من خلال الخلالي السوائل 9، ويمكن أيضا أن تكون من خلال الإشارات نظير الصماوي من الخلايا البطانية من خلال استجابتها لتدفق ووالميكانيكية تنبيغ إشارات التدفق عبر خلوى الإفراج عن 10. و"جرعة" اعتماد القص نفسه، PI، ويشير نظير الصماوي قد تكون مترابطة أيضا. تحقيقا لهذه الغاية، وتحديد استجابة الخلايا الوعائية إلى القص السوائل مع متنوعة "الجرعات" في الثقافة أحادي الطبقةأو زملاء الثقافة في المختبر يمكن أن توفر رؤى الآلية في إعادة الأوعية الدموية وتحسين المرض والتنبؤ العلاج. نظام تدفق المستخدمة في هذه التجربة يتكون من مضخة الدم، تدفق التخميد خزان الهواء المنبع، تدفق متر المصب يستخدم فقط أثناء الإعداد التجريبية، ثقافة الخلية المصب، موازية لوحة غرفة تدفق، وخزان وسائل الإعلام. السيطرة على المتغيرات تدفق الأوعية الدموية مثل يعني معدل التدفق، يدق في الدقيقة الواحدة، ويمكن أن يتحقق من خلال PI السيطرة على معدل التدفق، وتواتر النبض، وإدخال ضغط التخميد. هي مضخات الدم نابض المتاحة مع نزوح السكتة الدماغية متغير، في تواتر السكتات الدماغية التي تسيطر عليها، تتصل مباشرة يعني معدل التدفق الحجمي، وتواتر النبض. مقدمة من خزان الهواء داخل الدائرة تدفق يسمح للضغط التخميد، والحد من حجم التذبذب التدفق. وسائل الإعلام هو سائل غير قابل للإنضغاط، في حين أن الهواء داخل غرفة التخميد هو انضغاط، مما يسمح للضغط الزائد من موجة تدفق لتكونتمتصه ضغط الهواء. الهواء لنسبة وسائل الإعلام يسمح للسيطرة على كيفية حدوث الكثير من التخميد. تم إنشاء مخصص الثقافة خلية تدفق غرفة 75 ملم في الطول بمقدار 50 ملم في العرض من الاكريليك. يدخل التدفق من خلال مدخل الميناء، ويوسع من خلال فتحة متعددة، وتوفير تدفق ثابت عبر مجمل غرفة التدفق. تدفق وهياكل مماثلة موجودة في منفذ الغرفة. هي المصنفة الخلايا على الشرائح functionalized، وتعلق بعد ذلك إلى غرفة التدفق. وهذا يسمح لعدد كبير من السكان واسترجاعها بسهولة بعد الدراسة. تجارب المشارك الثقافة قد تستخدم غشاء البولي يسهل اختراقها للقضاء على اتصال خلية الى خلية بين الثقافات بينما يسمح النقل خلوى / التدفق. وقد سبق استخدام هذا النظام لنمذجة تدفق PI عالية وتأثيره على الثقافة أحادي الطبقة البطانية وEC / SMC شارك في الثقافة 1، 10، للتحقيق في استجابة الخلايا للأمراض PI عالية بشكل مرضي. من خلال وصف بروتوكول يستخدم لنمذجتها يخدع تدفقditions، ونأمل في مساعدة الآخرين في تحديد مساهمة إشارة تدفق إلى استجابة الخلية.
Protocol
1. Silanization وجزيء حيوي Functionalization من الشرائح أو البولي غشاء
ملاحظة: العديد من المواد الكيميائية والحلول في هذا البروتوكول لديهم معدلات التبخر عالية (الإيثانول (ETOH)، والأسيتون، وغيرها). خطوات أخرى تستلزم مرات حضانة طويلة لمعدلات التبخر منخفضة. يوصى فيلم البرافين لختم الحاويات. تحذير: تعتبر خطرة، أو متقلبة: العديد من المواد الكيميائية (حمض الكبريتيك، والأسيتون، (3-أمينو) triethoxysilane، غلوتارالدهيد، ETOH بما في ذلك). استشارة رقة بيانات سلامة المواد (MSDS) من كل مادة لتخزين السليم، والمناولة، والتخلص منها قبل الاستخدام.
- وضع شريحة زجاجية جديدة قياس 75 مم 50 مم 1 ملم، في نظيفة، شريحة زجاجية طبق تلطيخ بغض النظر عن التوجه، وضمان الانغماس الكامل. استخدام حاوية لخطوات 1،1-1،12.
ملاحظة: لثقافة مشتركة، تشمل البولي (PC) الغشاء مع 0،4 ميكرون حجم المسام، وقطع لحجم 75 مم 50 مم، لجميع الظريف لاحقاملاحظة لfunctionalization PC وEC البذر. - تزج الشرائح في حامض الكبريتيك (20٪)، O / N.
تحذير: استشر MSDS لحامض الكبريتيك قبل الاستخدام. - تغسل الشرائح عن طريق غمر في الماء منزوع الأيونات (DI) لمدة 5 دقائق، ثلاث مرات، وتغيير DI كل مرة.
- تزج الشرائح في الأسيتون لمدة 30 دقيقة.
تحذير: استشر MSDS لالأسيتون قبل الاستخدام. - تزج الشرائح في 6٪ (3-أمينو) حل triethoxysilane / الأسيتون O / N.
تحذير: استشر MSDS ل(3-أمينو) triethoxysilane والأسيتون قبل الاستخدام. - تزج الشرائح في الأسيتون لمدة 5 دقائق، ثلاث مرات، وتغيير الأسيتون في كل مرة.
تحذير: استشر MSDS لالأسيتون قبل الاستخدام. - تغسل الشرائح عن طريق غمر في DI لمدة 5 دقائق، ثلاث مرات، وتغيير DI كل مرة.
- تزج الشرائح في 1.5٪ محلول غلوتارالدهيد / DI لمدة 60 دقيقة.
تحذير: استشر MSDS لغلوتارالدهيد قبل الاستخدام. - تغسل الشرائح عن طريق غمر في DI لمدة 5 دقائق، مرتين، وتغيير DI كل مرة.
- مكان الشريحةالصورة إلى 70٪ من الإيثانول (ETOH) لمدة 30 دقيقة في العقيمة، غطاء تدفق الصفحي.
- إزالة ETOH والسماح بقايا لتتبخر المتبقية. تزج الشرائح في DI معقمة وهجرة من أجل ترطيب الشرائح.
ملاحظة: الشرائح أو قد تكون مختومة غشاء PC في حامل شريحة زجاجية وتخزينها في 4 درجات مئوية تصل إلى أسبوع واحد. عند الاستخدام لزراعة الخلايا، كرر الخطوات من 1.10 و 1.11. - إزالة الشريحة من حامل الشرائح ووضعه في 100 ملم 100 ملم طبق بتري مربع في غطاء تدفق الصفحي.
ملاحظة: سيتم استخدام هذه الحاويات لجميع الخطوات المتبقية.- إعداد الشريحة أو PC لزرع الخلايا البطانية لتجربة زراعة محصول واحد.
- معطف الشريحة functionalized أو PC (الخطوة 1.11) مع 1 مل من محلول فبرونيكتين (25 ميكروغرام / مل)، على جانب واحد، وتغطي مساحة تقارب تتعرض لغرفة زراعة الخلايا.
- احتضان الشرائح أو PC في حاضنة معقمة وضعت في 37 درجة مئوية لمدة 1-2 ساعة.
- بعد الحضانة، ونضح الحل المتبقية باستخدام غلاSS الشافطة ماصة متصلة فراغ.
ملاحظة: الشرائح يمكن الآن المخزنة O / N عند 4 درجات مئوية لاستخدامها في المستقبل.
- اتبع الخطوات 1.12.2 فقط لإعداد EC / SMC ثقافة مشتركة. إعداد والبذور الملساء الخلايا العضلية (SMC) ثقافة لتجربة الثقافة المشتركة.
- المكان سيليكون طوقا على رأس الشريحة (الخطوة 1.11)، مع أبعاد 75 مم 50 مم القطر الخارجي، قطرها الداخلي 50 ملم بنسبة 30 مم، سماكة 0.5 مم، والثقوب التي تتماشى مع غرفة تدفق فراغ.
- إعداد 1 مل SMC في 10٪ FBS / DMEM تعليق. تحييد 1 مل من محلول من 2 ملغ / مل الكولاجين النوع الأول بنسبة 7٪ NaHCO 3 و 0.1 M محلول هيدروكسيد الصوديوم لدرجة الحموضة من 7.4، وتخلط مع SMC تعليق مع كثافة الخلية النهائية من 2 × 10 6 خلية / مل.
- نشر الحل SMC داخل حشية واحتضان الشرائح عند 37 درجة مئوية و 5٪ CO 2 لمدة 30 دقيقة.
- بعد الحضانة، وتغطية الشريحة مع المصل 25 مل 0.1٪ بقري جنيني (FBS) مختلطة في لDulbecco التعديلالنسر المتوسطة (DMEM) لمدة 72 ساعة.
- إعداد الشريحة أو PC لزرع الخلايا البطانية لتجربة زراعة محصول واحد.
- الخلايا البطانية الثقافة (ECS) على الغشاء شريحة زجاجية / البولي.
- البذور 1 مل ECS في 10٪ FBS / DMEM، مع التركيز الأولي من 6.0 × 10 5 خلية / مل، على الأسطح فبرونيكتين من شريحة زجاجية أو غشاء البولي.
- احتضان الخلايا في حاضنة عند 37 درجة مئوية، و 5٪ CO 2، وFBS 10٪ لمدة 120 دقيقة.
- الشرائح غطاء تحتوي على خلايا مع إضافية 10٪ FBS / DMEM، ومكان في الحاضنة في 37 درجة مئوية، و 5٪ CO 2 O / N، حتى 70٪ -80٪ متموجة.
2. تحديد اللزوجة السائل ومعدل التدفق الحجمي
ملاحظة: مقاييس اللزوجة الدوارة هي المعدات الحساسة، وينبغي الرجوع إلى دليل المستخدم جهاز قياس اللزوجة قبل معايرة، التصفير، أو أداء القياسات.
- تحديد القص السوائل المطلوب (τ) من أدب الأوعية الدموية استهدفت التجربة و.
- قياس آثافةه 1٪ FBS / DMEM اللزوجة (μ)، وذلك باستخدام جهاز قياس اللزوجة الدوراني.
- تحديد المطلوب معدل التدفق الحجمي (Q) من بوازوي المعادلة:
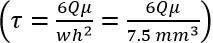 ،
،
حيث τ = السوائل القص، μ = اللزوجة، Q = المجلد. معدل التدفق، ث = غرفة العرض، وح = ارتفاع الغرفة). - وضع مضخة لمعدل المستمدة في الخطوة 2.3 تتدفق، واستخدام لجميع الخطوات اللاحقة.
3. تحديد مؤشر Pulsatility
ملاحظة: يجب أن تكون متصلا جميع منافذ اتصال داخل منظومة مع قفل حلقة إلى شوكة بحجم مناسب، أو الإناث اتصالات بالتركيبة إلى تعليق لاذع. ثم قد تكون مرتبطة توصيل أنابيب PVC إلى التجهيزات تعليق لاذع، وأكملت الدائرة.
- ربط الدائرة تدفق كما في الشكل 2، مع التخميد غرفة (الشكل 3) وبالموجات فوق الصوتية متر تدفق في اتجاه وتدفق الصحيح.
ملاحظة: بالموجات فوق الصوتية تدفق متر هو جزء حساس من المعدات، ووينبغي استشارة دليل المستخدم قبل استخدام. - ملء الدائرة التدفق والخزان بالماء DI، من خلال ضمان أنبوب مخرج الخزان (ضخ) هي غارقة داخل حجم الخزان. تصور الموجي تدفق باستخدام تدفق متر.
- فتح صمام إطلاق الهواء في الغرفة التخميد لتغيير نسبة حجم السائل / الهواء. انهيار صمام إطلاق الهواء على فترات مختلفة مستوى السائل وحساب مؤشر pulsatility (PI = (V ماكس - V مين) / V الوسط) باستخدام ذروة الموجي تدفق (V ماكس)، الحوض الصغير (V مين)، ويعني (V الوسط). سجل القيم PI في دفتر الملاحظات.
- علامة أدى مستوى السوائل وPI على غرفة التخميد، وذلك باستخدام شعر يميل، قلم حبر دائم للاستخدام في المستقبل. تحديد مستويات PI المرجوة من أمراض الأدب 11.
- السيليكون أنبوب Formation- الاختياري، طريقة أكثر تقدما من السيطرة على pulsatility
- مزيج قاعدة سيليكون المطاط الصناعي وكيل علاج في نسب مختلفة (على سبيل المثال، لوبانسبة الإلكتروني إلى crosslinker من 10: 1 إلى 36: 1) لاختلفت الرجوعية المرنة المستهدفة، كما هو موضح سابقا 2
- افتعال أنابيب السيليكون بتكرار عملية تراجع، علاج، لينخفض لفترة وجيزة قنية الصلب (14 G) إلى سيليكون خليط prepolymer مع نسبة محددة سلفا قاعدة إلى crosslinker.
- وضع قنية المغلفة prepolymer في فرن وضعت في 60 درجة مئوية لمدة 4 ساعات لعلاج طلاء البوليمر على قنية، والتحول الاتجاه في منتصف عملية المعالجة.
- تكرار عملية غمس مع نفس خليط سيليكون المطاط الصناعي ووضع مرة أخرى في الفرن لمدة 4 ساعات إضافية، مما يؤدي إلى ~ 0.3 ملم أنابيب سميكة.
- إزالة أنبوب سامسونج سيليكون من قنية الفولاذ المقاوم للصدأ.
- توصيل أنابيب تدفق الدائرة بدلا من التخميد غرفة، واختبار PI لكل واحد كما في 3.3.
4. مضخة التعقيم
- تزج غرفة التدفق (الشكل 2)، الأنابيب البلاستيكية، وحشيات في 10٪ بيروكسيد الهيدروجين (H 2 O 2). يغسل مع DI معقم قبل الخطوة 4.
- وضع مضخة الدم على الرف حاضنة الفراغ.
ملاحظة: يجب أن تكون الرفوف حاضنة الفولاذ المقاوم للصدأ، وتكون قادرة على دعم وزن الدائرة تدفق بأكملها. - ملء الدائرة التدفق والخزان مع 10٪ H 2 O 2 عن طريق ضمان أنبوب مخرج الخزان (ضخ) هي غارقة داخل حجم الخزان. تعميم H 2 O 2 عن طريق الضخ عبر الدائرة لمدة 20 دقيقة في غطاء تدفق الصفحي مع ضوء الأشعة فوق البنفسجية على.
- نضح عن H 2 O 2 من الأنابيب، ويغسل مع برنامج تلفزيوني العقيمة التي كتبها الضخ عبر الدائرة التدفق.
5. تدفق الجمعية الغرفة
ملاحظة: تتكون غرفة التدفق من الاكريليك، لوحة العرف، مع منافذ فراغ ومدخل والموانئ تدفق منفذ (انظر الشكل 2). ويتألف مجلس غرفة من وضع غرفة التدفق وحشيات على رأس الشرائح الثقافة، والمؤيدperly الانحياز، ويوصف أدناه.
- الاحماء 1٪ FBS / DMEM في 37 ° C حمام المياه وإعداد غرفة التدفق.
- اتخاذ EC تنزلق للخارج وسائل الإعلام (من الخطوة 1.13) ومكان طوقا على أعلى مع الجانب الخلية يصل.
- (اختياري) اتخاذ غشاء PC من وسائل الإعلام (من الخطوة 1.13) ومكان طوقا على أعلى مع الجانب الخلية يصل. ضع الشريحة ثقافة مشتركة مع المصنفة SMC (الخطوة 1.12.2) تحت غشاء PC.
- محاذاة قناة فراغ الغرفة تدفق مع الفتحات الموجودة في طوقا (الشكل 2).
- إرفاق فراغ أنبوب إلى الموانئ فراغ (الشكل 2) ضمان عدم تسرب سائل الإعلام إلى فراغ.
- ورقة البولي مكان تحت شريحة زجاجية وتدفق المشبك التجمع الغرفة مع المشابك الربيع، واحدة على كل جانب من غرفة التدفق (أرقام 2 و 5).
- النظام مكان تدفق في الحاضنة عند 37 درجة مئوية و 5٪ CO 2، وملء الدائرة مع وسائل الاعلام عن طريق الضخ من الخزان شغل في انخفاض pulsatility.الحفاظ على هذا التدفق لمدة 4 ساعة لشروط مسبقة الخلايا.
- ضبط حجم السائل في التخميد الغرفة إلى مستوى PI ملحوظ، والثقافة عن الوقت المطلوب.
النتائج
الحفاظ على ظروف التدفق هي التي تعتمد على التجميع الصحيح من الدائرة تدفق (الشكل 1). أنابيب قطرها هو اختيار هامة في التجمع، وبأقطار أكبر خفض مقاومة تدفق وهبوط الضغط لاحق قبل وبعد غرفة الثقافة. لضمان يقصد الضغط وسرعة تدفق وتجميع النظام مع تدفق متر قبل التجربة مع ...
Discussion
يصف هذا البروتوكول وسيلة لإعادة إنتاج تدفق نابض في المختبر، ويمكن أن يكون خطوة أولى مفيدة في تحديد مساهمة ظروف تدفق لأمراض المرض. وقد وجدت دراسات سابقة باستخدام هذا البروتوكول تساهم ظروف التدفق إلى الاستجابة الالتهابية الأوعية الدموية. 1، 10 بالإضافة إلى ذ...
Disclosures
الكتاب ليس لديهم ما يكشف.
Acknowledgements
الكتاب نود أن نعترف مصادر التمويل، بما في ذلك AHA (13GRNT16990019 إلى WT) وNHLBI (HL097246 وHL119371 لWT).
Materials
| Name | Company | Catalog Number | Comments |
| Acetone | Sigma-Aldrich | 34850 | |
| Sulfuric Acid | Sigma-Aldrich | 320501 | |
| (3-Aminopropyl)trethoxysilane | Sigma-Aldrich | 440140 | |
| Glutaraldehyde Solution | Sigma-Aldrich | G5882 | |
| Ethanol | Sigma-Aldrich | 459844 | |
| Glass Slide (70mm x 50mm) | Sigma-Aldrich | CLS294775X50 | |
| Polycarbonate Membrane | Millipore Corp. | HTTP09030 | |
| Silicone Gasket | Grace Bio-Labs | RD 475464 | |
| Fibronectin (25 μg/mL) | Sigma-Aldrich | F1141 | |
| Collagen Type-I | Sigma-Aldrich | C3867 | |
| NaHCO3 | Fluka | 36486 | |
| NaOH | Sigma-Aldrich | S5881 | |
| Damping Chamber | This chamber is custom made, and may be requested using the engineering drawing of Figure 3. | ||
| Blood Pump | Harvard Apparatus | 529552 | |
| Poly-Vinyl Carbonate Tubing | US Plastic | 65066, 65063, 65062 | Various sizes may be required |
| Luer Connections | Nordson Medical | Various | Various sizes will be required, and a number of parts should be purchased for replacement use. |
| Culture Chamber | Machined in-house | Custom | Acrylic may be purchased in sheets and machined for intended use. The engineering drawing shown in Figure 2 may be used to recreate this chamber |
| Square Petri Dish | Cole-Parmer | EW-14007-10 | |
| Glass Slide Holder | Capitol Scientific | WHE-900303 | |
| Fetal Bovine Serum | Mediatech, Inc. | 35-010-CV | |
| Dulbecco's Modified Eagle Medium | Mediatech, Inc. | 10-013-CV | |
| Flow Meter | Sonotec, GmbH | Sonoflow co.55/060 | |
| Sylgard Elastomer Kit | Sigma-Aldrich | 761036-5EA | |
| 14 G Steel Cannula | General Laboratory Supply | S8365-1 |
References
- Scott-Drechsel, D., Su, Z., Hunter, K., Li, M., Shandas, R., Tan, W. A new flow co-culture system for studying mechanobiology effects of pulse flow waves. Cytotechnology. 64 (6), 649-666 (2012).
- Tan, Y., et al. Stiffening-Induced High Pulsatility Flow Activates Endothelial Inflammation via a TLR2/NF-κB Pathway. PLoS ONE. 9 (7), e102195 (2014).
- Wexler, L., et al. Coronary Artery Calcification: Pathophysiology, Epidemiology, Imaging Methods, and Clinical Implications A Statement for Health Professionals From the American Heart Association. Circulation. 94 (5), 1175-1192 (1996).
- Lan, T. -. H., Huang, X. -. Q., Tan, H. -. M. Vascular fibrosis in atherosclerosis. Cardiovasc Pathol. 22 (5), 401-407 (2013).
- Lee, C. H., et al. Promoting endothelial recovery and reducing neointimal hyperplasia using sequential-like release of acetylsalicylic acid and paclitaxel-loaded biodegradable stents. Int J Nanomedicine. 9, 4117-4133 (2014).
- Intengan, H. D., Schiffrin, E. L. Vascular Remodeling in Hypertension Roles of Apoptosis Inflammation, and Fibrosis. Hypertension. 38 (3), 581-587 (2001).
- Greil, O., et al. Changes in carotid artery flow velocities after stent implantation: a fluid dynamics study with laser Doppler anemometry. J Endovasc Ther. 10 (2), 275-284 (2003).
- Egorova, A. D., van der Heiden, K., Poelmann, R. E., Hierck, B. P. Primary cilia as biomechanical sensors in regulating endothelial function. Differentiation. 83 (2), S56-S61 (2012).
- Liu, S. Q., Goldman, J. Role of blood shear stress in the regulation of vascular smooth muscle cell migration. IEEE T Bio-Med Eng. 48 (4), 474-483 (2001).
- Scott, D., Tan, Y., Shandas, R., Stenmark, K. R., Tan, W. High pulsatility flow stimulates smooth muscle cell hypertrophy and contractile protein expression. AJP: Lung C. 304 (1), L70-L81 (2013).
- Panaritis, V., et al. Pulsatility Index of Temporal and Renal Arteries as an Early Finding of Arteriopathy in Diabetic Patients.. Ann Vasc Surg. 19 (1), 80-83 (2005).
- Miao, H., et al. Effects of Flow Patterns on the Localization and Expression of VE-Cadherin at Vascular Endothelial Cell Junctions: In vivo and in vitro Investigations. J Vasc Res. 42 (1), 77-89 (2005).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved