このコンテンツを視聴するには、JoVE 購読が必要です。 サインイン又は無料トライアルを申し込む。
Method Article
血管細胞リモデリングの研究への応用生理学的および病理学的血流のインビトロモデル
要約
このプロトコルは、疾患の病理における細胞応答を決定するのを助けるために、インビトロで生理学的または病理学的な血流を複製します。血液ポンプの下流ダンピング室の圧力を導入することにより、脈管構造を横切る血流が血管内皮または模倣共培養の単層上で要約し、課すことができます。
要約
血管疾患は、米国内の死亡の一般的な原因です。ここで、我々は、血管疾患の病理に向けて流動力学の寄与を調べるための方法を提示します。壁の補強、瘢痕化、またはすべての流体の流量に影響を与える可能性があり、部分的狭窄、及び拍動流、または拍動指数の大きさにしばしば存在不健康な動脈。様々な流れ条件の複製は、血液ポンプの下流室を減衰流れ圧力を調整する結果です。閉じたフローシステム内の空気の導入は、ポンプからの脈動圧力を吸収する圧縮可能なメディアを可能にし、したがって、拍動指数を変化させます。本明細書に記載される方法は、単純に、高度に制御入力、および容易に測定結果を、再生されます。いくつかの制限は、システムで近似され、複雑な生理的なパルス波形のレクリエーションです。内皮細胞、平滑筋細胞、および線維芽細胞は、血流THRの影響を受けます動脈ウワーッ。血流の動的成分は、心拍出量および動脈壁のコンプライアンスによって決定されます。流動力学の血管細胞メカノトランスダクションは、サイトカイン放出および動脈内の細胞型の間のクロストークをトリガすることができます。血管細胞の共培養は、血管壁との機械的シグナルに対する血管応答における細胞間相互作用を反映して、より正確な画像です。流れの動的平均(または安定した)コンポーネントに対する細胞応答を含む流動力学の寄与は、したがって、疾患の病状および治療有効性を決定する上で重要な測定基準です。 in vitroでの共培養モデルを導入し、圧力がシミュレートされた心拍出量を生成する血液ポンプの下流に減衰を通して、種々の動脈疾患の病状を調査することができます。
概要
心血管疾患の罹患率は、不健康な血管系に起因する多くは、アメリカで最大です。健康な動脈は、内皮細胞(EC)の単層でコーティングされたソフト腔表面に、弾性組織で構成されています。動脈流は、正の平均流量で振動波の関数としてモデル化することができます。拍動指数(PI)は振動の大きさの商と平均流(。。PI =(最大-最小)/平均値 )で、1変数血管の弾力性とin vitroでモデル化された2動脈の弾力性は、フローのストレージ上で重要です。収縮期圧の下で拡張する心臓収縮のエネルギー、および血流PIの調節に重要な役割を果たしています。心臓が一貫、拍動、体積流量を維持するので、動脈の拡張は、流速、せん断応力、及びPIを減少させることにより流動性を高め、断面積を増大させます。弾力性に頻繁に、不健康な動脈存在変更またはコンプライアンス、血管リモデリングから補強、瘢痕組織または石灰化3、4が表示されます。加えて、新生内膜過形成(NIH)、5瘤および高血圧6および血管線維症4のような他の血管障害は、血管の直径を収縮することができます。しかし、現在の薬物治療、および血管疾患の治療装置は、多くの場合、多くの場合、血管の形態及び特性の変化によって複雑になる血管疾患における血管壁コンプライアンスまたは血流力学の重要性を無視します。どちらのバルーン血管形成術やステント留置術は、壁の弾力性7の合併症に答えます。したがって、血液の in vitroモデルは、動脈疾患と治療に起因する疾患の病理と治療の将来の有効性を検討する上で重要であるが流れます。本明細書において、我々はpathol血管疾患における細胞応答を決定するように設計生理学的および病理学的血流を複製する方法を記載オギース。流体の流れは、血管系内のすべてのセルに影響を与え、血管の健康に重要な機械的な信号である血管壁、でせん断応力が発生します。流体せん断のための血管内皮上のいくつかの機械式センサは内皮mechanosensing 8のための最近の研究で示さ一次繊毛を含む、同定されています。内皮細胞の活性及び形態は、流れの速度、方向、および脈動の影響を受けます。また、平滑筋細胞(SMC)移動は、間質液9を介して低速の流れのメカノ信号によって影響を受けることができ、また、流れおよびサイトカインを介して流量信号のメカノトランスダクションするためにそれらの応答を介して内皮細胞からのパラクリンシグナリングを通じてことができ10を解放します 。 「用量」の平均せん断、PIの依存性、およびパラクリンシグナル伝達はまた、相互に依存する場合があります。単層培養で変化 "投与"と流体せん断に対する血管細胞応答のこの目的のために、決意またはin vitroでの共培養は、血管リモデリングに機械的な洞察を提供し、病気や治療の予測を向上させることができます。この実験で使用されるフローシステムは、血液ポンプ、空気タンク、唯一実験中に使用される下流の流量計、下流の細胞培養、パラレルプレートフローチャンバー、およびメディアリザーバを減衰上流の流れから成ります。以下のような血流変数の制御は、流量平均、分当たりのビート、及びPIは、流量制御、パルス周波数、圧力減衰の導入によって達成され得ます。拍動血液ポンプは、体積流量、およびパルス周波数を意味するように直接関連して、制御されたストロークの周波数で、可変ストローク変位を用意しています。流れ回路内の空気タンクの導入は流れ振動の大きさを低減し、圧力減衰を可能にします。減衰チャンバ内の空気が流れ波から過剰な圧力があることをできるように、圧縮可能である一方でメディアは、非圧縮性流体であります空気圧縮により吸収されます。メディア比への空気は多くの減衰がどのように発生するかを制御することができます。幅50mmによって長さが75ミリメートルカスタム細胞培養フローチャンバーは、アクリルから作成されました。流れは、入口ポートを通って入り、入口マニホルドを通じて膨張し、フローチャンバーの全体一貫した流れを提供します。同様の流れと構造は、チャンバ出口に存在します。細胞は、官能化スライドガラス上に播種し、続いてフローチャンバーに取り付けられています。これは、簡単に研究した後に検索された大規模な集団を可能にします。共培養実験は、サイトカイン/フロー輸送を可能にしながら、培養の間、細胞間の接触を排除するために、多孔性ポリカーボネート膜を使用することができます。このシステムは、以前に病的に高いPI疾患に対する細胞応答を調査するため、10、高PIフローおよび内皮単層培養およびEC / SMC共培養1への影響をモデル化するために使用されてきました。これらのフローコンをモデル化するために使用するプロトコルを記述することによりditionsは、我々は、細胞応答への流れ信号の寄与を決定する際に他の人を支援したいと考えています。
プロトコル
1.シラン化スライドの生体分子機能化やポリカーボネートメンブレン
注:このプロトコル内化学物質やソリューションの多くは、高い蒸発速度(エタノール(エタノール)、アセトンなど )を持っています。他のステップは、低蒸発速度のための長いインキュベーション時間を必要とします。パラフィンフィルムは、容器を密閉することをお勧めします。注意:(含む:硫酸、アセトン、(3-アミノプロピル)トリエトキシシラン、グルタルアルデヒド、エタノール)の化学物質の多くは、危険な、または揮発性と見なされます。使用前に適切な保管、取り扱い、および処分のための各材料の材料安全データシート(MSDS)を参照してください。
- フルイマージョンを確保し、向きに関係なくきれいな、ガラススライド染色ディッシュ中に1ミリメートルによって50ミリメートルによって75ミリメートルを測定する新しいスライドガラスを配置します。ステップ1.1から1.12のコンテナを使用してください。
注:すべての後続のSTEために、50 mmの75 mmのサイズにカット0.4ミクロン孔サイズとの共培養のために、ポリカーボネートを含む(PC)膜PC官能とEC播種用のPS。 - 硫酸(20%)、O / Nでスライドを浸します。
注意:使用前に硫酸のMSDSを参照してください。 - DIを毎回変更し、5分間、脱イオン水(DI)で3回浸漬することにより洗浄スライド。
- 30分間アセトン中でスライドを浸し。
注意:使用前にアセトンのMSDSを参照してください。 - 6%(3-アミノプロピル)トリエトキシシラン/アセトン溶液、O / Nでスライドを浸します。
注意:使用前に(3-アミノプロピル)トリエトキシシラン及びアセトンのMSDSを参照してください。 - アセトンを毎回変え、5分、3回、アセトンでスライドを浸します。
注意:使用前にアセトンのMSDSを参照してください。 - 、5分、3回のDIに浸漬するたびに、DIを変更することによって、スライドを洗浄します。
- 60分間1.5%グルタルアルデヒド/ DI溶液中でスライドを浸し。
注意:使用前にグルタルアルデヒドのMSDSを参照してください。 - 、5分、2回のDIに浸漬するたびに、DIを変更することによって、スライドを洗浄します。
- 場所スライド無菌層流フード内で30分間、70%エタノール(EtOH)中に、S。
- エタノールを削除し、残った残留物が蒸発することができます。スライドを再水和するために、無菌DIとドレインでスライドを浸し。
注:スライドまたはPC膜をガラススライドホルダー中に密封し、一週間まで4℃で保存することができます。細胞培養に使用すると、繰り返しは1.10と1.11を繰り返します。 - スライドホルダーからスライドを削除し、層流フードでは100平方mmペトリ皿によって100ミリメートルにそれを置きます。
注:このコンテナには、残りのすべてのステップのために使用されます。- 単一栽培実験のための内皮細胞播種のためのスライドまたはPCを準備します。
- コート官能スライドやPC片側に1ミリリットルフィブロネクチン溶液(25μgの/ ml)で(ステップ1.11)、細胞培養室にさらされるおおよその領域をカバー。
- 1〜2時間、37℃に設定した滅菌インキュベーター内でスライドやPCをインキュベートします。
- インキュベーション後、GLAを使用して、残りの溶液を吸引真空に接続されたSSの吸引ピペット。
注:スライドは現在、将来の使用のために4℃でO / Nを格納することができます。
- 唯一のEC / SMC共培養を調製するための1.12.2の手順に従ってください。準備し、共培養実験のための平滑筋細胞(SMC)の培養を播種。
- 50ミリメートル、外径を30mm、0.5mmの厚さ、およびフローチャンバーの真空に合わせ穿孔により50mmの内径75ミリの大きさで、スライド(ステップ1.11)の上にシリコンガスケットを置きます。
- 10%FBS / DMEM懸濁液中に1ミリリットルSMCを準備します。 7%NaHCO 3および7.4のpHを0.1 M NaOH溶液で2 mg / mlのコラーゲンI型の1 mlの溶液を中和し、そして2×10 6細胞/ mlの最終細胞密度SMCの懸濁液と混合します。
- ガスケット内SMC溶液を広げ、30分間、37℃、5%CO 2でスライドをインキュベートします。
- インキュベーション後、ダルベッコ改変で混合25 mlの0.1%ウシ胎児血清(FBS)でスライドをカバー72時間イーグル培地(DMEM)。
- 単一栽培実験のための内皮細胞播種のためのスライドまたはPCを準備します。
- スライドガラス/ポリカーボネート膜上で培養内皮細胞(EC)。
- スライドガラスまたはポリカーボネート膜のフィブロネクチン表面上に6.0×10 5細胞/ mlの初期濃度と種子10%FBS / DMEM中の1ミリリットルのECを、。
- 37℃、5%CO 2インキュベーター中で細胞をインキュベートし、120分間、10%FBS。
- 37℃でインキュベーター中でさらに10%FBS / DMEMで細胞、および場所を含むカバースライド、5%CO 2、O / N、70%-80%コンフルエントになるまで。
流体の粘度および体積流量の2決意
注:回転粘度計は精密機器であり、粘度計のユーザマニュアルは、校正ゼロ、または測定を行う前に相談する必要があります。
- 実験の対象となる血管系の文献から所望の流体せん断(τ)を決定します。
- Measur回転式粘度計を使用して電子の1%FBS /(μ)DMEM粘度。
- ポアズイユの式から必要な体積流量(Q)を決定します。
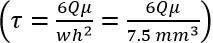 、
、
ここで、τ=流体せん断、μ=粘度、Q =体積チャンバ幅W =流量、及びh =室の高さ)。 - 設定ポンプステップ2.3で導出流量、およびそれ以降のすべてのステップのために使用します。
拍動指数の3決意
注:システム内のすべての接続ポートは、適切なサイズのロック・リング・ツー・バーブ、または雌型ルアー・ツー・バーブ接続で接続する必要があります。接続PVCチューブは、その後、バーブ継手に接続することができ、回路を完成。
- 正しい流れ方向にチャンバー( 図3)と超音波流量計を減衰して、 図2のように流れ回路を接続します。
注意:超音波流量計は、機器の敏感な部分である、とマニュアルには、使用前に相談する必要があります。 - (ポンプ)リザーバアウトレットチューブを確保することによって、DI水を用いて流れ回路とリザーバを充填リザーバ容積内に沈められます。流量計を用いた流量波形を視覚化します。
- 流体/空気の体積比を変化させる減衰室に外気開放弁。閉じる異なる流体レベル間隔で大気開放弁と拍動指数(PI =(V マックス - V最小)/ V の平均)を計算流量波形のピーク(V max)を使用することにより、トラフ(V最小)、および(V 平均)を意味します。ノートブックのレコードのPI値。
- マークは、将来の使用のために傾けフェルト、永続的なインクのペンを使用して、減衰室の流体レベルとPIを生じました。病理文献11から目的のPIレベルを決定します。
- シリコンチューブFormation-オプション、拍動を制御する、より高度な方法
- 異なる比(例えば、BASにシリコーンエラストマーベースと硬化剤を混合1〜36:10から電子への架橋剤の比率。1)に変化対象と弾性率のために、先に示したように2
- 簡単に所定の塩基対架橋剤の比を有するシリコーンプレポリマー混合物中に鋼製カニューレ(14 G)を浸漬し、繰り返し浸漬硬化プロセスによってシリコンチューブを製造します。
- 4時間は、硬化プロセスの途中で方向を切り替える、カニューレ上のポリマーコーティングを硬化させるために60℃に設定したオーブン中に、プレポリマー被覆カニューレを配置します。
- 同じシリコーンエラストマー混合物で浸漬法を繰り返し、〜厚さ0.3mmのチューブになり、さらに4時間、背面オーブン内に配置します。
- ステンレス鋼カニューレから極薄シリコンチューブを外します。
- 3.3のようにそれぞれのための代わり室を減衰させる回路、およびテストPIを流すチューブを接続します。
4.ポンプの滅菌
- 1フローチャンバー( 図2)、PVCチューブ、及びガスケットを浸します0%の過酸化水素(H 2 O 2)。ステップ4の前に滅菌DIで洗います。
- 予備のインキュベーターの棚の上の血液ポンプを配置します。
注:インキュベーターの棚はステンレス鋼であること、および全体の流れ回路の重量を支えることができるはずです。 - (ポンプ)リザーバアウトレットチューブを確実にすることによって、10%のH 2 O 2と流体回路とリザーバを充填リザーバ容積内に沈められます。上のUV光を層流フード中で20分間回路を介してポンピングすることによってH 2 O 2を循環させます 。
- すべて吸引チューブからH 2 O 2、およびフロー回路を通ってポンプで滅菌PBSで洗浄しました。
5.フロー商工会議総会
注:フローチャンバは、真空ポートと、入口および出口流れポート( 図2を参照)、アクリル、特注のプレートから成ります。チャンバアセンブリは、培養スライドの上にフローチャンバーとガスケットを配置することで構成され、プロperly整列、および以下に記載されています。
- 37℃の水浴中で1%FBS / DMEMをウォームアップし、フローチャンバーを準備します。
- (ステップ1.13から)メディアのうち、ECスライドを取り、セル側を上にして上の場所ガスケット。
- (オプション)(ステップ1.13から)メディアのうち、PC膜を取り、セル側を上にして上の場所ガスケット。 PC膜の下にシードされたSMC(ステップ1.12.2)との共培養のスライドを置きます。
- ガスケットの穴( 図2)とフローチャンバーの真空チャネルを合わせます。
- 真空へのメディアの漏れを確実にしない真空ポート( 図2)に真空管を取り付けます。
- スプリングクランプ、フローチャンバーの各側に1つ( 図2および図5)を用いてガラススライド及びクランプフローチャンバアセンブリの下に置きポリカーボネートシート。
- 場所フロー37℃のインキュベーター内のシステムおよび5%CO 2、および低脈動で満たされた容器からポンプでメディアとの回路を埋めます。細胞をプレコンディショニングのために4時間のためにこの流れを維持します。
- 所望の時間のためにマークPIレベル、および文化にダンピング室に流体音量を調整します。
結果
流れ条件の維持は、フロー回路( 図1)の正確な組立に依存しています。チューブの直径がより大きな直径を培養室の前後の流れ抵抗およびその後の圧力低下を低減することで、アセンブリ内の重要な選択です。意図された圧力と流速を確保するために、意図されたチューブを用いた実験の前に流量計を使用してシステムを組み立てます。培養チャンバの真空チャネルのアライン...
ディスカッション
このプロトコルは、in vitroでの拍動流を再生する方法を記載し、そして疾患の病理に流れ状態の寄与を決定するのに役立つ最初の工程であってもよいです。このプロトコルを使用して、以前の研究では、流れ状態は、血管炎症反応に寄与する発見した。さらに1、10、このプロトコルは、経験豊富な研究室のために意図されています。このように、いずれも深流体力学にお...
開示事項
著者らは、開示することは何もありません。
謝辞
著者は、AHA(WTに13GRNT16990019)とNHLBI(WTにHL097246とHL119371)などの資金源を承認したいと思います。
資料
| Name | Company | Catalog Number | Comments |
| Acetone | Sigma-Aldrich | 34850 | |
| Sulfuric Acid | Sigma-Aldrich | 320501 | |
| (3-Aminopropyl)trethoxysilane | Sigma-Aldrich | 440140 | |
| Glutaraldehyde Solution | Sigma-Aldrich | G5882 | |
| Ethanol | Sigma-Aldrich | 459844 | |
| Glass Slide (70mm x 50mm) | Sigma-Aldrich | CLS294775X50 | |
| Polycarbonate Membrane | Millipore Corp. | HTTP09030 | |
| Silicone Gasket | Grace Bio-Labs | RD 475464 | |
| Fibronectin (25 μg/mL) | Sigma-Aldrich | F1141 | |
| Collagen Type-I | Sigma-Aldrich | C3867 | |
| NaHCO3 | Fluka | 36486 | |
| NaOH | Sigma-Aldrich | S5881 | |
| Damping Chamber | This chamber is custom made, and may be requested using the engineering drawing of Figure 3. | ||
| Blood Pump | Harvard Apparatus | 529552 | |
| Poly-Vinyl Carbonate Tubing | US Plastic | 65066, 65063, 65062 | Various sizes may be required |
| Luer Connections | Nordson Medical | Various | Various sizes will be required, and a number of parts should be purchased for replacement use. |
| Culture Chamber | Machined in-house | Custom | Acrylic may be purchased in sheets and machined for intended use. The engineering drawing shown in Figure 2 may be used to recreate this chamber |
| Square Petri Dish | Cole-Parmer | EW-14007-10 | |
| Glass Slide Holder | Capitol Scientific | WHE-900303 | |
| Fetal Bovine Serum | Mediatech, Inc. | 35-010-CV | |
| Dulbecco's Modified Eagle Medium | Mediatech, Inc. | 10-013-CV | |
| Flow Meter | Sonotec, GmbH | Sonoflow co.55/060 | |
| Sylgard Elastomer Kit | Sigma-Aldrich | 761036-5EA | |
| 14 G Steel Cannula | General Laboratory Supply | S8365-1 |
参考文献
- Scott-Drechsel, D., Su, Z., Hunter, K., Li, M., Shandas, R., Tan, W. A new flow co-culture system for studying mechanobiology effects of pulse flow waves. Cytotechnology. 64 (6), 649-666 (2012).
- Tan, Y., et al. Stiffening-Induced High Pulsatility Flow Activates Endothelial Inflammation via a TLR2/NF-κB Pathway. PLoS ONE. 9 (7), e102195 (2014).
- Wexler, L., et al. Coronary Artery Calcification: Pathophysiology, Epidemiology, Imaging Methods, and Clinical Implications A Statement for Health Professionals From the American Heart Association. Circulation. 94 (5), 1175-1192 (1996).
- Lan, T. -. H., Huang, X. -. Q., Tan, H. -. M. Vascular fibrosis in atherosclerosis. Cardiovasc Pathol. 22 (5), 401-407 (2013).
- Lee, C. H., et al. Promoting endothelial recovery and reducing neointimal hyperplasia using sequential-like release of acetylsalicylic acid and paclitaxel-loaded biodegradable stents. Int J Nanomedicine. 9, 4117-4133 (2014).
- Intengan, H. D., Schiffrin, E. L. Vascular Remodeling in Hypertension Roles of Apoptosis Inflammation, and Fibrosis. Hypertension. 38 (3), 581-587 (2001).
- Greil, O., et al. Changes in carotid artery flow velocities after stent implantation: a fluid dynamics study with laser Doppler anemometry. J Endovasc Ther. 10 (2), 275-284 (2003).
- Egorova, A. D., van der Heiden, K., Poelmann, R. E., Hierck, B. P. Primary cilia as biomechanical sensors in regulating endothelial function. Differentiation. 83 (2), S56-S61 (2012).
- Liu, S. Q., Goldman, J. Role of blood shear stress in the regulation of vascular smooth muscle cell migration. IEEE T Bio-Med Eng. 48 (4), 474-483 (2001).
- Scott, D., Tan, Y., Shandas, R., Stenmark, K. R., Tan, W. High pulsatility flow stimulates smooth muscle cell hypertrophy and contractile protein expression. AJP: Lung C. 304 (1), L70-L81 (2013).
- Panaritis, V., et al. Pulsatility Index of Temporal and Renal Arteries as an Early Finding of Arteriopathy in Diabetic Patients.. Ann Vasc Surg. 19 (1), 80-83 (2005).
- Miao, H., et al. Effects of Flow Patterns on the Localization and Expression of VE-Cadherin at Vascular Endothelial Cell Junctions: In vivo and in vitro Investigations. J Vasc Res. 42 (1), 77-89 (2005).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved