Se requiere una suscripción a JoVE para ver este contenido. Inicie sesión o comience su prueba gratuita.
Method Article
En Vitro Modelo de fisiológicos y patológicos de flujo de sangre con aplicación a las investigaciones de remodelado vascular celular
En este artículo
Resumen
Este protocolo se replica el flujo de sangre fisiológica o patológica in vitro para ayudar en la determinación de la respuesta celular en patologías de enfermedades. Mediante la introducción de una cámara de presión aguas abajo de una bomba de sangre de amortiguación, el flujo de sangre a través de la vasculatura puede recapituló e impuso en una monocapa de endotelio vascular o un compañero de la cultura mimética.
Resumen
La enfermedad vascular es una causa común de muerte en los Estados Unidos. En este documento, se presenta un método para examinar la contribución de la dinámica del flujo hacia las patologías de enfermedades vasculares. Arterias no saludables a menudo presentan rigidez de la pared, la cicatrización, o estenosis parcial que todos puedan afectar las tasas de flujo de fluido, y la magnitud de flujo pulsátil, o índice de pulsatilidad. La replicación de diversas condiciones de flujo es el resultado de un ajuste de presión de flujo cámara aguas abajo de una bomba de sangre de amortiguación. La introducción de aire dentro de un sistema cerrado de flujo permite un medio compresible para absorber la presión pulsátil de la bomba, y por lo tanto varía el índice de pulsatilidad. El método descrito en este documento es simplemente reproducida, con la entrada altamente controlable, y los resultados fácilmente medibles. Algunas limitaciones son recreación de la compleja forma de onda de pulso fisiológico, que sólo se aproxima por el sistema. Las células endoteliales, células musculares lisas y fibroblastos se ven afectados por el flujo de sangre thrOugh la arteria. El componente dinámico del flujo de sangre se determina por la salida y la pared arterial cumplimiento cardíaco. Vascular celular mecano-transducción de la dinámica de flujo puede desencadenar la liberación de citoquinas y la diafonía entre los tipos de células dentro de la arteria. Co-cultivo de células vasculares es una imagen que refleja la interacción célula-célula más precisa sobre la pared del vaso sanguíneo y la respuesta vascular a la señalización mecánica. Contribución de la dinámica de flujo, incluyendo la respuesta de las células a los componentes dinámicos y medias (o constantes) de flujo, por lo tanto es una métrica importante para determinar patología de la enfermedad y la eficacia del tratamiento. A través de la introducción de un modelo de co-cultivo in vitro y la presión de amortiguación aguas abajo de la bomba de sangre que produce el gasto cardíaco simulado, diversas patologías de enfermedades arteriales pueden ser investigados.
Introducción
Las tasas de morbilidad de las enfermedades cardiovasculares son las más grandes de América, con muchas resultante de la vasculatura poco saludable. Las arterias sanas consisten en tejido elástico, con la superficie luminal suave revestido con una célula endotelial (CE) monocapa. Flujo arterial puede ser modelado como una función de onda oscilante con caudal medio positivo. El índice de pulsatilidad (PI) es el cociente de la magnitud de oscilación y la media de flujo (PI = (Max -.. Min) / media), 1 y ha sido modelada in vitro con elasticidad de los vasos variable de 2 elasticidad arterial es importante en el almacenamiento de flujo. energía a partir de las contracciones del corazón, la dilatación bajo presión sistólica, y juega un papel importante en la modulación de PI flujo sanguíneo. Debido a que el corazón mantiene una constante, pulsátil, flujo volumétrico, la expansión arterial aumenta el área de la sección transversal, la mejora de la estabilidad del flujo mediante la reducción de la velocidad del flujo, esfuerzo cortante, y PI. Con frecuencia, las arterias saludables presentes los cambios en la elasticidado cumplimiento, mostrando rigidez de la remodelación vascular, el tejido cicatricial o calcificación 3, 4. Además, otros trastornos vasculares, tales como la hiperplasia neointimal (NIH), 5 aneurisma y la hipertensión 6 y fibrosis vascular 4, pueden constreñir el diámetro del vaso. Sin embargo, el tratamiento actual de medicamentos y el tratamiento de las enfermedades vasculares dispositivo menudo descuidan la importancia de cumplimiento pared del vaso o del flujo sanguíneo en la dinámica de la enfermedad vascular, que a menudo se complica por los cambios en la morfología y las propiedades del vaso. Ni la angioplastia con balón, ni la colocación de stents responder a la complicación de la elasticidad de la pared 7. Por lo tanto, el modelado in vitro de la sangre fluye resultante de enfermedad arterial y los tratamientos es importante en la investigación de enfermedades y patologías futuro eficacia del tratamiento. En este documento, se describe un método de reproducir el flujo de sangre fisiológicos y patológicos diseñado para determinar la respuesta celular en Pathol enfermedad vasculargías. El flujo de fluido hace que la tensión de cizallamiento en la pared del vaso, que es una señal mecánica importante en la salud de los vasos, que afecta a todas las células dentro de la vasculatura. Varios sensores mecánicos en el endotelio vascular para cizallamiento de fluido han sido identificados, incluyendo cilio primario demostrado en estudios recientes para endotelial mechanosensing 8. Actividad de las células endoteliales y la morfología se ven afectados por la velocidad del flujo, la dirección y la pulsatilidad. Además, células de músculo liso (SMC) la migración puede verse afectada por mecano-señales de flujo de baja velocidad a través de fluido intersticial 9, y también puede ser a través de la señalización paracrina de las células endoteliales a través de su respuesta a fluir y mecano-transducción de señales de flujo a través de citoquinas liberar 10. La "dosis" dependencia de la cizalladura media, PI, y la señalización paracrina también puede ser interdependientes. Con este fin, la determinación de la respuesta celular vascular a un cizallamiento de fluido con variada "dosificación" en cultivo en monocapao co-cultivo in vitro podría proporcionar ideas mecanicistas en el remodelado vascular y mejorar la enfermedad y la predicción del tratamiento. El sistema de flujo utilizada en este experimento consiste en una bomba de sangre, una amortiguación de flujo aguas arriba del depósito de aire, un medidor de flujo aguas abajo sólo se utiliza durante la configuración experimental, un cultivo celular aguas abajo, la cámara de flujo de placas paralelas, y el depósito de medios de comunicación. El control de las variables de flujo vasculares tales como media velocidad de flujo, latidos por minuto, y PI se puede lograr a través de control de la velocidad de flujo, la frecuencia del pulso, y la introducción de presión de amortiguación. Bombas de sangre pulsátil están disponibles con desplazamiento de carrera variable, en frecuencia de carrera controlada, directamente relacionados con el sentido de caudal volumétrico, y la frecuencia del pulso. La introducción de un depósito de aire en el circuito de flujo permite la amortiguación de presión, reduciendo la magnitud de oscilación de flujo. Media es un fluido incompresible, mientras que el aire dentro de la cámara de amortiguación es compresible, permitiendo que el exceso de presión de la onda de flujo para serabsorbida por la compresión del aire. La relación de aire a los medios de comunicación permite el control sobre cómo se produce con mucha amortiguación. Un cultivo celular cámara de flujo a medida de 75 mm de largo por 50 mm de ancho fue creado a partir de acrílico. Flow entra a través del orificio de entrada, y se expande a través del colector de entrada, proporcionando un flujo consistente a través de la totalidad de la cámara de flujo. Flujo y estructuras similares están presentes en salida de la cámara. Las células se sembraron en portaobjetos funcionalizados, y posteriormente unidos a la cámara de flujo. Esto permite una gran población, fácilmente recuperados después del estudio. Experimentos de co-cultivo pueden utilizar una membrana de policarbonato porosa para eliminar el contacto de célula a célula entre las culturas al tiempo que permite el transporte de citoquinas / flujo. Este sistema se ha utilizado anteriormente para modelar el flujo de alta PI y su efecto en cultivo en monocapa endotelial y EC / SMC co-cultivo 1, 10, para investigar la respuesta celular a la enfermedad patológicamente alta PI. Al describir el protocolo utilizado para modelar el flujo de éstos concondiciones, esperamos ayudar a los demás en la determinación de la contribución de la señal de flujo a la celda de respuesta.
Access restricted. Please log in or start a trial to view this content.
Protocolo
1. Silanización y Biomolécula funcionalización de diapositivas o policarbonato Membrana
Nota: Muchos de los productos químicos y soluciones dentro de este protocolo tienen altas tasas de evaporación (etanol (EtOH), acetona, etc.). Otros pasos implican largos tiempos de incubación para bajas tasas de evaporación. Se recomienda película de parafina para sellar los contenedores. Precaución: Muchos de los productos químicos (incluyendo: ácido sulfúrico, acetona, (3-aminopropil) trietoxisilano, glutaraldehído, EtOH) se consideran peligrosos, o volátil. Consulte la hoja de datos de seguridad de materiales (MSDS) de cada material para el almacenamiento, manejo y disposición antes de su uso.
- Coloca nueva lámina de vidrio que mide 75 mm por 50 mm por 1 mm, en limpio, portaobjetos de vidrio plato de tinción sin tener en cuenta la orientación, garantizar la plena inmersión. Utilice contenedores para los pasos 1.1-1.12.
Nota: Para el co-cultivo, incluyen policarbonato (PC) de la membrana con 0,4 micras de tamaño de poro, cortado a la medida de 75 mm por 50 mm, para todos ste posteriorps para funcionalización PC y siembra CE. - Sumerja diapositivas en ácido sulfúrico (20%), O / N.
Precaución: Consulte MSDS para el ácido sulfúrico antes de su uso. - Lavar portaobjetos sumergiéndolo en agua desionizada (DI) durante 5 minutos, tres veces, cambiando DI cada vez.
- Sumergir diapositivas en acetona durante 30 min.
Precaución: Consulte MSDS para la acetona antes de su uso. - Sumergir diapositiva en 6% (3-aminopropil) trietoxisilano solución / acetona O / N.
Precaución: Consulte MSDS para (3-aminopropil) trietoxisilano y acetona antes de su uso. - Sumergir diapositivas en acetona durante 5 min, tres veces, cambiando acetona cada vez.
Precaución: Consulte MSDS para la acetona antes de su uso. - Lavar portaobjetos sumergiéndolo en DI durante 5 minutos, tres veces, cambiando DI cada vez.
- Sumerja diapositiva en solución de glutaraldehído / DI 1,5% durante 60 min.
Precaución: Consulte MSDS para glutaraldehído antes de su uso. - Lavar portaobjetos sumergiéndolo en DI durante 5 minutos, dos veces, cambiando DI cada vez.
- Lugar de diapositivass en 70% de etanol (EtOH) durante 30 min en, campana de flujo laminar estéril.
- Eliminar EtOH y permitir que se evapore residuo restante. Sumergir los portaobjetos en DI estéril y de drenaje con el fin de rehidratar las diapositivas.
Nota: Los portaobjetos o membrana PC se puede sellar en el soporte de portaobjetos de vidrio y se almacenó a 4 ° C durante hasta una semana. Tras el uso para el cultivo celular, repita los pasos 1.10 y 1.11. - Retire la diapositiva del soporte de diapositivas y colocarlo en un 100 mm por 100 mm placa de Petri cuadrado en la campana de flujo laminar.
Nota: Este contenedor se utiliza para todos los pasos restantes.- Preparar diapositiva o PC para la siembra de células endoteliales para el experimento monocultivo.
- Escudo de la diapositiva funcionalizado o PC (paso 1,11) con 1 ml de solución de fibronectina (25 mg / ml), en un lado, cubriendo el área aproximada expuesto a la cámara de cultivo celular.
- Incubar diapositivas o PC en la incubadora estéril a 37 ° C durante 1-2 horas.
- Después de la incubación, aspirar la solución restante utilizando una glass pipeta aspirador conectado a un vacío.
Nota: Las diapositivas puede ahora ser almacenada O / N a 4 ° C para su uso futuro.
- Siga 1.12.2 pasos sólo para preparar CE / SMC co-cultivo. Preparar y sembrar la cultura de células de músculo liso (SMC) para el experimento de co-cultivo.
- Place junta de silicona en la parte superior de la corredera (etapa 1.11), con dimensiones de 75 mm por 50 mm de diámetro exterior, diámetro interior de 50 mm por 30 mm, espesor de 0,5 mm, y perforaciones que se alinean con vacío de la cámara de flujo.
- Prepare 1 ml de SMC en el 10% de FBS / DMEM suspensión. Neutralizar 1 ml de solución de 2 mg / ml de colágeno de tipo I con 7% de NaHCO3 y solución 0,1 M de NaOH a pH de 7,4, y mezclar con la suspensión de SMC con la densidad celular final de 2 x 10 6 células / ml.
- Corre solución SMC dentro de la junta e incubar diapositivas a 37 ° C y CO 2 al 5% durante 30 min.
- Después de la incubación, cubrir la diapositiva 25 ml con suero bovino fetal al 0,1% (FBS) mezclado en modificado por DulbeccoMedio Eagle (DMEM) durante 72 horas.
- Preparar diapositiva o PC para la siembra de células endoteliales para el experimento monocultivo.
- Células endoteliales Cultura (ECS) de membrana de vidrio deslizante / policarbonato.
- Semilla de 1 ml ECs en 10% de FBS / DMEM, con concentración inicial de 6,0 x 10 5 células / ml, en las superficies de fibronectina de portaobjetos de vidrio o membrana de policarbonato.
- Se incuban las células en una incubadora a 37 ° C, 5% de CO 2, y 10% de FBS durante 120 min.
- Toboganes cubierta que contienen células con adicional del 10% de FBS / DMEM y lugar en la incubadora de 37 ° C, 5% de CO 2 O / N, hasta el 70% y el 80% de confluencia.
2. Determinación de la viscosidad del fluido y volumétrico Caudal
Nota: Los viscosímetros giratorias son equipos sensibles, y el manual de usuario viscosímetro deben ser consultados antes de la calibración, puesta a cero, o la realización de mediciones.
- Determinar la cizalladura de fluido deseada (τ) a partir de la literatura de la vasculatura objetivo del experimento.
- Measure 1% FBS / DMEM viscosidad (μ), usando un viscosímetro rotacional.
- Determinar la tasa de flujo volumétrico requerido (Q) de la ecuación de Poiseuille:
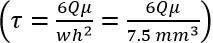 ,
,
donde τ = esfuerzo cortante del fluido, μ = viscosidad, Q = vol. caudal, w = cámara de anchura, y h = altura de la cámara). - Bomba de Ajuste a la tasa derivada en el paso 2.3 fluya, y el uso de todos los pasos posteriores.
3. Determinación del Índice de pulsatilidad
Nota: Todos los puertos de conexión dentro del sistema se deben conectar con la lengüeta de bloqueo-ring-a-tamaño adecuado, o las conexiones hembra luer-a púa. Conexión de tubos de PVC puede entonces conectarse a accesorios de lengüeta, y el circuito completo.
- Conectar circuito de flujo como en la Figura 2, con amortiguación cámara (Figura 3) y medidor de flujo ultrasónico en la dirección del flujo correcto.
Nota: caudalímetro ultrasónico es una pieza sensible del equipo, yel manual del usuario debe ser consultado antes de su uso. - Rellene circuito de flujo y el depósito con agua DI, asegurando tubo de salida del depósito (bombear) se sumerge dentro del volumen del depósito. Visualizar la forma de onda de flujo usando un medidor de flujo.
- Válvula de escape de aire libre en la cámara de amortiguación para cambiar la relación de volumen de líquido / aire. Cerrar la válvula de liberación de aire en diferentes intervalos de nivel de líquido y calcular el índice de pulsatilidad (PI = (V Max - V Min) / V Mean) mediante el uso de pico de la forma de onda de flujo (V Max), depresión (V Min), y la media (V media). Valores de PI de Registros en el cuaderno.
- Marcos resultante del nivel de fluido y PI en la cámara de amortiguación, con un fieltro de punta, pluma de tinta permanente para uso futuro. Determinar los niveles de PI deseados de la literatura patología 11.
- Tubo de silicona de formaciones opcional, el método más avanzado de pulsatilidad control
- Mezclar la base de elastómero de silicona y agente de curado a diferentes relaciones (por ejemplo, una basrelación de e-reticulante a partir de 10: 1 a 36: 1.) para variaron módulos elásticos dirigidos, como se ilustra previamente 2
- Fabrique tubos de silicona por repetida proceso de inmersión-cura, sumergiendo brevemente cánula de acero (14 G) en la mezcla de prepolímero de silicona con una relación base-reticulante predeterminado.
- Coloque la cánula prepolímero recubierto en un horno a 60 ° C durante 4 horas para curar el revestimiento de polímero sobre la cánula, el cambio de la dirección en el medio de proceso de curado.
- Repetir el proceso de inmersión con la misma mezcla de elastómero de silicona y colocarlo de nuevo en el horno durante 4 h adicionales, lo que resulta en ~ 0,3 mm tubos de espesor.
- Retire el tubo de silicona ultrafina de la cánula de acero inoxidable.
- Conecte los tubos al circuito en lugar de cámara de amortiguación, y PI prueba para cada flujo como en 3.3.
Esterilización 4. Bomba
- Sumergir la cámara de flujo (Figura 2), tubos de PVC, y las juntas en 1Peróxido de hidrógeno 0% (H 2 O 2). Lavar con DI estéril antes del paso 4.
- Coloque la bomba de sangre en un estante incubadora de repuesto.
Nota: Los estantes Incubadora deben ser de acero inoxidable, y ser capaz de soportar el peso del circuito de flujo entero. - Llenar el circuito de flujo y el depósito con 10% H 2 O 2, garantizando tubo de salida del depósito (para bombear) está sumergido dentro del volumen del depósito. Circule H 2 O 2 por bombeo a través del circuito durante 20 minutos en la campana de flujo laminar con luz UV en.
- Aspire todo el H 2 O 2 de la tubería, y lavar con PBS estéril por bombeo a través del circuito de flujo.
5. Flow conjunto de la cámara
Nota: La cámara de flujo consta de un acrílico, placa hecha a medida, con los puertos de vacío y de entrada y puertos de flujo de salida (ver Figura 2). Conjunto de la cámara consiste en colocar la cámara de flujo y las juntas en la parte superior de las diapositivas de la cultura, proPerly alineado, y se describe a continuación.
- Calentar 1% FBS / DMEM en un baño de agua a 37 ° C y preparar la cámara de flujo.
- Tome diapositivas CE fuera de los medios de comunicación (del paso 1.13) y el lugar de junta en la parte superior con el lado celular para arriba.
- (Opcional) Tome membrana PC de los medios de comunicación (del paso 1.13) y el lugar de junta en la parte superior con el lado celular para arriba. Coloque diapositivas co-cultivo con cabeza de serie SMC (paso 1.12.2) por debajo de la membrana PC.
- Alinear canal de vacío de la cámara de flujo con los orificios de la junta (Figura 2).
- Conecte el tubo de vacío a los puertos de vacío (Figura 2), lo que garantiza no hay fugas de los medios de comunicación a vacío.
- Place lámina de policarbonato debajo portaobjetos de vidrio y conjunto de cámara de flujo de abrazadera con abrazaderas de resorte, uno a cada lado de la cámara de flujo (Figuras 2 y 5).
- Sistema de Place de flujo en incubadora a 37 ° C y 5% de CO 2, y llenar el circuito con los medios de comunicación mediante el bombeo desde el depósito lleno a baja pulsatilidad.Mantener este flujo durante 4 horas para el acondicionamiento previo células.
- Ajuste el volumen de fluido en la amortiguación de cámara a nivel PI marcada, y la cultura para el tiempo deseado.
Access restricted. Please log in or start a trial to view this content.
Resultados
El mantenimiento de las condiciones de flujo depende de un correcto montaje del circuito de flujo (Figura 1). Tubo de diámetro es una importante selección en el montaje, con diámetros mayores reduciendo la resistencia al flujo y caída de presión posterior antes y después de la cámara de cultivo. Para garantizar la velocidad de presión y caudal previsto, montar el sistema con medidor de flujo antes de experimentar con la tubería prevista. Alineación de cámara de cultivo canal de vacío
Access restricted. Please log in or start a trial to view this content.
Discusión
Este protocolo describe un método de reproducción de flujo pulsátil in vitro, y puede ser el primer paso decisivo en la determinación de la contribución de las condiciones de flujo a las patologías de la enfermedad. Estudios anteriores utilizando este protocolo han encontrado condiciones de flujo contribuyen a. La respuesta inflamatoria vascular 1, 10 Además, este protocolo está destinado a laboratorios con experiencia. Como tal, ni en la mecánica de fluidos de profundidad, ni el análisis b...
Access restricted. Please log in or start a trial to view this content.
Divulgaciones
Los autores no tienen nada que revelar.
Agradecimientos
Los autores desean reconocer las fuentes de financiación, incluyendo la AHA (13GRNT16990019 a WT) y NHLBI (HL097246 y HL119371 de WT).
Access restricted. Please log in or start a trial to view this content.
Materiales
| Name | Company | Catalog Number | Comments |
| Acetone | Sigma-Aldrich | 34850 | |
| Sulfuric Acid | Sigma-Aldrich | 320501 | |
| (3-Aminopropyl)triethoxysilane | Sigma-Aldrich | 440140 | |
| Glutaraldehyde Solution | Sigma-Aldrich | G5882 | |
| Ethanol | Sigma-Aldrich | 459844 | |
| Glass Slide (70 mm x 50 mm) | Sigma-Aldrich | CLS294775X50 | |
| Polycarbonate Membrane | Millipore Corp. | HTTP09030 | |
| Silicone Gasket | Grace Bio-Labs | RD 475464 | |
| Fibronectin (25 μg/ml) | Sigma-Aldrich | F1141 | |
| Collagen Type-I | Sigma-Aldrich | C3867 | |
| NaHCO3 | Fluka | 36486 | |
| NaOH | Sigma-Aldrich | S5881 | |
| Damping Chamber | This chamber is custom made, and may be requested using the engineering drawing of Figure 3. | ||
| Blood Pump | Harvard Apparatus | 529552 | |
| Poly-Vinyl Carbonate Tubing | US Plastic | 65066, 65063, 65062 | Various sizes may be required |
| Luer Connections | Nordson Medical | Various | Various sizes will be required, and a number of parts should be purchased for replacement use. |
| Culture Chamber | Machined in-house | Custom | Acrylic may be purchased in sheets and machined for intended use. The engineering drawing shown in Figure 2 may be used to recreate this chamber. |
| Square Petri Dish | Cole-Parmer | EW-14007-10 | |
| Glass Slide Holder | Capitol Scientific | WHE-900303 | |
| Fetal Bovine Serum | Mediatech, Inc. | 35-010-CV | |
| Dulbecco's Modified Eagle Medium | Mediatech, Inc. | 10-013-CV | |
| Flow Meter | Sonotec, GmbH | Sonoflow co.55/060 | |
| Sylgard Elastomer Kit | Sigma-Aldrich | 761036-5EA | |
| 14 G Steel Cannula | General Laboratory Supply | S8365-1 |
Referencias
- Scott-Drechsel, D., Su, Z., Hunter, K., Li, M., Shandas, R., Tan, W. A new flow co-culture system for studying mechanobiology effects of pulse flow waves. Cytotechnology. 64 (6), 649-666 (2012).
- Tan, Y., et al. Stiffening-Induced High Pulsatility Flow Activates Endothelial Inflammation via a TLR2/NF-κB Pathway. PLoS ONE. 9 (7), e102195(2014).
- Wexler, L., et al. Coronary Artery Calcification: Pathophysiology, Epidemiology, Imaging Methods, and Clinical Implications A Statement for Health Professionals From the American Heart Association. Circulation. 94 (5), 1175-1192 (1996).
- Lan, T. -H., Huang, X. -Q., Tan, H. -M. Vascular fibrosis in atherosclerosis. Cardiovasc Pathol. 22 (5), 401-407 (2013).
- Lee, C. H., et al. Promoting endothelial recovery and reducing neointimal hyperplasia using sequential-like release of acetylsalicylic acid and paclitaxel-loaded biodegradable stents. Int J Nanomedicine. 9, 4117-4133 (2014).
- Intengan, H. D., Schiffrin, E. L. Vascular Remodeling in Hypertension Roles of Apoptosis Inflammation, and Fibrosis. Hypertension. 38 (3), 581-587 (2001).
- Greil, O., et al. Changes in carotid artery flow velocities after stent implantation: a fluid dynamics study with laser Doppler anemometry. J Endovasc Ther. 10 (2), 275-284 (2003).
- Egorova, A. D., van der Heiden, K., Poelmann, R. E., Hierck, B. P. Primary cilia as biomechanical sensors in regulating endothelial function. Differentiation. 83 (2), S56-S61 (2012).
- Liu, S. Q., Goldman, J. Role of blood shear stress in the regulation of vascular smooth muscle cell migration. IEEE T Bio-Med Eng. 48 (4), 474-483 (2001).
- Scott, D., Tan, Y., Shandas, R., Stenmark, K. R., Tan, W. High pulsatility flow stimulates smooth muscle cell hypertrophy and contractile protein expression. AJP: Lung C. 304 (1), L70-L81 (2013).
- Panaritis, V., et al. Pulsatility Index of Temporal and Renal Arteries as an Early Finding of Arteriopathy in Diabetic Patients. Ann Vasc Surg. 19 (1), 80-83 (2005).
- Miao, H., et al. Effects of Flow Patterns on the Localization and Expression of VE-Cadherin at Vascular Endothelial Cell Junctions: In vivo and in vitro Investigations. J Vasc Res. 42 (1), 77-89 (2005).
Access restricted. Please log in or start a trial to view this content.
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados