È necessario avere un abbonamento a JoVE per visualizzare questo. Accedi o inizia la tua prova gratuita.
Method Article
Modello in vitro di fisiologiche e patologiche flusso sanguigno con applicazione di indagini di rimodellamento vascolare cellulare
In questo articolo
Riepilogo
Questo protocollo replica fisiologica o patologica flusso di sangue in vitro per aiutare a determinare la risposta cellulare in patologie malattia. Introducendo una pressione camera di smorzamento a valle di una pompa per il sangue, il flusso di sangue attraverso il sistema vascolare può essere riassunta e imposto un monostrato di endotelio vascolare o un co-coltura mimetica.
Abstract
Malattia vascolare è una comune causa di morte negli Stati Uniti. Qui, vi presentiamo un metodo per esaminare il contributo della dinamica dei flussi verso patologie malattia vascolare. Arterie malsane spesso si presentano con irrigidimento della parete, cicatrici, o stenosi parziale, che possono influenzare tutte le portate di fluido, e l'entità del flusso pulsatile, o indice di pulsatilità. La replica di varie condizioni di flusso è il risultato di una pressione sintonizzazione flusso smorzamento camera a valle di una pompa di sangue. Introduzione di aria all'interno di un sistema di flusso chiuso permette un mezzo comprimibile per assorbire la pressione pulsatile dalla pompa, e quindi variare l'indice di pulsatilità. Il metodo qui descritto è semplicemente riprodotto, con il contributo altamente controllabile, e risultati facilmente misurabili. Alcune limitazioni sono ricreazione del complesso forma d'onda impulsiva fisiologica, che viene approssimata dal sistema. Le cellule endoteliali, cellule muscolari lisce e fibroblasti sono influenzati dal flusso sanguigno through l'arteria. La componente dinamica del flusso di sangue è determinata dall'uscita e parete arteriosa rispetto cardiaca. Vascolare cellule meccano-trasduzione di dinamiche di flusso può innescare il rilascio di citochine e cross-talk tra i tipi di cellule all'interno dell'arteria. Co-coltura di cellule vascolari è un'immagine che riflette più precisa interazione cellula-cellula sulla parete del vaso sanguigno e risposta vascolare alla segnalazione meccanica. Contributo della dinamica di flusso, compresa la risposta cellulare ai componenti dinamici e medi (o costante) di flusso, è quindi un parametro importante nel determinare la patologia della malattia e l'efficacia del trattamento. Attraverso l'introduzione di un modello di co-coltura in vitro e la pressione di smorzamento a valle della pompa sangue che produce un output cardiaco simulato, varie patologie malattia arteriosa possono essere esaminati.
Introduzione
Tassi di morbilità per le malattie cardiovascolari sono la più grande in America, con molti derivante dalla vascolarizzazione malsano. Arterie sane sono costituiti da tessuto elastico, con morbida superficie luminale rivestita con cellule endoteliali (CE) monostrato. Flusso arterioso può essere modellato come una funzione d'onda oscillante con positivo portata media. L'indice di pulsatilità (PI) è il quoziente di oscillazione grandezza e media portata (PI = (Max -. Min.) / Medio), 1 ed è stato modellato in vitro con elasticità nave variabile 2 elasticità arteriosa è importante per lo stoccaggio del flusso. energia da contrazioni del cuore, dilatando sotto pressione sistolica, e svolge un ruolo importante nella modulazione del flusso sanguigno PI. Poiché il cuore mantiene una costante, pulsatile, flusso volumetrico, espansione arteriosa aumenta l'area della sezione trasversale, migliorando la stabilità del flusso, riducendo la velocità di flusso, shear stress, e PI. Frequentemente, arterie malsane presenti modifiche elasticitào la conformità, la visualizzazione di irrigidimento da rimodellamento vascolare, tessuto cicatriziale o calcificazioni 3, 4. Inoltre, altri disturbi vascolari, come l'iperplasia neointimale (NIH), 5 aneurisma e ipertensione 6 e fibrosi vascolare 4, possono costringere diametro del vaso. Tuttavia, il trattamento farmacologico attuale e il trattamento delle malattie vascolari dispositivo spesso trascurano l'importanza della compliance parete del serbatoio o il flusso di sangue dinamiche in malattia vascolare che è spesso complicato dai cambiamenti nella morfologia e le proprietà vaso. Né angioplastica né stenting rispondere alla complicazione del muro elasticità 7. Pertanto, la modellazione in vitro di sangue flussi derivanti da malattia arteriosa e trattamenti è importante nelle indagini patologie della malattia e futuro l'efficacia del trattamento. Qui, si descrive un metodo di replica fisiologica e patologica del flusso sanguigno destinato a determinare la risposta delle cellule vascolari in Pathol malattianologie. Il flusso di fluido provoca tensione tangenziale alla parete del vaso, che è un segnale meccanico importante nella salute recipiente, che colpisce tutte le celle all'interno del sistema vascolare. Diversi sensori meccanici sull'endotelio vascolare per taglio fluido sono stati identificati, tra cui ciglio primario dimostrato in studi recenti per endoteliale mechanosensing 8. L'attività delle cellule endoteliali e la morfologia sono interessati da velocità di flusso, la direzione e pulsatilità. Inoltre, cellule muscolari lisce (SMC) migrazione può essere influenzata da meccano-segnali di bassa velocità di flusso attraverso liquido interstiziale 9, e può essere anche attraverso la segnalazione paracrina da cellule endoteliali attraverso la loro risposta a scorrere e meccano-trasduzione di segnali di flusso tramite citochine rilasciare 10. La "dose" dipendenza di taglio medio, PI, e la segnalazione paracrina può anche essere interdipendenti. A tal fine, la determinazione della risposta cellulare vascolare al taglio fluido con vario "dosaggio" in coltura monostratoo co-coltura in vitro potrebbe fornire spunti meccanicistici in rimodellamento vascolare e migliorare la malattia e la previsione di trattamento. Il sistema di flusso utilizzato in questo esperimento consiste di una pompa di sangue, un flusso di smorzamento serbatoio dell'aria a monte, un misuratore di flusso a valle usato solo durante l'installazione sperimentale, una coltura cellulare a valle, a piatti paralleli camera di flusso, e mezzi serbatoio. Controllo di variabili di flusso vascolari quali portata media, battiti per minuto, e PI può essere realizzata mediante rate controllare il flusso, frequenza degli impulsi, e l'introduzione della pressione di smorzamento. Pompe per il sangue pulsatili sono disponibili con spostamento corsa variabile, a frequenza di corsa controllata, direttamente connesse a significare portata volumetrica, e frequenza degli impulsi. Introduzione di un serbatoio d'aria nel circuito di flusso consente di smorzamento pressione, riducendo il flusso di oscillazione grandezza. Media è un fluido incomprimibile, mentre l'aria all'interno della camera di attenuazione è comprimibile, permettendo sovrappressione dall'onda flusso di essereassorbita dalla compressione dell'aria. L'aria di rapporto di supporti consente il controllo su come si verifica molto smorzamento. Una coltura cellulare camera di flusso personalizzato di 75 mm di lunghezza e di 50 mm di larghezza è stato creato da acrilico. Flusso entra attraverso la porta di ingresso, e si espande attraverso il collettore di aspirazione, fornendo un flusso costante attraverso la totalità della camera di flusso. Flusso e strutture simili sono presenti in uscita della camera. Le cellule sono seminate su vetrini funzionalizzati, e successivamente attaccati alla camera di flusso. Questo permette di grandi popolazioni, facilmente recuperati dopo lo studio. Esperimenti di co-coltura possono utilizzare una membrana di policarbonato poroso per eliminare il contatto cellula-cellula tra culture consentendo trasporto citochina / flusso. Questo sistema è stato precedentemente utilizzato per modellare il flusso di alta PI e il suo effetto sulla cultura monostrato endoteliale e CE / SMC co-coltura 1, 10, per indagare la risposta cellulare al patologicamente alta malattia PI. Descrivendo il protocollo utilizzato per modellare questi con flussocondizioni, speriamo di aiutare gli altri nel determinare il contributo segnale di portata alla cella risposta.
Access restricted. Please log in or start a trial to view this content.
Protocollo
1. silanizzazione e Biomolecule Funzionalizzazione di Slide o policarbonato membrana
Nota: Molte delle sostanze chimiche e delle soluzioni all'interno di questo protocollo hanno alti tassi di evaporazione (etanolo (EtOH), acetone, ecc.); Altri passi comportano lunghi tempi di incubazione per i tassi di evaporazione bassi. Pellicola paraffina è raccomandato per sigillare contenitori. Attenzione: Molte delle sostanze chimiche (tra cui: acido solforico, acetone, (3-amminopropil) trietossisilano, glutaraldeide, EtOH) sono considerati pericolosi, o volatili. Consultare scheda di sicurezza (SDS) di ogni materiale per una corretta conservazione, la manipolazione e lo smaltimento prima dell'uso.
- Posizionare nuovo vetrino misura 75 mm per 50 mm di 1 mm, in un ambiente pulito, vetrino piatto colorazione senza riguardo per l'orientamento, assicurando full immersion. Usare contenitori per i passi 1.1-1.12.
Nota: Per la co-coltura, includono policarbonato (PC) membrana con dimensione dei pori 0,4 micron, tagliati a misura di 75 mm per 50 mm, per tutte le successive steps per funzionalizzazione PC e semina CE. - Immergere vetrino in acido solforico (20%), O / N.
Attenzione: consultare scheda di sicurezza per acido solforico prima dell'uso. - Lavare diapositiva immergendo in acqua deionizzata (DI) per 5 min, tre volte, cambiando DI ogni volta.
- Immergere vetrino in acetone per 30 min.
Attenzione: consultare scheda di sicurezza per l'acetone prima dell'uso. - Immergere scivolo nel 6% (3-amminopropil) soluzione triethoxysilane / acetone O / N.
Attenzione: consultare scheda di sicurezza per (3-amminopropil) triethoxysilane e acetone prima dell'uso. - Immergere vetrino in acetone per 5 minuti, tre volte, cambiando di volta in volta acetone.
Attenzione: consultare scheda di sicurezza per l'acetone prima dell'uso. - Lavare diapositiva immergendo in DI per 5 minuti, tre volte, cambiando DI ogni volta.
- Immergere diapositiva 1,5% soluzione di glutaraldeide / DI per 60 min.
Attenzione: consultare scheda di sicurezza per glutaraldeide prima dell'uso. - Lavare diapositiva immergendo in DI per 5 minuti, due volte, cambiando DI ogni volta.
- Porre il vetrinos in 70% di etanolo (EtOH) per 30 min a, cappa a flusso laminare sterile.
- Rimuovere EtOH e lasciare evaporare i residui rimanenti. Immergere i vetrini in DI sterile e scarico al fine di reidratare le diapositive.
Nota: diapositive o membrana PC può essere sigillata in supporto vetrino e conservato a 4 ° C fino ad una settimana. Al momento uso per colture cellulari, ripetere i punti 1.10 e 1.11. - Rimuovere il vetrino dal supporto diapositive e posizionarlo in un 100 mm per 100 mm quadrati Petri nella cappa a flusso laminare.
Nota: Questo contenitore può essere utilizzato per tutti i passaggi rimanenti.- Preparare scivolo o PC per la semina delle cellule endoteliali per l'esperimento monocoltura.
- Coat diapositiva funzionalizzati o PC (passo 1.11) con 1 ml di soluzione di fibronectina (25 mcg / ml), da un lato, che copre l'area approssimativa esposta alla camera di coltura cellulare.
- Incubare i vetrini o PC in incubatrice sterili a 37 ° C per 1-2 ore.
- Dopo l'incubazione, aspirare la soluzione rimanente utilizzando una glass Aspiratore pipetta collegata ad un vuoto.
Nota: I vetrini possono ora essere memorizzato O / N a 4 ° C per un uso futuro.
- Seguire 1.12.2 procedura solo per la preparazione di CE / SMC co-coltura. Preparare e sementi coltura delle cellule muscolari lisce (SMC) per l'esperimento di co-coltura.
- Posizionare la guarnizione in silicone sulla parte superiore della slitta (passo 1.11), con dimensioni di 75 mm di diametro esterno 50 mm, diametro interno di 50 mm per 30 mm, spessore di 0,5 mm, e perforazioni che si allineano con vuoto camera di flusso.
- Preparare 1 ml SMC nel 10% sospensione FBS / DMEM. Neutralizzare 1 ml di soluzione di 2 mg / ml di collagene tipo I con 7% NaHCO3 e soluzione 0,1 M di NaOH a pH di 7,4, e mescolare con sospensioni SMC densità cellulare finale di 2 x 10 6 cellule / ml.
- Distribuire soluzione SMC all'interno guarnizione e incubare vetrini a 37 ° C e 5% CO 2 per 30 min.
- Dopo l'incubazione, coprire il vetrino con il siero 25 ml di 0,1% fetale bovino (FBS) miscelati in Dulbecco Modified(DMEM) per 72 ore.
- Preparare scivolo o PC per la semina delle cellule endoteliali per l'esperimento monocoltura.
- Le cellule endoteliali Cultura (ECS) di membrana di vetro scorrevole / policarbonato.
- Seed 1 ml EC a 10% FBS / DMEM, con concentrazione iniziale di 6,0 x 10 5 cellule / ml, sulle superfici di fibronectina vetrino o membrana di policarbonato.
- Incubare le cellule in un incubatore a 37 ° C, 5% CO 2, e 10% FBS per 120 min.
- Coprire i vetrini contenenti cellule con ulteriore 10% FBS / DMEM e posto in incubatrice a 37 ° C, 5% di CO 2 O / N, fino a 70% -80% confluenti.
2. Determinazione della viscosità del fluido e volumetrica Portata
Nota: viscosimetri rotanti sono apparecchiature sensibili, e il manuale utente viscosimetro dovrebbe essere consultato prima di calibrare, azzeramento, o l'esecuzione di misurazioni.
- Determinare taglio fluido desiderato (τ) dalla letteratura del sistema vascolare mirata dell'esperimento.
- Measure 1% FBS / additivo DMEM (μ), utilizzando un viscosimetro rotazionale.
- Determinare richiesto portata volumetrica (Q) dall'equazione Poiseuille:
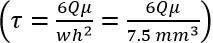 ,
,
dove τ = taglio fluido, μ = viscosità, Q = vol. portata, larghezza w = camera, e h = altezza da camera). - Impostare la pompa di portata derivata in fase 2.3, e l'uso per tutte le fasi successive.
3. Determinazione di indice di pulsatilità
Nota: Tutte le porte di connessione all'interno del sistema devono essere collegati con lock-ring-a-ardiglione dimensioni appropriate, o attacchi femmina luer-to-ardiglione. Collegamento tubo in PVC può allora essere collegato a raccordi filettati, e il circuito completato.
- Collegare circuito di flusso come in Figura 2, con camera di smorzamento (Figura 3) e flussometro ad ultrasuoni nella direzione del flusso corretto.
Nota: misuratore di portata ad ultrasuoni è un pezzo di materiale sensibile, eil manuale dovrebbe essere consultato prima dell'uso. - Riempire circuito di flusso e serbatoio con acqua deionizzata, garantendo tubo di scarico del serbatoio (per pompare) è sommerso all'interno del volume del serbatoio. Visualizza la forma d'onda del flusso con un flussometro.
- Valvola di sfiato aperta sulla camera di attenuazione per cambiare rapporto volume liquido / aria. Chiudere la valvola di sfiato aria a differenti intervalli di livello dei liquidi e calcolare l'indice di pulsatilità (PI = (V Max - V Min) / V Media) utilizzando picco di forma d'onda di flusso (V max), depressione (V min), e media (V Media). Registrano valori IP in notebook.
- Mark conseguente livello del liquido e PI in camera di attenuazione, con un feltro, penna inchiostro permanente per uso futuro. Determinare i livelli di PI desiderati da patologia letteratura 11.
- Tubo del silicone formation- opzionale, il metodo più avanzato di pulsatilità controllo
- Mescolare la base di elastomero di silicone e l'agente indurente con rapporti diversi (ad esempio, un bassorilievoRapporto e-to-reticolante da 10: 1 a 36:. 1) per variava moduli elastici mirati, come illustrato in precedenza 2
- Realizzare tubi in silicone da ripetuti processi dip-cure, immersione brevemente cannula di acciaio (14 G) in miscela prepolimero silicone con un predeterminato rapporto base-reticolante.
- Posizionare la cannula prepolimero rivestite in un forno impostato a 60 ° C per 4 ore per curare il rivestimento polimerico sulla cannula, la direzione di commutazione nel mezzo di polimerizzazione.
- Ripetere il processo di immersione con la stessa miscela di elastomero siliconico e mettere in forno per ulteriori 4 ore, che si traduce in ~ 0,3 millimetri di spessore tubi.
- Togliere il tubo in silicone ultrasottile dalla cannula in acciaio inox.
- Collegare i tubi di mandata del circuito invece di camera di smorzamento, e il test PI per ciascuno, come al punto 3.3.
4. Pompa Sterilizzazione
- Immergere la camera di flusso (figura 2), tubo in PVC, e guarnizioni in 10% di perossido di idrogeno (H 2 O 2). Lavare con DI sterile prima del punto 4.
- Posizionare la pompa di sangue su uno scaffale di ricambio incubatrice.
Nota: i ripiani dell'incubatore devono essere in acciaio inox, ed essere in grado di sostenere il peso dell'intero circuito di flusso. - Riempire il circuito di flusso e il serbatoio con il 10% H 2 O 2 assicurando tubo di scarico del serbatoio (pompa) è sommerso all'interno del volume del serbatoio. Circolare H 2 O 2 pompando attraverso il circuito per 20 min nella cappa a flusso laminare con luce UV su.
- Aspirare tutta H 2 O 2 dal tubo, e lavare con PBS sterile pompando attraverso il circuito di flusso.
5. Flusso Camera dell'Assemblea
Nota: La camera di flusso è costituito da un acrilico, piastra di misura, con luci a vuoto e di ingresso e le porte di uscita dell'aria (vedere Figura 2). Camera assemblaggio consiste nel posizionare la camera di flusso e guarnizioni in cima diapositive cultura, proPerly allineati, ed è descritto di seguito.
- Riscaldare 1% FBS / DMEM in un bagno d'acqua a 37 ° C e preparare camera di flusso.
- Prendere scivolo CE di supporti (dal punto 1.13) e la guarnizione posto sulla parte superiore con lato della cella fino.
- (Opzionale) Fate membrana PC di supporto (dal punto 1.13) e la guarnizione posto sulla parte superiore con lato della cella fino. Posizionare co-coltura di diapositive con testa di serie SMC (passo 1.12.2) sotto membrana PC.
- Allineate canale vuoto della camera di flusso con i fori nella guarnizione (Figura 2).
- Collegare tubo a vuoto di luci a vuoto (Figura 2) assicurando perdite di media a vuoto.
- Luogo policarbonato sotto vetrino ed assemblaggio camera di flusso morsetto con morsetti a molla, uno su ciascun lato della camera di flusso (figure 2 e 5).
- Sistema Luogo flusso in incubatore a 37 ° C e 5% di CO 2, e riempire circuito con mezzi pompando dal serbatoio riempito a bassa pulsatilità.Mantenere questo flusso per 4 ore per il precondizionamento cellule.
- Regolare il volume fluido nella camera di smorzamento a livello di PI marcato, e la cultura per il tempo desiderato.
Access restricted. Please log in or start a trial to view this content.
Risultati
Mantenimento delle condizioni di flusso fa affidamento sul corretto montaggio del circuito di flusso (Figura 1). Diametro del tubo è un'importante selezione in assemblaggio, con diametri superiori riducono la resistenza al flusso e la successiva caduta di pressione prima e dopo la camera di cultura. Per garantire velocità di pressione e portata prevista, montare il sistema con flussometro prima dell'esperimento con tubi previsto. Allineamento della camera di cultura canale vuoto (Figur...
Access restricted. Please log in or start a trial to view this content.
Discussione
Questo protocollo descrive un metodo di riprodurre flusso pulsatile in vitro, e può non primo passo per determinare il contributo delle condizioni di flusso a patologie malattia. Studi precedenti che utilizzano questo protocollo hanno trovato condizioni di flusso contribuiscono alla risposta infiammatoria vascolare. 1, 10 Inoltre, questo protocollo è destinato ai laboratori esperti. Come tale, né in profondità meccanica dei fluidi, né analisi biochimica viene qui descritto. Per la dinamica dei f...
Access restricted. Please log in or start a trial to view this content.
Divulgazioni
Gli autori non hanno nulla da rivelare.
Riconoscimenti
Gli autori desiderano ringraziare le fonti di finanziamento, tra cui AHA (13GRNT16990019 a WT) e NHLBI (HL097246 e HL119371 di WT).
Access restricted. Please log in or start a trial to view this content.
Materiali
| Name | Company | Catalog Number | Comments |
| Acetone | Sigma-Aldrich | 34850 | |
| Sulfuric Acid | Sigma-Aldrich | 320501 | |
| (3-Aminopropyl)triethoxysilane | Sigma-Aldrich | 440140 | |
| Glutaraldehyde Solution | Sigma-Aldrich | G5882 | |
| Ethanol | Sigma-Aldrich | 459844 | |
| Glass Slide (70 mm x 50 mm) | Sigma-Aldrich | CLS294775X50 | |
| Polycarbonate Membrane | Millipore Corp. | HTTP09030 | |
| Silicone Gasket | Grace Bio-Labs | RD 475464 | |
| Fibronectin (25 μg/ml) | Sigma-Aldrich | F1141 | |
| Collagen Type-I | Sigma-Aldrich | C3867 | |
| NaHCO3 | Fluka | 36486 | |
| NaOH | Sigma-Aldrich | S5881 | |
| Damping Chamber | This chamber is custom made, and may be requested using the engineering drawing of Figure 3. | ||
| Blood Pump | Harvard Apparatus | 529552 | |
| Poly-Vinyl Carbonate Tubing | US Plastic | 65066, 65063, 65062 | Various sizes may be required |
| Luer Connections | Nordson Medical | Various | Various sizes will be required, and a number of parts should be purchased for replacement use. |
| Culture Chamber | Machined in-house | Custom | Acrylic may be purchased in sheets and machined for intended use. The engineering drawing shown in Figure 2 may be used to recreate this chamber. |
| Square Petri Dish | Cole-Parmer | EW-14007-10 | |
| Glass Slide Holder | Capitol Scientific | WHE-900303 | |
| Fetal Bovine Serum | Mediatech, Inc. | 35-010-CV | |
| Dulbecco's Modified Eagle Medium | Mediatech, Inc. | 10-013-CV | |
| Flow Meter | Sonotec, GmbH | Sonoflow co.55/060 | |
| Sylgard Elastomer Kit | Sigma-Aldrich | 761036-5EA | |
| 14 G Steel Cannula | General Laboratory Supply | S8365-1 |
Riferimenti
- Scott-Drechsel, D., Su, Z., Hunter, K., Li, M., Shandas, R., Tan, W. A new flow co-culture system for studying mechanobiology effects of pulse flow waves. Cytotechnology. 64 (6), 649-666 (2012).
- Tan, Y., et al. Stiffening-Induced High Pulsatility Flow Activates Endothelial Inflammation via a TLR2/NF-κB Pathway. PLoS ONE. 9 (7), e102195(2014).
- Wexler, L., et al. Coronary Artery Calcification: Pathophysiology, Epidemiology, Imaging Methods, and Clinical Implications A Statement for Health Professionals From the American Heart Association. Circulation. 94 (5), 1175-1192 (1996).
- Lan, T. -H., Huang, X. -Q., Tan, H. -M. Vascular fibrosis in atherosclerosis. Cardiovasc Pathol. 22 (5), 401-407 (2013).
- Lee, C. H., et al. Promoting endothelial recovery and reducing neointimal hyperplasia using sequential-like release of acetylsalicylic acid and paclitaxel-loaded biodegradable stents. Int J Nanomedicine. 9, 4117-4133 (2014).
- Intengan, H. D., Schiffrin, E. L. Vascular Remodeling in Hypertension Roles of Apoptosis Inflammation, and Fibrosis. Hypertension. 38 (3), 581-587 (2001).
- Greil, O., et al. Changes in carotid artery flow velocities after stent implantation: a fluid dynamics study with laser Doppler anemometry. J Endovasc Ther. 10 (2), 275-284 (2003).
- Egorova, A. D., van der Heiden, K., Poelmann, R. E., Hierck, B. P. Primary cilia as biomechanical sensors in regulating endothelial function. Differentiation. 83 (2), S56-S61 (2012).
- Liu, S. Q., Goldman, J. Role of blood shear stress in the regulation of vascular smooth muscle cell migration. IEEE T Bio-Med Eng. 48 (4), 474-483 (2001).
- Scott, D., Tan, Y., Shandas, R., Stenmark, K. R., Tan, W. High pulsatility flow stimulates smooth muscle cell hypertrophy and contractile protein expression. AJP: Lung C. 304 (1), L70-L81 (2013).
- Panaritis, V., et al. Pulsatility Index of Temporal and Renal Arteries as an Early Finding of Arteriopathy in Diabetic Patients. Ann Vasc Surg. 19 (1), 80-83 (2005).
- Miao, H., et al. Effects of Flow Patterns on the Localization and Expression of VE-Cadherin at Vascular Endothelial Cell Junctions: In vivo and in vitro Investigations. J Vasc Res. 42 (1), 77-89 (2005).
Access restricted. Please log in or start a trial to view this content.
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon