需要订阅 JoVE 才能查看此. 登录或开始免费试用。
Method Article
倒胶体晶体聚(乙二醇)脚手架制作:肝脏组织工程三维细胞培养平台
摘要
This manuscript presents a detailed protocol for the fabrication of an emerging three-dimensional hepatocyte culture platform, the inverted colloidal crystal scaffold, and the concomitant techniques to assess hepatocyte behavior. The size-controllable pores, interconnectivity and ability to conjugate extracellular matrix proteins to the poly(ethylene glycol) (PEG) scaffold enhance Huh-7.5 cell performance.
摘要
维持肝细胞功能的体外,用于测试异生素"的细胞毒性,研究病毒感染和开发针对肝脏的药物为目的的能力,需要在哪些小区得到适当的生物化学和机械线索的平台。最近肝组织工程系统已采用合成的或天然的水凝胶组成的三维(3D)支架,由于其高保水性和其提供由该细胞所需要的机械性刺激的能力。出现了在倒胶态晶体(ICC)的脚手架越来越大的兴趣,最近的发展,其允许高空间组织,同型和异型细胞相互作用,以及细胞外基质(ECM)的相互作用。在此,我们描述了一个协议使用聚(乙二醇)二丙烯酸酯(PEGDA),颗粒沥滤方法来制造IC卡支架。简要地说,一个晶格是由微颗粒制成,在这之后的预聚合物:R染料溶液加入,适当地聚合,然后颗粒被除去,或者浸出,使用有机溶剂( 如,四氢呋喃)。晶格结果与控制的孔尺寸和interconnectivities允许媒体更容易地达到电池的高度多孔支架的溶解。这种独特的结构允许所述细胞附着的能力来涂覆PEGDA IC卡支架与蛋白质还示出对电池性能有显着影响的孔之间以及容易的通信,和高的表面积。我们分析了支架的形态,以及肝癌细胞(的Huh-7.5)行为存活率方面和功能探索ICC结构和ECM涂料的效果。总体而言,本文提供了在组织工程中广泛应用,尤其是肝脏组织工程支架出现了详细的协议。
引言
肝脏是一个高度血管器官与多种功能,包括血液解毒,异生素的代谢,以及生产的血清蛋白。肝组织具有复杂的三维(3D)微结构,其包含多种细胞类型,胆管,正弦,和不同的生物基质的组成和不同的氧浓度的区域。鉴于这种精细结构中,它已经难于创建体外 1适当肝模型。然而,对于在体外模型官能托管人肝细胞用于测试药物毒性2平台和学习与肝3相关联的疾病的需求上升。
当前肝组织工程平台已经通过分离,或者集中于几个,肝脏的参数,单元4即共培养,所述透明的生化组成简化了肝脏的复杂性升微环境5,流动动力学6,7和生物基质8的结构。在生物基质的结构可分为参数,如支架材料,细胞外基质(ECM)蛋白的组合物,基质硬度以及支架的设计和结构。已经有使用合成水凝胶,特别是聚(乙二醇)(PEG)水凝胶9的组织工程研究的上升,由于能够调整水凝胶的机械性能,生物活性,和降解速率。对于肝脏相关的研究,生物相容性水凝胶应用于肝病3的病毒感染研究。作为肝细胞平台设计,许多研究已经利用肝细胞三明治培养10,11和电池封装的水凝胶12,13内,以提供3D环境和细胞ECM和细胞-细胞相互作用这是必不可少的体内微环境模仿。豪版本,这些平台不具有高度的控制和空间组织的,通过支架14导致非均匀的性质。
倒晶胶体(ICC)14脚手架是,首先在21世纪初引进的细胞培养具有高度组织性的三维支架。所述支架的独特结构可以归因于使用的胶态晶体,可变直径的胶体粒子的有序晶格的简单的制造过程。简要地说,以总结的过程中,颗粒被整齐排列并利用热,以形成晶格退火。这种晶格的浸出,通过一种有机溶剂,在六边形填充球形腔室15具有高表面积的聚合水凝胶的结果。这种高度有序的支架已与合成和天然材料先前已经制成,包括但不限于聚(丙烯酰胺)16-21,聚(乳酸-共-乙醇酸)15,22-30,聚(乙二醇)31,32,聚(2-羟乙基甲基丙烯酸酯)21,33-35,和脱乙酰壳多糖36-39。由非污染材料ICC支架往往空腔14,23,40内促进细胞球体。多种细胞类型已经显示成功增殖,此配置中的分化和功能,包括软骨细胞41,骨髓基质细胞42,和干细胞43,44。关于肝细胞,研究已经与由钠2的SiO 3和聚(丙烯酰胺)的IC卡的支架,但不PEG进行。用简单的生物结合策略( 即 ,通过EDC / NHS胺偶联),ECM蛋白缀合的PEG基的支架可被制造,这可以证明更多细胞的结合位点是一个更象环境体内和增强肝功能。
在这份手稿和相关的视频,我们详细介绍了ICC支架的制造使用聚(乙二醇)二丙烯酸酯(PEGDA)水凝胶和聚苯乙烯微球的晶格,用于肝癌优化(的Huh-7.5)培养。我们证明在脚手架拓扑和电池性能方面的一般非粘着裸PEGDA ICC支架和胶原涂层PEGDA ICC脚手架之间的差异。细胞活力和功能测定定性和定量评估的Huh-7.5细胞的行为。
Access restricted. Please log in or start a trial to view this content.
研究方案
1. ICC脚手架制作(图1)
- 制备聚苯乙烯(PS)棱(直径= 6毫米;珠8-13层)。
- 为了准备模具,从0.2毫升煮沸型离心管切的提示关闭在40微升的水平。附着切割管的顶端与防水胶24×60毫米2显微镜盖玻璃滑动。
- 放包含在水悬浮液中进20ml小瓶在PS球(直径= 140微米),小心地吸取出来的水悬浮液,并加入18毫升70%的乙醇溶液到小瓶。把球体溶液放入超声波浴松开凝集球体。重复此洗涤步骤几次,以完全除去水和水溶性组分。
- 吸取100μl的乙醇到模具。
- 4 mm切割一200μl的微量移液器尖端的顶部。吸移管将25μl球体的成使用两倍200μl的微量实现模具的50微升在每个模具总体积。
- 放置模具上以120rpm过夜摇床上。
- 检查在光学显微镜下在各个模具中的球的布置。如果球未六边形有序,加50微升70%乙醇,并手动摇动在纵向和横向轴线方向纠正安排。
- 让我们在室温(RT)的乙醇蒸发了两个晚上。放置在一个130℃炉中的模具和胎圈复合物6小时退火的PS珠。
- 准备裸和ECM涂层支架PEGDA。
- 综合使用acrylating线性PEG大分子建立协议45,46 PEGDA大单体(M W = 4.6 kDa的)。
- 制备50%(重量/体积)在去离子(DI)水PEGDA溶液,并允许大分子单体以适当地在4,713 xg离心离心,直到它完全溶解溶解。
- 对于ECM结合ICC支架,溶解额外10%,在50%的PEGDA溶液(重量/体积)丙烯酰基PEG-NHS(M W = 3.4 kDa)的。
- 制备20%(重量/体积)的2-羟基-4'原液 - 在70%的乙醇(2-羟基乙氧基)-2-甲基苯(PI)。
- 加20%(重量/体积)每1ml的50%的PI原液50微升(重量/体积)PEGDA的。调整基于PEGDA的分子量的PI原液所需量。
- 涡旋1分钟离心管中的混合物,以达到均匀的溶液。
- 果皮从载玻片上(从步骤1.1.7)的模具,从模具中取出胶,推晶格出小心使用刮刀并将他们每个人到1.5毫升管。吸取300微升的PEGDA的解决方案和离心845 XG 5分钟,以允许适当PEGDA的解决方案渗透到晶格。
- 用镊子取下管晶格,仔细涂抹手套干多余的PEGDA的解决方案。放置在石蜡膜覆盖玻璃的晶格与扁平CIR丘拉尔面朝上。
- 露出PEGDA溶液渗入支架为365纳米的紫外线(UV)光(10.84毫瓦/厘米2),用于使用一个UV点灯5分钟。
- 放置在新的小瓶PEGDA聚合晶格(大约每小瓶10格),并加入20毫升四氢呋喃(THF)中。摇上以300rpm的轨道摇床小瓶。用1-2小时的间隔改变THF中的至少3倍。
注:完全是为了防止气泡进入支架,这反过来又可能导致不完全去除PS的改变THF时,不要取下THF。留出足够的解决方案覆盖格并添加新THF。
注意:THF是有毒的。戴上手套,实验服和护目镜。在通风橱下操作,避免吸入。 - 检查PS球是通过将水倒入用于THF溶液,观察溶液颜色溶解。重复步骤1.2.9如果PS球未正确溶解。
注:该解决方案的颜色会改变白,如果有任何剩余的聚苯乙烯微球。
- 清洁的生物安全柜(BSC)的支架。
- 消毒支架,制备的50ml离心管中与2ml每支架70%乙醇,并使用刮刀放置支架在管。允许支架在乙醇浸泡1小时。从这一步,进行在BSC的所有过程。
- 小心倒入乙醇出并在524 xg离心用磷酸盐缓冲盐水(PBS)(2毫升,每支架)和离心机代替3分钟以除去气泡。保持它在冰箱和1-2小时的间隔改变PBS几次。
- 对于I型胶原包被的支架,制备含有胶原蛋白1型原液另一50ml离心管中(1毫升,每支架),使用一个抹刀,和离心机的灭菌支架转移到该管中,在524×g离心3分钟。摇动以400rpm支架上轨道摇床进行30分钟,并保持在管中有电冰箱或过夜。
- 通过浸入新鲜的PBS支架,然后吸取PBS使用前洗两次用PBS支架。
注:其他ECM蛋白也可因为在NHS化学要求胺基团以形成键( 图2)来代替I型胶原。
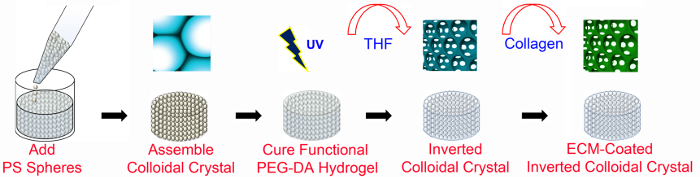
图1. 概述ICC制造,基于PEG的ICC支架使用微细加工技术与无ECM功能化制造。 ECM涂覆的IC卡的支架需要PEG-NHS以及PEGDA(如在图2详细说明)。在PS晶格的直径为6毫米,8-13珠层的高度。 PS,聚苯乙烯; PEGDA,聚(乙二醇)二丙烯酸酯;紫外线,紫外线; THF,四氢呋喃; ECM,细胞外基质。这个数字已被修改,并与无线许可后使用莱伊47。 请点击此处查看该图的放大版本。
2. ICC结构表征
- 分析ICC结构有或没有缀合的蛋白质,可使用扫描电子显微镜(SEM)47。
- 用4%多聚甲醛(PFA)的支架,连续脱水它们在25,50,75,95和100%的乙醇溶液,然后将它们在-80℃储存,直到乙醇完全蒸发。
- 干燥的样品在冷冻干燥器中48小时。
- 采用碳磁带并将其放置在溅射镀膜机加盖样品到样品架。
- 自动抽真空后,由在20mA溅射60秒10纳米厚的Pt膜包衣它。
- 使用SEM在5kV( 图3A, 图4A)的电压图像的ICC支架。
- 为了测量孔和腔体直径互联,分析利用图像分析软件48( 例如 ,ImageJ的; 图3B,C)SEM照片。
- 可视化的共轭胶原到该支架没有细胞,荧光标记中使用的抗体(1:100)胶原对胶原I型和图像共聚焦激光扫描显微镜47(CLSM; 图4B)。
3.咦-7.5细胞培养及幼苗
- 培养的Huh-7.5细胞以在100mM细胞培养皿2-2.5×10 6个细胞/ ml用10ml Dulbecco氏改良的Eagle氏培养基(DMEM)中补充有10%胎牛血清(FBS)和100单位/ ml的接种密度青霉素-链霉素(生长培养基)中于37℃和5%的CO 2,更改在BSC每三天媒体直到它们达到75-80%汇合。
- 准备支架在BSC细胞种植。
- 小心地将斯卡夫与平坦表面的24孔板孩子朝上。
- 洗脚手架,加入2毫升的PBS至每孔含有一个支架。吸出PBS并加入2毫升的新鲜PBS到每口井。
- 吸出PBS并吸管2毫升生长培养基(参见步骤3.1)和离开30分钟。吸出介质,并允许该支架干燥1小时。
- 从使用胰蛋白酶消化法在BSC培养板分离汇合的Huh-7.5细胞(步骤3.1)。
- 从板吸媒体,加入4毫升的PBS洗涤贴壁细胞,然后吸PBS。
- 吸管0.75-1毫升0.25%胰蛋白酶和发生在培养箱中在37℃,5%CO 2的3分钟。
- 从孵化器和吸管取出板5毫升媒体停止胰蛋白酶反应。吸管媒体,分离的细胞,以及胰蛋白酶混合物倒入15毫升管。
- 离心524 XG 3分钟,取出上清,悬浮颗粒在5毫升的媒体。
- 算使用血球细胞,并计算包含细胞以目标数N 0的细胞悬浮液的体积,每25微升(对于标准实验中,N 0为1×10 6个细胞)。
细胞悬浮液的体积=(细胞的目标数)/(细胞悬浮液的浓度) - 慢慢地吸取25微升细胞悬液(含N 0细胞)直接在每个支架(从步骤3.1.4)的顶部。放置在孵化器在24孔板中。
- 12小时后,小心地用使用抹刀2毫升的媒体传送支架进入一个新的24孔板,吸移管到每个孔中。放置在孵化器在24孔板中。
- 更改媒体每3天或取决于当媒体收集蛋白分泌分析(见步骤5.1)上。
4.细胞活力
- 要定性分析细胞活力,用荧光活/死染色试剂盒染色使用C细胞和图像LSM。
- 继包指令,准备用4μM钙黄绿素AM和媒体8μM乙啶同型二聚体-1溶液(见步骤3.1.3)。
注意:根据细胞数进行优化。如果细胞增殖和双数(约200万),使用试剂量的两倍。 - 在BSC,在每孔一个支架(步骤3.7)和移液管将500μl制备的溶液的吸出介质。孵育在37℃培养箱样品1小时。
- 覆盖板在箔出培养箱的除去板时,以保护样本的光。使用CLSM49图像样本。
- 继包指令,准备用4μM钙黄绿素AM和媒体8μM乙啶同型二聚体-1溶液(见步骤3.1.3)。
- 定量评估细胞生存力,使用比色测 定法50测量的酶活性(活细胞)( 即 ,2-(2-甲氧基-4-硝基苯基)-3-(4-硝基苯基)-5-(2,4-二磺苯基) -2H四氮唑(味精盐试剂))。
- 创建国际刑事法院平台的标准曲线( 即 ,吸光度(OD)诉图ersus给定小区数目)。
注:细胞接种是,相较于其他的平台不是100%有效,因为细胞可穿过支架的腔。- 确定细胞接种数目,N 0,将用于使标准曲线。
注意:选择包含了在该实验估计细胞数的范围内。例如,如果初始细胞数为5×10 5个细胞,并有一个估计〜3倍的增加通过在实验的最后一天,选择2.5×10 5,5×10 5,1×10 6,2× 10 6个细胞为N 0。 - 在按照步骤3.1-3.6中描述的ICC支架(一个N 0每25微升播种量支架)执行细胞种植。
- 6小时后,将支架转移到另一24孔板中。选择一个时间,使细胞粘附而不是细胞增殖。
- 所传送的IC卡支架进行细胞计数。
- 稀释10倍味精,盐试剂(MSR)解决方案与在BSC和吸管500微升1个MSR解决方案媒体为1x到每口井用的支架。在37℃下的24孔平板1小时。
- 从每口井,转移100微升到96孔板。作为空白,吸管100微升新鲜1×单钠盐试剂溶液为不同孔上96孔板。手动删除任何气泡在场采用干枪头,并覆盖96孔板的贴膜,保护它的光。
- 在λ= 450nm处测量的OD读数使用分光光度计。减去从其他值空白的OD找到准确外径51。
- 计数细胞数(N 升 )残留在井转移使用血细胞计数该支架(步骤4.2.1.3)后的位数。
注意:使用300μl的胰蛋白酶到trypsinize细胞。 - 计算出实际的细胞数,N A。
实际=初步 - 留在井
N A = N 0 -N 大号 - 通过绘制在步骤4.2.1.4.3对电池实际数量(N A)中得到的OD作出标准曲线,并用它来 估算在实验中的细胞数。
注意:如果任何的ICC参数( 即,致孔剂的大小,支架的尺寸,ECM蛋白, 等等 )被更改制作新的标准曲线。
- 确定细胞接种数目,N 0,将用于使标准曲线。
- 创建国际刑事法院平台的标准曲线( 即 ,吸光度(OD)诉图ersus给定小区数目)。
5.细胞功能
- 通过从所收集的媒体(来自步骤3.7)通过酶的Huh-7.5细胞(即白蛋白,尿素)分析蛋白质分泌酶联免疫吸附测定(ELISA)52。
注意:稀释介质,这取决于接种的细胞的数目和媒体收取的金额。在IC卡接种5×10 5个细胞,使用了〜1:25的比例,它引入到抗体-预涂井之前。 - 要定性分析细胞功能,免疫染色特定细胞内蛋白( 即白蛋白),酶( 即 ,CYP450),污点结构部件( 即,蜂窝的肌动蛋白),以及核和用CLSM 49的图像。
- 吸媒体(步骤3.7),并加入2毫升的PBS洗细胞载货ICC支架。
- 吸管1毫升4%PFA的孵育在室温下固定5分钟。
- 洗3次用2ml PBS中。
- 通过在1ml的0.1%的4-(1,1,3,3-四甲基丁基)苯基 - 聚乙二醇(表面活性剂)30分钟温育支架透膜。
- 洗3次用2ml的PBS,以消除任何泄漏的蛋白质。
- 移液器将500μl1%牛血清白蛋白(BSA),并在室温孵育1小时来阻断非特异性结合。
- 制备稀释的第一抗体( 例如,白蛋白,细胞色素P450)的解决方案。
- 吸管的1%BSA溶液到15毫升管500微升,并添加毫升4.5 0.1%表面活性剂溶液,以制备总5毫升0.1%BSA的溶液中。
- 吸移管98微升0.1%的BSA溶液的成200μl的微量离心管和2μl第一抗体以产生1:50的(一次抗体:0.1%BSA)中的第一抗体溶液。
- 吸管40上的支架一级抗体溶液的微升并覆盖用石蜡膜的基板。包装用铝箔的24孔板和菜在4℃下存放过夜。
- 洗3次用2毫升的PBS并轻轻摇动板洗涤之间。
- 制备稀释的生物素化的第二抗体( 即 ,抗小鼠抗体)原液。
- 吸移管198微升0.1%BSA溶液和2μl第二抗体,以产生1:100(二次抗体:0.1%BSA)中的二级抗体溶液。
- 制备在0.1%BSA溶液罗丹明或荧光素标记鬼笔环肽(以染色的细胞的肌动蛋白纤丝)的0.1%储备溶液。
- 吸取每个解决方案的25微升在管混匀W¯¯ELL。
- 吸取50微升脚手架上二级抗体原液。覆盖用石蜡膜将支架,包裹用铝箔和存储盘在RT 2小时。
- 洗3次用2ml PBS中。
- 吸移管200微升的0.2%4'- 6-二脒基-2-苯基吲哚(DAPI;一个核染色)上的脚手架溶液,并保持在室温2-3分钟。用铝箔覆盖的板。
- 洗涤2次用2ml PBS中。
- 用滴管,将安装媒体的基板上的下降。
- 小心地把该支架上使用CLSM 47载玻片和形象。
- 评估通过实时聚合酶链反应(qPCR的)的基因表达。使用标准试剂盒逆转录酶PCR(RT-PCR)53和qPCR 54根据制造商的说明。如下文所述,从细胞中提取的RNA。
- 放置在1.5ml微量离心管中的支架(来自步骤3.7)。
- 移液器加入1ml RNA提取溶液进入管的,并保持在超声波仪在RT 5分钟。
- 吸取200微升氯仿到每个离心管中,大力摇晃管在手15-20秒。保持所述管在室温〜3分钟,直到各相分离。
- 离心样本13,000 XG,4℃15分钟,并小心地取出管子,这样的阶段不要混用。
- 仔细吸取500-600微升从第一管上层水相的成第二离心管中。
- 异丙醇等体积(500-600微升)添加到该第二管中。
- 倒置该管3-5次,并离开所述管在室温静置10分钟。
- 以13,000 xg离心,4℃15分钟离心样品。
- 如果粒料是不可见在管,离心机的底部再5分钟。
注意:如果仍然没有可见的沉淀,RNA的量可能不足。
- 如果粒料是不可见在管,离心机的底部再5分钟。
- 一世nvert管与盖开放丢弃上清,吸管在1毫升70%的乙醇稀释于DEPC水进入管。
- 稍微涡管这样的小球从管壁分离,然后让管空气干燥。
- 加入50μlDPEC水重悬沉淀物。
- 保持移液直至沉淀溶解。
- 为了变性双链RNA成单链RNA保持10分钟在55℃。
- 轻轻鼓在管底部的手指,然后离心管短暂地(7 500 XG,4分钟,4℃)。
- 保持在冰管道,直到如在56中所述进行逆转录55和实时PCR。
Access restricted. Please log in or start a trial to view this content.
结果
对于IC卡支架的结构表征和各IC卡支架状态的功效的在培养的肝细胞比较代表结果示和说明。在这些结果中使用的IC卡的支架条件是0微克/毫升(裸),20微克/毫升(胶原20),200微克/毫升(胶原200),和400微克/毫升(胶原400)和初始胶原涂层咦-7.5细胞种植数量为1×10 6。
ICC孔互连和支架的拓扑结构表征。
Access restricted. Please log in or start a trial to view this content.
讨论
组织工程支架的快速发展提供一切必要的再生,维持或器官替代的应用程序修复组织,研究疾病,药物开发的物理和生化线索,和许多其他57。在肝组织工程,原代人肝细胞迅速失去其代谢功能,一旦从主体分离,从而为工程支架非常需要和显影平台维持肝功能。 体外肝细胞培养平台目前已经利用不同的生物材料。在这方面的研究已集中于模仿体内肝微环境的各种特征,如EC...
Access restricted. Please log in or start a trial to view this content.
披露声明
The authors have no competing financial interests to disclose.
致谢
笔者希望从国家研究基金会奖学金(NRF -NRFF2011-01)与竞争研究计划(NRF-CRP10-2012-07)承认支持。
Access restricted. Please log in or start a trial to view this content.
材料
| Name | Company | Catalog Number | Comments |
| 0.2 ml PCR tube | Axygen Scientific | PCR-02D-C | Boil-proof |
| Gorilla Glue | Gorilla Glue, Inc. | Depends on vendor. This was purchased from a local store. | |
| Glass slides | VWR | 631-1575 | Dimensions: 24×60 mm2 |
| Polystyrene spheres | Fisher Scientific | TSS#4314A | Diameter = 140 µm; 3x104 particles per milliliter and 1.4% size distribution |
| Ethanol | Merck | 1.00983.1011 | absolute for analysis EMSURE; Dilute to 70% with Milli-Q water |
| Ultrasonic Bath | Elma | S10H | Equiment |
| Furnace | Nabertherm | N7/H | Equipment |
| 200 µl pipette tip | Axygen Scientific | T-210-Y-R-S | |
| Rocking shaker | VWR | 444-0142 | |
| Polyethylene Glycol (PEG) | Merck | 1.09727.0100 | Mw= 4 kDa; acrylation of PEG monomers and purification of the resulting precipitate produces a PEGDA macromer with Mw = 4.6 kDa |
| Centrifuge | Beckman Coulter | 392932 | Equipment |
| Acrylate-Poly(Ethylene Glycol) - Succinimidyl Valerate | Laysan Bio | ACRL-PEG-SVA-3400-1g | Mw = 3.4 kDa |
| 2-hydroxy-4'-(2-hydroxyethoxy)-2-methylpropiophenone | Sigma Aldrich | 410896 | |
| Vortex | VWR | 58816-123 | Equipment |
| Microcentrifuge | Eppendorf | 5404 000.413 | |
| Paraffin Film | Parafilm M | #PM996 | Kept at 9" with allows intensity of 10.84 mW/cm2 |
| Bluewave 200 UV spotlight | Blaze Technology | 120008, 122300 | |
| Tetrahydrofuran (THF) | Merck | 107025 | |
| Orbital shaker | Heidolph | 543-123120-00-5 | |
| Collagen Type I | Sigma Aldrich | C3867-1VL | From rat. 1x, w/o CaCl2 & MgCl2; pH = 7.2 |
| Phosphate Buffered Saline (PBS) | Gibco | 20012-027 | 16% W/V AQ. 10 x 10 ml |
| Paraformaldehyde | VWR | 43368.9M | Equipment |
| Freezone 4.5 freeze drier | Labconco | 7750020 | Equipment |
| Sputter coater | Jeol Ltd. | JFC-1600 | Equipment |
| Scanning Electron Microscope | Jeol Ltd. | JSM 5310 | |
| Anti-mouse primary antibodies against Collagen type I | Abcam | ab6308 | |
| Anti-mouse secondary antibody conjugated with Alexa Fluor 488 | Life Technologies | A21121 | |
| Plate, Tissue Culture 24 Well, Flat Bottom (Nunclon) | Bio-Rev PTE LTD | 3820-024 | |
| Dulbecco's Modified Eagle's Medium(DMEM) 2.5 g/L Glucose w/ L-Gln | Lonza | 12-604F | |
| Fetal Bovine Serum (FBS) | Gibco | A15-151 | |
| Penicillin-Streptomycin (P/S) | Life Tchnologies | 15140-122 E | |
| 100 mm Corning non-treated culture dishes | Sigma Aldrich | CLS430591 | |
| 0.25% Trypsin-EDTA | Gibco | 25200-056 | Equipment; 37 °C, 5% Humidity |
| Forma Steri-Cycle CO2 Incubators | Thermofisher Scientific | 371 | |
| Hausser Bright-Line Phase Hemacytometer | Thermofisher Scientific | 02-671-6 | |
| Live/Dead Viability/Cytotoxicity Kit for mammalian cells | Life Technologies | L3224 | |
| CCK-8 Assay | Dojindo Laboratories | CK04-11 | Monosodium-salt reagent (MSR) |
| Infinite 200 PRO microplate reader | Tecan | ||
| Albumin Human ELISA kit | Abcam | ab108788 | |
| Triton X-100 | Bio-Rad | #1610407 | |
| Bovine Serum Albumin (BSA) | Sigma-Aldrich | A2153-50G | |
| Anti-mouse primary antibodies (against CYP3A4, albumin) | Santa Cruz Biotechnology | sc-53850; sc-271605 | |
| DAPI | Life Technologies | D3571 | |
| Alexa Fluor 555 labeled Phalloidin | Life Technologies | A34055 | |
| Trizol | Life Technologies | 15596-026 | |
| Chloroform | VWR | 22706.326 | |
| Isopropanol | Fisher Scientific | 67-63-0 | |
| DPEC water | Thermofisher Scientific | AM9916 | |
| Nanodrop 2000c Spectrophotometer | Thermofisher Scientific | ND-2000 | |
| iScript Reverse Transcription Supermix | Bio-Rad Laboratories | 1708840 | |
| SYBR select Master Mix for CFX | Life Technology | 4472937 | |
| Primers (to be chosen) | |||
| CFX96 Real-Time System, C-1000 Touch Thermal Cycler | Bio Rad Laboratories | SOFT-CFX-31-PATCH |
参考文献
- Yamada, M., et al. Controlled formation of heterotypic hepatic micro-organoids in anisotropic hydrogel microfibers for long-term preservation of liver-specific functions. Biomaterials. 33 (33), 8304-8315 (2012).
- Abboud, G., Kaplowitz, N. Drug-induced liver injury. Drug Safety. 30 (4), 277-294 (2007).
- Cho, N. J., et al. Viral infection of human progenitor and liver-derived cells encapsulated in three-dimensional PEG-based hydrogel. Biomed Mater. 4 (1), (2009).
- Revzin, A., et al. Designing a hepatocellular microenvironment with protein microarraying and poly (ethylene glycol) photolithography. Langmuir. 20 (8), 2999-3005 (2004).
- Sato, A., Kadokura, K., Uchida, H., Tsukada, K. An in vitro hepatic zonation model with a continuous oxygen gradient in a microdevice. Biochem Bioph Res Com. 453 (4), 767-771 (2014).
- Domansky, K., et al. Perfused multiwell plate for 3D liver tissue engineering. Lab Chip. 10 (1), 51-58 (2010).
- Hegde, M., et al. Dynamic interplay of flow and collagen stabilizes primary hepatocytes culture in a microfluidic platform. Lab Chip. 14 (12), 2033-2039 (2014).
- Flaim, C. J., Chien, S., Bhatia, S. N. An extracellular matrix microarray for probing cellular differentiation. Nat methods. 2 (2), 119-125 (2005).
- Underhill, G. H., Chen, A. A., Albrecht, D. R., Bhatia, S. N. Assessment of hepatocellular function within PEG hydrogels. Biomaterials. 28 (2), 256-270 (2007).
- Dunn, J., Tompkins, R. G., Yarmush, M. L. Hepatocytes in collagen sandwich: evidence for transcriptional and translational regulation. J cell biol. 116 (4), 1043-1053 (1992).
- Dunn, J. C., Tompkins, R. G., Yarmush, M. L. Long-term in vitro function of adult hepatocytes in a collagen sandwich configuration. Biotechnol progr. 7 (3), 237-245 (1991).
- Ling, Y., et al. A cell-laden microfluidic hydrogel. Lab Chip. 7 (6), 756-762 (2007).
- Kim, M., Lee, J. Y., Jones, C. N., Revzin, A., Tae, G. Heparin-based hydrogel as a matrix for encapsulation and cultivation of primary hepatocytes. Biomaterials. 31 (13), 3596-3603 (2010).
- Kotov, N. A., et al. Inverted Colloidal Crystals as Three-Dimensional Cell Scaffolds. Langmuir. 20 (19), 7887-7892 (2004).
- Shanbhag, S., Woo Lee, J., Kotov, N. Diffusion in three-dimensionally ordered scaffolds with inverted colloidal crystal geometry. Biomaterials. 26 (27), 5581-5585 (2005).
- Lee, Y. H., Huang, J. R., Wang, Y. K., Lin, K. H. Three-dimensional fibroblast morphology on compliant substrates of controlled negative curvature. Integr Biol. 5, 1447-1455 (2013).
- da Silva, J., Lautenschlager, F., Kuo, C. H. R., Guck, J., Sivaniah, E. 3D inverted colloidal crystals in realistic cell migration assays for drug screening applications. Integr Biol. 3, 1202-1206 (2011).
- da Silva, J., Lautenschlager, F., Sivaniah, E., Guck, J. R. The cavity-to-cavity migration of leukaemic cells through 3D honey-combed hydrogels with adjustable internal dimension and stiffness. Biomaterials. 31, 2201-2208 (2010).
- Lee, J., Lilly, G. D., Doty, R. C., Podsiadlo, P., Kotov, N. A. In vitro toxicity testing of nanoparticles in 3D cell culture. Small. 5, 1213-1221 (2009).
- Lee, J., Kotov, N. A. Notch ligand presenting acellular 3D microenvironments for ex vivo human hematopoietic stem-cell culture made by layer-by-layer assembly. Small. 5, 1008-1013 (2009).
- Liu, Y., et al. Rapid aqueous photo-polymerization route to polymer and polymer-composite hydrogel 3D inverted colloidal crystal scaffolds. J Biomed Mater Res. Part A. 83, 1-9 (2007).
- Ma, P. X., Choi, J. W. Biodegradable polymer scaffolds with well-defined interconnected spherical pore network. Tissue Eng. 7, 23-33 (2001).
- Cuddihy, M. J., Kotov, N. A. Poly (lactic-co-glycolic acid) bone scaffolds with inverted colloidal crystal geometry. Tissue Eng Part A. 14, 1639-1649 (2008).
- Choi, S. W., Zhang, Y., Xia, Y. Three-dimensional scaffolds for tissue engineering: the importance of uniformity in pore size and structure. Langmuir. 26, 19001-19006 (2010).
- Choi, S. W., Zhang, Y., Thomopoulos, S., Xia, Y. In vitro mineralization by preosteoblasts in poly(DL-lactide-co-glycolide) inverse opal scaffolds reinforced with hydroxyapatite nanoparticles. Langmuir. 26, 12126-12131 (2010).
- Choi, S. W., Zhang, Y., Macewan, M. R., Xia, Y. Neovascularization in biodegradable inverse opal scaffolds with uniform and precisely controlled pore sizes. Adv Healthc Mater. 2, 145-154 (2013).
- Zhang, Y., Choi, S. W., Xia, Y. Modifying the Pores of an Inverse Opal Scaffold With Chitosan Microstructures for Truly Three-Dimensional Cell Culture. Macromol Rapid Commun. 33, 296-301 (2012).
- Cai, X., et al. Investigation of neovascularization in three-dimensional porous scaffolds in vivo by a combination of multiscale photoacoustic microscopy and optical coherence tomography. Tissue Eng. Part C, Meth. 19, 196-204 (2013).
- Zhang, Y. S., Yao, J., Wang, L. V., Xia, Y. Fabrication of Cell Patches Using Biodegradable Scaffolds with a Hexagonal Array of Interconnected Pores (SHAIPs). Polymer. 55, 445-452 (2014).
- Zhang, Y. S., Regan, K. P., Xia, Y. Controlling the Pore Sizes and Related Properties of Inverse Opal Scaffolds for Tissue Engineering Applications. Macromol Rapid Commun. 34, 485-491 (2013).
- Stachowiak, A. N., Bershteyn, A., Tzatzalos, E., Irvine, D. J. Bioactive Hydrogels with an Ordered Cellular Structure Combine Interconnected Macroporosity and Robust Mechanical Properties. Adv Mater. 17, 399-403 (2005).
- Stachowiak, A. N., Irvine, D. J. Inverse opal hydrogel-collagen composite scaffolds as a supportive microenvironment for immune cell migration. J Biomed Mater Res. Part A. 85, 815-828 (2008).
- Liu, Y., Wang, S. 3D inverted opal hydrogel scaffolds with oxygen sensing capability. Colloids and surfaces. B, Biointerfaces. 58, 8-13 (2007).
- Bryant, S. J., Cuy, J. L., Hauch, K. D., Ratner, B. D. Photo-patterning of porous hydrogels for tissue engineering. Biomaterials. 28, 2978-2986 (2007).
- Bhrany, A. D., Irvin, C. A., Fujitani, K., Liu, Z., Ratner, B. D. Evaluation of a sphere-templated polymeric scaffold as a subcutaneous implant. JAMA facial plastic surgery. 15, 29-33 (2013).
- Kuo, Y. C., Chiu, K. H. Inverted colloidal crystal scaffolds with laminin-derived peptides for neuronal differentiation of bone marrow stromal cells. Biomaterials. 32 (3), 819-831 (2011).
- Yang, J. T., Kuo, Y. C., Chiu, K. H. Peptide-modified inverted colloidal crystal scaffolds with bone marrow stromal cells in the treatment for spinal cord injury. Colloids Surf. B, Biointerfaces. 84, 198-205 (2011).
- Kuo, Y. C., Tsai, Y. T. Inverted colloidal crystal scaffolds for uniform cartilage regeneration. Biomacromolecules. 11, 731-739 (2010).
- Choi, S. W., Xie, J., Xia, Y. Chitosan-Based Inverse Opals: Three-Dimensional Scaffolds with Uniform Pore Structures for Cell Culture. Adv Mater. 21, 2997-3001 (2009).
- Long, T. J., Sprenger, C. C., Plymate, S. R., Ratner, B. D. Prostate cancer xenografts engineered from 3D precision-porous poly(2-hydroxyethyl methacrylate) hydrogels as models for tumorigenesis and dormancy escape. Biomaterials. 35, 8164-8174 (2014).
- Kuo, Y. C., Tsai, Y. T. Inverted colloidal crystal scaffolds for uniform cartilage regeneration. Biomacromolecules. 11, 731-739 (2010).
- Kuo, Y. C., Chiu, K. H. Inverted colloidal crystal scaffolds with laminin-derived peptides for neuronal differentiation of bone marrow stromal cells. Biomaterials. 32, 819-831 (2011).
- Lee, J., Cuddihy, M. J., Cater, G. M., Kotov, N. A. Engineering liver tissue spheroids with inverted colloidal crystal scaffolds. Biomaterials. 30 (27), 4687-4694 (2009).
- Galperin, A., et al. Integrated bi-layered scaffold for osteochondral tissue engineering. Adv Healthc Mater. 2, 872-883 (2013).
- Waters, D. J., et al. Morphology of Photopolymerized End-linked Poly(ethylene glycol) Hydrogels by Small Angle X-ray Scattering. Macromolecules. 43 (16), 6861-6870 (2010).
- Elbert, D. L., Hubbell, J. A. Conjugate addition reactions combined with free-radical cross-linking for the design of materials for tissue engineering. Biomacromolecules. 2 (2), 430-441 (2001).
- Kim, M. H., et al. Biofunctionalized Hydrogel Microscaffolds Promote Three-Dimensional Hepatic Sheet Morphology. Macromol Biosci. , (2015).
- Ferreira, T., Rasband, W. ImageJ User Guide. , http://imagej.nih.gov/ij/docs/guide/146-30.html#toc-Subsection-30.1 (2012).
- JoVE Science Education Database. General Laboratory Techniques. Introduction to Fluorescence Microscopy. , JoVE. Cambridge, MA. (2015).
- Tominaga, H., et al. A water-soluble tetrazolium salt useful for colorimetric cell viability assay. Anal Commun. 36 (2), 47-50 (1999).
- JoVE Science Education Database. General Laboratory Techniques. Introduction to the Microplate Reader. , JoVE. Cambridge, MA. (2015).
- JoVE Science Education Database. Basic Methods in Cellular and Molecular Biology. The ELISA Method. , JoVE. Cambridge, MA. (2015).
- Nolan, T., Hands, R. E., Bustin, S. A. Quantification of mRNA using real-time RT-PCR. Nat Protoc. 1, 1559-1582 (2006).
- JoVE Science Education Database. Essentials of Environmental Microbiology. RNA Analysis of Environmental Samples Using RT-PCR. , JoVE. Cambridge, MA. (2016).
- JoVE Science Education. Essentials of Environmental Microbiology. , JoVE. (2015).
- Jeong, S., et al. The evolution of gene regulation underlies a morphological difference between two Drosophila sister species. Cell. 132 (5), 783-793 (2008).
- Griffith, L. G., Naughton, G. Tissue engineering--current challenges and expanding opportunities. Science. 295 (5557), 1009-1014 (2002).
- Hegde, M., et al. Dynamic Interplay of Flow and Collagen Stabilizes Primary Hepatocytes Culture in a Microfluidic Platform. Lab Chip. 14, 2033-2039 (2014).
- Kim, Y., Lasher, C. D., Milford, L. M., Murali, T., Rajagopalan, P. A comparative study of genome-wide transcriptional profiles of primary hepatocytes in collagen sandwich and monolayer cultures. Tissue Eng Pt C. 16 (6), 1449-1460 (2010).
- Baimakhanov, Z., et al. Efficacy of multi-layered hepatocyte sheet transplantation for radiation-induced liver damage and partial hepatectomy in a rat model. Cell Transplant. , (2015).
- Li, C. Y., et al. Micropatterned Cell-Cell Interactions Enable Functional Encapsulation of Primary Hepatocytes in Hydrogel Microtissues. Tissue Eng Pt A. 20 (15-16), 2200-2212 (2014).
- Shlomai, A., et al. Modeling host interactions with hepatitis B virus using primary and induced pluripotent stem cell-derived hepatocellular systems. P Natl A Sci USA. 111 (33), 12193-12198 (2014).
- Curcio, E., et al. Mass transfer and metabolic reactions in hepatocyte spheroids cultured in rotating wall gas-permeable membrane system. Biomaterials. 28, 5487-5497 (2007).
- Martinez-Hernandez, A., Amenta, P. The hepatic extracellular matrix. Vichows Archiv A Pathol Anat. 423, 1-11 (1993).
- Liu, Y., Wang, S., Lee, J. W., Kotov, N. A. A Floating Self-Assembly Route to Colloidal Crystal Templates for 3D Cell Scaffolds. Chem Mater. 17 (20), 4918-4924 (2005).
Access restricted. Please log in or start a trial to view this content.
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。