JoVE 비디오를 활용하시려면 도서관을 통한 기관 구독이 필요합니다. 전체 비디오를 보시려면 로그인하거나 무료 트라이얼을 시작하세요.
Method Article
반전 콜로이드 결정체 폴리 (에틸렌 글리콜) 비계의 제작 : 간 조직 공학을위한 삼차원 세포 배양 플랫폼
요약
This manuscript presents a detailed protocol for the fabrication of an emerging three-dimensional hepatocyte culture platform, the inverted colloidal crystal scaffold, and the concomitant techniques to assess hepatocyte behavior. The size-controllable pores, interconnectivity and ability to conjugate extracellular matrix proteins to the poly(ethylene glycol) (PEG) scaffold enhance Huh-7.5 cell performance.
초록
, 생체 이물질 '독성 테스트 바이러스 감염 연구 및 간암을 대상으로 약물을 개발하기위한 목적으로, 시험 관내 간세포의 기능을 유지하는 능력은 세포 적당한 생화학 적 및 기계적 신호를 수신 한 플랫폼이 필요하다. 최근 간 조직 공학 시스템은 높은 수분 보유하고 세포에 필요한 기계적인 자극을 제공 할 능력이 주어 합성 또는 천연 하이드로 겔로 구성된 3 차원 지지체를 이용 하였다. 반전 콜로이드 결정 (ICC) 지지체에 대한 관심이 증가되고있다, 높은 공간 조직 동형과 이형 세포의 상호 작용뿐만 아니라, 세포 외 기질 (ECM)의 상호 작용을 가능하게하는 최근에 개발. 여기서, 우리는 폴리 (에틸렌 글리콜) 디 아크릴 레이트 (PEGDA) 및 입자 침출 방법을 이용하여 ICC 지지체를 제조하는 프로토콜을 기술한다. 간략하게, 격자는 미세 입자로부터 만들어지는 전 후 polymeR 용액 중합 적절히 첨가되고, 입자는 유기 용매 (예 : 테트라 히드로 푸란)을 사용하여 제거하거나 침출된다. 제어 된 기공 크기 및 미디어보다 쉽게 세포에 도달 할 수 있도록 상호 연관성이있는 다공성 지지체의 격자 결과의 용해. 이 독특한 구조는 세포뿐만 아니라 쉽게 기공 사이의 통신, 및 단백질과 PEGDA의 ICC 지지체는 전지 성능에 현저한 효과를 나타낸다 코팅 할 수있는 능력에 부착하기위한 고 표면적을 허용한다. 우리는 가능성의 관점에서, 골격의 형태뿐만 아니라, 간암 세포 (허 7.5) 동작을 분석하고 ICC 구조 ECM 코팅의 효과를 조사하는 기능을한다. 전반적으로,이 논문은 조직 공학에서 다양한 응용 프로그램, 특히 간 조직 공학을 가진 새로운 발판의 상세한 프로토콜을 제공합니다.
서문
간은 혈액 해독, 생체 이물질의 대사 및 혈청 단백질의 생산을 포함하여 다양한 기능을 가진 매우 혈관 기관이다. 간 조직은 여러 종류의 세포, 담즙 누소관, 정현파 및 다른 biomatrix 조성물 및 다른 산소 농도의 영역으로 포함하는 복잡한 3 차원 마이크로 구조를 갖는다. 이러한 복잡한 구조를 고려할 때 시험 관내 (1) 적절한 간 모델을 만드는 것이 어려웠다. 그러나, 시험 관내 모델에서 기능 테스트 약물 독성 2 플랫폼 인간 간세포를 호스팅 간 3과 관련된 질환을 연구하는 수요가있다.
현재 간암 조직 공학 플랫폼 조나의 생화학 적 조성물을 분리, 또는 간장의 파라미터 중, 몇 개의 셀 (4) 즉, 공존 배양을 집중하여 간암의 복잡성을 단순화 한L 개의 미세 환경 5 유동 역학 6,7 및 biomatrix 8의 구성. biomatrix 구성은 지지체 물질, 세포 외 기질 (ECM) 단백질 조성물, 매트릭스 경도뿐만 아니라 지지체의 디자인 및 구조와 같은 파라미터로 나눌 수있다. 조정 하이드로 겔의 기계적 특성, 생체 활성 및 열화 율에 기능 부여, 합성 하이드로 겔, 특히 폴리 (에틸렌 글리콜) (PEG)을 사용하여 하이드로 겔 9 조직 공학 연구의 증가가 있었다. 간 관련 연구와 관련하여, 생체 적합성 하이드로 겔은 간 질환 3의 바이러스 감염 연구에 적용 하였다. 간세포 플랫폼 설계로서 수많은 연구는 생체 내 미세 환경에서 모방 필수적인 차원 환경과 셀 ECM 및 세포 - 세포 상호 작용을 제공하기 위해 하이드로 겔 (12, 13) 내에서 간세포 샌드위치 배양 10,11 세포 캡슐화를 이용했다. 하우버전, 이러한 플랫폼은 지지체 (14)를 통해 비 균일 한 특성을 선도, 제어 및 공간 조직의 높은 수준을 가지고 있지 않습니다.
반전 결정 콜로이드 (ICC)는 14 비계 먼저 2000 년대 초반에 도입 된 세포 배양을위한 매우 조직 차원의 발판이다. 발판의 독특한 구조는 콜로이드 성 결정 가변 직경의 콜로이드 입자의 정 합체를 이용하여 간단한 제조 공정에 기인 할 수있다. 간략하게, 프로세스를 요약하기 위해, 입자는 깔끔하게 배치 격자를 형성하는 열을 이용하여 어닐링된다. 고 표면적을 갖는 육방 충전 구형 캐비티 (15)의 중합 된 겔 결과, 유기 용매에 의한이 격자의 침출. 이 높은 순서 지지체 이전 (아크릴 아미드) 16-21, 폴리 (락트산 - 코 - 글리콜 산), 폴리에 한정 15,22-30, 합성 및 천연 재료 모두에서 만들어진 포함하되되었는지폴리 (에틸렌 글리콜) (31, 32), 폴리 (2- 히드 록시 에틸 메타 크릴 레이트) 21,33-35, 키토산 36-39. 비 오염 물질로 만들어진 ICC의 발판이 공동 14,23,40 내에서 세포 회전 타원체를 촉진하는 경향이있다. 여러 종류의 세포가 성공적으로 셀 (43, 44)을 확산이 구성에서 차별화 기능 연골 41, 골수 간질 세포 (42)를 포함하고, 줄기 밝혀졌다. 간세포 대해서는 연구 된 ICC 나 2 SiO3과 폴리 (아크릴 아미드)로 이루어지는 지지체 아니라 PEG로 수행되었다. 간단한 바이오 콘쥬 게이션 전략 (즉, EDC / NHS를 통해 아민 커플 링), ECM 단백질 공역 PEG 기반의 발판이 환경과 같은 생체 내에서 더를하고 간 기능을 향상시키기 위해 더 많은 세포 결합 부위를 입증 할 수있는, 제조 할 수있다.
이 원고 및 관련 비디오에서 세부 사항에게 ICC 지지체의 제조를 우리(허 7.5) 배양 간암에 최적화 된 폴리 (에틸렌 글리콜) 디 아크릴 레이트 (PEGDA), 하이드로 겔 및 폴리스티렌 미세 구조 격자를 사용. 우리는 비계 토폴로지 및 전지 성능의 관점에서 일반적으로 비 접착식 베어 PEGDA의 ICC의 발판과 콜라겐 코팅 PEGDA의 ICC 지지체의 차이점을 보여줍니다. 세포 생존 및 기능이 허 - 7.5 셀 행동을 평가하는 정 성적 및 정량적으로 측정한다.
Access restricted. Please log in or start a trial to view this content.
프로토콜
1. ICC의 비계 제작 (그림 1)
- 폴리스티렌 (PS) 울타리 (비드의 8-13 층 직경 = 6 mm)를 준비합니다.
- 40 μl의 수준에서 0.2 ml의 증발 증거의 microcentrifuge 튜브에서 팁을 절단, 금형을 제조 하였다. 방수 접착제 24 X 60mm (2) 현미경 커버 유리 전표에 컷 튜브의 상단을 준수합니다.
- 신중하게, 20 ml의 유리 병에 물 현탁액에 포함 된 PS 구 (직경 = 140 μm의)를 넣어 물 현탁액을 피펫, 그리고 유리 병에 18 ml의 70 %의 에탄올 용액을 추가합니다. 집계 구를 풀어 초음파 욕조에 구 솔루션을 넣습니다. 완전히 물 및 수용성 성분을 제거하기 위해 세정 공정이 여러 번 반복.
- 몰드에 에탄올 100 μL 피펫.
- 4mm하여 200 μL의 마이크로 피펫 팁의 상단을 잘라. 회를 달성하기 위해 200 ㎕를 마이크로 피펫을 사용하여 몰드로 분야의 25 μL 피펫각각의 금형에 50 μL의 총 부피.
- 120 rpm으로 하룻밤에 흔들 통에 금형을 놓습니다.
- 광학 현미경으로 각 금형의 구체의 배열을 확인합니다. 구체가 육방 정렬되지 않은 경우, 70 % 에탄올의 50 μL를 추가 한 구성을 정정하기 종횡 축 방향으로 수동으로 흔들.
- 이틀 동안 실온 (RT)에서 에탄올의 증발을 보자. 의 PS 구슬을 어닐링 6 시간 동안 130 ℃로 가열로에서 금형 및 비드 단지를 배치합니다.
- 베어와 ECM 코팅 PEGDA의 발판을 준비.
- (= 4.6 kDa의 승 M)를 선형 PEG의 거대 단량체를 아클을 위해 설립 프로토콜 45, 46을 사용하여 PEGDA의 거대 단량체를 합성.
- 탈 이온화 (DI) 물에 PEGDA 용액 (V / w) 50 %를 준비하고 로머가 제대로이 완전히 용해 될 때까지 4,713 XG에서 원심 분리하여 용해 할 수 있습니다.
- ECM 공액 ICC 지지체를 들어, 추가 용해10 % 50 % PEGDA 솔루션에 아크릴로 일 - PEG-NHS (M 3.4 = w kDa의) (V / w).
- 20 %를 준비 '2- 히드 록시 - (4)의 스톡 용액 (/ V w) - (2- 히드 록시에 톡시) -2- methylpropiophenone (PI) 70 % 에탄올이다.
- 20 % 50 % 1 ㎖ 당 (w / v)의 PI 원액의 50 μl를 추가 (W / V) PEGDA의. PEGDA의 분자량에 기초하여 PI 원액의 필요한 양을 조정한다.
- 소용돌이 1 분 동안 원심 분리 관에 가하여 균일 용액에 도달한다.
- 필 (단계 1.1.7에서) 유리 슬라이드에서 금형은 금형에서 접착제를 제거 조심스럽게 주걱을 사용하여 격자를 밀어 1.5 ML 튜브로 각각 배치합니다. 5 분 845 XG에서 PEGDA 솔루션 및 원심 분리기의 피펫 300 μL는 격자에 적절한 PEGDA 솔루션 침투를 허용합니다.
- 핀셋을 사용하여 튜브의 격자를 제거하고 조심스럽게 장갑 건조 초과 PEGDA 솔루션을시킨다. 평면 CIR과 파라핀 필름 피복 유리에 격자를 배치이 위를 향하도록 큘라면.
- 자외선 자리 램프를 사용하여 5 분 동안 365 nm의 자외선 (UV) 빛 (10.84 mW의 / cm 2)에 PEGDA 솔루션 침투 발판을 노출.
- 새로운 유리 병에 PEGDA 중합 결정 격자를 놓고 테트라 히드로 푸란 20 ㎖를 추가 (THF) (10 바이알 당 그릴 정도). 300 rpm으로 궤도 통에 유리 병을 흔들어. 1-2 시간의 간격으로 THF에게 적어도 3 회를 변경합니다.
참고 차례로 PS의 불완전한 제거를 일으킬 수있는 발판을 기포가 들어 가지 않도록하기 위해, THF를 변경할 때 완전히 THF를 제거하지 않는다. 격자를 커버하고 새로운 THF를 추가 할 수있는 충분한 솔루션을 둡니다.
주의 : THF 독성이다. 장갑, 실험실 코트와 고글을 착용 할 것. 흄 후드에서 작동하여 흡입을 피할 것. - PS 구가 사용 된 THF 용액에 물을 넣고 용액의 색을 관찰하여 용해되어 있는지 확인합니다. 의 PS 분야가 제대로 용해되지 않은 경우 단계를 반복 1.2.9.
참고 :이 솔루션의 색상이 변경됩니다백색 잔여 PS 분야가있는 경우.
- 바이오 안전성 캐비닛 (BSC)의 발판을 청소합니다.
- 골격을 살균, 지지체 당 70 % 에탄올 2 ㎖와 50 ㎖ 원심 분리 튜브를 준비하고, 주걱을 이용하여 튜브 내의 지지체를 배치. 골격이 1 시간 동안 에탄올에 담가 할 수 있습니다. 앞으로이 단계에서, BSC 모든 절차를 수행.
- 조심스럽게 에탄올을 부어 3 분 거품을 제거하기 위해 524 XG에 인산 완충 식염수 (PBS) (비계 당 2 ㎖) 및 원심 분리기로 교체합니다. 냉장고에 보관하고 1 ~ 2 시간의 간격으로 PBS를 몇 번 변경합니다.
- 콜라겐 유형, 콜라겐 타입 1 원액을 포함하는 다른 50 ML의 원심 분리기 튜브 (비계 당 1 ㎖) 준비 3 분 동안 524 XG에 주걱, 원심 분리기를 사용하여이 튜브에 소독 발판을 전송 발판을 나는 코팅. 30 분 동안 궤도 통에 400 rpm에서 공사장 공중 발판을 흔들어하고 냉장고에 튜브를 유지또는 밤새.
- PBS를 흡입 한 다음 신선한 PBS의 발판을 잠수에 의해 두 번 사용하기 전에 PBS로 발판을 씻으십시오.
주 : NHS의 화학 결합 (도 2)을 형성하는 아민기를 필요로하기 때문에 다른 ECM 단백질 대신 콜라겐 I 형으로 사용될 수있다.
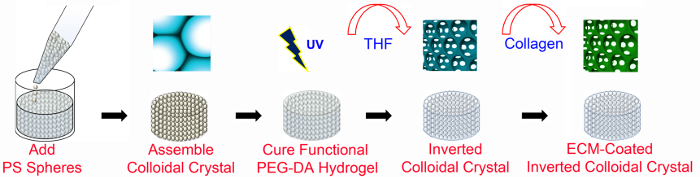
ICC 제조 1. 개요도. PEG 기반 ICC의 발판 함께하고 ECM-작용하지 않고 미세 가공 기술을 사용하여 제조된다. ECM 코팅 ICC의 발판은 PEG-NHS뿐만 아니라 PEGDA (그림 2에 설명 된대로)가 필요합니다. 추신 격자 6 mm의 직경과 8-13 비드 층의 높이를 갖는다. PS, 폴리스티렌; PEGDA, 폴리 (에틸렌 글리콜) 디 아크릴 레이트; UV, 자외선; THF, 테트라 하이드로 푸란; ECM, 세포 외 기질. 이 그림은 수정 및 Wi에서 허가를 받아 사용되었습니다목초지 (47). 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
2. ICC 구조 특성
- , 또는 공액 단백질없이 ICC 구조 분석 주사 전자 현미경 (SEM) (47)를 사용한다.
- 4 % 파라 포름 알데히드 (PFA)와 비계 해결 직렬 25, 50, 75, 95, 100 % 에탄올 솔루션을 탈수하고, 에탄올이 완전히 증발 될 때까지 -80 ℃에서 보관.
- 48 시간 동안 동결 건조기에서 건조 샘플.
- 스퍼터 코팅기에 탄소 테이프와 장소를 사용하여 샘플 홀더 상에 샘플을 부착합니다.
- 자동 진공 청소기로 청소 한 후, 20mA에서 60 초 동안 스퍼터링 10 나노 미터 두께의 Pt 막 코트를.
- 5 kV의 (도 3a,도 4a)의 전압을 사용하여 SEM 이미지 ICC 지지체.
- 기공을 측정하고공동 배선 직경은 이미지 분석 소프트웨어 (48) (도 3B, C 예 ImageJ에)을 이용하여 SEM 현미경 사진을 분석한다.
- 세포가없는 지지체에 접합 된 콜라겐, 형광 태그를 시각화하는 항체 (1 : 100)를 이용하여 콜라겐 공 초점 레이저 주사 현미경 (47)과 콜라겐 타입 I 화상에 대해 (CLSM을,도 4b).
3. 허 - 7.5 세포 배양 및 시드
- 10 ㎖ 둘 베코 변형 이글 배지에 10 % 소 태아 혈청 (FBS)으로 보충 (DMEM), 100 U / mL를 100mm 세포 배양 접시에서 2-2.5 × 106 세포 / ml의 접종 밀도로 배양 응 7.5 세포 BSC에 37 ° C에서 페니실린 - 스트렙토 마이신 (성장 미디어), 5 % CO 2. 변경 미디어 3 일마다 그들은 75-80%의 포화 상태에 도달 할 때까지.
- BSC에 세포의 파종을위한 발판을 준비합니다.
- 조심스럽게 scaff를 배치평면과 24 웰 플레이트에 어린이가 위를 향.
- 각 웰 발판을 포함하여 비계, 피펫 2 ml의 PBS를 세척합니다. PBS를 피펫 2ml를 각 웰에 신선한 PBS를 대기음.
- PBS를 성장 미디어 피펫 2 ml에 기음 (단계 3.1 참조), 30 분 동안 둡니다. 미디어를 기음과 비계가 1 시간 동안 건조 할 수 있습니다.
- 트립신 소화 방법을 사용하여 BSC의 문화 판에서 (3.1 단계)에서 합류 허 - 7.5 세포를 분리합니다.
- 접시에서 대기음 매체는 부착 세포를 씻어 4 ml의 PBS를 추가 한 후 PBS를 대기음.
- 피펫 37 ° C에서 인큐베이터에 0.75-1 ml의 0.25 % 트립신과 장소, 5 %의 3 분 CO 2.
- 트립신의 반응을 정지 인큐베이터와 피펫에서 5 ml의 미디어를 플레이트를 제거합니다. 15 ML 튜브에 피펫 미디어, 분리 된 세포 및 트립신 혼합물.
- 3 분 동안 524 XG에 원심 분리기, 뜨는을 제거하고 5 ml의 미디어 펠렛을 재현 탁.
- 혈구를 사용하여 세포를 세어 25 μL 당 대상 번호, N 0 세포를 포함하는 세포 현탁액의 양을 계산한다 (표준 실험을 위해, N 0는 1 × 10 6 세포이다).
세포 현탁액 부피 = (셀의 목표 개수) / (세포 현탁액의 농도) - 천천히 직접 (단계 3.1.4에서) 각 지지체 위에 세포 현탁액 (포함 N 0 세포)의 25 μl를 피펫. 인큐베이터에서 24 웰 플레이트를 놓습니다.
- 12 시간 후, 각 웰에 새로운 24 웰 플레이트 피펫에 주걱의 사용으로주의 깊게 미디어 2 ㎖을 발판을 전송합니다. 인큐베이터에서 24 웰 플레이트를 놓습니다.
- 3 일마다 미디어를 변경하거나 미디어는 단백질 분비 분석 (단계 5.1 참조)를 수집하는 경우에 따라 다릅니다.
4. 세포 생존
- 질적으로 세포 생존율을 분석하기 위해, C를 사용하여 세포와 이미지를 얼룩 형광 라이브 / 죽은 염색 키트를 사용하여LSM.
- 키트 지시에 따라, 4 μM의 칼 세인의 AM 8 μM 티듐 호모 다이머 -1 매체로하는 용액을 제조한다 (단계 3.1.3 참조).
참고 : 셀 수에 따라 최적화 할 수 있습니다. 세포 증식 및 (2 백만 정도) 수의 두 경우 시약의 두 배를 사용합니다. - BSC에에서 잘 발판 (단계 3.7) 및 피펫 제조 된 용액 500 μL와 각각 흡인 미디어. 1 시간 동안 37 ° C를 인큐베이터에서 샘플을 품어.
- 인큐베이터에서 접시를 제거 할 때 빛으로부터 샘플을 보호하기 위해 호일로 접시를 커버. CLSM49를 사용하여 이미지 샘플.
- 키트 지시에 따라, 4 μM의 칼 세인의 AM 8 μM 티듐 호모 다이머 -1 매체로하는 용액을 제조한다 (단계 3.1.3 참조).
- 정량적 (생균에서) 효소 활성을 측정하는 비색 분석법 (50)를 사용하여 세포 생존율을 평가하기 위해 (즉, 2- (2- 메 톡시 -4- 니트로 페닐) -3- (4- 니트로 페닐) -5- (2,4- 디 술포) -2H-테트라 졸륨 (모노 나트륨 소금 시약)).
- 국제 형사 재판소 플랫폼을위한 표준 곡선 (흡광도 (OD) V의 즉, 그래프 작성ersus) 휴대폰 번호 부여.
참고 : 세포 골격의 공동 통과 할 수 있기 때문에 셀 시드가, 다른 플랫폼에 비해 100 % 효율적이다.- 표준 곡선을 만들기 위해 사용되는 세포 시딩 번호, N 0을 결정한다.
참고 : 실험 추정되는 세포 수를 포함하는 범위를 선택합니다. 예를 들어, 초기 셀 수가 5 × 105 세포이고, 2.5 × 105, 5 × 105, 1 × 6, 2 개 선택 실험 마지막 날에 의해 약 2 ~ 3 배의 증가가 있으면 N 0과 같은 10 6 세포. - 단계 3.1-3.6에 설명 된대로 ICC의 비계 (25 μL의 시딩 볼륨 발판 당 하나의 N 0)에서 셀 시드를 수행합니다.
- 6 시간 후, 잘 다른 24 웰 플레이트에 발판을 전송합니다. 세포 부착을 허용하지만 확산 셀하지 않는 시간을 선택합니다.
- 전송 된 ICC 지지체에 세포 계산을 수행합니다.
- 발판으로 각 웰에 BSC와 피펫 500 μl의 1 배 MSR 솔루션에서 미디어 배로 10 배 모노 나트륨 소금 시약 (MSR) 솔루션을 희석. 1 시간 동안 37 ° C에서 24 웰 플레이트를 인큐베이션.
- 각 웰에서 웰 96 웰 플레이트에 100 μL 옮긴다. 빈, 피펫 96 웰 플레이트에 다른 우물에 신선한 1X 모노 나트륨 소금 시약 용액 100 ㎕로. 수동 광으로부터 보호하기 위해 호일의 96- 웰 플레이트 기포 드라이 피펫 팁을 이용하여 제거하고 커버 선물합니다.
- λ = 450 nm에서 측정 OD는 분광 광도계를 사용하여 읽기. 정확한 OD (51)를 찾기 위해 다른 값에서 빈 OD를 뺍니다.
- 혈구를 사용하여 지지체 (단계 4.2.1.3)을 전사 한 후 웰에 남아있는 세포의 수 (N의 L)를 계산.
참고 : 세포를 Trypsinize하는 트립신의 300 μl를 사용합니다. - 실제 세포 수, n은을 계산합니다.
실제 =초기는 - 잘 남아
N A = N 0 -N L - 대 실제 세포 수 (N A) 단계 4.2.1.4.3에서 얻은 OD를 플롯하여 표준 곡선을 확인하고 실험에서 세포 수를 추정 할 때 사용합니다.
주 : ICC 매개 변수 (즉, 기공 크기, 발판의 치수, ECM 단백질 등)이 변경되면 새로운 표준 곡선을 확인합니다.
- 표준 곡선을 만들기 위해 사용되는 세포 시딩 번호, N 0을 결정한다.
- 국제 형사 재판소 플랫폼을위한 표준 곡선 (흡광도 (OD) V의 즉, 그래프 작성ersus) 휴대폰 번호 부여.
5. 세포의 기능
- 효소에 의해 (단계 3.7)에서 수집 된 미디어에서 허 - 7.5 세포 (즉, 알부민, 요소)에 의해 단백질 분비 분석은 면역 분석법 (ELISA) (52)을 연결.
주 : 미디어 희석 시드 셀의 개수와 수집 매체의 양에 따라. 항체 예비 피복 된 웰에 도입되기 전에, 비 25 : 5 × 105 세포로 시딩 ICC를 들어, ~ 1를 사용한다. - 질적으로 세포 기능을 분석하기 위해, 특정 세포 내 단백질 발현 사이(즉, 알부민), 효소 (즉, CYP450), 얼룩 구조 구성 요소 (즉, 세포의 액틴)뿐만 아니라 핵 및 CLSM 49 사용 이미지입니다.
- 피펫 2 ml의 PBS (단계 3.7)에서 대기음 매체는 셀 - 라덴 ICC의 발판을 씻어.
- 피펫 한 4 % PFA ml의 고정을 실온에서 5 분 동안 배양한다.
- 2 ml의 PBS로 세척 배.
- 30 분 동안 0.1 % 4- (1,1,3,3- 테트라 메틸 부틸) 페닐 - 폴리에틸렌 글리콜 (계면 활성제)의 1 ml의 골격을 배양하여 막을 Permeabilize 하시려면.
- 2 씻을 배는 PBS는 누출 단백질을 제거 ml가.
- 피펫 500 ㎕의 1 % 소 혈청 알부민 (BSA)과 비특이적 결합을 차단하기 위해 1 시간 동안 RT에서 배양한다.
- 희석 차 항체 (즉, 알부민, CYP450) 솔루션을 준비합니다.
- 피펫 (500) 15 ㎖의 튜브에 1 % BSA 용액 μL와 총 5 ml를 0.1 %의 BSA 용액을 제조 4.5 mL의 0.1 % 계면 활성제 용액을 추가한다.
- 피펫 200 μL의 마이크로 원심 튜브에 0.1 % BSA 용액 98 μL와 1:50 생산할 차 항체 2 μL (차 항체를 0.1 %의 BSA) 차 항체 용액.
- 피펫 (40) 발판의 기본 항체 솔루션의 μL 및 파라핀 필름 기판을 커버한다. 알루미늄 호일로 24 웰 플레이트를 감싸고 밤새 4 ° C에서 접시를 저장합니다.
- 2 ml의 PBS로 세척 배 세척 사이에 부드럽게 판을 흔들어.
- 희석 바이오틴 차 항체 (즉, 안티 - 마우스 항체) 주식 솔루션을 준비합니다.
- (100) (차 항체 : 0.1 % BSA) 이차 항체 용액 198 ㎕를 피펫 0.1 % BSA 용액 2 ㎕의 제 1 항체를 생성한다.
- 0.1 %의 BSA 용액 중 로다 민 또는 형광 표지 팔로이 딘 (셀룰러 액틴 필라멘트 얼룩)의 0.1 % 스톡 용액을 준비한다.
- 피펫 용액 각 25 μL를 튜브와 혼합 승엘.
- 피펫 발판에있는 이차 항체 원액의 50 μL. 파라핀 필름 발판을 덮고 2 시간 동안 실온에서 알루미늄 호일 및 저장과 요리를 포장.
- 2 ml의 PBS로 세척 배.
- 피펫 0.2 % 4'-6-diamidino-2-페닐 인돌 200 μL (DAPI, 핵 얼룩) 발판에 솔루션 2-3 분 동안 실온에서 보관하십시오. 알루미늄 호일로 접시를 커버.
- 2 ml의 PBS로 세척 배.
- 점 적기를 사용하여 기판 상에 실장 미디어 방울을 놓는다.
- 조심스럽게 CLSM 47를 사용하여 유리 슬라이드 및 이미지에 발판을 넣어.
- 실시간 중합 효소 연쇄 반응 (qPCR의)에 의한 유전자 발현을 평가한다. 역전사 PCR (RT-PCR) (53)와 제조업체의 지침에 따라 qPCR에 (54)에 대한 표준 키트를 사용합니다. 아래에 설명 된대로 세포에서 RNA를 추출합니다.
- 1.5 ML의 microcentrifuge 관에서 (단계 3.7에서) 발판을 놓으십시오.
- 튜브로의 RNA 추출 용액을 피펫 1 mL 및 실온에서 5 분간 초음파 처리에 유의하십시오.
- 각각의 microcentrifuge 튜브에 클로로포름 200 μl를 피펫과 15 ~ 20 초 동안 손에 적극적으로 튜브를 흔들. 위상이 분리 될 때까지 2 ~ 3 분 동안 실온에서 튜브를 유지합니다.
- 13,000 XG, 15 분 동안 4 ° C에서 샘플을 원심 분리기와 위상이 혼합되지 않도록 조심스럽게 튜브를 제거합니다.
- 조심스럽게 초 미세 원심 관에 제 1 튜브의 상부 수성상의 500-600 μL 피펫.
- 이 두 번째 튜브에 이소프로판올의 동등한 볼륨 (500-600 μl를) 추가합니다.
- 튜브를 3-5 회 전환하고 10 분 동안 RT에서 서 튜브를 떠난다.
- 13,000 XG, 15 분 동안 4 ° C에서 샘플을 원심 분리기.
- 펠렛을 5 분 동안 다시 튜브, 원심 분리기의 하단에 표시되지 않는 경우.
주 : 여전히 가시적 펠릿이 없으면 RNA의 양이 불충분 할 수있다.
- 펠렛을 5 분 동안 다시 튜브, 원심 분리기의 하단에 표시되지 않는 경우.
- 나는튜브에 DEPC 물에 희석하여 1 ml의 70 % 에탄올에 뜨는 및 피펫을 폐기 열린 모자와 nvert 튜브.
- 펠렛은 튜브의 벽에서 분리 약간 튜브를 와동 후 튜브 공기 건조를 할 수 있습니다.
- 펠렛을 재현 탁하는 DPEC 물 50 μl를 추가합니다.
- 펠릿 용해 될 때까지 피펫을 유지합니다.
- 단일 가닥 RNA에 이중 가닥 RNA를 변성하기 위해 55 ° C에서 10 분 동안 유지.
- 가볍게 튜브 간단히 원심 분리 한 다음 (7,500 XG, 4 분, 4 ° C)를 튜브 바닥에 손가락을 드럼합니다.
- 56에서 설명한대로 역전사 효소 (55) 및 실시간 PCR을 수행 할 때까지 얼음 튜브를 유지한다.
Access restricted. Please log in or start a trial to view this content.
결과
국제 형사 재판소 지지체의 구조 특성 및 간세포를 배양의 각 ICC의 발판 조건의 효능의 비교에 대한 대표적인 결과가 표시하고 아래에 설명되어 있습니다. 이러한 결과에서 사용 ICC 골격 조건은 0 μg의 / ㎖ (맨발), 20 ㎍ / ㎖ (콜라겐 20), 200 ㎍ / ㎖ (콜라겐 200) 및 400 ㎍ / ㎖ (400 콜라겐) 및 초기의 콜라겐 코팅되어 허-7.5 셀 시드 수는 1 × 6입니다.
Access restricted. Please log in or start a trial to view this content.
토론
조직 공학 발판 빠르게 모든, 재생 유지, 또는 약물, 질병을 연구, 개발, 장기 교체 응용 프로그램에 대한 조직을 복구하는 데 필요한 물리적, 생화학 적 단서, 그리고 많은 다른 57를 제공하기 위해 진화하고있다. 간 조직 공학에서 차 인간 간세포 빠르게 한 번 몸에서 격리 대사 기능, 엔지니어링 발판을위한 훌륭한 필요성을 생성하고 간 기능을 유지하기 위해 플랫폼 개발을 잃게됩니다. <...
Access restricted. Please log in or start a trial to view this content.
공개
The authors have no competing financial interests to disclose.
감사의 말
저자는 국립 연구 재단 원정대 (NRF -NRFF2011-01)과 경쟁 연구 프로그램 (NRF-CRP10-2012-07)의 지원을 인정하고 싶습니다.
Access restricted. Please log in or start a trial to view this content.
자료
| Name | Company | Catalog Number | Comments |
| 0.2 ml PCR tube | Axygen Scientific | PCR-02D-C | Boil-proof |
| Gorilla Glue | Gorilla Glue, Inc. | Depends on vendor. This was purchased from a local store. | |
| Glass slides | VWR | 631-1575 | Dimensions: 24×60 mm2 |
| Polystyrene spheres | Fisher Scientific | TSS#4314A | Diameter = 140 µm; 3x104 particles per milliliter and 1.4% size distribution |
| Ethanol | Merck | 1.00983.1011 | absolute for analysis EMSURE; Dilute to 70% with Milli-Q water |
| Ultrasonic Bath | Elma | S10H | Equiment |
| Furnace | Nabertherm | N7/H | Equipment |
| 200 µl pipette tip | Axygen Scientific | T-210-Y-R-S | |
| Rocking shaker | VWR | 444-0142 | |
| Polyethylene Glycol (PEG) | Merck | 1.09727.0100 | Mw= 4 kDa; acrylation of PEG monomers and purification of the resulting precipitate produces a PEGDA macromer with Mw = 4.6 kDa |
| Centrifuge | Beckman Coulter | 392932 | Equipment |
| Acrylate-Poly(Ethylene Glycol) - Succinimidyl Valerate | Laysan Bio | ACRL-PEG-SVA-3400-1g | Mw = 3.4 kDa |
| 2-hydroxy-4'-(2-hydroxyethoxy)-2-methylpropiophenone | Sigma Aldrich | 410896 | |
| Vortex | VWR | 58816-123 | Equipment |
| Microcentrifuge | Eppendorf | 5404 000.413 | |
| Paraffin Film | Parafilm M | #PM996 | Kept at 9" with allows intensity of 10.84 mW/cm2 |
| Bluewave 200 UV spotlight | Blaze Technology | 120008, 122300 | |
| Tetrahydrofuran (THF) | Merck | 107025 | |
| Orbital shaker | Heidolph | 543-123120-00-5 | |
| Collagen Type I | Sigma Aldrich | C3867-1VL | From rat. 1x, w/o CaCl2 & MgCl2; pH = 7.2 |
| Phosphate Buffered Saline (PBS) | Gibco | 20012-027 | 16% W/V AQ. 10 x 10 ml |
| Paraformaldehyde | VWR | 43368.9M | Equipment |
| Freezone 4.5 freeze drier | Labconco | 7750020 | Equipment |
| Sputter coater | Jeol Ltd. | JFC-1600 | Equipment |
| Scanning Electron Microscope | Jeol Ltd. | JSM 5310 | |
| Anti-mouse primary antibodies against Collagen type I | Abcam | ab6308 | |
| Anti-mouse secondary antibody conjugated with Alexa Fluor 488 | Life Technologies | A21121 | |
| Plate, Tissue Culture 24 Well, Flat Bottom (Nunclon) | Bio-Rev PTE LTD | 3820-024 | |
| Dulbecco's Modified Eagle's Medium(DMEM) 2.5 g/L Glucose w/ L-Gln | Lonza | 12-604F | |
| Fetal Bovine Serum (FBS) | Gibco | A15-151 | |
| Penicillin-Streptomycin (P/S) | Life Tchnologies | 15140-122 E | |
| 100 mm Corning non-treated culture dishes | Sigma Aldrich | CLS430591 | |
| 0.25% Trypsin-EDTA | Gibco | 25200-056 | Equipment; 37 °C, 5% Humidity |
| Forma Steri-Cycle CO2 Incubators | Thermofisher Scientific | 371 | |
| Hausser Bright-Line Phase Hemacytometer | Thermofisher Scientific | 02-671-6 | |
| Live/Dead Viability/Cytotoxicity Kit for mammalian cells | Life Technologies | L3224 | |
| CCK-8 Assay | Dojindo Laboratories | CK04-11 | Monosodium-salt reagent (MSR) |
| Infinite 200 PRO microplate reader | Tecan | ||
| Albumin Human ELISA kit | Abcam | ab108788 | |
| Triton X-100 | Bio-Rad | #1610407 | |
| Bovine Serum Albumin (BSA) | Sigma-Aldrich | A2153-50G | |
| Anti-mouse primary antibodies (against CYP3A4, albumin) | Santa Cruz Biotechnology | sc-53850; sc-271605 | |
| DAPI | Life Technologies | D3571 | |
| Alexa Fluor 555 labeled Phalloidin | Life Technologies | A34055 | |
| Trizol | Life Technologies | 15596-026 | |
| Chloroform | VWR | 22706.326 | |
| Isopropanol | Fisher Scientific | 67-63-0 | |
| DPEC water | Thermofisher Scientific | AM9916 | |
| Nanodrop 2000c Spectrophotometer | Thermofisher Scientific | ND-2000 | |
| iScript Reverse Transcription Supermix | Bio-Rad Laboratories | 1708840 | |
| SYBR select Master Mix for CFX | Life Technology | 4472937 | |
| Primers (to be chosen) | |||
| CFX96 Real-Time System, C-1000 Touch Thermal Cycler | Bio Rad Laboratories | SOFT-CFX-31-PATCH |
참고문헌
- Yamada, M., et al. Controlled formation of heterotypic hepatic micro-organoids in anisotropic hydrogel microfibers for long-term preservation of liver-specific functions. Biomaterials. 33 (33), 8304-8315 (2012).
- Abboud, G., Kaplowitz, N. Drug-induced liver injury. Drug Safety. 30 (4), 277-294 (2007).
- Cho, N. J., et al. Viral infection of human progenitor and liver-derived cells encapsulated in three-dimensional PEG-based hydrogel. Biomed Mater. 4 (1), (2009).
- Revzin, A., et al. Designing a hepatocellular microenvironment with protein microarraying and poly (ethylene glycol) photolithography. Langmuir. 20 (8), 2999-3005 (2004).
- Sato, A., Kadokura, K., Uchida, H., Tsukada, K. An in vitro hepatic zonation model with a continuous oxygen gradient in a microdevice. Biochem Bioph Res Com. 453 (4), 767-771 (2014).
- Domansky, K., et al. Perfused multiwell plate for 3D liver tissue engineering. Lab Chip. 10 (1), 51-58 (2010).
- Hegde, M., et al. Dynamic interplay of flow and collagen stabilizes primary hepatocytes culture in a microfluidic platform. Lab Chip. 14 (12), 2033-2039 (2014).
- Flaim, C. J., Chien, S., Bhatia, S. N. An extracellular matrix microarray for probing cellular differentiation. Nat methods. 2 (2), 119-125 (2005).
- Underhill, G. H., Chen, A. A., Albrecht, D. R., Bhatia, S. N. Assessment of hepatocellular function within PEG hydrogels. Biomaterials. 28 (2), 256-270 (2007).
- Dunn, J., Tompkins, R. G., Yarmush, M. L. Hepatocytes in collagen sandwich: evidence for transcriptional and translational regulation. J cell biol. 116 (4), 1043-1053 (1992).
- Dunn, J. C., Tompkins, R. G., Yarmush, M. L. Long-term in vitro function of adult hepatocytes in a collagen sandwich configuration. Biotechnol progr. 7 (3), 237-245 (1991).
- Ling, Y., et al. A cell-laden microfluidic hydrogel. Lab Chip. 7 (6), 756-762 (2007).
- Kim, M., Lee, J. Y., Jones, C. N., Revzin, A., Tae, G. Heparin-based hydrogel as a matrix for encapsulation and cultivation of primary hepatocytes. Biomaterials. 31 (13), 3596-3603 (2010).
- Kotov, N. A., et al. Inverted Colloidal Crystals as Three-Dimensional Cell Scaffolds. Langmuir. 20 (19), 7887-7892 (2004).
- Shanbhag, S., Woo Lee, J., Kotov, N. Diffusion in three-dimensionally ordered scaffolds with inverted colloidal crystal geometry. Biomaterials. 26 (27), 5581-5585 (2005).
- Lee, Y. H., Huang, J. R., Wang, Y. K., Lin, K. H. Three-dimensional fibroblast morphology on compliant substrates of controlled negative curvature. Integr Biol. 5, 1447-1455 (2013).
- da Silva, J., Lautenschlager, F., Kuo, C. H. R., Guck, J., Sivaniah, E. 3D inverted colloidal crystals in realistic cell migration assays for drug screening applications. Integr Biol. 3, 1202-1206 (2011).
- da Silva, J., Lautenschlager, F., Sivaniah, E., Guck, J. R. The cavity-to-cavity migration of leukaemic cells through 3D honey-combed hydrogels with adjustable internal dimension and stiffness. Biomaterials. 31, 2201-2208 (2010).
- Lee, J., Lilly, G. D., Doty, R. C., Podsiadlo, P., Kotov, N. A. In vitro toxicity testing of nanoparticles in 3D cell culture. Small. 5, 1213-1221 (2009).
- Lee, J., Kotov, N. A. Notch ligand presenting acellular 3D microenvironments for ex vivo human hematopoietic stem-cell culture made by layer-by-layer assembly. Small. 5, 1008-1013 (2009).
- Liu, Y., et al. Rapid aqueous photo-polymerization route to polymer and polymer-composite hydrogel 3D inverted colloidal crystal scaffolds. J Biomed Mater Res. Part A. 83, 1-9 (2007).
- Ma, P. X., Choi, J. W. Biodegradable polymer scaffolds with well-defined interconnected spherical pore network. Tissue Eng. 7, 23-33 (2001).
- Cuddihy, M. J., Kotov, N. A. Poly (lactic-co-glycolic acid) bone scaffolds with inverted colloidal crystal geometry. Tissue Eng Part A. 14, 1639-1649 (2008).
- Choi, S. W., Zhang, Y., Xia, Y. Three-dimensional scaffolds for tissue engineering: the importance of uniformity in pore size and structure. Langmuir. 26, 19001-19006 (2010).
- Choi, S. W., Zhang, Y., Thomopoulos, S., Xia, Y. In vitro mineralization by preosteoblasts in poly(DL-lactide-co-glycolide) inverse opal scaffolds reinforced with hydroxyapatite nanoparticles. Langmuir. 26, 12126-12131 (2010).
- Choi, S. W., Zhang, Y., Macewan, M. R., Xia, Y. Neovascularization in biodegradable inverse opal scaffolds with uniform and precisely controlled pore sizes. Adv Healthc Mater. 2, 145-154 (2013).
- Zhang, Y., Choi, S. W., Xia, Y. Modifying the Pores of an Inverse Opal Scaffold With Chitosan Microstructures for Truly Three-Dimensional Cell Culture. Macromol Rapid Commun. 33, 296-301 (2012).
- Cai, X., et al. Investigation of neovascularization in three-dimensional porous scaffolds in vivo by a combination of multiscale photoacoustic microscopy and optical coherence tomography. Tissue Eng. Part C, Meth. 19, 196-204 (2013).
- Zhang, Y. S., Yao, J., Wang, L. V., Xia, Y. Fabrication of Cell Patches Using Biodegradable Scaffolds with a Hexagonal Array of Interconnected Pores (SHAIPs). Polymer. 55, 445-452 (2014).
- Zhang, Y. S., Regan, K. P., Xia, Y. Controlling the Pore Sizes and Related Properties of Inverse Opal Scaffolds for Tissue Engineering Applications. Macromol Rapid Commun. 34, 485-491 (2013).
- Stachowiak, A. N., Bershteyn, A., Tzatzalos, E., Irvine, D. J. Bioactive Hydrogels with an Ordered Cellular Structure Combine Interconnected Macroporosity and Robust Mechanical Properties. Adv Mater. 17, 399-403 (2005).
- Stachowiak, A. N., Irvine, D. J. Inverse opal hydrogel-collagen composite scaffolds as a supportive microenvironment for immune cell migration. J Biomed Mater Res. Part A. 85, 815-828 (2008).
- Liu, Y., Wang, S. 3D inverted opal hydrogel scaffolds with oxygen sensing capability. Colloids and surfaces. B, Biointerfaces. 58, 8-13 (2007).
- Bryant, S. J., Cuy, J. L., Hauch, K. D., Ratner, B. D. Photo-patterning of porous hydrogels for tissue engineering. Biomaterials. 28, 2978-2986 (2007).
- Bhrany, A. D., Irvin, C. A., Fujitani, K., Liu, Z., Ratner, B. D. Evaluation of a sphere-templated polymeric scaffold as a subcutaneous implant. JAMA facial plastic surgery. 15, 29-33 (2013).
- Kuo, Y. C., Chiu, K. H. Inverted colloidal crystal scaffolds with laminin-derived peptides for neuronal differentiation of bone marrow stromal cells. Biomaterials. 32 (3), 819-831 (2011).
- Yang, J. T., Kuo, Y. C., Chiu, K. H. Peptide-modified inverted colloidal crystal scaffolds with bone marrow stromal cells in the treatment for spinal cord injury. Colloids Surf. B, Biointerfaces. 84, 198-205 (2011).
- Kuo, Y. C., Tsai, Y. T. Inverted colloidal crystal scaffolds for uniform cartilage regeneration. Biomacromolecules. 11, 731-739 (2010).
- Choi, S. W., Xie, J., Xia, Y. Chitosan-Based Inverse Opals: Three-Dimensional Scaffolds with Uniform Pore Structures for Cell Culture. Adv Mater. 21, 2997-3001 (2009).
- Long, T. J., Sprenger, C. C., Plymate, S. R., Ratner, B. D. Prostate cancer xenografts engineered from 3D precision-porous poly(2-hydroxyethyl methacrylate) hydrogels as models for tumorigenesis and dormancy escape. Biomaterials. 35, 8164-8174 (2014).
- Kuo, Y. C., Tsai, Y. T. Inverted colloidal crystal scaffolds for uniform cartilage regeneration. Biomacromolecules. 11, 731-739 (2010).
- Kuo, Y. C., Chiu, K. H. Inverted colloidal crystal scaffolds with laminin-derived peptides for neuronal differentiation of bone marrow stromal cells. Biomaterials. 32, 819-831 (2011).
- Lee, J., Cuddihy, M. J., Cater, G. M., Kotov, N. A. Engineering liver tissue spheroids with inverted colloidal crystal scaffolds. Biomaterials. 30 (27), 4687-4694 (2009).
- Galperin, A., et al. Integrated bi-layered scaffold for osteochondral tissue engineering. Adv Healthc Mater. 2, 872-883 (2013).
- Waters, D. J., et al. Morphology of Photopolymerized End-linked Poly(ethylene glycol) Hydrogels by Small Angle X-ray Scattering. Macromolecules. 43 (16), 6861-6870 (2010).
- Elbert, D. L., Hubbell, J. A. Conjugate addition reactions combined with free-radical cross-linking for the design of materials for tissue engineering. Biomacromolecules. 2 (2), 430-441 (2001).
- Kim, M. H., et al. Biofunctionalized Hydrogel Microscaffolds Promote Three-Dimensional Hepatic Sheet Morphology. Macromol Biosci. , (2015).
- Ferreira, T., Rasband, W. ImageJ User Guide. , http://imagej.nih.gov/ij/docs/guide/146-30.html#toc-Subsection-30.1 (2012).
- JoVE Science Education Database. General Laboratory Techniques. Introduction to Fluorescence Microscopy. , JoVE. Cambridge, MA. (2015).
- Tominaga, H., et al. A water-soluble tetrazolium salt useful for colorimetric cell viability assay. Anal Commun. 36 (2), 47-50 (1999).
- JoVE Science Education Database. General Laboratory Techniques. Introduction to the Microplate Reader. , JoVE. Cambridge, MA. (2015).
- JoVE Science Education Database. Basic Methods in Cellular and Molecular Biology. The ELISA Method. , JoVE. Cambridge, MA. (2015).
- Nolan, T., Hands, R. E., Bustin, S. A. Quantification of mRNA using real-time RT-PCR. Nat Protoc. 1, 1559-1582 (2006).
- JoVE Science Education Database. Essentials of Environmental Microbiology. RNA Analysis of Environmental Samples Using RT-PCR. , JoVE. Cambridge, MA. (2016).
- JoVE Science Education. Essentials of Environmental Microbiology. , JoVE. (2015).
- Jeong, S., et al. The evolution of gene regulation underlies a morphological difference between two Drosophila sister species. Cell. 132 (5), 783-793 (2008).
- Griffith, L. G., Naughton, G. Tissue engineering--current challenges and expanding opportunities. Science. 295 (5557), 1009-1014 (2002).
- Hegde, M., et al. Dynamic Interplay of Flow and Collagen Stabilizes Primary Hepatocytes Culture in a Microfluidic Platform. Lab Chip. 14, 2033-2039 (2014).
- Kim, Y., Lasher, C. D., Milford, L. M., Murali, T., Rajagopalan, P. A comparative study of genome-wide transcriptional profiles of primary hepatocytes in collagen sandwich and monolayer cultures. Tissue Eng Pt C. 16 (6), 1449-1460 (2010).
- Baimakhanov, Z., et al. Efficacy of multi-layered hepatocyte sheet transplantation for radiation-induced liver damage and partial hepatectomy in a rat model. Cell Transplant. , (2015).
- Li, C. Y., et al. Micropatterned Cell-Cell Interactions Enable Functional Encapsulation of Primary Hepatocytes in Hydrogel Microtissues. Tissue Eng Pt A. 20 (15-16), 2200-2212 (2014).
- Shlomai, A., et al. Modeling host interactions with hepatitis B virus using primary and induced pluripotent stem cell-derived hepatocellular systems. P Natl A Sci USA. 111 (33), 12193-12198 (2014).
- Curcio, E., et al. Mass transfer and metabolic reactions in hepatocyte spheroids cultured in rotating wall gas-permeable membrane system. Biomaterials. 28, 5487-5497 (2007).
- Martinez-Hernandez, A., Amenta, P. The hepatic extracellular matrix. Vichows Archiv A Pathol Anat. 423, 1-11 (1993).
- Liu, Y., Wang, S., Lee, J. W., Kotov, N. A. A Floating Self-Assembly Route to Colloidal Crystal Templates for 3D Cell Scaffolds. Chem Mater. 17 (20), 4918-4924 (2005).
Access restricted. Please log in or start a trial to view this content.
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기더 많은 기사 탐색
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유