Bu içeriği görüntülemek için JoVE aboneliği gereklidir. Oturum açın veya ücretsiz deneme sürümünü başlatın.
Method Article
Ters Kolloidal Kristal Poli (etilen glikol) İskele imalatı: Karaciğer Doku Mühendisliği için Üç boyutlu Hücre Kültürü Platformu
Bu Makalede
Özet
This manuscript presents a detailed protocol for the fabrication of an emerging three-dimensional hepatocyte culture platform, the inverted colloidal crystal scaffold, and the concomitant techniques to assess hepatocyte behavior. The size-controllable pores, interconnectivity and ability to conjugate extracellular matrix proteins to the poly(ethylene glycol) (PEG) scaffold enhance Huh-7.5 cell performance.
Özet
, Ksenobiyotiklerin 'sitotoksisite testi virüs enfeksiyonu okuyan ve karaciğer hedefleyen ilaçların geliştirilmesi amacıyla, in vitro hepatosit fonksiyonunu korumak için yeteneği, hücreler uygun biyokimyasal ve mekanik ipuçları aldığınız bir platform gerektirir. Son karaciğer doku mühendisliği sistemleri, yüksek su tutma ve hücreler tarafından ihtiyaç duyulan mekanik uyarıcılara sağlamak için kendi özellikleri göz önüne alındığında, sentetik ya da doğal hidrojeller oluşan üç boyutlu (3D) iskeleleri kullanmışlardır. ters koloidal kristal (ICC) iskele artan bir ilgi olmuştur, yüksek uzaysal organizasyon, homotipik ve heterotypic hücre etkileşimi yanı sıra hücre dışı matriks (ECM) etkileşimi sağlayan bir son gelişme. Burada, poli (etilen glikol) diakrilat (PEGDA) ve partikül ayrıştırma yöntemi kullanılarak ICC iskele imal etmek için bir protokol açıklar. Kısaca, bir örgü mikrosfer parçacıklarından yapıldığı bir ön polimer daha sonraR solüsyonu doğru polimerize ilave edilir ve tanecikler daha sonra organik bir çözücü (ör tetrahidrofuran) kullanılarak kaldırılır veya yıkanarak ekstre edilir. Kontrollü gözenek boyutları ve ortam daha kolay hücrelere ulaşmasına izin interconnectivities ile çok gözenekli iskele kafes sonuçlarının çözünme. Bu benzersiz yapı hücreleri hem de kolay gözenekler arasındaki iletişim ve proteinlerle PEGDA ICC skafold, hücre performansı üzerinde belirgin bir etki gösterir kat yeteneği yapışması için yüksek bir yüzey alanı sağlar. Biz canlılığı açısından iskele morfolojisi yanı sıra hepatokarsinom hücre (Huh-7.5) davranış analiz ve ICC yapısı ve ECM kaplamaların etkisini araştırmak için çalışır. Genel olarak, bu kağıt doku mühendisliği geniş bir uygulama, özellikle karaciğer doku mühendisliği sahip gelişmekte olan bir iskele ayrıntılı bir protokol sağlar.
Giriş
Karaciğer kan detoksifikasyon, ksenobiyotiklerin metabolizması ve serum proteinlerinin üretimi dahil fonksiyonları çok sayıda, bir çok kanlanan bir organdır. Karaciğer dokusu birden fazla hücre tipleri, safra kanalcıklarının, sinüzoidler ve farklı biyomatris kompozisyon ve farklı oksijen konsantrasyonlarına bölgelerinin içeren karmaşık bir üç boyutlu (3D) mikro-yapıya sahiptir. Bu ayrıntılı yapısı göz önüne alındığında, in vitro 1 uygun bir karaciğer model oluşturmak için zor olmuştur. Ancak, in vitro modellerde fonksiyonel test ilaç toksisitesi 2 platformları gibi insan hepatositleri barındırma ve karaciğer 3 ile ilişkili hastalıkların araştırılması için yükselen bir talep var.
Güncel karaciğer doku mühendisliği platformları zona, biyokimyasal bileşimi bir izole veya karaciğer parametreleri, bir kaç hücrelerinin 4 yani ko-kültür odaklanarak karaciğer karmaşıklığını basitleştirilmiş varl microenvironments 5, akış dinamikleri 6,7 ve biyolojik matris 8 yapılandırma. biyolojik matris konfigürasyonu, iskele malzemeler, hücre dışı matris (ECM) proteinlerin bileşimin, bir matris sertlik ve skafoldun tasarım ve yapı gibi parametreler ayrılabilir. Ayarlamak hidrojelin mekanik özellikler, biyo ve bozulma oranı yeteneği göz önüne alındığında, sentetik hidrojeller, özellikle poli (etilen glikol) (PEG) 9 hidrojeller ile doku mühendisliği çalışmaları bir artış olmuştur. Karaciğer ile ilişkili araştırma ile ilgili, biyouyumlu hidrojel karaciğer hastalığı 3 virüs enfeksiyonu çalışması için uygulanmıştır. Hepatosit platformu tasarım olarak, çok sayıda çalışma in vivo mikroçevresinin taklit etmek için gerekli olan 3D çevre ve hücre-ECM ve hücre-hücre etkileşim sağlamak için bir hidrojel 12,13 içindeki hepatosit sandviç kültürü 10,11 ve hücre kapsülleme kullanmışlardır. However, bu platformlar iskele 14 ile düzgün olmayan özellikleri lider, kontrol ve mekansal organizasyon yüksek derecede sahip değillerdir.
Ters kristal kolloidal (ICC) 14 iskelesi ilk 2000'lerin başında tanıtılan hücre kültürü için son derece organize 3D iskele olduğunu. skafold eşsiz yapısı kolloidal kristal, değişken çap koloidal parçacıkları sıralı kafes kullanarak basit imalat sürecine bağlı olabilir. Kısaca, süreç özetlemek, parçacıklar özenle düzenlenmiş ve bir kafes oluşturacak şekilde ısı kullanılarak tavlanır. Yüksek yüzey alanına sahip, altıgen şeklinde yerleştirilmiş küresel oyuk 15 bir polimerleştirilmiş hidrojel sonuçlarında bir organik çözücü, bu kafesin ayrıştırma,. Bu çok düzenli skafold, daha önce (akrilamid) 16-21, poli (laktik-ko-glikolik asit), poli 15,22-30 sınırlı, sentetik ve doğal malzemeler hem de yapılan da dahil olmak üzere, ancak edilmiştir, Poli (etilen glikol) 31,32, poli (2-hidroksietil metakrilat) 21,33-35 ve çitosan 36-39. Olmayan kirlenme malzemelerden yapılmış ICC iskeleleri boşlukların 14,23,40 içinde hücresel parçacıklarının teşvik etmek eğilimindedir. Çok sayıda hücre türleri başarıyla hücrelerin 43,44, prolifere Bu yapılandırma içinde ayırt ve işlevi, kondrositler 41, kemik iliği stromal hücreleri 42 de dahil olmak üzere, ve sap gösterilmiştir. Hepatosit ile ilgili olarak, çalışmalar, ICC Na 2 SiO 3 ve poli (akrilamid) imal iskeleler, ancak PEG ile gerçekleştirilmiştir. Basit bir bioconjugation stratejileriyle (örneğin, EDC / NHS ile amin birleştirme), ECM proteinleri konjuge edilmiş PEG-bazlı iskeleleri ortamı gibi in vivo olarak daha büyük olabilir ve hepatik fonksiyonu geliştirmek için daha fazla hücre bağlama sitesi ispat ki, imal edilebilir.
Bu yazıda ve ilgili videoda, detay ICC iskele yapımını biz(Huh-7.5), kültür hepatokarsinoma için optimize edilmiş poli (etilen glikol) diakrilat (PEGDA) hidrojel ve bir polistiren mikro-küre kafes kullanılarak. Bu iskele topoloji ve hücre performansı açısından, genel olarak yapışkan olmayan çıplak PEGDA ICC iskeleler ve kolajen kaplı PEGDA ICC iskele arasındaki farkları gösterir. Hücre canlılığı ve fonksiyonu Huh-7.5 hücre davranışını değerlendirmek için kalitatif ve kantitatif olarak ölçülür.
Access restricted. Please log in or start a trial to view this content.
Protokol
1. ICC İskele İmalatı (Şekil 1)
- polistiren (PS) menfezler (; boncuk 8-13 katmanları çapı = 6 mm) hazırlayın.
- 40 ul seviyesinde 0.2 ml kaynatın geçirmez mikrosantrifüj tüpler ipuçları kesti, kalıp hazırlamak. Su geçirmez yapıştırıcı ile 24 x 60 mm 2 mikroskop cam kapak fişleri kesme tüplerin üst uyun.
- dikkatle 20 ml'lik bir şişe bir su süspansiyonu içinde bulunan PS küreleri (çap = 140 mm) konulan su süspansiyonu üzerinden pipet ve şişe içine 18 ml% 70 etanol çözeltisi ilave edilir. toplu küreler gevşetmek için ultrasonik banyoya küre çözümü koyun. Tamamen Su ve suda çözünür bileşenleri çıkarmak için bu yıkama aşamasından birkaç kez tekrarlayın.
- kalıplar içine etanol içinde 100 ul pipet.
- 4 mm 200 ul mikropipet ucu üst kesti. iki kez elde etmek için 200 ul mikropipet kullanılarak kalıba kürelerin pipetle 25 ulHer bir kalıp içinde 50 ul toplam hacim.
- 120 rpm gecede bir sallanan çalkalayıcı üzerinde kalıpları yerleştirin.
- bir optik mikroskop altında, her kalıpta kürelerin düzenleme kontrol edin. Küreler altıgen sipariş ise,% 70 etanol içinde 50 ul ve düzenleme düzeltmek için uzunlamasına ve yanal ekseni yönünde elle çalkalanır.
- İki gece boyunca oda sıcaklığında (RT) etanol buharlaşması olsun. PS boncuk tavlanmasına 6 saat süreyle 130 ° C fırın içinde kalıp ve boncuk kompleksi yerleştirin.
- çıplak ve ECM-kaplı PEGDA iskeleleri hazırlanması.
- (= 4.6 kDa w M) doğrusal PEG makromerleri acrylating kurulan protokolleri 45,46 kullanarak PEGDA makromerleri sentez.
- iyonu giderilmiş (Di) su içinde PEGDA çözeltisi (ağ / hac)% 50 hazırlamak ve makromer doğru tamamen eriyene kadar 4713 x g'de santrifüj çözünmesi için izin verir.
- ECM konjuge ICC İskele, ek çözülür% 10 50,% PEGDA çözeltisi akriloil-PEG-NHS (M 3.4 W = kDa) (a / h).
- % 20 Hazırlama, 2-hidroksi-4 stok çözeltisi (w / v) - (2-hidroksietoksi) -2-methylpropiophenone (PI),% 70 etanol içinde.
- % 20,% 50 1 ml (ağırlık / hacim), PI stok çözeltisi 50 ul ekle (a / h) PEGDA arasında. PEGDA molekül ağırlığına göre PI stok çözeltisi gerekli miktarını ayarlayın.
- 1 dakika vorteksleyin santrifüj tüpüne karışım, homojen bir çözelti ulaşmak için.
- Peel (aşama 1.1.7 itibaren) cam slayt kalıpları, kalıplardan tutkal kaldırmak dikkatlice bir spatula kullanarak kafesler dışarı itmek ve bir 1.5 ml tüp içine her biri yerleştirin. 5 dakika boyunca 845 xg'de PEGDA çözeltisi ve santrifüj Pipet 300 ul kafes içerisine düzgün PEGDA çözeltisi filtre edilmesi.
- cımbız kullanarak tüp kafes çıkarın ve dikkatlice eldiven kuru aşırı PEGDA çözüm kurulayın. Düz CIR ile parafin film kaplı cam üzerinde kafes yerleştirinyukarı bakacak vasküler yüzey.
- UV nokta lamba kullanılarak 5 dakika boyunca 365 nm ultraviyole (UV) ışık (10.84 mW / cm2) için PEGDA çözüm sızmış iskele Açığa.
- Yeni şişelerde PEGDA polimerize kristal kafeslerindeki yerleştirin ve 20 ml tetrahidrofuran ilave (THF) (10 vial başına kafeslerin civarında). 300 rpm'de bir orbital çalkalayıcı üzerinde şişeleri çalkalanır. 1-2 saatlik bir aralık ile, THF, en azından 3 kez değiştirin.
Not: sırayla PS eksik kaldırılmasını neden olabilir iskeleleri, girmesini kabarcıklarını önlemek amacıyla THF değiştirirken tamamen THF çıkarmayın. menfezler kapak ve yeni THF eklemek için yeterli bir çözüm bırakın.
Dikkat: THF toksiktir. eldiven, laboratuvar önlüğü ve gözlük takın. davlumbaz altında çalıştırarak solumaktan kaçının. - PS küreler kullanılan THF içine su koyarak ve çözüm rengi gözlemleyerek çözülür olup olmadığını kontrol edin. PS küreler düzgün çözülmüş değilse adımı tekrarlayın 1.2.9.
Not: Çözelti rengi değişecektirbeyaz kalan PS küreler varsa.
- Biyogüvenlik kabini (BSC) iskeleleri temizleyin.
- iskeleler sterilize etmek için, iskele ortalama% 70, 2 ml etanol ile 50 ml santrifüj tüpüne hazırlama ve bir ıspatula kullanılarak tüp içinde iskeleleri yerleştirin. iskeleleri 1 saat etanol içinde bekletin. ileri bu adımı, BSC tüm işlemleri yürütmek.
- Dikkatlice etanol dökmek ve 3 dak kabarcıklarını çıkarmak için 524 x g'de fosfat tamponlu salin (PBS) (iskele başına 2 mi) ve santrifüj ile değiştirin. buzdolabında tutun ve 1-2 saat ara ile PBS birkaç kez değiştirin.
- Kollajen türü için, kolajen tip 1 stok çözeltisi ihtiva eden başka bir 50 ml santrifüj tüpüne (iskele başına 1 mi) hazırlanması 3 dakika boyunca 524 x g'de bir spatula ve santrifüj kullanılarak bu boru sterilize iskeleleri transfer iskelesi I-kaplı. 30 dakika boyunca orbital bir karıştırıcı üzerinde 400 rpm'de iskeleleri çalkalanır ve Soğutucu tüp tutmakya da bir gecede.
- PBS aspire sonra taze PBS iskeleleri daldırarak ve iki kez kullanımdan önce PBS ile iskeleleri yıkayın.
Not: NHS kimyasal bağı (Şekil 2) oluşturmak için bir amin grubu gerektirdiği için, başka bir ECM proteinleri de yerine kolajen tip I kullanılabilir.
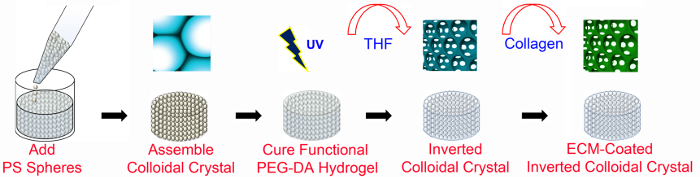
ICC imalat 1. Genel Bakış Şekil. PEG-bazlı ICC iskeleleri ile ECM-fonksiyonlandırmalar olmadan mikroüretim teknikleri kullanılarak imal edilir. ECM ile kaplanmış ICC iskeleleri, PEG-NHS ve PEGDA (Şekil 2'de ayrıntılı olarak) gerektirir. PS örgü 6 mm'lik bir çapa ve 8-13 kordon tabakaları arasında bir yüksekliğe sahiptir. PS, polistiren; PEGDA, poli (etilen glikol) diakrilat; UV morötesi; THF, tetrahidrofuran; ECM, hücre dışı matriks. Bu rakam değiştirilmiş ve Wi izni ile kullanılmaktadırley 47. Bu rakamın büyük halini görmek için lütfen buraya tıklayınız.
2. ICC Yapısı Karakterizasyonu
- , Ya da konjuge proteinler olmadan ICC yapısını analiz taramalı elektron mikroskobu (SEM) 47 kullanın.
- % 4 paraformaldehid (PFA) ile iskeleleri Fix, seri 25, 50, 75, 95 ve% 100 etanol çözümleri bunları kurutmak ve etanol tamamen buharlaşır kadar -80 ° C'de saklayın.
- 48 saat boyunca, bir dondurmalı kurutucu içinde kuru örnekler.
- Bir püskürtme kaplayıcı karbon bant ve yer kullanarak numune tutucu üzerine numuneyi yapıştırın.
- Otomatik vakumlama sonra, 20 mA 60 saniye boyunca püskürtme yoluyla 10 nm kalınlığında Pt filmi ile kapla.
- 5 kV (Şekil 3A, Şekil 4A) bir gerilimde SEM kullanarak görüntü ICC iskeleler.
- gözenek ölçmek veboşlukların arabağlantı çapı, görüntü analiz yazılımı 48 (Şekil 3B, C, örneğin ImageJ) kullanarak SEM mikrograflar analiz.
- Hücreleri olmadan iskele konjüge kolajen, floresan etiket görselleştirmek için antikorları (1: 100) kullanılarak kolajen konfokal lazer tarama mikroskobu 47 ile kollajen tip I ve görüntü karşı (CLSM, Şekil 4B).
3. Huh-7.5 Hücre Kültürü ve Tohum
- 10 mi Dulbecco Modifiye Eagle Ortamı,% 10 fetal sığır serumu (FBS) ile desteklenmiş (DMEM) ve 100 U / ml, 100 mm'lik bir hücre kültür tabaklarında 2-2.5 x 10 6 hücre / ml'lik bir tohumlama yoğunluğunda kültür Huh-7.5 hücreleri BSC 37 ° C 'de, penisilin-streptomisin (büyüme ortamı) ve% 5 CO 2. değiştirme ortamı, her üç günde bir bu% 75-80 konfluent ulaşana kadar.
- BSC hücre tohumlama için iskeleleri hazırlayın.
- Dikkatle Scaff koyundüz yüzeyli bir 24 plaka yaş yukarı bakacak.
- Her iyi bir iskele içeren için iskele, pipet 2 ml PBS yıkamak için. PBS ve pipet 2 ml her kuyuya taze PBS aspire.
- PBS ve büyüme ortamı pipetle 2 ml hacme sahip (adım 3.1) ve 30 dakika boyunca bırakın. medya aspire ve iskele 1 saat kurumasını bekleyin.
- tripsin sindirim yöntemini kullanarak BSC kültür plaka (adım 3.1) birleşen Huh-7.5 hücreleri ayırmak.
- plaka aspire medya, yapışık hücreleri yıkamak için 4 ml PBS ekleyin ve sonra PBS aspire.
- Pipet, 37 ° C'de bir kuluçka 0.75-1 mi,% 0.25 tripsin ve yeri,% 5, 3 dakika için CO2.
- tripsin reaksiyonu durdurmak için kuvöz ve pipetle 5 ml ortamı plakasını sökün. 15 ml'lik bir tüp içine pipetle ortam, ayrılan hücreler ve tripsin kanşım.
- 3 dakika boyunca 524 xg'de santrifüj, süpernatant kaldırmak ve 5 ml medya pelletini.
- Bir hemasitometre kullanarak hücreleri saymak ve 25 ul başına, hedef numarası, N 0 hücreleri içeren hücre süspansiyonu hacmini hesaplamak (standart deney için, N 0 1 x 10 6 hücre) olduğunu.
Hücre süspansiyonu hacmi = (hücreler hedef sayısı) / (hücre süspansiyonu konsantrasyonu) - Yavaş yavaş doğrudan (adım 3.1.4 itibaren) her iskele üstündeki hücre süspansiyonu içeren (N 0 hücreleri) 25 ul pipetle. inkübatör 24 oyuklu plaka koyun.
- 12 saat sonra, her bir yeni bir 24 oyuklu plaka ve pipet içine bir spatula kullanılarak dikkatli bir şekilde ortam 2 ml iskelesi aktarın. inkübatör 24 oyuklu plaka koyun.
- 3 günde ortamı değiştirmek ya da medya protein salgılanması analizi (Adım 5.1) için toplanan zaman bağlı.
4. Hücre Canlılık
- niteliksel hücre canlılığını analiz etmek, C kullanarak hücrelerin ve görüntü leke floresan canlı / ölü boyama kitleri kullanınLSM.
- Kit talimat izlenerek, 4 uM kalsein AM ve 8 uM etidyum homo-dimer-1 medya sahip bir çözelti hazırlanmıştır (adım 3.1.3).
Not: Hücre sayısına bağlı olarak optimize edin. Hücreler çoğalmaya ve (yaklaşık 2 milyon) sayısı çift ise reaktif çift miktarda kullanın. - BSC, iyi bir yapı iskeleti (aşama 3.7) ve pipet hazırlanan solüsyon 500 ul her aspire ortam. 1 saat boyunca 37 ° C kuluçka makinesi içinde inkübe edin.
- kuluçka plaka çıkarırken ışıktan örnekleri korumak için folyo tabak örtün. CLSM49 kullanarak görüntü örnekleri.
- Kit talimat izlenerek, 4 uM kalsein AM ve 8 uM etidyum homo-dimer-1 medya sahip bir çözelti hazırlanmıştır (adım 3.1.3).
- Kantitatif (canlı hücreler olarak) enzimsel aktivitesini ölçmek kolorimetrik tahlilleri 50 kullanılarak hücre sağ kalabilirliğinin değerlendirmek için (yani, 2- (2-metoksi-4-nitrofenil) -3- (4-nitrofenil) -5- (2,4-disulfofenil) -2H-tetrazolyum (monosodyum tuzu reaktifi)).
- ICC platformu için standart bir eğri (absorbans (OD) v, yani bir grafik oluşturmakErsus) hücre sayısı verilen.
Not: Hücreler iskelelerinin boşluklarında geçebilir çünkü Hücre tohumlama, diğer platformlara kıyasla% 100 etkilidir.- Standart eğri yapmak için kullanılacak hücre ekim numaraları, n, 0 belirler.
Not: Deneyde tahmin edilmektedir hücre sayıları içeren bir dizi seçin. Örneğin, ilk hücre sayısı 5 x 10 5 hücre ve 2.5 x 10 5, 5 x 10 5, 1 x 10 6, ve 2 x seçim deney son gününe kadar tahminen ~ 3 kat artış varsa N 0 olarak 10 6 hücre. - Adımlarda 3,1-3,6 açıklandığı gibi ICC iskeleleri (25 ul tohumlama hacmi iskele başına bir N 0) hücre ekim yapın.
- 6 saat sonra, iyi bir 24-çukurlu plaka iskeleleri aktarın. Hücre uyumu sağlar, ancak çoğalmasını hücre bir zamanı seçin.
- transfer ICC iskele üzerinde hücre sayımı gerçekleştirin.
- Bir iskele her kuyuya BSC ve pipet 500 ul 1x MSR çözeltisi içinde medya ile 1x 10x monosodyum tuzu ayıracı (MSR) çözümü sulandırmak. 1 saat süre ile 37 ° C'de 24 oyuklu plaka inkübe edin.
- her bir kaynaktan, bir 96-yuvalı plaka içine 100 ul aktarın. Boş, pipet 96 oyuklu bir plaka, farklı kuyu taze 1x monosodyum tuzu reaktif çözeltisi 100 ul olarak. El ile ışıktan korumak için folyo 96-plaka herhangi kabarcıklar kuru pipet kullanarak bulundular kaldırmak ve kapağı.
- λ = 450 nm ölçün OD bir spektrofotometre kullanılarak okuma. Doğru OD 51 bulmak için diğer değerlerden boş OD çıkarın.
- Hemasitometre kullanarak iskele (adım 4.2.1.3) aktardıktan sonra kuyuda kalan hücrelerin sayısını (N L) sayın.
Not: hücrelerini trypsinize için tripsin 300 ul kullanın. - Gerçek hücre sayısını, N A hesaplayın.
gerçek =İlk - iyi sol
N A = N 0 N L - Vs gerçek hücre sayısı (N A) Aşama 4.2.1.4.3 elde edilen OD çizerek standart eğri yapmak ve deneylerde hücre sayısını tahmin etmek için bu kullanın.
Not: Herhangi bir ICC parametreleri (örneğin, porojen boyutu, iskelenin boyutları, ECM protein, vs.) değiştirilirse, yeni bir standart eğri olun.
- Standart eğri yapmak için kullanılacak hücre ekim numaraları, n, 0 belirler.
- ICC platformu için standart bir eğri (absorbans (OD) v, yani bir grafik oluşturmakErsus) hücre sayısı verilen.
5. Hücre İşleyişine
- Enzim tarafından (aşama 3,7) toplanan ortamdan Huh-7.5 hücrelerinin (örneğin, albümin, üre) protein salgılanmasını analiz immünosorbent deneyi (ELISA) ile 52 bağlantılı.
Not: ortamı seyreltilir, tohumlu hücre sayısı ve toplanan ortamın miktarına bağlı olarak. Antikor-Ön kaplanmış kuyulara sunmadan önce, 25 oranını: 5 x 10 5 hücre ICC numaralı seribaşı, bir ~ 1 kullanın. - niteliksel hücre fonksiyonunu analiz etmek, belirli hücre içi proteinleri immunostain(Örneğin, albümin), enzimler (örneğin, CYP450), leke yapı bileşenleri (yani, hücre aktin) ve çekirdekler ve CLSM 49 kullanarak görüntüsü.
- ve pipet 2 ml PBS (aşama 3,7) medya aspire hücre yüklü ICC iskeleleri yıkayın.
- Pipet 1% 4 PFA ml ve sabitleme için, oda sıcaklığında 5 dakika inkübe edilir.
- 2 ml PBS ile yıkayın 3x.
- 30 dakika boyunca% 0.1 4- (1,1,3,3-tetrametilbütil) fenil-polietilen glikol (yüzey aktif madde), 1 ml iskeleleri inkübe edilerek membranlar geçirgenliği.
- 2 ile yıkayın 3x PBS herhangi sızıntı proteinleri uzaklaştırmak için ml.
- Pipet 500 ul% 1 sığır serumu albümini (BSA) ve spesifik olmayan engelleme 1 saat boyunca oda sıcaklığında inkübe edilir.
- Seyreltilmiş birincil antikor (yani, albumin, CYP450) çözeltisi hazırlayın.
- Pipet 500 15 ml tüp içine% 1 BSA çözeltisi ul toplam 5 mi% 0.1 BSA çözeltisi hazırlamak için 4.5 ml% 0.1 yüzey aktif madde çözeltisi ilave edilir.
- Pipet 200 ul mikrosantrifüj tüpü içine% 0.1 BSA çözeltisi 98 ul 1:50 üretilmesi için birincil antikor 2 ul (birincil antikor:% 0.1 BSA) içinde primer antikor çözeltisi.
- Pipet 40 iskele üzerinde birincil antikor çözüm ul ve parafin film ile alt tabakayı kapsamaktadır. Alüminyum folyo ile 24 plaka sarın ve gece boyunca 4 ° C'de çanak saklayın.
- 2 ml PBS ile yıkayın 3x ve yıkama arasında yavaşça plaka sallayın.
- Seyreltilmiş biyotinile edilmiş ikincil antikor (örneğin, anti-fare antikoru) bir stok çözelti hazırlayın.
- 100 (ikincil antikor:% 0.1 BSA) ikincil antikor çözeltisi pipetle 198 ul% 0.1 BSA çözeltisi ve 2 ul, ikinci antikor, bir 1 üretmek.
- % 0.1 BSA çözeltisi içinde rodamin ya da floresan işaretlenmiş falloidinle (selüler aktin filamanlarını leke) içindeki bir% 0.1 stok çözelti hazırlayın.
- Pipet, her çözeltiden 25 ul bir tüp ve W karışımıell.
- Pipet platform üzerinde ikincil antikor stok çözeltisi 50 ul. Parafin film iskele kapağı 2 st için oda sıcaklığında alüminyum folyo ve mağaza ile çanak sarın.
- 2 ml PBS ile yıkayın 3x.
- Pipet% 0.2 4'-6-diamidino-2-fenilindol, 200 ul (DAPI; bir çekirdek boyası) bir platform üzerinde çözeltisi ve 2-3 dakika için oda sıcaklığında saklayın. alüminyum folyo ile plaka örtün.
- 2 ml PBS ile yıkayın 2x.
- bir damlalık kullanılarak, alt-tabaka üzerine monte edilmek ortam bir damla yerleştirin.
- Dikkatle CLSM 47 kullanarak bir bardak slayt ve görüntü üzerinde iskelesi koydu.
- gerçek zamanlı, polimeraz zincir reaksiyonu (qPCR) gen ekspresyonunu değerlendirmek. Ters transkriptaz PCR (RT-PCR) 53 ve üreticinin talimatlarına göre qPCR 54 standart kitleri kullanın. aşağıda tarif edildiği gibi hücre RNA ekstrakte edin.
- 1.5 ml mikrosantrifüj tüpü içinde (aşama 3,7) iskele yerleştirin.
- Tüpe bir RNA özütleme çözeltisi pipetle 1 ml oda sıcaklığında 5 dakika süre ile bir sonikatöre tutun.
- Her bir mikrosantrifüj tüpü içine kloroform 200 ul pipet ve 15-20 saniye için el kuvvetli bir şekilde tüp sallayın. fazlar ayrılana kadar ~ 3 dakika, oda sıcaklığında tüpler tutun.
- 13.000 xg, 15 dakika 4 ° C'de örnek Santrifüj ve fazlar karışmaz böylece dikkatlice tüpleri çıkarın.
- Dikkatli bir şekilde ikinci bir mikrosantrifüj tüpü içine önce tüpten üst aköz faz 500-600 ul pipetle.
- bu ikinci tüpün izopropanol eşdeğer bir hacmi (500-600 ul) eklenir.
- tüpü 3-5 kez ters çevirin ve 10 dakika oda sıcaklığında kaldıktan tüpü terk.
- 13.000 x g'de 15 dakika boyunca 4 ° C'de santrifüjleyin.
- Pelet 5 dakika daha tüp, santrifüj altındaki görünür değilse.
Not: hala görünür pelet ise, RNA miktarı yetersiz olabilir.
- Pelet 5 dakika daha tüp, santrifüj altındaki görünür değilse.
- bentüp içine DEPC su ile seyreltilir, 1 ml% 70 etanol içinde süpernatan ve pipet atmak için açık kapakla nvert borular.
- pelet tüpün duvarından ayrılır yani biraz tüpü vorteks ve ardından tüp hava kurumaya bırakın.
- Pelet tekrar süspansiyon DPEC su 50 ul ekle.
- pelet eriyene kadar pipetlenmesini tutun.
- Tek-şeritli RNA'ya iki-şeritli RNA denatüre etmek için 55 ° C'de 10 dakika süre ile devam edin.
- Hafif tüpler kısaca santrifüj sonra (7500 xg, 4 dakika, 4 ° C) tüp alt parmaklarını davul ve.
- 56 de tarif edildiği gibi ters transkriptaz 55 ve gerçek zamanlı PCR performans kadar buz tüpler tutun.
Access restricted. Please log in or start a trial to view this content.
Sonuçlar
ICC iskele yapısal karakterizasyon ve hepatositler kültüre her ICC iskele condition en etkinliğinin karşılaştırılması için temsili sonuçlar gösterilmiştir ve aşağıda açıklanmıştır. Bu sonuçlar kullanılan ICC iskele şartları 0 ug / ml (çıplak), 20 ug / ml (Kollajen 20), 200 ug / ml (Kollajen 200) ve 400 ug / ml (400 kolajen) ve ilk kollajen kaplamalar huh-7.5 hücre tohum sayısı 1x10 6.
...
Access restricted. Please log in or start a trial to view this content.
Tartışmalar
Doku mühendisliği iskeleleri hızla tüm yeniden korumak veya ilaçlar, hastalığın okuyan gelişen organ değiştirme uygulaması için dokuları onarmak için gerekli olan fiziksel ve biyokimyasal ipuçları, ve diğerleri 57 sağlamak için gelişmektedir. karaciğer doku mühendisliği, birincil insan hepatositler hızla kez vücuttan izole onların metabolik fonksiyonları, mühendislik iskeleleri için büyük bir ihtiyaç yaratmak ve karaciğer fonksiyon korumak için platformlar geliştirme kaybed...
Access restricted. Please log in or start a trial to view this content.
Açıklamalar
The authors have no competing financial interests to disclose.
Teşekkürler
Yazarlar Ulusal Araştırma Vakfı Bursu (NRF -NRFF2011-01) ve Rekabet Araştırmaları Programı (NRF-CRP10-2012-07) dan destek için teşekkürlerimizi sunarız.
Access restricted. Please log in or start a trial to view this content.
Malzemeler
| Name | Company | Catalog Number | Comments |
| 0.2 ml PCR tube | Axygen Scientific | PCR-02D-C | Boil-proof |
| Gorilla Glue | Gorilla Glue, Inc. | Depends on vendor. This was purchased from a local store. | |
| Glass slides | VWR | 631-1575 | Dimensions: 24×60 mm2 |
| Polystyrene spheres | Fisher Scientific | TSS#4314A | Diameter = 140 µm; 3x104 particles per milliliter and 1.4% size distribution |
| Ethanol | Merck | 1.00983.1011 | absolute for analysis EMSURE; Dilute to 70% with Milli-Q water |
| Ultrasonic Bath | Elma | S10H | Equiment |
| Furnace | Nabertherm | N7/H | Equipment |
| 200 µl pipette tip | Axygen Scientific | T-210-Y-R-S | |
| Rocking shaker | VWR | 444-0142 | |
| Polyethylene Glycol (PEG) | Merck | 1.09727.0100 | Mw= 4 kDa; acrylation of PEG monomers and purification of the resulting precipitate produces a PEGDA macromer with Mw = 4.6 kDa |
| Centrifuge | Beckman Coulter | 392932 | Equipment |
| Acrylate-Poly(Ethylene Glycol) - Succinimidyl Valerate | Laysan Bio | ACRL-PEG-SVA-3400-1g | Mw = 3.4 kDa |
| 2-hydroxy-4'-(2-hydroxyethoxy)-2-methylpropiophenone | Sigma Aldrich | 410896 | |
| Vortex | VWR | 58816-123 | Equipment |
| Microcentrifuge | Eppendorf | 5404 000.413 | |
| Paraffin Film | Parafilm M | #PM996 | Kept at 9" with allows intensity of 10.84 mW/cm2 |
| Bluewave 200 UV spotlight | Blaze Technology | 120008, 122300 | |
| Tetrahydrofuran (THF) | Merck | 107025 | |
| Orbital shaker | Heidolph | 543-123120-00-5 | |
| Collagen Type I | Sigma Aldrich | C3867-1VL | From rat. 1x, w/o CaCl2 & MgCl2; pH = 7.2 |
| Phosphate Buffered Saline (PBS) | Gibco | 20012-027 | 16% W/V AQ. 10 x 10 ml |
| Paraformaldehyde | VWR | 43368.9M | Equipment |
| Freezone 4.5 freeze drier | Labconco | 7750020 | Equipment |
| Sputter coater | Jeol Ltd. | JFC-1600 | Equipment |
| Scanning Electron Microscope | Jeol Ltd. | JSM 5310 | |
| Anti-mouse primary antibodies against Collagen type I | Abcam | ab6308 | |
| Anti-mouse secondary antibody conjugated with Alexa Fluor 488 | Life Technologies | A21121 | |
| Plate, Tissue Culture 24 Well, Flat Bottom (Nunclon) | Bio-Rev PTE LTD | 3820-024 | |
| Dulbecco's Modified Eagle's Medium(DMEM) 2.5 g/L Glucose w/ L-Gln | Lonza | 12-604F | |
| Fetal Bovine Serum (FBS) | Gibco | A15-151 | |
| Penicillin-Streptomycin (P/S) | Life Tchnologies | 15140-122 E | |
| 100 mm Corning non-treated culture dishes | Sigma Aldrich | CLS430591 | |
| 0.25% Trypsin-EDTA | Gibco | 25200-056 | Equipment; 37 °C, 5% Humidity |
| Forma Steri-Cycle CO2 Incubators | Thermofisher Scientific | 371 | |
| Hausser Bright-Line Phase Hemacytometer | Thermofisher Scientific | 02-671-6 | |
| Live/Dead Viability/Cytotoxicity Kit for mammalian cells | Life Technologies | L3224 | |
| CCK-8 Assay | Dojindo Laboratories | CK04-11 | Monosodium-salt reagent (MSR) |
| Infinite 200 PRO microplate reader | Tecan | ||
| Albumin Human ELISA kit | Abcam | ab108788 | |
| Triton X-100 | Bio-Rad | #1610407 | |
| Bovine Serum Albumin (BSA) | Sigma-Aldrich | A2153-50G | |
| Anti-mouse primary antibodies (against CYP3A4, albumin) | Santa Cruz Biotechnology | sc-53850; sc-271605 | |
| DAPI | Life Technologies | D3571 | |
| Alexa Fluor 555 labeled Phalloidin | Life Technologies | A34055 | |
| Trizol | Life Technologies | 15596-026 | |
| Chloroform | VWR | 22706.326 | |
| Isopropanol | Fisher Scientific | 67-63-0 | |
| DPEC water | Thermofisher Scientific | AM9916 | |
| Nanodrop 2000c Spectrophotometer | Thermofisher Scientific | ND-2000 | |
| iScript Reverse Transcription Supermix | Bio-Rad Laboratories | 1708840 | |
| SYBR select Master Mix for CFX | Life Technology | 4472937 | |
| Primers (to be chosen) | |||
| CFX96 Real-Time System, C-1000 Touch Thermal Cycler | Bio Rad Laboratories | SOFT-CFX-31-PATCH |
Referanslar
- Yamada, M., et al. Controlled formation of heterotypic hepatic micro-organoids in anisotropic hydrogel microfibers for long-term preservation of liver-specific functions. Biomaterials. 33 (33), 8304-8315 (2012).
- Abboud, G., Kaplowitz, N. Drug-induced liver injury. Drug Safety. 30 (4), 277-294 (2007).
- Cho, N. J., et al. Viral infection of human progenitor and liver-derived cells encapsulated in three-dimensional PEG-based hydrogel. Biomed Mater. 4 (1), (2009).
- Revzin, A., et al. Designing a hepatocellular microenvironment with protein microarraying and poly (ethylene glycol) photolithography. Langmuir. 20 (8), 2999-3005 (2004).
- Sato, A., Kadokura, K., Uchida, H., Tsukada, K. An in vitro hepatic zonation model with a continuous oxygen gradient in a microdevice. Biochem Bioph Res Com. 453 (4), 767-771 (2014).
- Domansky, K., et al. Perfused multiwell plate for 3D liver tissue engineering. Lab Chip. 10 (1), 51-58 (2010).
- Hegde, M., et al. Dynamic interplay of flow and collagen stabilizes primary hepatocytes culture in a microfluidic platform. Lab Chip. 14 (12), 2033-2039 (2014).
- Flaim, C. J., Chien, S., Bhatia, S. N. An extracellular matrix microarray for probing cellular differentiation. Nat methods. 2 (2), 119-125 (2005).
- Underhill, G. H., Chen, A. A., Albrecht, D. R., Bhatia, S. N. Assessment of hepatocellular function within PEG hydrogels. Biomaterials. 28 (2), 256-270 (2007).
- Dunn, J., Tompkins, R. G., Yarmush, M. L. Hepatocytes in collagen sandwich: evidence for transcriptional and translational regulation. J cell biol. 116 (4), 1043-1053 (1992).
- Dunn, J. C., Tompkins, R. G., Yarmush, M. L. Long-term in vitro function of adult hepatocytes in a collagen sandwich configuration. Biotechnol progr. 7 (3), 237-245 (1991).
- Ling, Y., et al. A cell-laden microfluidic hydrogel. Lab Chip. 7 (6), 756-762 (2007).
- Kim, M., Lee, J. Y., Jones, C. N., Revzin, A., Tae, G. Heparin-based hydrogel as a matrix for encapsulation and cultivation of primary hepatocytes. Biomaterials. 31 (13), 3596-3603 (2010).
- Kotov, N. A., et al. Inverted Colloidal Crystals as Three-Dimensional Cell Scaffolds. Langmuir. 20 (19), 7887-7892 (2004).
- Shanbhag, S., Woo Lee, J., Kotov, N. Diffusion in three-dimensionally ordered scaffolds with inverted colloidal crystal geometry. Biomaterials. 26 (27), 5581-5585 (2005).
- Lee, Y. H., Huang, J. R., Wang, Y. K., Lin, K. H. Three-dimensional fibroblast morphology on compliant substrates of controlled negative curvature. Integr Biol. 5, 1447-1455 (2013).
- da Silva, J., Lautenschlager, F., Kuo, C. H. R., Guck, J., Sivaniah, E. 3D inverted colloidal crystals in realistic cell migration assays for drug screening applications. Integr Biol. 3, 1202-1206 (2011).
- da Silva, J., Lautenschlager, F., Sivaniah, E., Guck, J. R. The cavity-to-cavity migration of leukaemic cells through 3D honey-combed hydrogels with adjustable internal dimension and stiffness. Biomaterials. 31, 2201-2208 (2010).
- Lee, J., Lilly, G. D., Doty, R. C., Podsiadlo, P., Kotov, N. A. In vitro toxicity testing of nanoparticles in 3D cell culture. Small. 5, 1213-1221 (2009).
- Lee, J., Kotov, N. A. Notch ligand presenting acellular 3D microenvironments for ex vivo human hematopoietic stem-cell culture made by layer-by-layer assembly. Small. 5, 1008-1013 (2009).
- Liu, Y., et al. Rapid aqueous photo-polymerization route to polymer and polymer-composite hydrogel 3D inverted colloidal crystal scaffolds. J Biomed Mater Res. Part A. 83, 1-9 (2007).
- Ma, P. X., Choi, J. W. Biodegradable polymer scaffolds with well-defined interconnected spherical pore network. Tissue Eng. 7, 23-33 (2001).
- Cuddihy, M. J., Kotov, N. A. Poly (lactic-co-glycolic acid) bone scaffolds with inverted colloidal crystal geometry. Tissue Eng Part A. 14, 1639-1649 (2008).
- Choi, S. W., Zhang, Y., Xia, Y. Three-dimensional scaffolds for tissue engineering: the importance of uniformity in pore size and structure. Langmuir. 26, 19001-19006 (2010).
- Choi, S. W., Zhang, Y., Thomopoulos, S., Xia, Y. In vitro mineralization by preosteoblasts in poly(DL-lactide-co-glycolide) inverse opal scaffolds reinforced with hydroxyapatite nanoparticles. Langmuir. 26, 12126-12131 (2010).
- Choi, S. W., Zhang, Y., Macewan, M. R., Xia, Y. Neovascularization in biodegradable inverse opal scaffolds with uniform and precisely controlled pore sizes. Adv Healthc Mater. 2, 145-154 (2013).
- Zhang, Y., Choi, S. W., Xia, Y. Modifying the Pores of an Inverse Opal Scaffold With Chitosan Microstructures for Truly Three-Dimensional Cell Culture. Macromol Rapid Commun. 33, 296-301 (2012).
- Cai, X., et al. Investigation of neovascularization in three-dimensional porous scaffolds in vivo by a combination of multiscale photoacoustic microscopy and optical coherence tomography. Tissue Eng. Part C, Meth. 19, 196-204 (2013).
- Zhang, Y. S., Yao, J., Wang, L. V., Xia, Y. Fabrication of Cell Patches Using Biodegradable Scaffolds with a Hexagonal Array of Interconnected Pores (SHAIPs). Polymer. 55, 445-452 (2014).
- Zhang, Y. S., Regan, K. P., Xia, Y. Controlling the Pore Sizes and Related Properties of Inverse Opal Scaffolds for Tissue Engineering Applications. Macromol Rapid Commun. 34, 485-491 (2013).
- Stachowiak, A. N., Bershteyn, A., Tzatzalos, E., Irvine, D. J. Bioactive Hydrogels with an Ordered Cellular Structure Combine Interconnected Macroporosity and Robust Mechanical Properties. Adv Mater. 17, 399-403 (2005).
- Stachowiak, A. N., Irvine, D. J. Inverse opal hydrogel-collagen composite scaffolds as a supportive microenvironment for immune cell migration. J Biomed Mater Res. Part A. 85, 815-828 (2008).
- Liu, Y., Wang, S. 3D inverted opal hydrogel scaffolds with oxygen sensing capability. Colloids and surfaces. B, Biointerfaces. 58, 8-13 (2007).
- Bryant, S. J., Cuy, J. L., Hauch, K. D., Ratner, B. D. Photo-patterning of porous hydrogels for tissue engineering. Biomaterials. 28, 2978-2986 (2007).
- Bhrany, A. D., Irvin, C. A., Fujitani, K., Liu, Z., Ratner, B. D. Evaluation of a sphere-templated polymeric scaffold as a subcutaneous implant. JAMA facial plastic surgery. 15, 29-33 (2013).
- Kuo, Y. C., Chiu, K. H. Inverted colloidal crystal scaffolds with laminin-derived peptides for neuronal differentiation of bone marrow stromal cells. Biomaterials. 32 (3), 819-831 (2011).
- Yang, J. T., Kuo, Y. C., Chiu, K. H. Peptide-modified inverted colloidal crystal scaffolds with bone marrow stromal cells in the treatment for spinal cord injury. Colloids Surf. B, Biointerfaces. 84, 198-205 (2011).
- Kuo, Y. C., Tsai, Y. T. Inverted colloidal crystal scaffolds for uniform cartilage regeneration. Biomacromolecules. 11, 731-739 (2010).
- Choi, S. W., Xie, J., Xia, Y. Chitosan-Based Inverse Opals: Three-Dimensional Scaffolds with Uniform Pore Structures for Cell Culture. Adv Mater. 21, 2997-3001 (2009).
- Long, T. J., Sprenger, C. C., Plymate, S. R., Ratner, B. D. Prostate cancer xenografts engineered from 3D precision-porous poly(2-hydroxyethyl methacrylate) hydrogels as models for tumorigenesis and dormancy escape. Biomaterials. 35, 8164-8174 (2014).
- Kuo, Y. C., Tsai, Y. T. Inverted colloidal crystal scaffolds for uniform cartilage regeneration. Biomacromolecules. 11, 731-739 (2010).
- Kuo, Y. C., Chiu, K. H. Inverted colloidal crystal scaffolds with laminin-derived peptides for neuronal differentiation of bone marrow stromal cells. Biomaterials. 32, 819-831 (2011).
- Lee, J., Cuddihy, M. J., Cater, G. M., Kotov, N. A. Engineering liver tissue spheroids with inverted colloidal crystal scaffolds. Biomaterials. 30 (27), 4687-4694 (2009).
- Galperin, A., et al. Integrated bi-layered scaffold for osteochondral tissue engineering. Adv Healthc Mater. 2, 872-883 (2013).
- Waters, D. J., et al. Morphology of Photopolymerized End-linked Poly(ethylene glycol) Hydrogels by Small Angle X-ray Scattering. Macromolecules. 43 (16), 6861-6870 (2010).
- Elbert, D. L., Hubbell, J. A. Conjugate addition reactions combined with free-radical cross-linking for the design of materials for tissue engineering. Biomacromolecules. 2 (2), 430-441 (2001).
- Kim, M. H., et al. Biofunctionalized Hydrogel Microscaffolds Promote Three-Dimensional Hepatic Sheet Morphology. Macromol Biosci. , (2015).
- Ferreira, T., Rasband, W. ImageJ User Guide. , http://imagej.nih.gov/ij/docs/guide/146-30.html#toc-Subsection-30.1 (2012).
- JoVE Science Education Database. General Laboratory Techniques. Introduction to Fluorescence Microscopy. , JoVE. Cambridge, MA. (2015).
- Tominaga, H., et al. A water-soluble tetrazolium salt useful for colorimetric cell viability assay. Anal Commun. 36 (2), 47-50 (1999).
- JoVE Science Education Database. General Laboratory Techniques. Introduction to the Microplate Reader. , JoVE. Cambridge, MA. (2015).
- JoVE Science Education Database. Basic Methods in Cellular and Molecular Biology. The ELISA Method. , JoVE. Cambridge, MA. (2015).
- Nolan, T., Hands, R. E., Bustin, S. A. Quantification of mRNA using real-time RT-PCR. Nat Protoc. 1, 1559-1582 (2006).
- JoVE Science Education Database. Essentials of Environmental Microbiology. RNA Analysis of Environmental Samples Using RT-PCR. , JoVE. Cambridge, MA. (2016).
- JoVE Science Education. Essentials of Environmental Microbiology. , JoVE. (2015).
- Jeong, S., et al. The evolution of gene regulation underlies a morphological difference between two Drosophila sister species. Cell. 132 (5), 783-793 (2008).
- Griffith, L. G., Naughton, G. Tissue engineering--current challenges and expanding opportunities. Science. 295 (5557), 1009-1014 (2002).
- Hegde, M., et al. Dynamic Interplay of Flow and Collagen Stabilizes Primary Hepatocytes Culture in a Microfluidic Platform. Lab Chip. 14, 2033-2039 (2014).
- Kim, Y., Lasher, C. D., Milford, L. M., Murali, T., Rajagopalan, P. A comparative study of genome-wide transcriptional profiles of primary hepatocytes in collagen sandwich and monolayer cultures. Tissue Eng Pt C. 16 (6), 1449-1460 (2010).
- Baimakhanov, Z., et al. Efficacy of multi-layered hepatocyte sheet transplantation for radiation-induced liver damage and partial hepatectomy in a rat model. Cell Transplant. , (2015).
- Li, C. Y., et al. Micropatterned Cell-Cell Interactions Enable Functional Encapsulation of Primary Hepatocytes in Hydrogel Microtissues. Tissue Eng Pt A. 20 (15-16), 2200-2212 (2014).
- Shlomai, A., et al. Modeling host interactions with hepatitis B virus using primary and induced pluripotent stem cell-derived hepatocellular systems. P Natl A Sci USA. 111 (33), 12193-12198 (2014).
- Curcio, E., et al. Mass transfer and metabolic reactions in hepatocyte spheroids cultured in rotating wall gas-permeable membrane system. Biomaterials. 28, 5487-5497 (2007).
- Martinez-Hernandez, A., Amenta, P. The hepatic extracellular matrix. Vichows Archiv A Pathol Anat. 423, 1-11 (1993).
- Liu, Y., Wang, S., Lee, J. W., Kotov, N. A. A Floating Self-Assembly Route to Colloidal Crystal Templates for 3D Cell Scaffolds. Chem Mater. 17 (20), 4918-4924 (2005).
Access restricted. Please log in or start a trial to view this content.
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır