このコンテンツを視聴するには、JoVE 購読が必要です。 サインイン又は無料トライアルを申し込む。
Method Article
肝組織工学のための三次元細胞培養プラットフォーム:逆コロイド結晶ポリ(エチレングリコール)足場の作製
要約
This manuscript presents a detailed protocol for the fabrication of an emerging three-dimensional hepatocyte culture platform, the inverted colloidal crystal scaffold, and the concomitant techniques to assess hepatocyte behavior. The size-controllable pores, interconnectivity and ability to conjugate extracellular matrix proteins to the poly(ethylene glycol) (PEG) scaffold enhance Huh-7.5 cell performance.
要約
インビトロでの肝細胞の機能を維持する能力は 、生体異物「細胞毒性を試験ウイルス感染を研究し、肝臓での標的薬の開発のために、細胞は、適切な生化学的および機械的な合図を受信するプラットフォームを必要とします。最近の肝組織工学システムは、その高い保水性、細胞によって必要とされる機械的な刺激を提供する能力を与えられた、合成または天然のハイドロゲルからなる三次元(3D)スキャフォールドを採用しています。反転コロイド結晶(ICC)足場、高い空間組織、同型および異細胞の相互作用、ならびに細胞外マトリックス(ECM)の相互作用を可能にする最近の開発、への関心が高まってきました。ここで、我々は、ポリ(エチレングリコール)ジアクリレート(PEGDA)と粒子浸出法を用いてICC足場を製造するためのプロトコルを説明します。簡潔には、格子は、後のプリpolyme微小球粒子から形成されていますRの溶液は適切に重合し、添加し、次いで、粒子を有機溶媒( 例えば、テトラヒドロフラン)を使用して、除去し、または浸出されます。メディアをより簡単に細胞に到達することを可能にする制御された細孔サイズとinterconnectivitiesを有する高度に多孔質足場の格子結果の解散。このユニークな構造は、細胞が同様に簡単に毛穴の間の通信、およびタンパク質とPEGDAのICC足場はまた、電池性能に顕著な効果を示してコートする能力のことを遵守するための高い表面積を可能にします。私たちは、生存能力の点で足場の形態と同様に肝細胞癌細胞(ホ-7.5)行動を分析し、ICCの構造およびECMコーティングの効果を調査するために機能します。全体的に、この論文は、組織工学における幅広い用途を持つ新興足場、特に肝組織工学の詳細なプロトコルを提供します。
概要
肝臓は、血液の解毒、生体異物の代謝、および血清タンパク質の産生を含む多数の機能を有する高度に血管器官です。肝臓組織は、複数の細胞型、毛細胆管、正弦波、及び異なるバイオマトリックス組成物と異なる酸素濃度のゾーンを含む、複雑な3次元(3D)微細構造を有します。この精巧な構造を考えると、 インビトロ 1 における適切な肝臓モデルを作成することは困難でした。しかし、薬物毒性2をテストし、肝臓3に関連する疾患を研究するためのプラットフォームとして、ヒト肝細胞をホスティングしているin vitroモデルにおける機能の需要があります。
現在の肝臓組織工学プラットフォームは、肝臓のパラメータ、セル4の、すなわち共培養、透明帯の生化学的組成の、1を単離し、または数に着目して、肝臓の複雑さを単純化していますリットルの微小環境5、流体力学6,7およびバイオマトリックス8の構成。バイオマトリックスの構成は、このような足場材料、細胞外マトリックス(ECM)タンパク質の組成は、マトリックス剛性だけでなく、足場の設計や構造などのパラメータに分けることができます。曲ヒドロゲルの機械的性質、生物活性、および分解速度の能力を考えると、合成ヒドロゲル、特にポリ(エチレングリコール)(PEG)9ヒドロゲルを用いた組織工学研究の上昇がありました。肝臓に関連する研究については、生体適合性ヒドロゲルは、肝疾患3のウイルス感染の研究のために適用しました。肝細胞プラットフォームの設計としては、多くの研究は、in vivo微小環境に模倣するために必須である3D環境および細胞- ECMおよび細胞-細胞相互作用を提供するために、ヒドロゲル12,13内の肝細胞サンドイッチ培養10,11及びセルカプセル化を利用してきました。ハウ版、これらのプラットフォームは、足場14を介して不均一な特性につながる、制御および空間的構成の高度を持っていません。
反転結晶コロイド(ICC)は14足場は、最初の2000年代初頭に導入された細胞培養のための高度に組織化された3次元の足場です。足場のユニークな構造は、コロイド結晶、可変直径のコロイド粒子の規則正しい格子を使用した簡単な製造プロセスに起因し得ます。簡潔には、プロセスを要約するために、粒子が整然と配置され、格子を形成するために熱を使用してアニールされます。高表面積をもつ六角形パックされた球状の空洞15中の重合ヒドロゲル結果の有機溶剤によって、この格子の浸出、、。この高度に秩序足場は、以前含む、合成および天然両方の材料で作られたが、ポリ(アクリルアミド)、16-21に限定されるものではなく、ポリ(乳酸-コ-グリコール酸)、15,22-30されています、ポリ(エチレングリコール)31,32、ポリ(2-ヒドロキシエチルメタクリレート)、21,33-35、およびキトサン36-39。非ファウリングの素材で作られたICC足場は、空洞14,23,40内の細胞スフェロイドを促進する傾向があります。複数の細胞型は、骨髄間質細胞が42、軟骨細胞41を含め、正常にこの構成の中に、増殖分化および機能することが示され、細胞43,44幹されています。肝細胞について、研究がICC用のNa 2にSiO 3及びポリ(アクリルアミド)からなる骨格ではなく、PEGを用いて実施されてきました。単純なバイオコンジュゲーション戦略を有する( すなわち 、EDC / NHSを介して、アミンカップリング)、ECMタンパク質共役PEGベースの足場が環境など、in vivoでの詳細あると肝機能を向上させるために多くの細胞結合部位を証明することができ、製造することができます。
この原稿と関連するビデオでは、我々の詳細ICC足場の製作肝細胞癌(ホ-7.5)の培養のために最適化されたポリ(エチレングリコール)ジアクリレート(PEGDA)ヒドロゲル、ポリスチレン微小球格子を使用。私たちは、足場のトポロジと電池性能の点で、一般的に非粘着性の裸のPEGDAのICC足場とコラーゲンコーティングPEGDAのICC足場との違いを示しています。細胞の生存および機能ホ-7.5細胞の挙動を評価するために、定性的および定量的に測定されます。
Access restricted. Please log in or start a trial to view this content.
プロトコル
1. ICCの足場の作製(図1)
- ポリスチレン(PS)格子(;ビーズの8-13層直径= 6 mm)を準備します。
- 金型を製造するために、40μlのレベルで0.2ミリリットル沸騰プルーフマイクロ遠心チューブからヒントを遮断します。防水接着剤で24×60 mm 2の顕微鏡カバーガラススリップにカットチューブの上部を接着。
- 慎重に水懸濁液をピペット、およびバイアルに70%エタノール溶液の18ミリリットルを追加し、20ミリリットルバイアルに水懸濁液中に含まれるPS球(直径= 140μm)を置きます。集約された球を緩めるために、超音波浴中に球体液を入れてください。完全に水と水溶性成分を除去するために、この洗浄工程を数回繰り返します。
- 鋳型に100μlのエタノールをピペット。
- 4ミリメートルによって200μlのマイクロピペットチップの上部をカットします。二回達成するために、200μlのマイクロピペットを用いて、金型内に球体のピペットを25μl各型で総容量50μl。
- 120 rpmで一晩ロッキングシェーカー上金型を置きます。
- 光学顕微鏡下で各型の中での球の配置を確認してください。球体が六角形に順序付けされていない場合は、70%エタノールの50μlを添加し、配置を補正するために、長手方向及び横軸方向に手動で振ります。
- 2泊室温(RT)でエタノールを蒸発させてください。 PSビーズをアニールするために6時間、130℃の炉内のカビやビーズ複合体を配置します。
- 裸とECMコーティングされたPEGDA足場を準備します。
- リニアPEGマクロマー(4.6キロダルトン= ワット Mを)アクリレート化するために確立されたプロトコール45,46を使用して、PEGDAマクロマーを合成します。
- 脱イオン(DI)水に50%(w / v)のPEGDA溶液を調製し、完全に溶解するまでマクロマーが適切4,713×gで遠心分離することによって溶解させます。
- ECM共役ICC足場の場合、追加を溶解50%PEGDA溶液中の10%(w / v)のアクリロイル-PEG-NHS(3.4キロダルトン= W M)。
- 70%エタノール(2-ヒドロキシエトキシ)-2-メチルプロピオフェノン(PI) - 2-ヒドロキシ-4-の20%(w / v)のストック溶液 'を準備します。
- PEGDAの(w / vの)50%の1ミリリットル当たりのPIストック溶液(w / v)の20%の50μLを加えます。 PEGDAの分子量に基づいてPIストック溶液の必要量を調整します。
- ボルテックスで1分間遠心分離管中の混合物を均一な溶液に到達します。
- ピール(ステップ1.1.7から)ガラススライドからの金型は、金型から接着剤を除去し、慎重にへらを使用して格子を押し出すと1.5mlチューブにそれらのそれぞれに配置します。格子に適切なPEGDA液の浸透を可能にするために5分間、845×gでPEGDA液と遠心機のピペットを300μl。
- ピンセットを用いて、チューブから格子を外し、慎重に手袋を乾燥過剰PEGDA液をブロット。フラットCIRとパラフィンフィルムで覆われたガラス上に格子を配置cular面を上向き。
- PEGDA溶液はUVスポットランプを用いて5分間、365 nmの紫外線(UV)光(10.84ミリワット/ cm 2)とする足場を浸潤さらします。
- (1バイアルあたり10格子の周りの)新しいバイアルにPEGDA重合結晶格子を配置し、20mlのテトラヒドロフラン(THF)を追加します。 300 rpmでオービタルシェーカー上でバイアルを振ります。 1〜2時間の間隔でTHFを少なくとも3回を変更します。
注:順番にPSの不完全な除去を引き起こすことができる足場を、気泡が入らないために、THFを変更する場合、完全にTHFを除去しないでください。格子をカバーし、新しいTHFを追加するのに十分な解決策を残します。
注意:THFは有毒です。手袋、白衣とゴーグルを着用してください。ヒュームフードの下で操作することにより、吸入しないようにしてください。 - PS球を使用THF溶液に水を入れて溶液の色を観察することによって溶解されるかどうかを確認してください。 PS球が適切に溶解されていない場合はステップ1.2.9を繰り返します。
注:溶液の色に変わります白残りのPS球がある場合。
- バイオセーフティキャビネット(BSC)で足場を清掃してください。
- 足場を滅菌するために、骨格あたりの70%エタノール2mlの50ml遠心チューブを準備し、スパチュラを用いてチューブに足場を置きます。足場は1時間エタノール中に浸すことを許可します。このステップから前方に、BSC内のすべての手続きを行っています。
- 慎重にエタノールを注ぐと泡を除去するために3分間524×gでリン酸緩衝生理食塩水(PBS)(足場あたり2ml)および遠心分離と交換します。冷蔵庫に保管し、1〜2時間の間隔でPBSを数回変更します。
- I型コラーゲンでコーティングされた足場のため、1型コラーゲン原液(足場につき1 ml)を含む別の50ml遠心チューブを準備し、スパチュラ、および3分間524×gで遠心分離器を使用して、このチューブに滅菌足場を転送します。 30分間、オービタルシェーカー上で400rpmで足場を振るとrefrigeratにチューブを保ちますまたは一晩。
- 新鮮なPBSで足場を浸漬した後、PBSを吸引することにより、二回使用前にPBSで足場を洗ってください。
注:NHS化学を結合( 図2)を形成するためのアミン基を必要とするので、他のECMタンパク質はまた、代わりにコラーゲンタイプIを使用することができます。
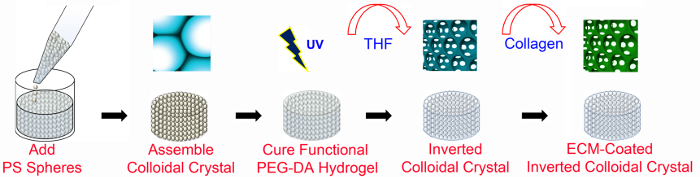
ICC製造の 図1. 概要。PEGベースのICC足場をECM-機能化ととすることなく、微細加工技術を用いて製造されます。 ECMコーティングされたICCの足場は、( 図2で説明するように)、PEG-NHSと同様にPEGDAが必要です。 PS格子は6mmの直径8-13ビード層の高さを有します。 PS、ポリスチレン; PEGDA、ポリ(エチレングリコール)ジアクリレート。 UV、紫外線、 THF、テトラヒドロフラン; ECM、細胞外マトリックス。この図は、変更されたとWiからの許可を得て使用されていますレイ47。 この図の拡大版をご覧になるにはこちらをクリックしてください。
2. ICC構造キャラクタリゼーション
- 、または複合タンパク質なしICC構造を分析走査電子顕微鏡(SEM)47を使用します。
- 4%パラホルムアルデヒド(PFA)で足場を修正し、シリアル25、50、75、95および100%のエタノール溶液でそれらを脱水し、エタノールが完全に蒸発するまで-80℃で保管してください。
- 48時間凍結乾燥機で乾燥したサンプル。
- スパッタコーターでカーボンテープと場所を使用してサンプルホルダーにサンプルを貼り付けます。
- 自動真空引きした後、20mAで60秒間、スパッタ法により厚さ10nmのPt膜でコートに。
- 5キロボルト( 図3A、 図4A)の電圧でSEMを用いた画像ICC足場。
- 細孔を測定し、キャビティの相互接続径、画像解析ソフトウェア48用いたSEM顕微鏡写真を分析する( 例えば 、ImageJのを; 図3B、C)。
- 細胞を含まない足場に共役コラーゲン、蛍光タグを視覚化するための抗体(1:100)を使用して、コラーゲン共焦点レーザー走査顕微鏡47とI型コラーゲンおよび画像に対して(CLSMを、 図4B)。
3.ホ-7.5細胞培養および播種
- 培養のHuh-7.5 10 100 MM細胞培養皿中で2~2.5×10 6細胞/ mlの播種密度で細胞mlのダルベッコ改変イーグル培地(DMEM)に10%ウシ胎児血清(FBS)を補充し、100 U / mlのペニシリン-ストレプトマイシン(成長培地)37℃、5%CO 2の変更でメディアBSCで3日ごとに彼らは百分の75から80までの集密度に達するまで。
- BSCにおける細胞播種のための足場を準備します。
- scaffを慎重に置きます上向きに平らな表面を有する24ウェルプレートで歳。
- 各ウェル足場を含むへの足場、ピペットを2 mlのPBSを洗浄します。 PBSおよびピペット2ミリリットルを各ウェルに新鮮なPBSを吸引します。
- PBSおよび増殖培地のピペット2ミリリットルを吸引する(ステップ3.1を参照)、30分間のまま。メディアを吸引除去し、足場は1時間乾燥させます。
- トリプシン消化法を用いて、BSCにおける培養プレートから(ステップ3.1から)コンフルエントのHuh-7.5細胞を切り離します。
- プレートから培地を吸引し、付着細胞を洗浄した後、PBSを吸引するために4ミリリットルのPBSを追加します。
- 3分間37℃のインキュベーターでピペット0.75〜1ミリリットル0.25%トリプシン及び場所、5%CO 2。
- トリプシン反応を停止するインキュベーターやピペット5ミリリットルメディアからプレートを取り外します。 15ミリリットルチューブにピペットメディア、剥離した細胞、およびトリプシン混合物。
- 3分間524×gで遠心分離し、上清を除去し、5ミリリットルのメディアでペレットを再懸濁します。
- 血球計数器を用いて細胞を計数し、25μL当たり、ターゲット番号、N 0細胞を含む細胞懸濁液の体積を計算する(標準の実験のために、N 0が 1×10 6細胞)です。
細胞懸濁液の体積=(セルの目標数)/(細胞懸濁液の濃度) - ゆっくりと(ステップ3.1.4から)各足場の上に直接(N 0細胞を含む)の細胞懸濁液25μLをピペット。インキュベーター中で24ウェルプレートを置きます。
- 12時間後、各ウェルに、新しい24ウェルプレートおよびピペット内にへらを使用して慎重にメディアの2ミリリットルを足場を転送します。インキュベーター中で24ウェルプレートを置きます。
- (ステップ5.1参照)3日ごとにメディアを変更するか、メディアがタンパク質分泌分析のために収集されたときに応じて。
4.細胞生存率
- 質的に細胞生存率を分析するために、Cを用いて細胞や画像を染色するために蛍光生/死染色キットを使用LSM。
- キットの指示に続いて、4μMのカルセインAMおよび8μMエチジウムホモダイマー-1メディアのある溶液を調製する(ステップ3.1.3を参照してください)。
注:細胞数に応じて最適化します。細胞は数(約2万円)で増殖し、二重の場合、試薬の二重の量を使用してください。 - 足場(ステップ3.7)および調製された溶液のピペットを500μlと、各ウェルにおけるBSCで、培地を吸引。 1時間37℃のインキュベーター中でサンプルをインキュベートします。
- インキュベーターからプレートを取り外すとき光から試料を保護するために、プレートをホイルで覆います。 CLSM49を使用して画像サンプル。
- キットの指示に続いて、4μMのカルセインAMおよび8μMエチジウムホモダイマー-1メディアのある溶液を調製する(ステップ3.1.3を参照してください)。
- 定量的(生細胞内)、酵素活性を測定する比色アッセイ50を使用して、細胞の生存率を評価するために( すなわち 、2-(2-メトキシ-4-ニトロフェニル)-3-(4-ニトロフェニル)-5-(2,4-ジスルホ) -2H-テトラゾリウム(一ナトリウム塩試薬))。
- ICCプラットフォーム( すなわち 、吸光度のグラフ(OD)Vのための標準曲線を作成します。ersus)細胞数与えられました。
注:細胞は足場の空洞を通過することができるので、細胞播種は、他のプラットフォームと比較して100%効率的ではありません。- 標準曲線を作製するために使用されることをN 0、細胞播種数を決定します。
注:実験で推定された細胞数を含む範囲を選択してください。たとえば、最初の細胞数が5×10 5細胞であり、2.5×10 5、5×10 5、1×10 6、および2×選択し、実験の最後の日までに推定〜3倍の増加が存在する場合N 0として10 6細胞。 - ステップ3.1から3.6に記載されているようにICC足場(25μLの播種量と足場あたり1 N 0)で細胞播種を行います。
- 6時間後、別のウェル24ウェルプレートに足場を移します。細胞接着ではなく、細胞増殖を可能にする時間を選択します。
- 転送ICC足場に細胞計数を行います。
- 足場と各ウェルにBSCとピペット500μlの1×MSR溶液中のメディアで1Xに10倍のモノナトリウム塩試薬(MSR)溶液を希釈。 1時間、37℃で24ウェルプレートをインキュベートします。
- 各ウェルからは、96ウェルプレートに100μlのを転送します。ブランク、ピペット96ウェルプレート上の異なるウェルに新鮮な1×モノナトリウム塩試薬溶液100μlとして。手動で乾燥ピペットチップを使用して存在する任意の気泡を除去し、光から保護するためにホイルで96ウェルプレートを覆います。
- λ= 450nmで分光光度計を使用して読んでODを測定します。正確なOD 51を見つけるために、他の値からブランクODを引きます。
- 血球計数器を使用して足場(ステップ4.2.1.3)を転送した後、ウェル内に残っている細胞の数(N個のL)をカウントします。
注意:使用をトリプシン300μlの細胞をトリプシン処理します。 - 実際のセル数、N Aを計算します。
実際=初期 - ウェル中の左
N A = N 0 -N L - 対実際のセル数(N A)ステップ4.2.1.4.3で得られたODをプロットすることにより標準曲線を作成し、実験中の細胞数を推定するために使用します。
注:任意のICCパラメータ( すなわち、ポロゲンのサイズは、足場の寸法は、ECMタンパク質など)が変更された場合は、新しい標準曲線を作成します。
- 標準曲線を作製するために使用されることをN 0、細胞播種数を決定します。
- ICCプラットフォーム( すなわち 、吸光度のグラフ(OD)Vのための標準曲線を作成します。ersus)細胞数与えられました。
5.細胞機能
- 酵素結合免疫吸着検定法(ELISA)52により(ステップ3.7)を集め、メディアからのHuh-7.5細胞( すなわち、アルブミン、尿素)によってタンパク質分泌を分析します。
注:メディアを希釈し、播種した細胞の数および収集媒体の量に応じ。抗体-プレコートウェルにそれを導入する前に、25比率:ICCに播種し、5×10 5細胞については、〜1を使用します。 - 定性的に特定の細胞内タンパク質の免疫染色、細胞の機能を分析するために( すなわち 、アルブミン)、酵素( すなわち 、CYP450)、ステイン構造成分( すなわち、細胞アクチン)と同様にCLSM 49を用いて、核および画像。
- セルを含んだICC足場を洗浄する(ステップ3.7)培地を吸引し、ピペット2ミリリットルのPBS。
- ピペット1 4%PFA mlの固定のために室温で5分間インキュベートします。
- 2mlのPBSでの洗浄3回。
- 30分間、0.1%の4-(1,1,3,3-テトラメチルブチル)フェニル - ポリエチレングリコール(界面活性剤)1mlに足場をインキュベートすることによって、膜を透過性。
- 2による洗浄3回は、任意の漏れたタンパク質を除去するためにPBSをML。
- ピペット500μlの1%ウシ血清アルブミン(BSA)および非特異的結合をブロックするために室温で1時間インキュベートします。
- 希釈した一次抗体( すなわち、アルブミン、CYP450)溶液を調製します。
- ピペット15mlチューブに1%BSA溶液500μlおよび0.1%BSA溶液の合計を5mL調製するために、0.1%界面活性剤溶液4.5 mlで加えます。
- 一次抗体溶液:1時50分(0.1%BSA一次抗体)を産生するために、200μlのマイクロチューブと一次抗体の2μlの中に0.1%のBSA溶液のピペット98μlの。
- 足場上の一次抗体溶液のピペットを40μl、パラフィンフィルムで基板をカバーしています。アルミホイルで24ウェルプレートをラップし、4℃で一晩皿を格納します。
- 2mlのPBSでの洗浄3回、洗浄の間に静かにプレートを振ります。
- 希釈したビオチン化二次抗体( すなわち 、抗マウス抗体)原液を準備します。
- 100(二次抗体:0.1%BSA)二次抗体溶液1を製造するためのピペット198μlの0.1%BSA溶液および2μlの第二の抗体。
- 0.1%BSA溶液中のローダミンまたはフルオレセイン標識したファロイジン(携帯アクチンフィラメントを染色する)の0.1%ストック溶液を準備します。
- ピペット各溶液25μlチューブ内およびwは混ぜますエル。
- 足場上の二次抗体原液のピペットを50μl。パラフィンフィルムで足場をカバーし、2時間室温でアルミ箔とストアと皿を包みます。
- 2mlのPBSでの洗浄3回。
- ピペット0.2%4'-6-ジアミジノ-2-フェニル200μlの(DAPI;核染色)足場上の溶液と、2-3分間RTで続けます。アルミホイルでプレートをカバーしています。
- 2mlのPBSでの洗浄2回。
- スポイトを使用して、基板への実装メディアのドロップを置きます。
- 慎重にCLSM 47を使用して、スライドガラスや画像に足場を置きます。
- リアルタイムポリメラーゼ連鎖反応(qPCR)によって遺伝子発現を評価します。逆転写酵素PCR(RT-PCR)53と、製造元の指示に従って定量PCR 54のための標準的なキットを使用してください。以下に説明するように、細胞からRNAを抽出します。
- 1.5ミリリットルマイクロチューブに(ステップ3.7から)足場を置きます。 ピペット1ミリリットルチューブに、RTで5分間超音波処理器に保ちます。
- 各マイクロチューブに200μlのクロロホルムをピペットで15〜20秒間手で激しくチューブを振ります。相を分離するまで、2〜3分間室温でチューブを保管してください。
- 13,000×gで、15分間、4℃でサンプルを遠心分離し、相が混在しないように慎重にチューブを取り外します。
- 慎重に第二マイクロ遠心チューブに第1のチューブからの上部の水相の500-600μLをピペット。
- この第二のチューブにイソプロパノールの等量(500から600μl)を追加します。
- チューブを3-5回転倒し、10分間室温で放置チューブを残します。
- 13,000×gで、15分間、4℃でサンプルを遠心。
- ペレットを5分間再びチューブ、遠心機の下部に表示されていない場合。
注:まだ目に見える沈殿物がない場合、RNAの量が不足することができます。
- ペレットを5分間再びチューブ、遠心機の下部に表示されていない場合。
- 私チューブにDEPC水で希釈した1ミリリットルの70%エタノールで上清とピペットを廃棄するオープンキャップ付nvertチューブ。
- 少しペレットがチューブの壁から脱離するようにチューブをボルテックスした後、チューブの空気が乾燥してみましょう。
- ペレットを再懸濁しDPECの50μlの水を加えます。
- ペレットが溶解するまでピペッティングをしてください。
- 一本鎖RNAに二本鎖RNAを変性するために55℃で10分間続けます。
- 軽くチューブの底に指をドラム、その後(7500×gで、4分、4℃)チューブを簡単に遠心してください。
- 56で説明したように、逆転写酵素55とリアルタイムPCRを行うまで氷上でチューブを保管してください。
Access restricted. Please log in or start a trial to view this content.
結果
ICC足場の構造的特徴と肝細胞を培養することで、各ICC足場条件の有効性を比較するための代表的な結果が示され、以下に説明されています。これらの結果に使用されるICC足場条件は、0μgの/ mlの(ベア)のコラーゲンコーティングを20μg/ mlの(コラーゲン20)を200μg/ mlの(コラーゲン200)、及び400μgの/ mlの(コラーゲン400)と初期あります許-7.5細胞播種数は1×10 ...
Access restricted. Please log in or start a trial to view this content.
ディスカッション
組織工学足場は急速にすべての、再生、維持、または薬物を、疾患を研究開発、臓器置換の適用のための組織を修復するために必要な物理的および生化学的手がかり、および他の多くの57を提供するように進化しています。肝組織工学では、初代ヒト肝細胞は急速にエンジニアリング足場と肝機能を維持するための開発プラットフォームのための大きい必要性を作成し、一度本体から...
Access restricted. Please log in or start a trial to view this content.
開示事項
The authors have no competing financial interests to disclose.
謝辞
著者らは、国立研究財団フェローシップ(NRF -NRFF2011-01)と競争的研究計画(NRF-CRP10-2012-07)からの支援を承認したいと思います。
Access restricted. Please log in or start a trial to view this content.
資料
| Name | Company | Catalog Number | Comments |
| 0.2 ml PCR tube | Axygen Scientific | PCR-02D-C | Boil-proof |
| Gorilla Glue | Gorilla Glue, Inc. | Depends on vendor. This was purchased from a local store. | |
| Glass slides | VWR | 631-1575 | Dimensions: 24×60 mm2 |
| Polystyrene spheres | Fisher Scientific | TSS#4314A | Diameter = 140 µm; 3x104 particles per milliliter and 1.4% size distribution |
| Ethanol | Merck | 1.00983.1011 | absolute for analysis EMSURE; Dilute to 70% with Milli-Q water |
| Ultrasonic Bath | Elma | S10H | Equiment |
| Furnace | Nabertherm | N7/H | Equipment |
| 200 µl pipette tip | Axygen Scientific | T-210-Y-R-S | |
| Rocking shaker | VWR | 444-0142 | |
| Polyethylene Glycol (PEG) | Merck | 1.09727.0100 | Mw= 4 kDa; acrylation of PEG monomers and purification of the resulting precipitate produces a PEGDA macromer with Mw = 4.6 kDa |
| Centrifuge | Beckman Coulter | 392932 | Equipment |
| Acrylate-Poly(Ethylene Glycol) - Succinimidyl Valerate | Laysan Bio | ACRL-PEG-SVA-3400-1g | Mw = 3.4 kDa |
| 2-hydroxy-4'-(2-hydroxyethoxy)-2-methylpropiophenone | Sigma Aldrich | 410896 | |
| Vortex | VWR | 58816-123 | Equipment |
| Microcentrifuge | Eppendorf | 5404 000.413 | |
| Paraffin Film | Parafilm M | #PM996 | Kept at 9" with allows intensity of 10.84 mW/cm2 |
| Bluewave 200 UV spotlight | Blaze Technology | 120008, 122300 | |
| Tetrahydrofuran (THF) | Merck | 107025 | |
| Orbital shaker | Heidolph | 543-123120-00-5 | |
| Collagen Type I | Sigma Aldrich | C3867-1VL | From rat. 1x, w/o CaCl2 & MgCl2; pH = 7.2 |
| Phosphate Buffered Saline (PBS) | Gibco | 20012-027 | 16% W/V AQ. 10 x 10 ml |
| Paraformaldehyde | VWR | 43368.9M | Equipment |
| Freezone 4.5 freeze drier | Labconco | 7750020 | Equipment |
| Sputter coater | Jeol Ltd. | JFC-1600 | Equipment |
| Scanning Electron Microscope | Jeol Ltd. | JSM 5310 | |
| Anti-mouse primary antibodies against Collagen type I | Abcam | ab6308 | |
| Anti-mouse secondary antibody conjugated with Alexa Fluor 488 | Life Technologies | A21121 | |
| Plate, Tissue Culture 24 Well, Flat Bottom (Nunclon) | Bio-Rev PTE LTD | 3820-024 | |
| Dulbecco's Modified Eagle's Medium(DMEM) 2.5 g/L Glucose w/ L-Gln | Lonza | 12-604F | |
| Fetal Bovine Serum (FBS) | Gibco | A15-151 | |
| Penicillin-Streptomycin (P/S) | Life Tchnologies | 15140-122 E | |
| 100 mm Corning non-treated culture dishes | Sigma Aldrich | CLS430591 | |
| 0.25% Trypsin-EDTA | Gibco | 25200-056 | Equipment; 37 °C, 5% Humidity |
| Forma Steri-Cycle CO2 Incubators | Thermofisher Scientific | 371 | |
| Hausser Bright-Line Phase Hemacytometer | Thermofisher Scientific | 02-671-6 | |
| Live/Dead Viability/Cytotoxicity Kit for mammalian cells | Life Technologies | L3224 | |
| CCK-8 Assay | Dojindo Laboratories | CK04-11 | Monosodium-salt reagent (MSR) |
| Infinite 200 PRO microplate reader | Tecan | ||
| Albumin Human ELISA kit | Abcam | ab108788 | |
| Triton X-100 | Bio-Rad | #1610407 | |
| Bovine Serum Albumin (BSA) | Sigma-Aldrich | A2153-50G | |
| Anti-mouse primary antibodies (against CYP3A4, albumin) | Santa Cruz Biotechnology | sc-53850; sc-271605 | |
| DAPI | Life Technologies | D3571 | |
| Alexa Fluor 555 labeled Phalloidin | Life Technologies | A34055 | |
| Trizol | Life Technologies | 15596-026 | |
| Chloroform | VWR | 22706.326 | |
| Isopropanol | Fisher Scientific | 67-63-0 | |
| DPEC water | Thermofisher Scientific | AM9916 | |
| Nanodrop 2000c Spectrophotometer | Thermofisher Scientific | ND-2000 | |
| iScript Reverse Transcription Supermix | Bio-Rad Laboratories | 1708840 | |
| SYBR select Master Mix for CFX | Life Technology | 4472937 | |
| Primers (to be chosen) | |||
| CFX96 Real-Time System, C-1000 Touch Thermal Cycler | Bio Rad Laboratories | SOFT-CFX-31-PATCH |
参考文献
- Yamada, M., et al. Controlled formation of heterotypic hepatic micro-organoids in anisotropic hydrogel microfibers for long-term preservation of liver-specific functions. Biomaterials. 33 (33), 8304-8315 (2012).
- Abboud, G., Kaplowitz, N. Drug-induced liver injury. Drug Safety. 30 (4), 277-294 (2007).
- Cho, N. J., et al. Viral infection of human progenitor and liver-derived cells encapsulated in three-dimensional PEG-based hydrogel. Biomed Mater. 4 (1), (2009).
- Revzin, A., et al. Designing a hepatocellular microenvironment with protein microarraying and poly (ethylene glycol) photolithography. Langmuir. 20 (8), 2999-3005 (2004).
- Sato, A., Kadokura, K., Uchida, H., Tsukada, K. An in vitro hepatic zonation model with a continuous oxygen gradient in a microdevice. Biochem Bioph Res Com. 453 (4), 767-771 (2014).
- Domansky, K., et al. Perfused multiwell plate for 3D liver tissue engineering. Lab Chip. 10 (1), 51-58 (2010).
- Hegde, M., et al. Dynamic interplay of flow and collagen stabilizes primary hepatocytes culture in a microfluidic platform. Lab Chip. 14 (12), 2033-2039 (2014).
- Flaim, C. J., Chien, S., Bhatia, S. N. An extracellular matrix microarray for probing cellular differentiation. Nat methods. 2 (2), 119-125 (2005).
- Underhill, G. H., Chen, A. A., Albrecht, D. R., Bhatia, S. N. Assessment of hepatocellular function within PEG hydrogels. Biomaterials. 28 (2), 256-270 (2007).
- Dunn, J., Tompkins, R. G., Yarmush, M. L. Hepatocytes in collagen sandwich: evidence for transcriptional and translational regulation. J cell biol. 116 (4), 1043-1053 (1992).
- Dunn, J. C., Tompkins, R. G., Yarmush, M. L. Long-term in vitro function of adult hepatocytes in a collagen sandwich configuration. Biotechnol progr. 7 (3), 237-245 (1991).
- Ling, Y., et al. A cell-laden microfluidic hydrogel. Lab Chip. 7 (6), 756-762 (2007).
- Kim, M., Lee, J. Y., Jones, C. N., Revzin, A., Tae, G. Heparin-based hydrogel as a matrix for encapsulation and cultivation of primary hepatocytes. Biomaterials. 31 (13), 3596-3603 (2010).
- Kotov, N. A., et al. Inverted Colloidal Crystals as Three-Dimensional Cell Scaffolds. Langmuir. 20 (19), 7887-7892 (2004).
- Shanbhag, S., Woo Lee, J., Kotov, N. Diffusion in three-dimensionally ordered scaffolds with inverted colloidal crystal geometry. Biomaterials. 26 (27), 5581-5585 (2005).
- Lee, Y. H., Huang, J. R., Wang, Y. K., Lin, K. H. Three-dimensional fibroblast morphology on compliant substrates of controlled negative curvature. Integr Biol. 5, 1447-1455 (2013).
- da Silva, J., Lautenschlager, F., Kuo, C. H. R., Guck, J., Sivaniah, E. 3D inverted colloidal crystals in realistic cell migration assays for drug screening applications. Integr Biol. 3, 1202-1206 (2011).
- da Silva, J., Lautenschlager, F., Sivaniah, E., Guck, J. R. The cavity-to-cavity migration of leukaemic cells through 3D honey-combed hydrogels with adjustable internal dimension and stiffness. Biomaterials. 31, 2201-2208 (2010).
- Lee, J., Lilly, G. D., Doty, R. C., Podsiadlo, P., Kotov, N. A. In vitro toxicity testing of nanoparticles in 3D cell culture. Small. 5, 1213-1221 (2009).
- Lee, J., Kotov, N. A. Notch ligand presenting acellular 3D microenvironments for ex vivo human hematopoietic stem-cell culture made by layer-by-layer assembly. Small. 5, 1008-1013 (2009).
- Liu, Y., et al. Rapid aqueous photo-polymerization route to polymer and polymer-composite hydrogel 3D inverted colloidal crystal scaffolds. J Biomed Mater Res. Part A. 83, 1-9 (2007).
- Ma, P. X., Choi, J. W. Biodegradable polymer scaffolds with well-defined interconnected spherical pore network. Tissue Eng. 7, 23-33 (2001).
- Cuddihy, M. J., Kotov, N. A. Poly (lactic-co-glycolic acid) bone scaffolds with inverted colloidal crystal geometry. Tissue Eng Part A. 14, 1639-1649 (2008).
- Choi, S. W., Zhang, Y., Xia, Y. Three-dimensional scaffolds for tissue engineering: the importance of uniformity in pore size and structure. Langmuir. 26, 19001-19006 (2010).
- Choi, S. W., Zhang, Y., Thomopoulos, S., Xia, Y. In vitro mineralization by preosteoblasts in poly(DL-lactide-co-glycolide) inverse opal scaffolds reinforced with hydroxyapatite nanoparticles. Langmuir. 26, 12126-12131 (2010).
- Choi, S. W., Zhang, Y., Macewan, M. R., Xia, Y. Neovascularization in biodegradable inverse opal scaffolds with uniform and precisely controlled pore sizes. Adv Healthc Mater. 2, 145-154 (2013).
- Zhang, Y., Choi, S. W., Xia, Y. Modifying the Pores of an Inverse Opal Scaffold With Chitosan Microstructures for Truly Three-Dimensional Cell Culture. Macromol Rapid Commun. 33, 296-301 (2012).
- Cai, X., et al. Investigation of neovascularization in three-dimensional porous scaffolds in vivo by a combination of multiscale photoacoustic microscopy and optical coherence tomography. Tissue Eng. Part C, Meth. 19, 196-204 (2013).
- Zhang, Y. S., Yao, J., Wang, L. V., Xia, Y. Fabrication of Cell Patches Using Biodegradable Scaffolds with a Hexagonal Array of Interconnected Pores (SHAIPs). Polymer. 55, 445-452 (2014).
- Zhang, Y. S., Regan, K. P., Xia, Y. Controlling the Pore Sizes and Related Properties of Inverse Opal Scaffolds for Tissue Engineering Applications. Macromol Rapid Commun. 34, 485-491 (2013).
- Stachowiak, A. N., Bershteyn, A., Tzatzalos, E., Irvine, D. J. Bioactive Hydrogels with an Ordered Cellular Structure Combine Interconnected Macroporosity and Robust Mechanical Properties. Adv Mater. 17, 399-403 (2005).
- Stachowiak, A. N., Irvine, D. J. Inverse opal hydrogel-collagen composite scaffolds as a supportive microenvironment for immune cell migration. J Biomed Mater Res. Part A. 85, 815-828 (2008).
- Liu, Y., Wang, S. 3D inverted opal hydrogel scaffolds with oxygen sensing capability. Colloids and surfaces. B, Biointerfaces. 58, 8-13 (2007).
- Bryant, S. J., Cuy, J. L., Hauch, K. D., Ratner, B. D. Photo-patterning of porous hydrogels for tissue engineering. Biomaterials. 28, 2978-2986 (2007).
- Bhrany, A. D., Irvin, C. A., Fujitani, K., Liu, Z., Ratner, B. D. Evaluation of a sphere-templated polymeric scaffold as a subcutaneous implant. JAMA facial plastic surgery. 15, 29-33 (2013).
- Kuo, Y. C., Chiu, K. H. Inverted colloidal crystal scaffolds with laminin-derived peptides for neuronal differentiation of bone marrow stromal cells. Biomaterials. 32 (3), 819-831 (2011).
- Yang, J. T., Kuo, Y. C., Chiu, K. H. Peptide-modified inverted colloidal crystal scaffolds with bone marrow stromal cells in the treatment for spinal cord injury. Colloids Surf. B, Biointerfaces. 84, 198-205 (2011).
- Kuo, Y. C., Tsai, Y. T. Inverted colloidal crystal scaffolds for uniform cartilage regeneration. Biomacromolecules. 11, 731-739 (2010).
- Choi, S. W., Xie, J., Xia, Y. Chitosan-Based Inverse Opals: Three-Dimensional Scaffolds with Uniform Pore Structures for Cell Culture. Adv Mater. 21, 2997-3001 (2009).
- Long, T. J., Sprenger, C. C., Plymate, S. R., Ratner, B. D. Prostate cancer xenografts engineered from 3D precision-porous poly(2-hydroxyethyl methacrylate) hydrogels as models for tumorigenesis and dormancy escape. Biomaterials. 35, 8164-8174 (2014).
- Kuo, Y. C., Tsai, Y. T. Inverted colloidal crystal scaffolds for uniform cartilage regeneration. Biomacromolecules. 11, 731-739 (2010).
- Kuo, Y. C., Chiu, K. H. Inverted colloidal crystal scaffolds with laminin-derived peptides for neuronal differentiation of bone marrow stromal cells. Biomaterials. 32, 819-831 (2011).
- Lee, J., Cuddihy, M. J., Cater, G. M., Kotov, N. A. Engineering liver tissue spheroids with inverted colloidal crystal scaffolds. Biomaterials. 30 (27), 4687-4694 (2009).
- Galperin, A., et al. Integrated bi-layered scaffold for osteochondral tissue engineering. Adv Healthc Mater. 2, 872-883 (2013).
- Waters, D. J., et al. Morphology of Photopolymerized End-linked Poly(ethylene glycol) Hydrogels by Small Angle X-ray Scattering. Macromolecules. 43 (16), 6861-6870 (2010).
- Elbert, D. L., Hubbell, J. A. Conjugate addition reactions combined with free-radical cross-linking for the design of materials for tissue engineering. Biomacromolecules. 2 (2), 430-441 (2001).
- Kim, M. H., et al. Biofunctionalized Hydrogel Microscaffolds Promote Three-Dimensional Hepatic Sheet Morphology. Macromol Biosci. , (2015).
- Ferreira, T., Rasband, W. ImageJ User Guide. , http://imagej.nih.gov/ij/docs/guide/146-30.html#toc-Subsection-30.1 (2012).
- JoVE Science Education Database. General Laboratory Techniques. Introduction to Fluorescence Microscopy. , JoVE. Cambridge, MA. (2015).
- Tominaga, H., et al. A water-soluble tetrazolium salt useful for colorimetric cell viability assay. Anal Commun. 36 (2), 47-50 (1999).
- JoVE Science Education Database. General Laboratory Techniques. Introduction to the Microplate Reader. , JoVE. Cambridge, MA. (2015).
- JoVE Science Education Database. Basic Methods in Cellular and Molecular Biology. The ELISA Method. , JoVE. Cambridge, MA. (2015).
- Nolan, T., Hands, R. E., Bustin, S. A. Quantification of mRNA using real-time RT-PCR. Nat Protoc. 1, 1559-1582 (2006).
- JoVE Science Education Database. Essentials of Environmental Microbiology. RNA Analysis of Environmental Samples Using RT-PCR. , JoVE. Cambridge, MA. (2016).
- JoVE Science Education. Essentials of Environmental Microbiology. , JoVE. (2015).
- Jeong, S., et al. The evolution of gene regulation underlies a morphological difference between two Drosophila sister species. Cell. 132 (5), 783-793 (2008).
- Griffith, L. G., Naughton, G. Tissue engineering--current challenges and expanding opportunities. Science. 295 (5557), 1009-1014 (2002).
- Hegde, M., et al. Dynamic Interplay of Flow and Collagen Stabilizes Primary Hepatocytes Culture in a Microfluidic Platform. Lab Chip. 14, 2033-2039 (2014).
- Kim, Y., Lasher, C. D., Milford, L. M., Murali, T., Rajagopalan, P. A comparative study of genome-wide transcriptional profiles of primary hepatocytes in collagen sandwich and monolayer cultures. Tissue Eng Pt C. 16 (6), 1449-1460 (2010).
- Baimakhanov, Z., et al. Efficacy of multi-layered hepatocyte sheet transplantation for radiation-induced liver damage and partial hepatectomy in a rat model. Cell Transplant. , (2015).
- Li, C. Y., et al. Micropatterned Cell-Cell Interactions Enable Functional Encapsulation of Primary Hepatocytes in Hydrogel Microtissues. Tissue Eng Pt A. 20 (15-16), 2200-2212 (2014).
- Shlomai, A., et al. Modeling host interactions with hepatitis B virus using primary and induced pluripotent stem cell-derived hepatocellular systems. P Natl A Sci USA. 111 (33), 12193-12198 (2014).
- Curcio, E., et al. Mass transfer and metabolic reactions in hepatocyte spheroids cultured in rotating wall gas-permeable membrane system. Biomaterials. 28, 5487-5497 (2007).
- Martinez-Hernandez, A., Amenta, P. The hepatic extracellular matrix. Vichows Archiv A Pathol Anat. 423, 1-11 (1993).
- Liu, Y., Wang, S., Lee, J. W., Kotov, N. A. A Floating Self-Assembly Route to Colloidal Crystal Templates for 3D Cell Scaffolds. Chem Mater. 17 (20), 4918-4924 (2005).
Access restricted. Please log in or start a trial to view this content.
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved