A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
המצאה של הפוך קולואיד קריסטל פולי (אתילן גליקול) פיגום: פלטפורמת תרבית תאים תלת ממדי עבור הנדסת רקמות כבדה
In This Article
Summary
This manuscript presents a detailed protocol for the fabrication of an emerging three-dimensional hepatocyte culture platform, the inverted colloidal crystal scaffold, and the concomitant techniques to assess hepatocyte behavior. The size-controllable pores, interconnectivity and ability to conjugate extracellular matrix proteins to the poly(ethylene glycol) (PEG) scaffold enhance Huh-7.5 cell performance.
Abstract
היכולת לשמור על תפקוד hepatocyte במבחנה, לצורך בדיקת הרעילות 'xenobiotics, לומד זיהום בנגיף ופיתוח תרופות הממוקדות על הכבד, דורשת פלטפורמה שבה תאים מקבלים רמזים ביוכימיים מכאניים מתאימים. מערכות הנדסיות כבדות רקמות שנעשו לאחרונה מועסקי פיגומים תלת ממדי (3D) מורכב הידרוג סינטטי או טבעי, נתון החזקת המים הגבוהה שלהם ואת יכולתם לספק הגירויים המכאניים הדרושים על ידי התאים. חלה התעניינות גוברת בגביש קולואידים ההפוך (ICC) הפיגום, התפתחות מאוחרת, המאפשרת ארגון מרחבית גבוה, homotypic ואינטראקצית תא heterotypic, כמו גם תאי מטריקס תאים (ECM) אינטראקציה. בזאת, אנו מתארים פרוטוקול לפברק פיגום ICC באמצעות פולי (אתילן גליקול) diacrylate (PEGDA) ואת שיטת שטיפת חלקיקים. בקצרה, סריג הוא עשוי חלקיקים microsphere, שלאחריו א-פולימריים מראשפתרון r מתווסף, polymerized כראוי, ואת החלקיקים ואז הסיר, או דלף, באמצעות ממיס אורגני (למשל, tetrahydrofuran). פירוקה של תוצאות הסריג ב פיגום נקבובי ביותר עם גדלים נקבוביים מבוקרים interconnectivities המאפשר תקשורת להגיע תאים יותר בקלות. מבנה ייחודי זה מאפשר שטח פנים גבוה עבור התאים לדבוק כמו גם תקשורת קלה בין נקבובי, ואת היכולת לצפות את פיגום ICC PEGDA עם חלבונים גם מראה השפעה ניכרת על ביצועי תא. אנחנו מנתחים את המורפולוגיה של הפיגום כמו גם תא hepatocarcinoma (הא-7.5) התנהגות מבחינת כדאיות ולתפקד לחקור את השפעת מבנה ICC וציפויי ECM. בסך הכל, מאמר זה מספק פרוטוקול מפורט של פיגום המתעורר כי יש יישומים רחבים בהנדסת רקמות, במיוחד הנדסת רקמות כבדה.
Introduction
הכבד הוא איבר vascularized מאוד עם מספר רב של פונקציות, כולל סילוק רעלים מן הדם, חילוף חומרים של xenobiotics, ואת הייצור של חלבונים בסרום. יש כבד רקמות מייקרו תלת ממדי (3D) מורכב, הכולל סוגי תאים מרובים, מרה, נקבות, sinusoids, ואזורים של רכב biomatrix שונה ריכוז חמצן שונה. בהינתן המבנה המורכב הזה, זה כבר קשה כדי ליצור מודל כבד ראוי במבחנה 1. עם זאת, יש ביקוש הגובר פונקציונלי במודלים חוץ גופית אירוח hepatocytes אדם כפלטפורמות לצורך בדיקת רעילות התרופה 2 ולומדים מחלות הקשורות בכבד 3.
פלטפורמות הנדסת רקמות כבדות נוכחיות יש לפשט את המורכבות של הכבד על ידי בידוד אחד, או התמקדות כמה, אחד מהפרמטרים של הכבד, כלומר שיתוף התרבות של תאים 4, הרכב הביוכימי של zonamicroenvironments l 5, דינמיקת זרימת 6,7 ואת התצורה של biomatrix 8. תצורה של biomatrix ניתן לחלק פרמטרים כגון חומרי פיגום, רכב החלבונים (ECM) מטריקס, נוקשות מטריקס כמו גם את העיצוב ומבנה של הפיגום. חל עלייה במחקרי הנדסת רקמות באמצעות הידרוג סינטטי, במיוחד פולי (אתילן גליקול) (PEG) הידרוג 9, נתן את היכולת לכוון את התכונות המכאנית של הידרוג'ל, פעילות ביולוגית, ואת קצב הידרדרות. לגבי מחקר כבד קשור, הידרוג הביולוגי יושם ללימוד הידבקות בוירוס של מחלה כבדה 3. כתוצאה עיצוב פלטפורמה hepatocyte, מחקרים רבים השתמשו תרבויות כריך hepatocyte 10,11 ו אנקפסולציה תא בתוך הידרוג'ל 12,13 לספק סביבת 3D ותא-ECM ואינטראקציה בין תאים שהם חיוניים כדי לחקות microenvironment vivo. HoweVer, פלטפורמות אלה אינן בעלי רמה גבוהה של שליטה וארגון מרחבים, שמובילות נכסים לא אחידים באמצעות הפיגום 14.
קולואידים קריסטל הפוכה (ICC) 14 הפיגום הוא פיגום 3D מאורגן עבור תרבית תאים כי הוצג לראשונה בתחילת שנות ה -2000. המבנה הייחודי של הפיגום ניתן לייחס לתהליך הייצור הפשוט באמצעות גביש קולואידים, סריג הורה של חלקיקים קולואידים של קוטר משתנה. בקצרה, כדי לסכם את התהליך, חלקיקים מסודרים בקפידה annealed שימוש בחום כדי ליצור סריג. השטיפה של סריג זה, על ידי ממס אורגני, בתוך תוצאות הידרוג'ל polymerized חללי כדורי ארז hexagonally 15 עם שטח פנים גבוהים. פיגום מאוד הורה זה נעשה בעבר עם חומרים סינתטיים וטבעיים כאחד, כולל אך לא מוגבל פולי (acrylamide) 16-21, פולי (לקטית-שיתוף גליקולית וחומצה) 15,22-30, פולי (אתילן גליקול) 31,32, פולי (methacrylate 2-hydroxyethyl) 21,33-35, ו chitosan 36-39. פיגומי ICC עשויים מחומרים שאינם עכירות נוטים לקדם spheroids הסלולר בתוך החללים 14,23,40. סוגי תאים מרובים הוכחו להתרבות בהצלחה, להבדיל ותפקוד בתוך בתצורה זו, כולל chondrocytes 41, בתאי סטרומה מח עצם 42, ותאי גזע 43,44. לגבי hepatocyte, נעשו מחקרים עם פיגומים ICC עשויים Na 2 SiO 3 ו פולי (acrylamide), אבל לא PEG. עם אסטרטגיות bioconjugation פשוט (כלומר, צימוד אמין באמצעות EDC / NHS), ECM חלבונים מצומדות מבוססי PEG פיגומים יכול להיות מפוברק, כי יכול להוכיח יותר תאים אתרי הקישור להיות יותר in vivo כמו הסביבה ולשפר את תפקוד הכבד.
בכתב היד הזה והסרטון המשויך, נפרטו את הייצור של פיגום ICCבאמצעות פולי (אתילן גליקול) diacrylate הידרוג'ל (PEGDA) ו סריג microsphere פוליסטירן, מותאם במיוחד hepatocarcinoma (הא-7.5) תרבות. אנו מדגימים את ההבדלים בין פיגומי ICC nonadhesive החשופים PEGDA בכלל פיגום ICC PEGDA מצופה קולגן מבחינת טופולוגיה פיגום וביצועי תא. כדאיות ותפקוד תא נמדדת איכותית וכמותית להעריך התנהגות תא הא-7.5.
Access restricted. Please log in or start a trial to view this content.
Protocol
1. ייצור פיגום ICC (איור 1)
- הכן את פוליסטירן (PS) חסימה (קוטר = 6 מ"מ; 8-13 שכבות של חרוזים).
- כדי להכין את התבנית, לחתוך את העצות מן 0.2 מיליליטר צינורות microcentrifuge הוכחה לרתיחה ברמת 40 μl. ציית העליון של צינורות לחתוך עד 24 x 60 מ"מ 2 תלושי זכוכית מיקרוסקופ לכסות עם דבק עמיד למים.
- שים את התחומים PS (קוטר = 140 מיקרומטר) בתוך השעיה מים לתוך 20 מ"ל בקבוקון, בזהירות פיפטה את ההשעיה מים, ולהוסיף 18 מ"ל של 70% פתרון אתנול לתוך בקבוקון. שים את הפתרון במישור לתוך אמבטיה קולית כדי לשחרר תחומים מצטברים. חזור על שלב זה כביסה מספר פעמים כדי להסיר רכיבים מים מסיסים במים לחלוטין.
- פיפטה 100 μl של אתנול לתוך התבניות.
- חותכים את החלק העליון של קצה micropipette 200 μl ידי 4 מ"מ. פיפטה 25 μl של הספירות לתוך התבנית פעמיים באמצעות micropipette 200 μl להשיגנפח כולל של 50 μl בכל עובש.
- מניחים את התבניות על שייקר נדנדה ב לילה סל"ד 120.
- בדוק את הסדר של הספירות בכל עובש תחת מיקרוסקופ אופטי. אם הספירות אינן הורה hexagonally, להוסיף 50 μl של 70% אתנול ו לנער ידני בכיוון ציר האורך לרוחב לתקן את ההסדר.
- תנו להתאדות אתנול בטמפרטורת החדר (RT) למשך שני לילות. מניחים את התבנית ומורכב חרוז בכבשן C 130 מעלות במשך 6 שעות כדי לחשל את החרוזים PS.
- הכנת פיגומי PEGDA חשופים ECM מצופה.
- לסנתז macromers PEGDA תוך שימוש בפרוטוקולים הוקמה 45,46 עבור acrylating macromers PEG ליניארי (M w = 4.6 KDA).
- כן 50% (w / v) פתרון PEGDA ב דה מיונן (DI) מים ולאפשר macromer לפזר ידי צנטריפוגה כראוי 4,713 XG עד שהוא נמס לגמרי.
- עבור פיגומי ICC מצומדות ECM, לפזר נוסף10% (w / v) Acryloyl-PEG-NHS (M w = 3.4 KDA) בתמיסה 50% PEGDA.
- הכן 20% (w / v) פתרון המניות של 2-הידרוקסי-4 '- (2-hydroxyethoxy) -2-methylpropiophenone (PI) באתנול 70%.
- הוסף 50 μl של 20% (w / v) פתרון המניות PI לכל 1 מ"ל של 50% (w / v) של PEGDA. התאם את הסכום הדרוש של פתרון המניות PI לפי המשקל המולקולרי של PEGDA.
- וורטקס את התערובת צינור צנטריפוגות דקות 1 להגיע לפתרון הומוגנית.
- מקלף את תבניות משקופית הזכוכית (משלב 1.1.7), להסיר את הדבק מהתבניות, לדחוף הסריגים החוצה בעזרת מרית בזהירות ומניח כל אחד מהם לתוך צינור 1.5 מיליליטר. פיפטה 300 μl של פתרון צנטריפוגות PEGDA ב 845 XG במשך 5 דקות, כדי לאפשר חדירת פתרון PEGDA הנכונה לתוך הסריג.
- הסר את הסריג מהצינור באמצעות פינצטה ובזהירות למחוק יבש עודף פתרון PEGDA על כפפות. מניח את הסריג על כוס סרט מכוסי פרפין עם CIR השטוחמשטח cular פונה כלפי מעלה.
- לחשוף את הפיגום הסתננו פתרון PEGDA 365 ננומטר אולטרה סגול (UV) אור (10.84 mW / cm 2) במשך 5 דקות באמצעות מנורת ספוט UV.
- מניח סריגי גביש PEGDA-polymerized צלוחיות חדשות (כ -10 סריגים לכל בקבוקון) ולהוסיף 20 מיליליטר של tetrahydrofuran (THF). לנער את הצלוחיות על שייקר מסלולית ב 300 סל"ד. שנת THF לפחות 3 פעמים עם מרווח של 1-2 שעות.
הערה: אל תסיר THF לחלוטין כאשר משנים את THF על מנת למנוע בועות מלהיכנס הפיגומים, אשר בתורו יכול לגרום להסרה חלקית של PS. השאר פתרון מספיק כדי לכסות את הסורגים ולהוסיף THF חדש.
זהירות: THF הוא רעיל. יש להשתמש בכפפות, מעיל ומשקפי במעבדה. הימנע משאיפת ידי הפעלה מתחת למכסה המנוע קטר. - בדוק אם תחומי PS הם מומסים ידי הצבת מים לתוך תמיסת THF המשומשת התבוננות צבע הפתרון. חזור על שלב 1.2.9 אם ספירות PS אינן מומסות כראוי.
הערה: צבע הפתרון ישתנהלבן אם יש תחומים PS הנותרים.
- נקה את הפיגומים בקבינט הבטיחות הביולוגי (BSC).
- כדי לעקר את הפיגומים, להכין צינור צנטריפוגה 50 מ"ל עם 2 מ"ל של אתנול 70% לכל פיגום ומניחים הפיגומים בצינור בעזרת מרית. אפשר הפיגומים להשרות באתנול במשך שעה 1. משלב זה ואילך, לנהל את כל ההליכים של BSC.
- יוצקים בזהירות את אתנול ולהחליף חיץ מלוחים פוספט (PBS) (2 מ"ל לכל הפיגום) צנטריפוגות ב 524 XG במשך 3 דקות כדי להסיר בועות. שמור את זה במקרר ולשנות את PBS כמה פעמים עם מרווח של 1-2 שעות.
- עבור סוג קולגן מצופה שאני פיגומים, להכין עוד צינור 50 מ"ל צנטריפוגות המכיל פתרון המניות קולגן מסוג 1 (1 מ"ל לכל הפיגום), להעביר את הפיגומים מעוקר כדי הצינור הזה בעזרת מרית, ו צנטריפוגות ב 524 XG במשך 3 דקות. לנער את הפיגומים ב 400 סל"ד על שייקר מסלולית במשך 30 דקות ולשמור את צינורית מכשיר הקירוראו לילה.
- לשטוף את הפיגומים עם PBS פעמים לפני השימוש על ידי השריית הפיגומים ב PBS הטרי ולאחר מכן aspirating PBS.
הערה: חלבונים אחרים ECM יכול לשמש גם במקום סוג קולגן אני בגלל הכימיה NHS דורש קבוצה אמינית ליצור קשר מיוחד (איור 2).
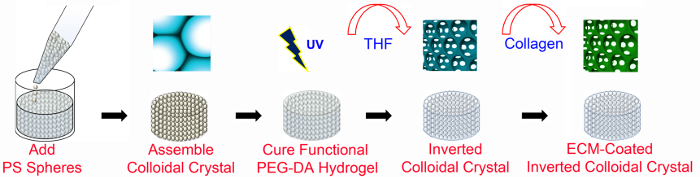
באיור 1. סקירה כללית של ייצור ICC. פיגומים ICC מבוססי PEG מיוצרים תוך שימוש בטכניקות microfabrication עם ובלי-functionalization ECM. פיגומים ICC ECM מצופה דורשים PEG-NHS וכן PEGDA (כמפורט באיור 2). סריג PS בעל קוטר של 6 מ"מ וגובה של 8-13 שכבות חרוזות. PS, קלקר; PEGDA, פולי (אתילן גליקול) diacrylate; UV, אולטרה סגול; THF, tetrahydrofuran; ECM, תאי מטריקס. דמות זו שונתה, ונמצאת בשימוש באישורו מהאינטרנט47 ליי. אנא לחץ כאן כדי לצפות בגרסה גדולה יותר של דמות זו.
2. אפיון מבנה ICC
- כדי לנתח את המבנה ICC עם או בלי חלבונים מצומדות, השתמש במיקרוסקופ אלקטרונים סורק (SEM) 47.
- תקן הפיגומים עם 4% paraformaldehyde (PFA), מייבשים אותם סדרתי 25, 50, 75, 95 ו -100 פתרונות אתנול%, ולאחסן אותם ב -80 ° C עד מתאדה אתנול לחלוטין.
- דגימות יבשות בתוך יבשים להקפיא במשך 48 שעות.
- הצמד את המדגם על בעל מדגם באמצעות קלטת הפחם ומניח coater גמגום.
- לאחר שאיבת אבק אוטומטי, לצפות אותו סרט Pt של עובי 10 ננומטר על ידי המקרטעת במשך 60 שניות ב 20 mA.
- פיגומים ICC תמונה באמצעות SEM במתח של 5 קילו וולט (איור 3 א, איור 4 א).
- כדי למדוד את הנקבוביותבקוטר של חללים הקישוריות, לנתח micrographs SEM באמצעות ניתוח תמונה תוכנה 48 (למשל, ImageJ; איור 3B, C).
- כדי להמחיש את הקולגן מצומדות אל הגרדום ללא תאים, תג fluorescently קולגן באמצעות נוגדנים (1: 100) נגד שאני סוג קולגן תמונה עם מיקרוסקופ סריקת לייזר confocal 47 (CLSM; איור 4).
3. הא-7.5 תרבות זריעת תאים
- תרבות הא-7.5 התאים בצפיפות זריעה של 2-2.5 x 10 מ"ל 6 תאים / במנות תרבית תאים 100 מ"מ עם 10 מ"ל בינוני של הנשר שונה של Dulbecco (DMEM) בתוספת 10% בסרום שור עוברית (FBS) ו -100 U / ml פניצילין, סטרפטומיצין (התקשורת צמיחה) בשעה 37 ° C ו 5% CO 2. שנה את התקשורת בכל שלושה ימים של BSC עד שהם הגיעו 75-80% confluency.
- הכן את פיגומי זריעת תאים של BSC.
- בזהירות את scaffבנים בצלחת 24-היטב עם המשטח השטוח פונים כלפי מעלה.
- כדי לשטוף את הפיגום, פיפטה 2 מ"ל PBS על כל היטב המכיל פיגום. לשאוב PBS ו פיפטה 2 מ"ל טרי PBS לבאר כל אחד.
- לשאוב PBS ו פיפטה 2 מ"ל של התקשורת צמיחה (ראה שלב 3.1) ולהשאיר למשך 30 דקות. לשאוב את התקשורת ולאפשר הפיגום להתייבש במשך שעה 1.
- ניתוק תאים הא-7.5 ומחוברות (משלב 3.1) מצלחת התרבות של BSC בשיטת עיכול טריפסין.
- לשאוב תקשורת מצלחת, להוסיף 4 מיליליטר PBS לשטוף תאים חסידים ואחר כך לשאוב PBS.
- פיפטה 0.75-1 מ"ל 0.25% טריפסין ומניחים באינקובטור ב 37 מעלות צלזיוס, 5% CO 2 דקות 3.
- הסר את צלחת מן החממה פיפטה 5 מ"ל התקשורת כדי לעצור את התגובה טריפסין. התקשורת פיפטה, תאים מנותקים, ואת תערובת טריפסין לתוך צינור 15 מ"ל.
- צנטריפוגה ב 524 XG במשך 3 דקות, להסיר את supernatant ו resuspend גלולה ב 5 מ"ל התקשורת.
- ספירת תאים באמצעות hemocytometer ולחשב את עוצמת הקול של ההשעיה התא המכיל תאים בבית מספר היעד, N 0, לכל 25 μl (עבור ניסוי רגיל, N 0 הוא 1 x 10 6 תאים).
נפח תא ההשעיה = (מספר היעד של תאים) / (ריכוז של תרחיף תאים) - לאט פיפטה 25 μl של השעיה תא (המכיל N 0 תאים) ישירות על גבי כל פיגום (משלב 3.1.4). מניחים את צלחת 24 גם בחממה.
- לאחר 12 שעות, להעביר את הפיגומים בזהירות עם שימוש מרית לתוך צלחת 24 גם חדשה פיפטה 2 מיליליטר של מדיה לתוך כל טוב. מניחים את צלחת 24 גם בחממה.
- שנה את התקשורת כל 3 ימים או תלוי מתי נאספת תקשורת לניתוח הפרשת חלבון (ראה שלב 5.1).
כדאיות התא 4.
- כדי לנתח כדאיויות תא איכותי, השתמש חי ניאון / ערכות מכתימות מתות להכתים את תאי תמונה באמצעות CLSM.
- בעקבות הוראת ערכה, להכין פתרון עם AM 4 מיקרומטר calcein ו -8 מיקרומטר ethidium ההומו-דימר-1 בתקשורת (ראה שלב 3.1.3).
הערה: מטב תלוי את המספר הסלולרי. השתמש כמות כפולה של מגיב אם התאים להתרבות כפול מספר (כ -2 מיליון). - ב BSC, התקשורת לשאוב בכל טוב עם פיגום (שלב 3.7) ו פיפטה 500 μl של פתרון מוכן. דגירת דגימות 37 ° C חממה עבור שעה 1.
- מכסים את הצלחות בנייר כסף כדי להגן על דגימות מן האור בעת הסרת צלחת מתוך האינקובטור. דגימות תמונה באמצעות CLSM49.
- בעקבות הוראת ערכה, להכין פתרון עם AM 4 מיקרומטר calcein ו -8 מיקרומטר ethidium ההומו-דימר-1 בתקשורת (ראה שלב 3.1.3).
- כדי להעריך כדאיות התא כמותית, שמדד את הפעילות האנזימטית (בתאים חיים) באמצעות מבחני colorimetric 50 (כלומר, 2- (2-methoxy-4-nitrophenyl) -3- (4-nitrophenyl) -5- (2,4-disulfophenyl) -2H-tetrazolium (מגיב-מלח גלוטמט)).
- צור עקומת סטנדרט עבור פלטפורמת ICC (כלומר, גרף של הספיגה (OD) נersus נתון מספר התא).
הערה: זריעת Cell היא לא 100% יעילה בהשוואה לפלטפורמות אחרות, מאז תאים יכולים לעבור דרך החללים של פיגומים.- לקבוע את מספרי זריעת תאים, N 0 אשר ישמש על מנת להפוך את העקומה הסטנדרטית.
הערה: בחר מגוון הכולל מספרים סלולריים המוערכות בניסוי. לדוגמא, אם את המספר הסלולרי הראשוני הוא 5 x 10 5 תאים יש עלייה של פי הערכה ~ 3 עד ליום האחרון של הניסוי, לבחור 2.5 x 10 5, 5 x 10 5, 1 x 10 6, ו -2 x 10 6 תאים כמו N 0. - בצע זריעת תא הפיגומים ICC (אחד N 0 כל פיגום עם נפח זריעה של 25 μl) כמתואר בשלבים 3.1-3.6.
- לאחר 6 שעות, להעביר את הפיגומים לצלחת 24 גם אחר כן. בחר זמן המאפשר דבקות תא אבל לא תא תפוצה.
- בצעו ספירת תאים על הפיגום ICC העבירה.
- לדלל 10x מגיב מונוסודיום-מלח פתרון (MSR) כדי 1X עם התקשורת הפתרון BSC ו פיפטה 500 μl 1x MSR לבאר כל עם פיגום. דגירת צלחת 24 גם ב 37 מעלות צלזיוס במשך שעה 1.
- מכל טוב, להעביר 100 μl לתוך צלחת 96-היטב היטב. כתוצאה ריקה, פיפטה 100 μl של פתרון מגיב 1x מונוסודיום-מלח טרי לתוך בארות שונות על ההצלחה 96-היטב. ההסרה ידנית כל בועות נוכחות באמצעות קצה פיפטה יבש לכסות את צלחת 96-היטב בנייר כסף כדי להגן עליו מפני אור.
- OD מדוד ב λ = 450 ננומטר ההקראה ספקטרופוטומטר. הפחת את OD הריק מערכים אחרים כדי למצוא את OD המדויק 51.
- ספירת התאים (L N) שנותרה הבאר לאחר העברת הפיגום (שלב 4.2.1.3) באמצעות hemocytometer.
הערה: השתמש 300 μl של טריפסין כדי trypsinize התאים. - לחשב את מספר הסלולרי בפועל, נ א.
= בפועלראשוני - נשאר גם
N A = N 0 -N L - הפוך עקומת סטנדרט ידי התוויית OD שהושגו בשלב 4.2.1.4.3 לעומת מספר הסלולרי בפועל (נ א) ולהשתמש זה להעריך את מספר הסלולרי בניסויים.
הערה: הפוך עקומת סטנדרט חדש אם כל הפרמטרים ICC (כלומר, גודל porogen, מידות של הפיגום, ECM חלבון, וכו ') משתנים.
- לקבוע את מספרי זריעת תאים, N 0 אשר ישמש על מנת להפוך את העקומה הסטנדרטית.
- צור עקומת סטנדרט עבור פלטפורמת ICC (כלומר, גרף של הספיגה (OD) נersus נתון מספר התא).
תפקוד התא 5.
- לנתח הפרשת חלבון על ידי התאים הא-7.5 (כלומר, אלבומין, אוריאה) מהתקשורת שנאספו (משלב 3.7) על ידי האנזים צמוד assay immunosorbent (ELISA) 52.
הערה: לדלל את התקשורת, בהתאם למספר של תאים שנזרעו וכמות התקשורת שנאספה. במשך 5 x 10 5 תאים שנזרעו בכאל, השתמש ~ 1: 25 יחס, לפני החדרת אותו בארות נוגדן-Precoated. - כדי לנתח איכותית תפקוד התא, immunostain חלבונים ספציפיים תאיים(כלומר, אלבומין), אנזימים (כלומר, CYP450), רכיבים מבניים כתם (כלומר, יקטין הסלולר) כמו גם את הגרעינים ואת תמונה באמצעות CLSM 49.
- לשאוב התקשורת (משלב 3.7) ו פיפטה 2 מ"ל PBS כדי לשטוף את הפיגומים ICC-לאדן התא.
- פיפטה 1 מ"ל של 4% PFA דגירה במשך 5 דקות בטמפרטורת החדר למשך קיבעון.
- לשטוף 3x עם 2 מ"ל PBS.
- Permeabilize ממברנות ידי דוגרים הפיגומים ב 1 מ"ל של 0.1% 4- (1,1,3,3-tetramethylbutyl) גליקול פניל-פוליאתילן (חומרים פעילי שטח) למשך 30 דקות.
- 3x לשטוף עם 2 מיליליטר PBS להסיר כל חלבונים דולפים.
- פיפטה 500 μl 1% אלבומין בסרום שור (BSA) ו דגירה ב RT עבור שעה 1 לחסום הלא ספציפית מחייב.
- הכן נוגדן ראשוני מדולל (כלומר, אלבומין, CYP450) פתרון.
- פיפטה 500 μl של פתרון BSA 1% לתוך צינור 15 מ"ל ולהוסיף 4.5 מ"ל של 0.1% פתרון פעילי שטח להכין פתרון BSA 5 מ"ל של 0.1% בסך הכל.
- פיפטה 98 μl של פתרון BSA 0.1% לתוך צינור 200 μl microcentrifuge ו -2 μl של הנוגדן הראשוני לייצר 01:50 (נוגדן ראשוני: BSA 0.1%) פתרון נוגדן ראשוני.
- פיפטה 40 μl של פתרון הנוגדן הראשוני על הפיגום ולכסות את המצע עם סרט פרפין. עוטפים 24 את הצלחת היטב בנייר אלומיניום ולאחסן את המנה ב 4 מעלות צלזיוס למשך הלילה.
- לשטוף 3x עם 2 מ"ל PBS ולנער את הצלחת בעדינות בין הכביסה.
- כן נוגדנים משני biotinylated מדוללים (כלומר, אנטי עכבר נוגדנים) פתרון מניות.
- פיפטה 198 μl 0.1% פתרון BSA ו -2 μl נוגדן השני כדי לייצר 1: 100 (נוגדנים משני: 0.1% BSA) פתרון נוגדנים משני.
- כן פתרון מניות 0.1% rhodamine או והעמסה שכותרתו phalloidin (להכתים את הסיבים יקטינו הסלולר) בפתרון 0.1% BSA.
- פיפטה 25 μl של כל פתרון בתוך שפופרת ומערבבים well.
- פיפטה 50 μl של פתרון מניות נוגדנים משני על הפיגום. מכסה את הפיגום עם סרט פרפין, לעטוף את המנה עם רדיד אלומיניום ולאחסן ב RT עבור שעה 2.
- לשטוף 3x עם 2 מ"ל PBS.
- פיפטה 200 μl של 0.2% 4'-6-diamidino-2-phenylindole (DAPI; כתם גרעין) פתרון על הפיגום ולשמור ב RT במשך 2-3 דקות. מכסים את הצלחת בנייר אלומיניום.
- לשטוף 2x עם 2 מ"ל PBS.
- באמצעות טפטף, במקום ירידה של תקשורת הרכבה על פני המצע.
- בזהירות לשים את הפיגום בשקופית זכוכית תמונה באמצעות CLSM 47.
- הערכת ביטוי גנים על ידי תגובת שרשרת פולימרז בזמן אמת (qPCR). השתמש ערכות תקן PCR transcriptase הפוכה (RT-PCR) 53 ו qPCR 54 לפי הוראות היצרן. חלץ את RNA מתאי כמתואר להלן.
- מניחים את הפיגום (משלב 3.7) בצינור microcentrifuge 1.5 מ"ל.
- פיפטה 1 מ"ל של פתרון מיצוי RNA לתוך הצינור ולשמור בתוך sonicator במשך 5 דקות ב RT.
- פיפטה 200 μl של כלורופורם אל צינור אחד microcentrifuge ולנער את הצינור במרץ ביד במשך 15-20 שניות. שמור את הצינורות ב RT עבור ~ 3 דקות עד השלבים נפרדים.
- צנטריפוגה מדגם ב 13,000 XG, 4 מעלות צלזיוס במשך 15 דקות ולהסיר את הצינורות בקפידה כך שלבי לא הולכים ביחד.
- בזהירות פיפטה 500-600 μl של שלב מהימי העליון מהצינור הראשון לתוך צינור microcentrifuge שני.
- הוסף נפח שווה ערך (500-600 μl) של isopropanol צינור השני.
- להפוך את הצינור 3-5 פעמים ולהשאיר הצינור עומד ב RT במשך 10 דקות.
- צנטריפוגה מדגם ב 13,000 XG, 4 מעלות צלזיוס במשך 15 דקות.
- אם גלולה אינה גלויה בתחתית הצינור, צנטריפוגות שוב במשך 5 דקות.
הערה: אם עדיין אין גלולה גלויה, בסך של RNA עשוי להיות מספיק.
- אם גלולה אינה גלויה בתחתית הצינור, צנטריפוגות שוב במשך 5 דקות.
- אניצינורות nvert עם הכובע פתוח להשליך supernatant פיפטה באתנול 1 מיליליטר 70% מדוללים במי DEPC לתוך הצינור.
- מעט מערבולת הצינור כך גלולה מנתק מהקיר של הצינור ולאחר מכן אפשר יבש צינור אוויר.
- הוסף 50 μl של מי DPEC כדי resuspend הגלולה.
- שמור pipetting עד להמסת הגלולה.
- שמור במשך 10 דקות ב 55 מעלות על מנת לפגל RNA פעמיים תקועים לתוך רנ"א חד-גדילי.
- קל לתופף אצבעות על התחתונה הצינור ולאחר מכן צנטריפוגות בקצרה הצינורות (7,500 XG, 4 דק ', 4 ° C).
- שמור את הצינורות בקרח עד ביצוע 55 transcriptase ההפוכה בזמן אמת PCR, כמתואר 56.
Access restricted. Please log in or start a trial to view this content.
תוצאות
תוצאות הנציג לאפיון המבני של הפיגום כאל לבין ההשוואה של כל היעילות של מצב פיגום כאל culturing hepatocytes מוצגות והסבירו להלן. התנאים פיגום ICC להשתמש בתוצאות אלה הם ציפויים קולגן של 0 מיקרוגרם / מ"ל (Bare), 20 מיקרוגרם / מ"ל (קולגן 20), 200 מיקרוגרם / מ"ל ?...
Access restricted. Please log in or start a trial to view this content.
Discussion
פיגומים להנדסת רקמות מתפתחים במהירות כדי לספק את כל הרמזים פיסיים ביוכימיים צורך להתחדש, לשמור, או לתקן רקמות עבור היישום של החלפת איברים, לומד מחלה, פיתוח תרופות, ורבים אחרים 57. בהנדסה הכבד רקמות, hepatocytes אדם מן המעלה הראשונה לאבד פונקציות מטבוליות שלהם במהירות ?...
Access restricted. Please log in or start a trial to view this content.
Disclosures
The authors have no competing financial interests to disclose.
Acknowledgements
המחברים מבקשים להודות התמיכה מתוך אחוות קרן המחקר הלאומית (NRF -NRFF2011-01) ותכנית מחקר תחרותי (NRF-CRP10-2012-07).
Access restricted. Please log in or start a trial to view this content.
Materials
| Name | Company | Catalog Number | Comments |
| 0.2 ml PCR tube | Axygen Scientific | PCR-02D-C | Boil-proof |
| Gorilla Glue | Gorilla Glue, Inc. | Depends on vendor. This was purchased from a local store. | |
| Glass slides | VWR | 631-1575 | Dimensions: 24×60 mm2 |
| Polystyrene spheres | Fisher Scientific | TSS#4314A | Diameter = 140 µm; 3x104 particles per milliliter and 1.4% size distribution |
| Ethanol | Merck | 1.00983.1011 | absolute for analysis EMSURE; Dilute to 70% with Milli-Q water |
| Ultrasonic Bath | Elma | S10H | Equiment |
| Furnace | Nabertherm | N7/H | Equipment |
| 200 µl pipette tip | Axygen Scientific | T-210-Y-R-S | |
| Rocking shaker | VWR | 444-0142 | |
| Polyethylene Glycol (PEG) | Merck | 1.09727.0100 | Mw= 4 kDa; acrylation of PEG monomers and purification of the resulting precipitate produces a PEGDA macromer with Mw = 4.6 kDa |
| Centrifuge | Beckman Coulter | 392932 | Equipment |
| Acrylate-Poly(Ethylene Glycol) - Succinimidyl Valerate | Laysan Bio | ACRL-PEG-SVA-3400-1g | Mw = 3.4 kDa |
| 2-hydroxy-4'-(2-hydroxyethoxy)-2-methylpropiophenone | Sigma Aldrich | 410896 | |
| Vortex | VWR | 58816-123 | Equipment |
| Microcentrifuge | Eppendorf | 5404 000.413 | |
| Paraffin Film | Parafilm M | #PM996 | Kept at 9" with allows intensity of 10.84 mW/cm2 |
| Bluewave 200 UV spotlight | Blaze Technology | 120008, 122300 | |
| Tetrahydrofuran (THF) | Merck | 107025 | |
| Orbital shaker | Heidolph | 543-123120-00-5 | |
| Collagen Type I | Sigma Aldrich | C3867-1VL | From rat. 1x, w/o CaCl2 & MgCl2; pH = 7.2 |
| Phosphate Buffered Saline (PBS) | Gibco | 20012-027 | 16% W/V AQ. 10 x 10 ml |
| Paraformaldehyde | VWR | 43368.9M | Equipment |
| Freezone 4.5 freeze drier | Labconco | 7750020 | Equipment |
| Sputter coater | Jeol Ltd. | JFC-1600 | Equipment |
| Scanning Electron Microscope | Jeol Ltd. | JSM 5310 | |
| Anti-mouse primary antibodies against Collagen type I | Abcam | ab6308 | |
| Anti-mouse secondary antibody conjugated with Alexa Fluor 488 | Life Technologies | A21121 | |
| Plate, Tissue Culture 24 Well, Flat Bottom (Nunclon) | Bio-Rev PTE LTD | 3820-024 | |
| Dulbecco's Modified Eagle's Medium(DMEM) 2.5 g/L Glucose w/ L-Gln | Lonza | 12-604F | |
| Fetal Bovine Serum (FBS) | Gibco | A15-151 | |
| Penicillin-Streptomycin (P/S) | Life Tchnologies | 15140-122 E | |
| 100 mm Corning non-treated culture dishes | Sigma Aldrich | CLS430591 | |
| 0.25% Trypsin-EDTA | Gibco | 25200-056 | Equipment; 37 °C, 5% Humidity |
| Forma Steri-Cycle CO2 Incubators | Thermofisher Scientific | 371 | |
| Hausser Bright-Line Phase Hemacytometer | Thermofisher Scientific | 02-671-6 | |
| Live/Dead Viability/Cytotoxicity Kit for mammalian cells | Life Technologies | L3224 | |
| CCK-8 Assay | Dojindo Laboratories | CK04-11 | Monosodium-salt reagent (MSR) |
| Infinite 200 PRO microplate reader | Tecan | ||
| Albumin Human ELISA kit | Abcam | ab108788 | |
| Triton X-100 | Bio-Rad | #1610407 | |
| Bovine Serum Albumin (BSA) | Sigma-Aldrich | A2153-50G | |
| Anti-mouse primary antibodies (against CYP3A4, albumin) | Santa Cruz Biotechnology | sc-53850; sc-271605 | |
| DAPI | Life Technologies | D3571 | |
| Alexa Fluor 555 labeled Phalloidin | Life Technologies | A34055 | |
| Trizol | Life Technologies | 15596-026 | |
| Chloroform | VWR | 22706.326 | |
| Isopropanol | Fisher Scientific | 67-63-0 | |
| DPEC water | Thermofisher Scientific | AM9916 | |
| Nanodrop 2000c Spectrophotometer | Thermofisher Scientific | ND-2000 | |
| iScript Reverse Transcription Supermix | Bio-Rad Laboratories | 1708840 | |
| SYBR select Master Mix for CFX | Life Technology | 4472937 | |
| Primers (to be chosen) | |||
| CFX96 Real-Time System, C-1000 Touch Thermal Cycler | Bio Rad Laboratories | SOFT-CFX-31-PATCH |
References
- Yamada, M., et al. Controlled formation of heterotypic hepatic micro-organoids in anisotropic hydrogel microfibers for long-term preservation of liver-specific functions. Biomaterials. 33 (33), 8304-8315 (2012).
- Abboud, G., Kaplowitz, N. Drug-induced liver injury. Drug Safety. 30 (4), 277-294 (2007).
- Cho, N. J., et al. Viral infection of human progenitor and liver-derived cells encapsulated in three-dimensional PEG-based hydrogel. Biomed Mater. 4 (1), (2009).
- Revzin, A., et al. Designing a hepatocellular microenvironment with protein microarraying and poly (ethylene glycol) photolithography. Langmuir. 20 (8), 2999-3005 (2004).
- Sato, A., Kadokura, K., Uchida, H., Tsukada, K. An in vitro hepatic zonation model with a continuous oxygen gradient in a microdevice. Biochem Bioph Res Com. 453 (4), 767-771 (2014).
- Domansky, K., et al. Perfused multiwell plate for 3D liver tissue engineering. Lab Chip. 10 (1), 51-58 (2010).
- Hegde, M., et al. Dynamic interplay of flow and collagen stabilizes primary hepatocytes culture in a microfluidic platform. Lab Chip. 14 (12), 2033-2039 (2014).
- Flaim, C. J., Chien, S., Bhatia, S. N. An extracellular matrix microarray for probing cellular differentiation. Nat methods. 2 (2), 119-125 (2005).
- Underhill, G. H., Chen, A. A., Albrecht, D. R., Bhatia, S. N. Assessment of hepatocellular function within PEG hydrogels. Biomaterials. 28 (2), 256-270 (2007).
- Dunn, J., Tompkins, R. G., Yarmush, M. L. Hepatocytes in collagen sandwich: evidence for transcriptional and translational regulation. J cell biol. 116 (4), 1043-1053 (1992).
- Dunn, J. C., Tompkins, R. G., Yarmush, M. L. Long-term in vitro function of adult hepatocytes in a collagen sandwich configuration. Biotechnol progr. 7 (3), 237-245 (1991).
- Ling, Y., et al. A cell-laden microfluidic hydrogel. Lab Chip. 7 (6), 756-762 (2007).
- Kim, M., Lee, J. Y., Jones, C. N., Revzin, A., Tae, G. Heparin-based hydrogel as a matrix for encapsulation and cultivation of primary hepatocytes. Biomaterials. 31 (13), 3596-3603 (2010).
- Kotov, N. A., et al. Inverted Colloidal Crystals as Three-Dimensional Cell Scaffolds. Langmuir. 20 (19), 7887-7892 (2004).
- Shanbhag, S., Woo Lee, J., Kotov, N. Diffusion in three-dimensionally ordered scaffolds with inverted colloidal crystal geometry. Biomaterials. 26 (27), 5581-5585 (2005).
- Lee, Y. H., Huang, J. R., Wang, Y. K., Lin, K. H. Three-dimensional fibroblast morphology on compliant substrates of controlled negative curvature. Integr Biol. 5, 1447-1455 (2013).
- da Silva, J., Lautenschlager, F., Kuo, C. H. R., Guck, J., Sivaniah, E. 3D inverted colloidal crystals in realistic cell migration assays for drug screening applications. Integr Biol. 3, 1202-1206 (2011).
- da Silva, J., Lautenschlager, F., Sivaniah, E., Guck, J. R. The cavity-to-cavity migration of leukaemic cells through 3D honey-combed hydrogels with adjustable internal dimension and stiffness. Biomaterials. 31, 2201-2208 (2010).
- Lee, J., Lilly, G. D., Doty, R. C., Podsiadlo, P., Kotov, N. A. In vitro toxicity testing of nanoparticles in 3D cell culture. Small. 5, 1213-1221 (2009).
- Lee, J., Kotov, N. A. Notch ligand presenting acellular 3D microenvironments for ex vivo human hematopoietic stem-cell culture made by layer-by-layer assembly. Small. 5, 1008-1013 (2009).
- Liu, Y., et al. Rapid aqueous photo-polymerization route to polymer and polymer-composite hydrogel 3D inverted colloidal crystal scaffolds. J Biomed Mater Res. Part A. 83, 1-9 (2007).
- Ma, P. X., Choi, J. W. Biodegradable polymer scaffolds with well-defined interconnected spherical pore network. Tissue Eng. 7, 23-33 (2001).
- Cuddihy, M. J., Kotov, N. A. Poly (lactic-co-glycolic acid) bone scaffolds with inverted colloidal crystal geometry. Tissue Eng Part A. 14, 1639-1649 (2008).
- Choi, S. W., Zhang, Y., Xia, Y. Three-dimensional scaffolds for tissue engineering: the importance of uniformity in pore size and structure. Langmuir. 26, 19001-19006 (2010).
- Choi, S. W., Zhang, Y., Thomopoulos, S., Xia, Y. In vitro mineralization by preosteoblasts in poly(DL-lactide-co-glycolide) inverse opal scaffolds reinforced with hydroxyapatite nanoparticles. Langmuir. 26, 12126-12131 (2010).
- Choi, S. W., Zhang, Y., Macewan, M. R., Xia, Y. Neovascularization in biodegradable inverse opal scaffolds with uniform and precisely controlled pore sizes. Adv Healthc Mater. 2, 145-154 (2013).
- Zhang, Y., Choi, S. W., Xia, Y. Modifying the Pores of an Inverse Opal Scaffold With Chitosan Microstructures for Truly Three-Dimensional Cell Culture. Macromol Rapid Commun. 33, 296-301 (2012).
- Cai, X., et al. Investigation of neovascularization in three-dimensional porous scaffolds in vivo by a combination of multiscale photoacoustic microscopy and optical coherence tomography. Tissue Eng. Part C, Meth. 19, 196-204 (2013).
- Zhang, Y. S., Yao, J., Wang, L. V., Xia, Y. Fabrication of Cell Patches Using Biodegradable Scaffolds with a Hexagonal Array of Interconnected Pores (SHAIPs). Polymer. 55, 445-452 (2014).
- Zhang, Y. S., Regan, K. P., Xia, Y. Controlling the Pore Sizes and Related Properties of Inverse Opal Scaffolds for Tissue Engineering Applications. Macromol Rapid Commun. 34, 485-491 (2013).
- Stachowiak, A. N., Bershteyn, A., Tzatzalos, E., Irvine, D. J. Bioactive Hydrogels with an Ordered Cellular Structure Combine Interconnected Macroporosity and Robust Mechanical Properties. Adv Mater. 17, 399-403 (2005).
- Stachowiak, A. N., Irvine, D. J. Inverse opal hydrogel-collagen composite scaffolds as a supportive microenvironment for immune cell migration. J Biomed Mater Res. Part A. 85, 815-828 (2008).
- Liu, Y., Wang, S. 3D inverted opal hydrogel scaffolds with oxygen sensing capability. Colloids and surfaces. B, Biointerfaces. 58, 8-13 (2007).
- Bryant, S. J., Cuy, J. L., Hauch, K. D., Ratner, B. D. Photo-patterning of porous hydrogels for tissue engineering. Biomaterials. 28, 2978-2986 (2007).
- Bhrany, A. D., Irvin, C. A., Fujitani, K., Liu, Z., Ratner, B. D. Evaluation of a sphere-templated polymeric scaffold as a subcutaneous implant. JAMA facial plastic surgery. 15, 29-33 (2013).
- Kuo, Y. C., Chiu, K. H. Inverted colloidal crystal scaffolds with laminin-derived peptides for neuronal differentiation of bone marrow stromal cells. Biomaterials. 32 (3), 819-831 (2011).
- Yang, J. T., Kuo, Y. C., Chiu, K. H. Peptide-modified inverted colloidal crystal scaffolds with bone marrow stromal cells in the treatment for spinal cord injury. Colloids Surf. B, Biointerfaces. 84, 198-205 (2011).
- Kuo, Y. C., Tsai, Y. T. Inverted colloidal crystal scaffolds for uniform cartilage regeneration. Biomacromolecules. 11, 731-739 (2010).
- Choi, S. W., Xie, J., Xia, Y. Chitosan-Based Inverse Opals: Three-Dimensional Scaffolds with Uniform Pore Structures for Cell Culture. Adv Mater. 21, 2997-3001 (2009).
- Long, T. J., Sprenger, C. C., Plymate, S. R., Ratner, B. D. Prostate cancer xenografts engineered from 3D precision-porous poly(2-hydroxyethyl methacrylate) hydrogels as models for tumorigenesis and dormancy escape. Biomaterials. 35, 8164-8174 (2014).
- Kuo, Y. C., Tsai, Y. T. Inverted colloidal crystal scaffolds for uniform cartilage regeneration. Biomacromolecules. 11, 731-739 (2010).
- Kuo, Y. C., Chiu, K. H. Inverted colloidal crystal scaffolds with laminin-derived peptides for neuronal differentiation of bone marrow stromal cells. Biomaterials. 32, 819-831 (2011).
- Lee, J., Cuddihy, M. J., Cater, G. M., Kotov, N. A. Engineering liver tissue spheroids with inverted colloidal crystal scaffolds. Biomaterials. 30 (27), 4687-4694 (2009).
- Galperin, A., et al. Integrated bi-layered scaffold for osteochondral tissue engineering. Adv Healthc Mater. 2, 872-883 (2013).
- Waters, D. J., et al. Morphology of Photopolymerized End-linked Poly(ethylene glycol) Hydrogels by Small Angle X-ray Scattering. Macromolecules. 43 (16), 6861-6870 (2010).
- Elbert, D. L., Hubbell, J. A. Conjugate addition reactions combined with free-radical cross-linking for the design of materials for tissue engineering. Biomacromolecules. 2 (2), 430-441 (2001).
- Kim, M. H., et al. Biofunctionalized Hydrogel Microscaffolds Promote Three-Dimensional Hepatic Sheet Morphology. Macromol Biosci. , (2015).
- Ferreira, T., Rasband, W. ImageJ User Guide. , http://imagej.nih.gov/ij/docs/guide/146-30.html#toc-Subsection-30.1 (2012).
- JoVE Science Education Database. General Laboratory Techniques. Introduction to Fluorescence Microscopy. , JoVE. Cambridge, MA. (2015).
- Tominaga, H., et al. A water-soluble tetrazolium salt useful for colorimetric cell viability assay. Anal Commun. 36 (2), 47-50 (1999).
- JoVE Science Education Database. General Laboratory Techniques. Introduction to the Microplate Reader. , JoVE. Cambridge, MA. (2015).
- JoVE Science Education Database. Basic Methods in Cellular and Molecular Biology. The ELISA Method. , JoVE. Cambridge, MA. (2015).
- Nolan, T., Hands, R. E., Bustin, S. A. Quantification of mRNA using real-time RT-PCR. Nat Protoc. 1, 1559-1582 (2006).
- JoVE Science Education Database. Essentials of Environmental Microbiology. RNA Analysis of Environmental Samples Using RT-PCR. , JoVE. Cambridge, MA. (2016).
- JoVE Science Education. Essentials of Environmental Microbiology. , JoVE. (2015).
- Jeong, S., et al. The evolution of gene regulation underlies a morphological difference between two Drosophila sister species. Cell. 132 (5), 783-793 (2008).
- Griffith, L. G., Naughton, G. Tissue engineering--current challenges and expanding opportunities. Science. 295 (5557), 1009-1014 (2002).
- Hegde, M., et al. Dynamic Interplay of Flow and Collagen Stabilizes Primary Hepatocytes Culture in a Microfluidic Platform. Lab Chip. 14, 2033-2039 (2014).
- Kim, Y., Lasher, C. D., Milford, L. M., Murali, T., Rajagopalan, P. A comparative study of genome-wide transcriptional profiles of primary hepatocytes in collagen sandwich and monolayer cultures. Tissue Eng Pt C. 16 (6), 1449-1460 (2010).
- Baimakhanov, Z., et al. Efficacy of multi-layered hepatocyte sheet transplantation for radiation-induced liver damage and partial hepatectomy in a rat model. Cell Transplant. , (2015).
- Li, C. Y., et al. Micropatterned Cell-Cell Interactions Enable Functional Encapsulation of Primary Hepatocytes in Hydrogel Microtissues. Tissue Eng Pt A. 20 (15-16), 2200-2212 (2014).
- Shlomai, A., et al. Modeling host interactions with hepatitis B virus using primary and induced pluripotent stem cell-derived hepatocellular systems. P Natl A Sci USA. 111 (33), 12193-12198 (2014).
- Curcio, E., et al. Mass transfer and metabolic reactions in hepatocyte spheroids cultured in rotating wall gas-permeable membrane system. Biomaterials. 28, 5487-5497 (2007).
- Martinez-Hernandez, A., Amenta, P. The hepatic extracellular matrix. Vichows Archiv A Pathol Anat. 423, 1-11 (1993).
- Liu, Y., Wang, S., Lee, J. W., Kotov, N. A. A Floating Self-Assembly Route to Colloidal Crystal Templates for 3D Cell Scaffolds. Chem Mater. 17 (20), 4918-4924 (2005).
Access restricted. Please log in or start a trial to view this content.
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved