Для просмотра этого контента требуется подписка на Jove Войдите в систему или начните бесплатную пробную версию.
Method Article
Изготовление Перевернутый коллоидный кристалл поли (этиленгликоль) строительные леса: трехмерная Cell Culture платформа для печени тканевой инженерии
В этой статье
Резюме
This manuscript presents a detailed protocol for the fabrication of an emerging three-dimensional hepatocyte culture platform, the inverted colloidal crystal scaffold, and the concomitant techniques to assess hepatocyte behavior. The size-controllable pores, interconnectivity and ability to conjugate extracellular matrix proteins to the poly(ethylene glycol) (PEG) scaffold enhance Huh-7.5 cell performance.
Аннотация
Способность поддерживать функцию гепатоцитов в пробирке, для целей тестирования цитотоксичности ксенобиотиков, изучение вирусной инфекции и разработки лекарств , нацеленных на печень, требует платформу , в которой клетки получают соответствующие биохимические и механические сигналы. Последние ткани печени инженерные системы использовали трехмерные (3D) каркасы, состоящие из синтетических или натуральных гидрогели, учитывая их высокую задержку воды и их способность обеспечивать механические стимулы, необходимые клетками. Там было растущий интерес к перевернутой коллоидный кристалл (ICC) эшафот, новейшая разработка, которая обеспечивает высокую пространственную организацию, однотипны и взаимодействие гетеротипичной клеток, а также матрицу взаимодействия (ECM) клеточно-внеклеточный. В данном случае мы опишем протокол для изготовления строительных лесов ICC с использованием поли (этиленгликоль) диакрилат (PEGDA) и метод выщелачивания частиц. Если коротко, то решетка изготовлена из частиц микросфер, после чего предварительно polymeR раствор добавляют, правильно полимеризуется, а частицы затем удаляются, или выщелоченные, с использованием органического растворителя (например, тетрагидрофуран). Растворение результатов решетки в сильно пористом помост с контролируемым размером пор и interconnectivities, которые позволяют медиа достичь клетки более легко. Эта уникальная структура позволяет большую площадь поверхности для клеток придерживаться, а также легкой связи между порами, а также возможность покрыть ICC эшафот PEGDA с белками также показывает заметное влияние на производительность клеток. Мы анализируем морфологии эшафот, а также гепатокарциномой клетки поведения (Хух-7,5) с точки зрения жизнеспособности и функции для изучения влияния структуры ICC и ECM покрытий. В целом, этот документ содержит подробный протокол формирующейся строительных лесов, который имеет широкое применение в тканевой инженерии, особенно печени тканевой инженерии.
Введение
Печень является насыщена сосудами орган с множеством функций, в том числе детоксикацию крови, метаболизма ксенобиотиков, а также при производстве сывороточных белков. Ткань печени имеет сложную трехмерную (3D) микроструктуру, состоящий из нескольких типов клеток, желчные канальцы, синусоиды и зон различного состава BIOMATRIX и различных концентраций кислорода. Учитывая эту сложную структуру, было трудно создать правильную модель печени в пробирке 1. Тем не менее, существует растущий спрос на функционал в моделях пробирке хостинг гепатоцитов человека в качестве платформ для тестирования лекарственной токсичности 2 и изучение заболеваний , связанных с печенью 3.
Текущий ткани печени инженерные платформы упростили сложность печени путем выделения одного или сосредоточив внимание на некоторые из них, параметров печени, а именно совместное культивирование клеток 4, биохимический состав гопал микросреды 5, динамика 6,7 потока и конфигурация биоматрицы 8. Конфигурация биоматрицы можно разбить на такие параметры, как каркасные материалы, состав внеклеточного матрикса (ЕСМ) белки, матрица жесткости, а также конструкции и структуры строительных лесов. Там было увеличение инженерных исследований тканей с использованием синтетических гидрогели, особенно поли (этиленгликоль) (ПЭГ) гидрогели 9, принимая во внимание возможность настраивать механические свойства, биологическая активность и скорость разложения гидрогеля в. Что касается печени исследований , связанных, биосовместимый гидрогель был применен для исследования вирусной инфекции заболевания печени 3. В конструкции платформы гепатоцитов, многочисленные исследования использовали гепатоцитов сэндвич культур 10,11 и клеток герметизацию в гидрогель 12,13 , чтобы обеспечить 3D окружающей среды и клеток-ECM и взаимодействия клетка-клетка , которые имеют важное значение , чтобы имитировать в естественных условиях микросреды. ХауВер, эти платформы не обладают высокой степенью контроля и пространственной организации, что приводит к неравномерной свойств через строительные леса 14.
Перевернутый кристалл коллоидный (ICC) 14 строительных лесов является высоко организованной 3D эшафот для культивирования клеток , которая была впервые введена в начале 2000 - х годов. уникальная структура эшафот можно отнести к простому процессу изготовления с использованием коллоидного кристалл, упорядоченную решетку коллоидных частиц переменного диаметра. В кратком изложении, чтобы подвести итог процесса, частицы аккуратно уложенные и отжигают с использованием тепла, образуя решетку. Выщелачивание этой решетки, органическим растворителем, в полимеризованной приводит гидрогелевых в шестиугольника упакованная сферических полостей 15 с высокой площадью поверхности. Это высокоупорядоченную подмости были ранее с обеих синтетических и натуральных материалов, в том числе , но не ограничиваясь ими поли (акриламид) , 16-21, поли (молочной-гликолевой кислоты) 15,22-30, Поли (этиленгликоль) , 31,32, поли (2-гидроксиэтилметакрилат) 21,33-35, и хитозан 36-39. Каркасы из ICC не обрастания материалов , как правило, способствуют клеточные сфероидов внутри полостей 14,23,40. Несколько типов клеток было показано , что успешно пролиферировать, дифференцироваться и функционировать в рамках этой конфигурации, в том числе хондроцитами 41, костный мозг стромальные клетки 42, и стволовые клетки 43,44. Что касается гепатоцитов, были проведены исследования с МТП каркасах из Na 2 SiO 3 и поли (акриламид), но не PEG. С помощью простых стратегий биоконъюгации (т.е. амин связи через EDC / NHS), ECM белки-сопряженными каркасы ПЭГ-основе могут быть изготовлены, которые могут доказать , сайты связывания более клеток , чтобы быть более в естественных условиях , как окружающая среда и улучшать функцию печени.
В этой рукописи и связанной с ним видео, мы подробно изготовление эшафот ICCс использованием поли (этиленгликоль) диакрилат (PEGDA) гидрогеля и полистирольных микросфер решетку, оптимизированный для гепатокарциномой (Хух-7,5) культуры. Показано, различия между голыми в целом неадгезивных каркасы ICC PEGDA и коллагеновой покрытием PEGDA МТП эшафот с точки зрения топологии строительных лесов и производительности клеток. Жизнеспособность клеток и функции измеряются качественно и количественно оценить поведение клеток Huh-7.5.
Access restricted. Please log in or start a trial to view this content.
протокол
1. МТП Эшафот Fabrication (Рисунок 1)
- Подготовьте полистирол (PS) решетки (диаметр = 6 мм; 8-13 слои шариков).
- Чтобы подготовить почву, отрезать кончики от от 0,2 мл кипячения доказательство микропробирок на уровне 40 мкл. Приклейте верхнюю часть срезанных труб до 24 х 60 мм 2 микроскопа покровного стекла промахов с водонепроницаемым клеем.
- Помещенный сферы PS (диаметр = 140 мкм), содержащиеся в водной суспензии в мл флакон 20, осторожно пипеткой по подвесу воды, и добавить 18 мл 70% -ного раствора этанола в пробирке. Помещенный решение сферы в ультразвуковой ванне, чтобы ослабить агрегированные сферы. Повторите эту стадию промывки несколько раз для того, чтобы удалить воду и водорастворимые компоненты полностью.
- Пипетировать 100 мкл этанола в пресс-формы.
- Отрежьте верхнюю часть 200 мкл микропипетки наконечник на 4 мм. Пипетка 25 мкл сфер в пресс-форму в два раза с использованием 200 мкл микропипетки для достиженияобщий объем 50 мкл в каждую пресс-форму.
- Поместите формы на ротационном шейкере при 120 оборотов в минуту в течение ночи.
- Проверьте расположение сфер в каждой пресс-форме под оптическим микроскопом. Если сферы не упорядочены шестиугольной, добавить 50 мкл 70% этанола и встряхивают вручную в продольном и поперечном направлении оси, чтобы исправить расположение.
- Пусть испариться этанол, при комнатной температуре (RT) в течение двух ночей. Поместите форму и бусинка комплекс в C печи 130 ° в течение 6 ч для отжига PS бусинки.
- Подготовка и босые ECM покрытием каркасы PEGDA.
- Обобщить PEGDA макромеры с использованием установленных протоколов 45,46 для acrylating линейных ПЭГ макромеры (M W = 4,6 кДа).
- Готовят 50% (вес / объем) раствор PEGDA в деионизованной (ДИ) воды и позволяют макромер правильно растворить центрифугированием при 4,713 XG, пока он полностью не растворится.
- Для ECM, конъюгированный каркасах ICC, растворите дополнительный10% (вес / объем) акрилоил-ПЭГ-НГС (М ш = 3,4 кД) в 50% -ном растворе PEGDA.
- Приготовьте 20% (вес / об) маточного раствора 2-гидрокси-4 '- (2-гидроксиэтокси) -2-метилпропиофенон (PI) в 70% этаноле.
- Добавляют 50 мкл 20% (вес / объем) PI маточного раствора на 1 мл 50% (вес / объем) PEGDA. Отрегулировать необходимое количество PI исходного раствора, основанного на молекулярной массе PEGDA.
- Вихревой смесь в центрифужной пробирке в течение 1 мин, чтобы достичь однородного раствора.
- Очистите формы от предметное стекло (со стадии 1.1.7), удалить клей из пресс-форм, раздвинуть решетки тщательно с помощью шпателя и поместите каждый из них в 1,5 мл трубки. Пипеток 300 мкл раствора PEGDA и центрифуге при 845 мкг в течение 5 мин, чтобы обеспечить надлежащее PEGDA решение инфильтрации в решетке.
- Удалите решетку из трубки с помощью пинцета и тщательно промокните сухой избыток раствора PEGDA на перчатках. Поместите решетку на парафиновой пленки, покрытой стеклом с плоской CIRлярных поверхность лицевой стороной вверх.
- Выставляют решение PEGDA пропитанную леску до 365 нм ультрафиолетового (УФ) излучения (10,84 мВт / см 2) в течение 5 мин с использованием УФ - спот лампа.
- Поместите PEGDA-полимеризованные кристаллические решетки в новых флаконах (около 10 решеток на флакон) и добавляют 20 мл тетрагидрофурана (ТГФ). Встряхнуть чаш на орбитальном шейкере со скоростью 300 оборотов в минуту. Изменение ТГФ по меньшей мере, 3 раза с интервалом 1-2 ч.
Примечание: Не удалить ТГФ полностью при изменении ТГФ, чтобы предотвратить пузыри от попадания строительные леса, которые, в свою очередь, может привести к неполному удалению PS. Оставьте достаточно раствора для покрытия решетки и добавить новую ТГФ.
Внимание: ТГФ является токсичным. Надевайте перчатки, лабораторный халат и защитные очки. Избегайте вдыхания при работе под вытяжкой. - Проверьте, если сферы PS растворяются, помещая воду в использованный раствор ТГФ и наблюдая цвет раствора. Повторите шаг 1.2.9, если сферы PS должным образом не растворится.
Примечание: цветовое решение изменитсябелый, если есть какие-либо оставшиеся PS сферы.
- Очистите каркасы в шкафу биологической безопасности (BSC).
- Стерилизовать каркасы, готовят 50 мл центрифужные пробирки с 2 мл 70% этанола на строительные леса и поместить подмости в трубе с помощью шпателя. Разрешить каркасы, чтобы впитать в этаноле в течение 1 часа. От этого шага вперед, проводить все процедуры в BSC.
- Аккуратно влить этанол и заменить фосфатным буферным солевым раствором (PBS) (2 мл на помосте) и центрифуге при 524 х г в течение 3 мин, чтобы удалить пузырьки. Храните его в холодильнике и изменить PBS несколько раз с интервалом 1-2 ч.
- Для получения коллагена типа I с покрытием подмости, подготовить другой центрифужную пробирку объемом 50 мл, содержащую коллаген типа 1 исходный раствор (1 мл на помосте), перенос простерилизованные подмости в эту трубку с помощью шпателя и центрифуге при 524 х г в течение 3 мин. Встряхнуть строительные леса при 400 оборотах в минуту на орбитальном шейкере в течение 30 мин и держать трубку в холодильнымили на ночь.
- Вымойте каркасы с PBS дважды перед использованием погружая строительных лесов в свежем PBS, а затем аспирационных PBS.
Примечание: Другие белки ECM также могут быть использованы вместо I типа коллагена , потому что химия НСЗ требует аминогруппы с образованием связь (рисунок 2).
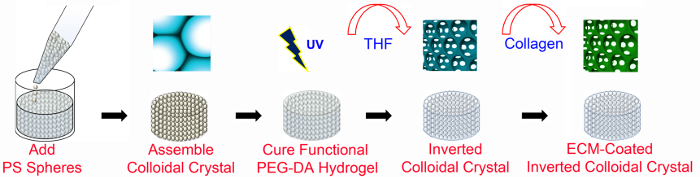
Рисунок 1. Обзор изготовления ICC. Каркасы ICC на основе ПЭГ изготовлены с использованием методов микротехнологий и без ECM-функционализации. ECM-покрытием каркасы ICC требуют PEG-NHS, а также PEGDA (как подробно описано на рисунке 2). Решетка PS имеет диаметр 6 мм и высотой 8-13 бусин слоев. PS, полистирол; PEGDA, поли (этиленгликоль) диакрилат; УФ, ультрафиолетовый; ТГФ тетрагидрофуран; ECM, внеклеточный матрикс. Эта цифра была изменена и использована с разрешения WiЛей 47. Пожалуйста , нажмите здесь , чтобы посмотреть увеличенную версию этой фигуры.
2. Структура Характеристика МТП
- Для анализа структуры ICC с или без конъюгированных белков, используют сканирующей электронной микроскопии (SEM) 47.
- Закрепить подмости 4% параформальдегида (PFA), последовательно обезвоживают их в 25, 50, 75, 95 и 100% этанола решений, и хранить их при температуре -80 ° С до тех пор, пока не испарится этанол полностью.
- Сухие образцы в сублимационной сушилке в течение 48 часов.
- Наклейте образец на держатель образца с помощью копировальной ленты и поместите его в распыл для нанесения покрытий.
- После автоматической уборки пылесосом, пальто с пленкой Pt толщиной 10 нм с помощью распыления в течение 60 сек при 20 мА.
- Подмости изображения ICC помощью сканирующего электронного микроскопа при напряжении 5 кВ (Фигура 3А, 4А).
- Для измерения пор идиаметр взаимосвязь полостей, анализировать SEM микрофотографии с помощью программного обеспечения для анализа изображений 48 (например, ImageJ, рисунок 3B, C).
- Для того, чтобы визуализировать сопряженную коллаген на эшафот без клеток флуоресцентно тег коллаген с использованием антител (1: 100) против коллагена типа I и изображения с помощью конфокальной лазерной сканирующей микроскопии 47 (CLSM; Рисунок 4B).
3. Хух-7,5 Культура клеток и Посев
- Культура Ха-7,5 клеток при плотности высева 2-2,5 × 10 6 клеток / мл в 100 - мм чашки для культивирования клеток с 10 мл Дульбекко модифицированной Игла среде (DMEM) , дополненной 10% фетальной бычьей сыворотки (FBS) и 100 ед / мл пенициллин-стрептомицина (питательная среда) при температуре 37 ° с и 5% CO 2. Изменение СМИ через каждые три дня в КБС , пока они не достигли 75-80% слитности.
- Подготовьте каркасы для посева клеток в BSC.
- Осторожно поместите Scaffлетних в 24-луночный планшет с плоской поверхностью лицевой стороной вверх.
- Мыть эшафоте, пипеткой 2 мл PBS в каждую лунку, содержащую леску. Аспирируйте PBS и пипетки 2 мл свежего PBS в каждую лунку.
- Аспирируйте PBS и пипетки 2 мл питательной среды (см шаг 3.1) и оставить на 30 мин. Аспирата средств массовой информации и позволяют подмости высохнуть в течение 1 часа.
- Отделить вырожденные клетки Huh-7,5 (с шагом 3.1) из культуральной пластины в BSC с использованием трипсина метода пищеварения.
- Аспирируйте средств массовой информации из пластины, добавьте 4 мл PBS, чтобы вымыть прилипшие клетки, а затем аспирация PBS.
- Пипетка 0,75-1 мл 0,25% трипсина и место в инкубаторе при температуре 37 ° С, 5% СО 2 в течение 3 мин.
- Удалить пластины из инкубатора и пипеткой 5 мл среды, чтобы остановить реакцию трипсина. Пипетка средства массовой информации, отдельные клетки, и трипсин смеси в 15 мл пробирку.
- Центрифуга при 524 х г в течение 3 мин, удалить супернатант и ресуспендируют осадок в 5 мл среды.
- Граф клеток с использованием гемоцитометра и рассчитать объем клеточной суспензии, содержащей клетки в целевом количестве, N 0, в 25 мкл (для стандартного эксперимента, N 0 составляет 1 × 10 6 клеток).
Объем клеточной суспензии = (целевое число клеток) / (концентрация суспензии клеток) - Медленно пипеткой 25 мкл клеточной суспензии (содержащей N 0 ячеек) непосредственно на верхней части каждой помост (со стадии 3.1.4). Поместите 24-луночный планшет в инкубаторе.
- Через 12 ч, передают подмости тщательно с использованием шпателя в новый 24-луночный планшет и пипеткой 2 мл среды в каждую лунку. Поместите 24-луночный планшет в инкубаторе.
- Изменение среды каждые 3 дня или в зависимости от того, когда средства массовой информации собирается для анализа секреции белков (см шаг 5.1).
4. Жизнеспособность клеток
- Для того, чтобы качественно проанализировать жизнеспособность клеток, использовать флуоресцентные живые / мертвые комплекты окрашивания для окрашивания клеток и изображения с помощью CLSM.
- Следуя инструкции комплекта, приготовить раствор с 4 мкМ кальцеина AM и 8 мкМ этидия гомодимер-1 в средствах массовой информации (см шаг 3.1.3).
Примечание: Оптимизация в зависимости от числа клеток. Используйте двойное количество реагента, если клетки пролиферируют и дважды в количестве (около 2 млн). - В BSC, аспирата средств массовой информации в каждую лунку с леской (шаг 3.7) и пипеткой 500 мкл приготовленного раствора. Инкубируйте образцов в C инкубаторе 37 ° в течение 1 часа.
- Покрывал пластины в фольгой для защиты образцов от света при снятии пластины из инкубатора. Образцы изображений с использованием CLSM49.
- Следуя инструкции комплекта, приготовить раствор с 4 мкМ кальцеина AM и 8 мкМ этидия гомодимер-1 в средствах массовой информации (см шаг 3.1.3).
- Для количественной оценки жизнеспособности клеток, измерение ферментативной активности (в живых клетках) с использованием колориметрического анализа 50 (то есть, 2- (2-метокси-4-нитрофенил) -3- (4-нитрофенил) -5- (2,4-disulfophenyl) -2H-тетразолия (мононатриевая-солевой реагент)).
- Создайте стандартную кривую для платформы ICC (т.е. график оптической плотности (OD) Versus заданное число клеток).
Примечание: Cell высева не на 100% эффективнее по сравнению с другими платформами, так как клетки могут проходить через полости строительные леса.- Определить число клеток высева, N 0 , которые будут использоваться , чтобы сделать стандартную кривую.
Примечание: Выберите диапазон, который включает в себя количество клеток, которые оцениваются в эксперименте. Например, если начальное число клеток 5 × 10 5 клеток и существует , по оценкам , ~ 3 кратное увеличение в последний день эксперимента, выбрать 2,5 х 10 5, 5 х 10 5, 1 × 10 6, и 2 х 10 6 клеток в качестве N 0. - Выполните посев клеток в каркасах ICC (один N 0 на помосте с объемом высева 25 мкл) , как описано в пунктах 3.1-3.6.
- Через 6 ч, передают подмости на другой 24-луночный планшет хорошо. Выберите время, которое позволяет присоединение клеток, но не пролиферации клеток.
- Выполнить подсчет клеток на переданный эшафот ICC.
- Развести 10x мононатриевая-солевой раствор реагента (MSR) до 1 раза со средствами массовой информации в BSC и пипеткой 500 мкл раствора 1x MSR в каждую лунку с леской. Выдержите 24-луночный планшет при 37 ° С в течение 1 часа.
- Из каждой лунки, передавать по 100 мкл в 96-луночный планшет хорошо. В качестве заготовки, пипеткой 100 мкл свежего раствора реагента 1x мононатрия-соль в разные лунки на 96-луночный планшет. Вручную удалите пузырьки присутствуют с помощью сухой пипетки и покрывают 96-луночного планшета в фольгу, чтобы защитить его от света.
- Мера OD при λ = 450 нм считывание с использованием спектрофотометра. Вычтите пустой OD от других значений , чтобы найти точную OD 51.
- Подсчитайте количество клеток (N L) , оставшегося в скважине после переноса на эшафот (этап 4.2.1.3) с помощью гемоцитометра.
Примечание: Используйте 300 мкл трипсина Trypsinize клеток. - Вычислить фактическое число клеток, N A.
фактические =Первоначальный - левый в хорошо
N A = N 0 -N L - Сделать стандартную кривую оптической плотности , полученного на стадии 4.2.1.4.3 против фактического числа клеток (N A) и использовать эту функцию для оценки количества клеток в экспериментах.
Примечание: Создать новую стандартную кривую , если какие - либо параметры ICC (т.е. размер порообразователь, размеры эшафота, ECM белок и т.д.) меняются.
- Определить число клеток высева, N 0 , которые будут использоваться , чтобы сделать стандартную кривую.
- Создайте стандартную кривую для платформы ICC (т.е. график оптической плотности (OD) Versus заданное число клеток).
5. Функция Cell
- Анализ секреции белка клетками Ха-7,5 (то есть, альбумин, мочевина) из собранных средств массовой информации (со стадии 3.7) с помощью твердофазного иммуноферментного анализа (ELISA) 52.
Примечание: Развести носитель, в зависимости от количества клеток, посеянных и количества собранных средств массовой информации. Для 5 × 10 5 клеток высевали в МУС, использовать ~ 1: соотношение 25, перед введением ее в антитело , предварительно покрытые лунки. - Для того, чтобы качественно проанализировать функции клеток, immunostain специфические внутриклеточные белки(То есть, альбумин), ферменты (например, CYP450), окрашивают структурные компоненты (то есть сотовая актин), а также ядра и изображения с помощью КЛСМ 49.
- Аспирируйте СМИ (со стадии 3.7) и пипеткой 2 мл PBS мыть клетки нагруженных строительных лесов ICC.
- Пипетка 1 мл 4% PFA и инкубировать в течение 5 мин при комнатной температуре для фиксации.
- Промыть 3 раза с 2 мл PBS.
- Проницаемыми мембранами путем инкубирования подмости в 1 мл 0,1% 4- (1,1,3,3-тетраметилбутил) фенил-полиэтиленгликоль (поверхностно-активное вещество) в течение 30 мин.
- Промыть 3 раза с 2 мл PBS, чтобы удалить протекшие белки.
- Пипетка 500 мкл 1% бычьего сывороточного альбумина (БСА) и инкубируют при комнатной температуре в течение 1 ч, чтобы блокировать неспецифическое связывание.
- Подготовить разбавленный первичного антитела (т.е., альбумин, CYP450) раствора.
- Пипетка 500 мкл 1% раствора БСА в 15 мл пробирку и добавляют 4,5 мл 0,1% раствора поверхностно-активного подготовить общую 5 мл 0,1% бычьего сывороточного альбумина раствор.
- Пипетка 98 мкл 0,1% раствора БСА в микроцентрифужных пробирку 200 мкл и 2 мкл первичного антитела с получением 1:50 (первичное антитело: 0,1% бычьего сывороточного альбумина) раствора первичного антитела.
- Пипеток 40 мкл раствора первичного антитела на помост и покрывают субстрат с парафиновой пленки. Обертка 24-луночный планшет с алюминиевой фольгой и хранить посуду при температуре 4 ° С в течение ночи.
- Вымойте 3x с 2 мл PBS и встряхните планшет слегка между стиркой.
- Подготовить разбавленный биотинилированного вторичного антитела (т.е. антитела против мышиных антител) исходного раствора.
- Пипетка 198 мкл 0,1% раствора БСА и 2 мкл второго антитела с получением 1: 100 (вторичное антитело: 0,1% бычьего сывороточного альбумина) вторичного раствора антител.
- Приготовьте 0,1% исходного раствора родамина или флуоресцеина меченых фаллоидином (для окрашивания клеточных нитей актина) в 0,1% растворе БСА.
- Внесите 25 мкл каждого раствора в трубке и перемешать шELL.
- 50 мкл вторичного антитела маточного раствора на строительные леса. Накройте леску с парафиновой пленкой, завернуть блюдо с алюминиевой фольгой и хранить при комнатной температуре в течение 2 часов.
- Промыть 3 раза с 2 мл PBS.
- Пипетка 200 мкл 0,2% 4'-6-диамидино-2-фенилиндола (DAPI; ядро морилки) раствор на эшафоте и держать при комнатной температуре в течение 2-3 мин. Закройте планшет с алюминиевой фольгой.
- Мытье 2x с 2 мл PBS.
- Используя пипетку, поместите каплю монтажных сред на подложке.
- Осторожно эшафот на предметное стекло и изображения , используя CLSM 47.
- Оценка экспрессии генов в режиме реального времени полимеразной цепной реакции (КПЦР). Используйте стандартные наборы для обратной транскриптазы ПЦР (RT-PCR) 53 и кПЦР 54 в соответствии с инструкциями изготовителя. Извлечение РНК из клеток, как описано ниже.
- Поместите на эшафот (со стадии 3.7) в микроцентрифужных пробирку 1,5 мл.
- Пипетка 1 мл раствора для экстракции РНК в пробирку и хранить в ультразвуковом в течение 5 мин при комнатной температуре.
- Пипетировать 200 мкл хлороформа в каждую пробирку микроцентрифужных и трясти трубку энергично в руке в течение 15-20 сек. Храните пробирки при комнатной температуре в течение ~ 3 мин, пока фазы не отделяют.
- Центрифуга образца при 13000 х г, 4 & deg; С в течение 15 мин и осторожно удалите трубки таким образом, что фазы не перемешиваются.
- Тщательно пипеткой 500-600 мкл верхней водной фазы от первой трубки во вторую пробирку микроцентрифужных.
- Добавьте эквивалентный объем (500-600 мкл) изопропилового спирта к этой второй трубки.
- Переверните пробирку 3-5 раз и оставить трубку, стоя при комнатной температуре в течение 10 мин.
- Центрифуга образца при 13000 х г, 4 & deg; С в течение 15 мин.
- Если осадок не виден в нижней части трубки, центрифуга снова в течение 5 мин.
Примечание: Если не существует до сих пор не видно осадок, количество РНК может быть недостаточной.
- Если осадок не виден в нижней части трубки, центрифуга снова в течение 5 мин.
- яnvert трубки с крышкой открытой отказаться от супернатанта и пипетку в 1 мл 70% этанола, разведенного в воде DEPC в трубку.
- Слегка вихревой трубы, поэтому осадок отсоединяется от стенки трубы, а затем дайте трубке высохнуть на воздухе.
- Добавляют 50 мкл DPEC воды в ресуспендируют осадок.
- Хранить пипетирования до гранул не растворится.
- Хранить в течение 10 мин при 55 ° С для того, чтобы денатурации двухцепочечной РНК в одноцепочечной РНК.
- Слегка барабан пальцы на дне трубки, а затем центрифугировать Пробирки кратковременно (7,500 XG, 4 мин, 4 ° С).
- Хранить пробирки во льду до выполнения обратной транскриптазы 55 и ПЦР в реальном времени , как описано в 56.
Access restricted. Please log in or start a trial to view this content.
Результаты
Представительные результаты для структурной характеристики эшафота ICC и сравнения эффективности каждого ICC подмости условие в культивировании печеночных клеток показаны и объяснены ниже. Условия подмости МТП, используемые в этих результатов являются коллагеновые ?...
Access restricted. Please log in or start a trial to view this content.
Обсуждение
Тканевая инженерия каркасы быстро развиваются , чтобы обеспечить все физические и биохимические сигналы , необходимые для восстановления, поддержания или ремонта тканей для применения замены органов, изучение болезней, разработки лекарств, и многие другие 57. В печени тканевой и?...
Access restricted. Please log in or start a trial to view this content.
Раскрытие информации
The authors have no competing financial interests to disclose.
Благодарности
Авторы хотели бы выразить признательность поддержку от Национального исследовательского фонда стипендий (NRF -NRFF2011-01) и конкурентоспособных исследований программы (СРН-CRP10-2012-07).
Access restricted. Please log in or start a trial to view this content.
Материалы
| Name | Company | Catalog Number | Comments |
| 0.2 ml PCR tube | Axygen Scientific | PCR-02D-C | Boil-proof |
| Gorilla Glue | Gorilla Glue, Inc. | Depends on vendor. This was purchased from a local store. | |
| Glass slides | VWR | 631-1575 | Dimensions: 24×60 mm2 |
| Polystyrene spheres | Fisher Scientific | TSS#4314A | Diameter = 140 µm; 3x104 particles per milliliter and 1.4% size distribution |
| Ethanol | Merck | 1.00983.1011 | absolute for analysis EMSURE; Dilute to 70% with Milli-Q water |
| Ultrasonic Bath | Elma | S10H | Equiment |
| Furnace | Nabertherm | N7/H | Equipment |
| 200 µl pipette tip | Axygen Scientific | T-210-Y-R-S | |
| Rocking shaker | VWR | 444-0142 | |
| Polyethylene Glycol (PEG) | Merck | 1.09727.0100 | Mw= 4 kDa; acrylation of PEG monomers and purification of the resulting precipitate produces a PEGDA macromer with Mw = 4.6 kDa |
| Centrifuge | Beckman Coulter | 392932 | Equipment |
| Acrylate-Poly(Ethylene Glycol) - Succinimidyl Valerate | Laysan Bio | ACRL-PEG-SVA-3400-1g | Mw = 3.4 kDa |
| 2-hydroxy-4'-(2-hydroxyethoxy)-2-methylpropiophenone | Sigma Aldrich | 410896 | |
| Vortex | VWR | 58816-123 | Equipment |
| Microcentrifuge | Eppendorf | 5404 000.413 | |
| Paraffin Film | Parafilm M | #PM996 | Kept at 9" with allows intensity of 10.84 mW/cm2 |
| Bluewave 200 UV spotlight | Blaze Technology | 120008, 122300 | |
| Tetrahydrofuran (THF) | Merck | 107025 | |
| Orbital shaker | Heidolph | 543-123120-00-5 | |
| Collagen Type I | Sigma Aldrich | C3867-1VL | From rat. 1x, w/o CaCl2 & MgCl2; pH = 7.2 |
| Phosphate Buffered Saline (PBS) | Gibco | 20012-027 | 16% W/V AQ. 10 x 10 ml |
| Paraformaldehyde | VWR | 43368.9M | Equipment |
| Freezone 4.5 freeze drier | Labconco | 7750020 | Equipment |
| Sputter coater | Jeol Ltd. | JFC-1600 | Equipment |
| Scanning Electron Microscope | Jeol Ltd. | JSM 5310 | |
| Anti-mouse primary antibodies against Collagen type I | Abcam | ab6308 | |
| Anti-mouse secondary antibody conjugated with Alexa Fluor 488 | Life Technologies | A21121 | |
| Plate, Tissue Culture 24 Well, Flat Bottom (Nunclon) | Bio-Rev PTE LTD | 3820-024 | |
| Dulbecco's Modified Eagle's Medium(DMEM) 2.5 g/L Glucose w/ L-Gln | Lonza | 12-604F | |
| Fetal Bovine Serum (FBS) | Gibco | A15-151 | |
| Penicillin-Streptomycin (P/S) | Life Tchnologies | 15140-122 E | |
| 100 mm Corning non-treated culture dishes | Sigma Aldrich | CLS430591 | |
| 0.25% Trypsin-EDTA | Gibco | 25200-056 | Equipment; 37 °C, 5% Humidity |
| Forma Steri-Cycle CO2 Incubators | Thermofisher Scientific | 371 | |
| Hausser Bright-Line Phase Hemacytometer | Thermofisher Scientific | 02-671-6 | |
| Live/Dead Viability/Cytotoxicity Kit for mammalian cells | Life Technologies | L3224 | |
| CCK-8 Assay | Dojindo Laboratories | CK04-11 | Monosodium-salt reagent (MSR) |
| Infinite 200 PRO microplate reader | Tecan | ||
| Albumin Human ELISA kit | Abcam | ab108788 | |
| Triton X-100 | Bio-Rad | #1610407 | |
| Bovine Serum Albumin (BSA) | Sigma-Aldrich | A2153-50G | |
| Anti-mouse primary antibodies (against CYP3A4, albumin) | Santa Cruz Biotechnology | sc-53850; sc-271605 | |
| DAPI | Life Technologies | D3571 | |
| Alexa Fluor 555 labeled Phalloidin | Life Technologies | A34055 | |
| Trizol | Life Technologies | 15596-026 | |
| Chloroform | VWR | 22706.326 | |
| Isopropanol | Fisher Scientific | 67-63-0 | |
| DPEC water | Thermofisher Scientific | AM9916 | |
| Nanodrop 2000c Spectrophotometer | Thermofisher Scientific | ND-2000 | |
| iScript Reverse Transcription Supermix | Bio-Rad Laboratories | 1708840 | |
| SYBR select Master Mix for CFX | Life Technology | 4472937 | |
| Primers (to be chosen) | |||
| CFX96 Real-Time System, C-1000 Touch Thermal Cycler | Bio Rad Laboratories | SOFT-CFX-31-PATCH |
Ссылки
- Yamada, M., et al. Controlled formation of heterotypic hepatic micro-organoids in anisotropic hydrogel microfibers for long-term preservation of liver-specific functions. Biomaterials. 33 (33), 8304-8315 (2012).
- Abboud, G., Kaplowitz, N. Drug-induced liver injury. Drug Safety. 30 (4), 277-294 (2007).
- Cho, N. J., et al. Viral infection of human progenitor and liver-derived cells encapsulated in three-dimensional PEG-based hydrogel. Biomed Mater. 4 (1), (2009).
- Revzin, A., et al. Designing a hepatocellular microenvironment with protein microarraying and poly (ethylene glycol) photolithography. Langmuir. 20 (8), 2999-3005 (2004).
- Sato, A., Kadokura, K., Uchida, H., Tsukada, K. An in vitro hepatic zonation model with a continuous oxygen gradient in a microdevice. Biochem Bioph Res Com. 453 (4), 767-771 (2014).
- Domansky, K., et al. Perfused multiwell plate for 3D liver tissue engineering. Lab Chip. 10 (1), 51-58 (2010).
- Hegde, M., et al. Dynamic interplay of flow and collagen stabilizes primary hepatocytes culture in a microfluidic platform. Lab Chip. 14 (12), 2033-2039 (2014).
- Flaim, C. J., Chien, S., Bhatia, S. N. An extracellular matrix microarray for probing cellular differentiation. Nat methods. 2 (2), 119-125 (2005).
- Underhill, G. H., Chen, A. A., Albrecht, D. R., Bhatia, S. N. Assessment of hepatocellular function within PEG hydrogels. Biomaterials. 28 (2), 256-270 (2007).
- Dunn, J., Tompkins, R. G., Yarmush, M. L. Hepatocytes in collagen sandwich: evidence for transcriptional and translational regulation. J cell biol. 116 (4), 1043-1053 (1992).
- Dunn, J. C., Tompkins, R. G., Yarmush, M. L. Long-term in vitro function of adult hepatocytes in a collagen sandwich configuration. Biotechnol progr. 7 (3), 237-245 (1991).
- Ling, Y., et al. A cell-laden microfluidic hydrogel. Lab Chip. 7 (6), 756-762 (2007).
- Kim, M., Lee, J. Y., Jones, C. N., Revzin, A., Tae, G. Heparin-based hydrogel as a matrix for encapsulation and cultivation of primary hepatocytes. Biomaterials. 31 (13), 3596-3603 (2010).
- Kotov, N. A., et al. Inverted Colloidal Crystals as Three-Dimensional Cell Scaffolds. Langmuir. 20 (19), 7887-7892 (2004).
- Shanbhag, S., Woo Lee, J., Kotov, N. Diffusion in three-dimensionally ordered scaffolds with inverted colloidal crystal geometry. Biomaterials. 26 (27), 5581-5585 (2005).
- Lee, Y. H., Huang, J. R., Wang, Y. K., Lin, K. H. Three-dimensional fibroblast morphology on compliant substrates of controlled negative curvature. Integr Biol. 5, 1447-1455 (2013).
- da Silva, J., Lautenschlager, F., Kuo, C. H. R., Guck, J., Sivaniah, E. 3D inverted colloidal crystals in realistic cell migration assays for drug screening applications. Integr Biol. 3, 1202-1206 (2011).
- da Silva, J., Lautenschlager, F., Sivaniah, E., Guck, J. R. The cavity-to-cavity migration of leukaemic cells through 3D honey-combed hydrogels with adjustable internal dimension and stiffness. Biomaterials. 31, 2201-2208 (2010).
- Lee, J., Lilly, G. D., Doty, R. C., Podsiadlo, P., Kotov, N. A. In vitro toxicity testing of nanoparticles in 3D cell culture. Small. 5, 1213-1221 (2009).
- Lee, J., Kotov, N. A. Notch ligand presenting acellular 3D microenvironments for ex vivo human hematopoietic stem-cell culture made by layer-by-layer assembly. Small. 5, 1008-1013 (2009).
- Liu, Y., et al. Rapid aqueous photo-polymerization route to polymer and polymer-composite hydrogel 3D inverted colloidal crystal scaffolds. J Biomed Mater Res. Part A. 83, 1-9 (2007).
- Ma, P. X., Choi, J. W. Biodegradable polymer scaffolds with well-defined interconnected spherical pore network. Tissue Eng. 7, 23-33 (2001).
- Cuddihy, M. J., Kotov, N. A. Poly (lactic-co-glycolic acid) bone scaffolds with inverted colloidal crystal geometry. Tissue Eng Part A. 14, 1639-1649 (2008).
- Choi, S. W., Zhang, Y., Xia, Y. Three-dimensional scaffolds for tissue engineering: the importance of uniformity in pore size and structure. Langmuir. 26, 19001-19006 (2010).
- Choi, S. W., Zhang, Y., Thomopoulos, S., Xia, Y. In vitro mineralization by preosteoblasts in poly(DL-lactide-co-glycolide) inverse opal scaffolds reinforced with hydroxyapatite nanoparticles. Langmuir. 26, 12126-12131 (2010).
- Choi, S. W., Zhang, Y., Macewan, M. R., Xia, Y. Neovascularization in biodegradable inverse opal scaffolds with uniform and precisely controlled pore sizes. Adv Healthc Mater. 2, 145-154 (2013).
- Zhang, Y., Choi, S. W., Xia, Y. Modifying the Pores of an Inverse Opal Scaffold With Chitosan Microstructures for Truly Three-Dimensional Cell Culture. Macromol Rapid Commun. 33, 296-301 (2012).
- Cai, X., et al. Investigation of neovascularization in three-dimensional porous scaffolds in vivo by a combination of multiscale photoacoustic microscopy and optical coherence tomography. Tissue Eng. Part C, Meth. 19, 196-204 (2013).
- Zhang, Y. S., Yao, J., Wang, L. V., Xia, Y. Fabrication of Cell Patches Using Biodegradable Scaffolds with a Hexagonal Array of Interconnected Pores (SHAIPs). Polymer. 55, 445-452 (2014).
- Zhang, Y. S., Regan, K. P., Xia, Y. Controlling the Pore Sizes and Related Properties of Inverse Opal Scaffolds for Tissue Engineering Applications. Macromol Rapid Commun. 34, 485-491 (2013).
- Stachowiak, A. N., Bershteyn, A., Tzatzalos, E., Irvine, D. J. Bioactive Hydrogels with an Ordered Cellular Structure Combine Interconnected Macroporosity and Robust Mechanical Properties. Adv Mater. 17, 399-403 (2005).
- Stachowiak, A. N., Irvine, D. J. Inverse opal hydrogel-collagen composite scaffolds as a supportive microenvironment for immune cell migration. J Biomed Mater Res. Part A. 85, 815-828 (2008).
- Liu, Y., Wang, S. 3D inverted opal hydrogel scaffolds with oxygen sensing capability. Colloids and surfaces. B, Biointerfaces. 58, 8-13 (2007).
- Bryant, S. J., Cuy, J. L., Hauch, K. D., Ratner, B. D. Photo-patterning of porous hydrogels for tissue engineering. Biomaterials. 28, 2978-2986 (2007).
- Bhrany, A. D., Irvin, C. A., Fujitani, K., Liu, Z., Ratner, B. D. Evaluation of a sphere-templated polymeric scaffold as a subcutaneous implant. JAMA facial plastic surgery. 15, 29-33 (2013).
- Kuo, Y. C., Chiu, K. H. Inverted colloidal crystal scaffolds with laminin-derived peptides for neuronal differentiation of bone marrow stromal cells. Biomaterials. 32 (3), 819-831 (2011).
- Yang, J. T., Kuo, Y. C., Chiu, K. H. Peptide-modified inverted colloidal crystal scaffolds with bone marrow stromal cells in the treatment for spinal cord injury. Colloids Surf. B, Biointerfaces. 84, 198-205 (2011).
- Kuo, Y. C., Tsai, Y. T. Inverted colloidal crystal scaffolds for uniform cartilage regeneration. Biomacromolecules. 11, 731-739 (2010).
- Choi, S. W., Xie, J., Xia, Y. Chitosan-Based Inverse Opals: Three-Dimensional Scaffolds with Uniform Pore Structures for Cell Culture. Adv Mater. 21, 2997-3001 (2009).
- Long, T. J., Sprenger, C. C., Plymate, S. R., Ratner, B. D. Prostate cancer xenografts engineered from 3D precision-porous poly(2-hydroxyethyl methacrylate) hydrogels as models for tumorigenesis and dormancy escape. Biomaterials. 35, 8164-8174 (2014).
- Kuo, Y. C., Tsai, Y. T. Inverted colloidal crystal scaffolds for uniform cartilage regeneration. Biomacromolecules. 11, 731-739 (2010).
- Kuo, Y. C., Chiu, K. H. Inverted colloidal crystal scaffolds with laminin-derived peptides for neuronal differentiation of bone marrow stromal cells. Biomaterials. 32, 819-831 (2011).
- Lee, J., Cuddihy, M. J., Cater, G. M., Kotov, N. A. Engineering liver tissue spheroids with inverted colloidal crystal scaffolds. Biomaterials. 30 (27), 4687-4694 (2009).
- Galperin, A., et al. Integrated bi-layered scaffold for osteochondral tissue engineering. Adv Healthc Mater. 2, 872-883 (2013).
- Waters, D. J., et al. Morphology of Photopolymerized End-linked Poly(ethylene glycol) Hydrogels by Small Angle X-ray Scattering. Macromolecules. 43 (16), 6861-6870 (2010).
- Elbert, D. L., Hubbell, J. A. Conjugate addition reactions combined with free-radical cross-linking for the design of materials for tissue engineering. Biomacromolecules. 2 (2), 430-441 (2001).
- Kim, M. H., et al. Biofunctionalized Hydrogel Microscaffolds Promote Three-Dimensional Hepatic Sheet Morphology. Macromol Biosci. , (2015).
- Ferreira, T., Rasband, W. ImageJ User Guide. , http://imagej.nih.gov/ij/docs/guide/146-30.html#toc-Subsection-30.1 (2012).
- JoVE Science Education Database. General Laboratory Techniques. Introduction to Fluorescence Microscopy. , JoVE. Cambridge, MA. (2015).
- Tominaga, H., et al. A water-soluble tetrazolium salt useful for colorimetric cell viability assay. Anal Commun. 36 (2), 47-50 (1999).
- JoVE Science Education Database. General Laboratory Techniques. Introduction to the Microplate Reader. , JoVE. Cambridge, MA. (2015).
- JoVE Science Education Database. Basic Methods in Cellular and Molecular Biology. The ELISA Method. , JoVE. Cambridge, MA. (2015).
- Nolan, T., Hands, R. E., Bustin, S. A. Quantification of mRNA using real-time RT-PCR. Nat Protoc. 1, 1559-1582 (2006).
- JoVE Science Education Database. Essentials of Environmental Microbiology. RNA Analysis of Environmental Samples Using RT-PCR. , JoVE. Cambridge, MA. (2016).
- JoVE Science Education. Essentials of Environmental Microbiology. , JoVE. (2015).
- Jeong, S., et al. The evolution of gene regulation underlies a morphological difference between two Drosophila sister species. Cell. 132 (5), 783-793 (2008).
- Griffith, L. G., Naughton, G. Tissue engineering--current challenges and expanding opportunities. Science. 295 (5557), 1009-1014 (2002).
- Hegde, M., et al. Dynamic Interplay of Flow and Collagen Stabilizes Primary Hepatocytes Culture in a Microfluidic Platform. Lab Chip. 14, 2033-2039 (2014).
- Kim, Y., Lasher, C. D., Milford, L. M., Murali, T., Rajagopalan, P. A comparative study of genome-wide transcriptional profiles of primary hepatocytes in collagen sandwich and monolayer cultures. Tissue Eng Pt C. 16 (6), 1449-1460 (2010).
- Baimakhanov, Z., et al. Efficacy of multi-layered hepatocyte sheet transplantation for radiation-induced liver damage and partial hepatectomy in a rat model. Cell Transplant. , (2015).
- Li, C. Y., et al. Micropatterned Cell-Cell Interactions Enable Functional Encapsulation of Primary Hepatocytes in Hydrogel Microtissues. Tissue Eng Pt A. 20 (15-16), 2200-2212 (2014).
- Shlomai, A., et al. Modeling host interactions with hepatitis B virus using primary and induced pluripotent stem cell-derived hepatocellular systems. P Natl A Sci USA. 111 (33), 12193-12198 (2014).
- Curcio, E., et al. Mass transfer and metabolic reactions in hepatocyte spheroids cultured in rotating wall gas-permeable membrane system. Biomaterials. 28, 5487-5497 (2007).
- Martinez-Hernandez, A., Amenta, P. The hepatic extracellular matrix. Vichows Archiv A Pathol Anat. 423, 1-11 (1993).
- Liu, Y., Wang, S., Lee, J. W., Kotov, N. A. A Floating Self-Assembly Route to Colloidal Crystal Templates for 3D Cell Scaffolds. Chem Mater. 17 (20), 4918-4924 (2005).
Access restricted. Please log in or start a trial to view this content.
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены