Method Article
在质膜用新型荧光探针磷脂酰-4,5-二磷酸的单分子超分辨率成像
摘要
PI(4,5)P2调节各种细胞功能,但其在细胞质膜的纳米级组织知之甚少。由标记的PI(4,5)P 2与融合于普列克底物蛋白同源结构域的双色荧光探针,我们描述了一种新的方法来研究的PI(4,5)P2在质膜2的空间分布在纳米尺度。
摘要
Phosphoinositides in the cell membrane are signaling lipids with multiple cellular functions. Phosphatidylinositol 4,5-bisphosphate (PI(4,5)P2) is a determinant phosphoinositide of the plasma membrane (PM), and it is required to modulate ion channels, actin dynamics, exocytosis, endocytosis, intracellular signaling, and many other cellular processes. However, the spatial organization of PI(4,5)P2 in the PM is controversial, and its nanoscale distribution is poorly understood due to the technical limitations of research approaches. Here by utilizing single molecule localization microscopy and the Pleckstrin Homology (PH) domain based dual color fluorescent probes, we describe a novel method to visualize the nanoscale distribution of PI(4,5)P2 in the PM in fixed membrane sheets as well as live cells.
引言
磷酸肌醇向总膜脂质的一小部分,但在多种细胞过程中起关键作用。它们包括来自肌醇环的可逆的磷酸化或去磷酸化的第三派生七个成员, 第 4和第 5的位置1。磷脂酰肌醇4磷酸盐(PI4P)和磷脂酰肌醇4,5-二磷酸(PI(4,5)P2)是相对独立运作的细胞质膜(PM)2,3的行列式血脂两大磷酸肌醇。磷脂酰肌醇(3,4,5)-trisphosphate(PIP 3)比PI4P和PI(4,5)P2丰富得多,但它在不同的细胞过程,包括癌症4和糖尿病5独特的功能。这些脂质与他们的效应和许多其它蛋白复合物的分子相互作用。因此,关键的是要了解这些坡的空间组织sphoinositides在纳米尺度的PM。
越来越多的证据表明,在该密闭PM区域的蛋白质复合物或分子簇可以作为信令热点6。例如,突触1a中,一种调节膜融合7-9的关键蛋白质,显示在PM簇的组织。从突触1a的集群组织的一致看法不同,磷酸肌醇在下午的空间分布是有争议的。 PI(4,5)P2分布模式的范围从10-12均匀,大片13,14,以密集使用集群14-18,取决于细胞类型和实验方法。 PI(4,5)P2在较高分辨率的空间组织也不一致。利用受激发射损耗的一项研究(STED)显微镜19揭示了大量密集的PI(4,5)P2的纳米团簇(〜直径为73纳米)的PC-12细胞20张PM 。这个结果是从采用快速冷冻电子显微镜(EM)21,22,它保留活细胞的完整PM结构比化学固定要好得多的方法研究不同。后者表现为PI(4,5)P2的不同池;相对浓缩的PI(4,5)在胞膜窖和涂覆的凹坑P 2以及在平坦下午区域均匀分布。此外,纳米级PI(4,5)P2组织膜片可在活细胞和固定细胞不同。我们最近的研究工作使用单分子定位显微镜(SMLM)23固定和生活INS-1细胞这个问题。
SMLM是基于在任何给定时间随机切换仅荧光的一小部分,使得个体的荧光团能够以高精度进行本地化。许多超分辨率成像的方法已被采用类似的原理超越常规光镜的衍射极限的发展,这样的小号光敏定位显微镜(PALM)24,荧光光敏定位显微镜(FPALM)25,随机光学重建显微镜(STORM)26,27和直接STORM(dSTORM)28。随着光电开关或光激活荧光团(染料或荧光蛋白),SMLM技术允许在活细胞中31,32的视频速率纳米分辨率24,29,30科学家图像生物结构。
使用PI(4,5)P2作为一个例子,我们推出了SMLM方法来研究对PM磷酸肌醇的纳米级分布。 PLCδ1(磷脂酶Cδ1)特异性结合的PI的PH结构域(4,5)P 2是在PM成像PI(4,5)P2的亚细胞分布和动力学33,34行之有效的探针。我们的基因标记这个领域有两个荧光蛋白,PAmCherry1 35和36 IRFP 以产生双色融合蛋白(IRFP-PAmCherry1-PHPLCδ1)( 图1A-B)。PAmCherry1用作PH结构域的供PALM可光活化探针和IRFP作为一般指标PALM采集之前识别转染的细胞。我们将此双色荧光探针在固定膜片SMLM成像。对于实时成像PALM,我们标记mEOS3 37,而不是PAmCherry1的PHPLCδ1域生成其更好光子效率和亮度( 图1C-D)的mEOS3.1-PHPLCδ1探头。
SMLM显像与胰岛素分泌INS-1细胞38的PM这些新颖的探头已发现的PI(4,5)P 2中的大多数在PM区域以及浓缩的PI(4,5)P2的均一标记这是在平坦PM和一些丝状伪足状结构23疏混合微区。呐PI(4,5)P2的noScale,则分布提供了重新思考它在活细胞中如何发挥作用的结构基础。
研究方案
1.膜片制备及固定
- 准备贴有IRFP-PAmCherry1-PH PLCδ1膜片
- 制备DNA质粒编码IRFP-PAmCherry1-PH PLC采用标准分子生物学技术δ123。
- 培养INS-1细胞上#1.518毫米圆形盖玻片预涂覆有30微克/毫升纤连蛋白50-70%汇合以下标准的INS-1细胞培养协议38,39。转染的细胞每天达到50〜70%汇合后。
- 用脂质体转染试剂以下制造商的协议δ1转染细胞与IRFP-PAmCherry1-PH PLC。转染后,让细胞生长48小时。
- 在实验的当天,涂层盖玻片(上一侧)〜0.5 - 1毫升500微克/毫升聚-D-赖氨酸(PDL;用蒸馏水2 O稀释)1-2小时。然后通过放置纸巾流失PDL盖玻片的边缘。放置盖玻片上的预冷(4℃)金属以备后用板。
- 洗预染INS-1细胞上以〜0.5盖玻片生长 - 含有1mM EGTA 1毫升冰冷的磷酸盐缓冲盐水(PBS)。重复洗三次,沥干PBS。
- 放置与培养的细胞(细胞侧朝下)上有一对镊子的一预冷却的金属板PDL中涂覆的盖玻片的盖玻片。离开板在7冰箱(4℃) - 10分钟,以允许细胞附着到PDL中涂覆的盖玻片( 图2)。
注:温育时间应在7〜 - 10分钟使细胞给PDL涂覆表面的更好附着。这款冰箱环境干燥,孵化不宜过长。 - 从冰箱中取出金属板。轻轻剥离含有用镊子预先转染的细胞在盖玻片。这产生细胞膜片上的薄层PDL涂层的盖玻片。轻轻地用〜0.5洗膜片 - 1毫升冰冷的PBS,然后用〜0.5修复 - 1毫升冰冷的4%多聚甲醛(PFA)+ 0.2%的戊二醛(GA)在PBS中于4℃下15分钟。
注意:多聚甲醛和戊二醛是有毒的。处理它们与皮肤和眼睛的保护在通风橱。 - 固定后,图像的膜片立即(见第3节)或〜0.5存储在 - 1ml的PBS于4℃。
注:定影膜片后,将没有平衡从胞质溶胶对PI(4,5)P2的PH探针的结合。结合的PH探针会逐渐从膜片分离并扩散到溶液(尽管它可能需要数天到数周)。因此,样品制备后立即建议图像的固定的样品。
- 准备膜片的PI(4,5)P2特异性抗体标记
- 培养INS-1细胞上#1.5 18毫米的圆形盖玻片预涂覆有30µ微克/毫升纤连蛋白,以50%-70%汇合。如在步骤1.1.3中所述转染的细胞与DNA质粒的第二天。
- 重复从1.1.4步骤如上所述1.1.7。
注:在4℃执行下列步骤。 - 洗含有固定点片三次以〜0.5的盖玻片-含有50mM NH 4(CL 1)毫升冰冷的PBS中。淬火以〜0.5的片材-在PBS中1毫升0.1N%的硼氢化钠7分钟,并用清洗〜0.5 - 1ml的PBS(不含50mM的NH 4 Cl)的。
- 封锁〜0.5的样品- 1毫升封闭溶液45分钟(含5%(体积/体积)正常山羊血清,5%(体积/体积)牛血清白蛋白和50mM 氯化铵 PBS溶液)。在1小时封闭液:(300稀释1)1毫升主要PI(4,5)P2抗体-然后,孵育〜0.5。含有50mM 氯化铵 1ml的PBS -以〜0.5洗涤三次(每次10分钟)。
- 孵育样品〜0.5 - 1毫升次级的F(ab')2山羊抗小鼠抗体与荧光团(1:300)缀合在1小时封闭缓冲液。 1ml的PBS - 以〜0.5洗涤三次。
- 与修复交样品4%PFA + 0.2%的GA 15分钟,然后再洗涤样品三次,用PBS(每次7分钟)。进行到第3节成像或〜0.5〜1毫升的PBS在4℃保存以备后用。
注:在4℃制备样品。使用4%PFA + 0.2%的GA固定液以保留在PM磷酸肌醇的生理分布。 RT制备或固定单独用4%PFA可能引起显著工件( 图4)。
2.细胞培养制备与mEOS3.1-PH PLCδ1活细胞成像
- 制备如前面23所描述编码mEOS3.1-PH PLCδ1的DNA质粒。
- 培养INS-1细胞上#1.518毫米圆形盖玻片预涂覆有30微克/毫升纤连蛋白,直到他们达到50%-70%confluency下列标准INS-1细胞培养协议38,39。
- 第二天,转染INS-1细胞,使用脂质体转染试剂以下制造的协议δ1DNA质粒的mEOS3.1-PH 的PLC。孵育前成像48小时。
膜片和活细胞PALM 3.图像采集
- 手掌图像采集膜片的
注意:在此,全内反射荧光(TIRF)显微镜基于SMLM系统(100X油,APO,NA = 1.49,WD0.12毫米)23被用于所有的图像采集。- 成像前,稀1μl的荧光珠溶液的10ml PBS + 50mM的MgCl 2的。加入200μl稀释液入含有成像室的细胞样品(从步骤1.1.8 / 1.2.6)10分钟。然后,用PBS洗三次。
- 启动PALM成像系统。在相关的图像处理软件,选择"IRFP信道#34;按钮(642 nm激光激发,七十五分之七百nm发射)。发现细胞膜表达PH探头在IRFP通道。
注:膜片应该有附近的荧光珠。这是必需的漂移校正以后。 - 使用"捕捉"按钮来收集细胞膜IRFP通道的常规TIRF图像作为未来图像重建的参考。通过在TIRF角度设置成像2140键入SET正常TIRF角度( 即 ,在到达临界角后,又转1.5度)。使用这个角度除非另有说明设置的所有步骤。
注意:在这里描述的TIRF系统,3500是垂直向上的角度2200是TIRF临界角,和2140是普通的TIRF角度,这是以后的TIRF临界角1.5度以上。 3.2.3下面提到的窄TIRF角度为2120,这是达到TIRF临界角接连2度。 - 通过单击日切换到PAmCherry1通道ËRFP通道按钮(561 nm激发,五十零分之六百nm发射过滤器)。一路调整滚动条中的"AOTF"垫右侧有561 nm激光的全功率照明10-20秒漂白背景膜荧光。
- 在"格式"选项卡,并在"ND序列采集"选项卡中的快速采集协议设定最佳相机设置(2x2融合)(通常在20赫兹10,000-40,000图像)。
- 点击"立即运行"按钮 - 在较低水平(1%0.1%)开始收购PAmCherry1图像(561 nm激光在满功率,50毫秒/帧)并同时405 nm激光激活。调整405nm的激光的强度,从而在每一帧中在空间上分离的各个点是容易辨认。
注:可活化PAmCherry1分子的数目采集过程中逐渐减小。 405nm的激光强度应逐渐增加,以保持在每个单独的分子信号的最优密度帧。 - 继续获取图像,直到没有PAmCherry1单分子信号被激活。
- PALM成像在活细胞中
- 成像前,如在步骤3.1.1中所述稀释荧光珠进入成像室10分钟。然后,打开相关的成像软件启动Palm成像。
注:使用活细胞成像的磁性快速释放成像室。保持摄像视场的在35℃下恒定灌注与细胞外缓冲液(胞外溶液温度控制器的中心:135 mM氯化钠,5.6毫摩尔的KCl,2.6毫摩尔氯化钙 ,1.2mM的MgCl 2的,3毫米的葡萄糖,和20mM HEPES; pH值= 7.3)。 - 选择GFP通道按钮(五十零分之五百二十五nm发射)。识别细胞膜根据下488 nm激光激发从mEOS3绿色荧光表达荧光探针。确保荧光珠附近的成像,因为这期间还包括在以后需要离线DRI英尺修正。
- 点击"捕获"按钮,收集细胞膜的mEOS3(绿色)通道TIRF图像作为参考图像。通过在TIRF角度设置活细胞成像在2120打字使用浅倏逝波激发照明(在达到临界角后,又转2度)。
注意:这最小化与未结合mEos3-PH在胞质溶胶相邻质膜的荧光。 - 切换到"RFP通道"按钮(561 nm激发,五十零分之六百nm发射)。使用全功率561 nm激光漂白为10〜20秒,在"AOTF垫"滚动条的膜片的背景荧光(见3.1.4)。
- 通过单击红色通道"立即运行"按钮(561 nm的全功率,在"相机"设置选项卡设置为10毫秒/帧)并同时405 nm激光激活启动图像采集。调整405纳米的激光强度来激活空间分离点在每个帧中。
注:为获取收益,未转换mEOS3.1-PH PLCδ1分子数缓慢下降。逐渐增加405nm的激光功率来优化单分子的信号。成像采集长度取决于实验目的。连续采集的图像在正常条件下5分钟。如果需要更长的采集,收集多个图像堆栈,而不是一个单一的,大的图像堆栈。每个图像栈的文件大小不得超过4 GB或稍后会影响软件分析。
- 成像前,如在步骤3.1.1中所述稀释荧光珠进入成像室10分钟。然后,打开相关的成像软件启动Palm成像。
4. SMLM图像处理与重建
- 图像文件(.TIF图像堆栈)转移到一个图像分析站。如前所述37在Matlab启动图像重建程序(定制编写的),并通过点击主菜单中的"文件"选项卡中加载图像堆栈,然后在"打开",然后选择"新建文件"。
- 识别和LOCA丽泽从每一帧单独分子事件。设置过滤强度阈值与在"小波"阈值数量(1-10)。重建前直观地验证点检测的最佳参数设置。然后去"掌"选项卡,然后单击"一步过程",开始图像重建。
注:点检测强度阈值是任意的,取决于个人的经验。几个试验可能需要产生一个最佳的检测阈值,无论是拿起了太多的不合格(DIM)点也过滤掉过多的限定(亮)点。调整其他参数来优化数据分析。这里,附近的距离(在一个范围内的相邻帧组合荧光点)被设定为65纳米(1/2象素宽度)和嵌合作为单个分子。峡帧(这些帧和邻里的距离内发生合并,拟合为单分子事件的个别分子事件)是设定为26帧(1.3秒)PAmCherry1成像40。根据单分子探测和捕获率的属性,以避免在SMLM过计数40调整这些参数。在重建过程中的荧光珠应用漂移校正。- 用于成像由IRFP-PAmCherry1-PH PLCδ1标记固定膜片,重建从同一膜片整个图像堆栈成一个单一的超分辨率图像37。
- 用于通过mEOS3.1-PH PLCδ1标记活细胞样本,整个图像堆栈分离成1000帧的几个较小的堆,使得1000连续帧堆栈被重构为单个超分辨率图像,其具有时间分辨率10秒。在结束时,将所有的时间序列图像到最后的时间序列栈23。
注:在活细胞成像PALM,激活探头少数可移动或分离从PI(4,5)P2漂白前的PM。为了考虑探针的过采样,图像分析过程中结合个别分子信号(而不是65纳米)130纳米范围内的相邻帧为单个发射事件。
- 获得的重建图像后,开展与在Matlab定制编写的程序来量化分子密度,微域密度/大小和集群对相关41分析进一步的图像分析。
结果
我们的超分辨率系统的定位不确定性(σ)为14.73处23。 TIRF和PALM图像之间的直接比较显示出的空间分辨率的一个显著的改进。 图3A-B显示了代表PI(4,5)P2标记的PI(4,5)P 2抗体和IRFP-PAmCherry1-PH 的PLC的TIRF图像δ1典型的膜片和活细胞。在膜片与常规的TIRF显微镜图像是非常类似于在标记的增强型绿色荧光蛋白完整的活细胞(绿色荧光蛋白)标记的PH域(EGFP-PHPLCδ1)( 图3C)。所有样品显示偶数探针分布。与此相反,样品的非最佳的固定导致急剧稠密的PI(4,5)P 2簇和在信号强度降低( 图4)。在最佳条件下的固定,T他的PI(4,5)P 2在固定的细胞( 图5)的超分辨率图像显示探针在PM的显著部均匀分布,只有有限的浓度梯度。与PI(4,5)P2探头丰富一些膜补丁稀疏分布并有各种尺寸。活细胞的PALM图像显示类似的空间分布作为固定的细胞( 图6)。 PI(4,5)P2信号随在局部地区快速的动态时间结果的详细分析,没有他们的丰度广泛领域的显著变化。
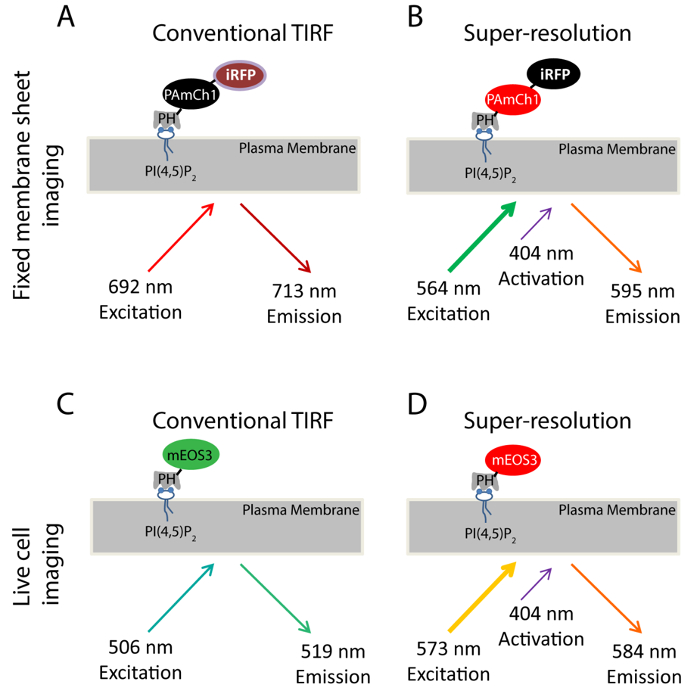
图1.方案本研究中使用的荧光探针。(AB)IRFP-PAmCherry1-PH PLCδ1探针在固定膜片的实验中使用。在传统的全内反射荧光成像(A),640纳米激光用于激励IRFP(例:692纳米; EM:713纳米)。在这种情况下采取的TIRF图像用作由PALM成像(B)获得的超分辨率成像的TIRF参考图像。 405nm激光用于光激活的PAmCherry1荧光团和561 nm激光被用来激发PAmCherry1(例如:564纳米; EM:595纳米)的PALM成像。 ( 光盘 )在活细胞的实验中使用mEos3.1-PHPLCδ1探针。 (c)在常规的TIRF成像,488nm的激光器被用于激发mEOS3.1(例如:506纳米; EM:519纳米)。 ( 四 )由405 nm激光光转化后,mEos3.1变成红色的形式(例如:573纳米; EM:584纳米)。和561 nm激光用于收购PALM ,请点击此处查看大图这个数字。
S / ftp_upload / 54466 / 54466fig2.jpg"/>
图2.方案从INS-1细胞的膜片制剂:(A)将带有朝下到PDL涂覆盖玻片培养细胞的盖玻片并等待7〜10分钟,在4℃下,以允许细胞附着到PDL-涂盖玻片。 (B)剥掉用镊子顶部盖玻片和固定连接到PDL预涂盖玻片膜片。 (C)图像的TIRFM和Palm的样品。 请点击此处查看该图的放大版本。
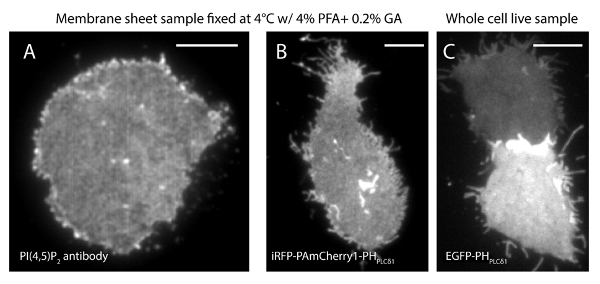
图3. PI(4,5)P2 空间组织是传统的全内反射荧光显微镜下膜片和完整活细胞相似。(A)膜片的典型的TIRF图像固定在4℃下用4%PFA和0.2%的GA。 PI(4,5)P2被标记的PI(4,5)P 2特异性抗体。 ( 二 )从INS-1细胞表达IRFP-PAmCherry1-PH PLCδ1的膜,片材。在不同层次表达EGFP-PHPLCδ1两种完整活细胞(C)的TIRF图像。比例尺:(A):3微米; (B)和(C):5微米请点击此处查看该图的放大版本。
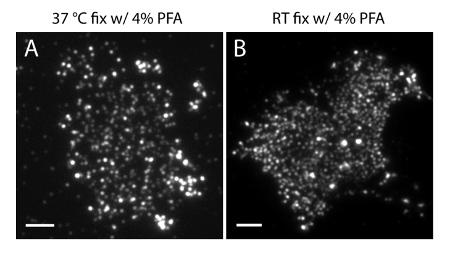
图4的PI(4,5)P2在膜片空间组织是共同的固定的条件很敏感。(A)的膜片单独固定在37℃用4%PFA并用PI(4,5)P2特异性抗体标记( 如图3A)。 (B)的膜板片固定在RT与单独的PFA和PI(4,5)P2特异性抗体标记。需要注意的是PI的致密簇(4,5)P 2探针是清晰可见的TIRF显微镜下,相较于在图3A所示的多甚至荧光图像。比例尺:AB:3微米请点击此处查看该图的放大版本。
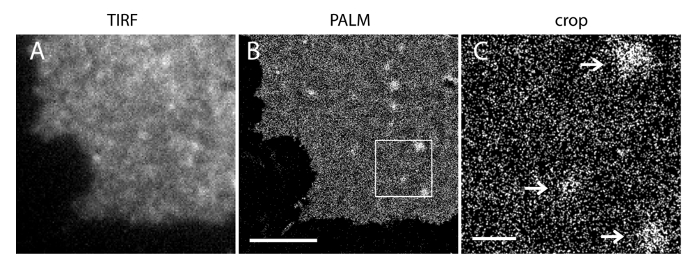
图5. PALM的PI的成像(4,5)P2探针揭示在INS-1细胞PM其纳米尺度分布:(A)来自INS-1细胞中表达IRFP-PAmCherry1-PH一个膜片的IRFP TIRF图像PLCδ1。(B)对应的PM的手掌图像的基础上PAmCherry1信号重构同一区域。注意均匀的PI(4,5)P2主要PM地区和一些PI(4,5)P2微区2空间分布。 (C)在(B)中的盒装区域的放大图。箭头表示稀疏分布与PI(4,5)P2探头丰富PM微区。比例尺:A和B:3微米; C:500纳米。 请点击此处查看该图的放大版本。
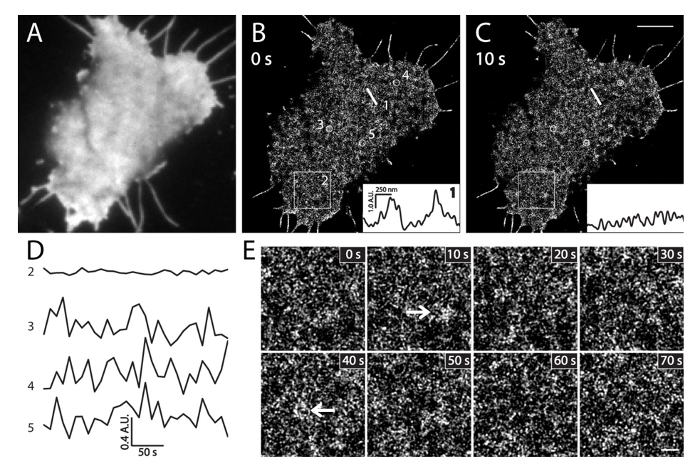
图6. PALM成像活INS-1细胞( 一 )在现场INS-1细胞表达mEos3.1-PH PLC PI(4,5)P2的TIRF形象δ1。图像中的PALM采集(35℃)之前的绿色通道被迅速获得的。 (B)以10秒的时间间隔顺序活细胞PALM图像。插图显示沿(B)中在不同的时间在同一直线1位置的局部的PI(4,5)P 2密度和(C)的强度分布。注意:在10秒内他们大局部强度的变化。 (D)的PI的平均强度的改变的时间过程(4,5)P 2,在(B)的大面积(BOX2,3×3微米)和小圆圈(3,4和5中,500纳米直径)中5 PALM成像分钟(帧/ 10秒)。注意局部PI(4,5)P2探头的快速强度波动(圈3,4和5)相比,在广泛的领域(专栏2)非常小的变化。在(B)中在指定时间的BOX2区域(E)的放大的PALM图像。箭头指示PI(4,5)P2丰富膜下p补丁hysiological条件。比例尺:C:3微米; E:500纳米。 请点击此处查看该图的放大版本。
讨论
为了排除故障,两个过程需要格外注意:薄膜片材生产和样品固定。在协议中描述的,在步骤1.1.6盖玻片的孵育时间为膜片生产很重要的。我们的实验条件下的最佳温育时间是7-10分钟( 图2)。不到10分钟孵化不再会产生完整的细胞,而不是在盖玻片PDL和较短的孵化膜片将导致更少或对PDL涂层的盖玻片没有膜片。在协议中描述的,固定在固定剂和温度是保持在PM的PI(4,5)P2分配是至关重要的。在固定RT或单独使用4%-PFA的可能扭曲,下午在血脂正常分布。
通过应用PALM显微膜脂的研究,我们能够观察到的PI纳米尺度分布(4,5)P2,介导米的关键磷酸肌醇任何根本性的细胞活动。 PI(4,5)P2的有限的浓度梯度此空间分布在INS-1细胞提供了用于重新思考脂质-蛋白质相互作用和PI(4,5)P2在这些细胞中的本地信令事件的框架。此外,在该工作开发的方法也可以应用到其他膜磷脂研究与适当的探针,由此,提供新颖的工具来研究在生物过程磷酸肌醇。
在这项工作中使用膜片的绕过磷脂形态学研究的两大关注点:洗涤剂治疗和细胞质的潜在信号污染。洗涤剂往往造成聚类和PM磷脂信号显著损失。胞质信号的污染是在PM 23的低丰度磷酸肌醇,如PI(3,4,5)P 3和PI(3,4)P 2的情况下是特别成问题的。膜片样品能够断路器操作过mvent这些问题,而不显著破坏与质膜相关联结构,诸如皮质肌动蛋白网和网格蛋白小窝42,43。在PM的PI(4,5)P 2的相对均匀的分布与使用的GST-PH PLCδ1探针在成纤维膜44等速冻电磁研究一致。
要注意的是不正确的检测体处理的条件可以产生误导的结果是很重要的。首先,关键是要在较低温度下(4℃)进行固定的步骤,并使用固定剂的GA对膜片的生产。正如图3所示,温暖温度和PFA固定无GA不足以修复细胞PM磷酸肌醇。这可能扭曲完好的PI(4,5)P 2分配,并生成未在活细胞生理条件下观察到尖锐簇。二,使用PAmCherry1作为在SMLM探头,而不是其他探头,是举足轻重的定量PALM成像。 PAmCherry1应用程序的好处来自其良好的特点单分子光物理性质35,40,45,如亮度,高光激活的效率,最重要的是非常有限的光闪烁。这些特性使我们能够消除光闪烁的潜在集群文物和定量分析膜PI(4,5)P2的分子密度。
这种方法也有其局限性。首先,在该研究中使用的膜片的方法可能无法完全模仿PI(4,5)P2的生理分布,因为该单元被成像前中断。然而,我们的现场PALM成像显示PI(4,5)P2相似相对均匀分布,支持与膜片的样品观察到的结果。其次,我们在以前的工作讨论23,SMLM需要成像专业技术和额外的张力,以避免不同的进程,包括所用的探头,样品制备和固定,图像采集和重建可能出现的图像伪影。最后,虽然基于PH结构域探针和抗体在磷酸肌醇的研究46,47被广泛使用它仍然可能不是所有的PI(4,5)P 2中的膜可以通过这种方法来检测。例如,通过其他内源蛋白质结合的PI(4,5)P2未必是PH探针或抗体访问,这可能会导致PI(4,5)P2的低估由于探头本身的空间阻碍。标记的PI(4,5)P2的另一种方法将使用最近的氟的PI(4,5)P 2 48,预标记的PI(4,5)P2的模拟与原始的尾部的变形PI(4,5)P2。然而,它可以迅速地转换成快速活细胞代谢其它磷酸肌醇亚型自肌醇环的相同endogenou小号PI(4,5)P2。这引起了关注这个预先标记的PI(4,5)P2模拟活细胞是否能够忠实地代表PI(4,5)P2,而不是它的代谢产物。因此,尽管有一些限制,基于PH结构域的探针仍然已广泛用于监测对细胞的PM的PI(4,5)P2分布和动力学的最佳探头之间。
这种方法的未来应用可以扩展到其它的磷酸肌醇的研究,如PI(3,4,5)P 3和PI(3,4)P 2。总之,这里使用的新型SMLM方法开辟了新的方法来研究磷酸肌醇在细胞中。使用PI(4,5)P2作为一个例子,我们证明PALM成像在细胞膜分子的形态和定量研究的独特性能,以及它的缺点。这种方法可适应的利益其它分子,将有在细胞生物学广泛的应用。
披露声明
The authors have nothing to disclose.
致谢
This work is supported by the National Institutes of Health (NIH) grants R01DK093953 (X.L.), P30NS069271, BRFSG-2014-07 (X.L.). C.J. is partially supported by American Heart Associate pre-doctoral fellowship (14PRE20380168, to C.J.).
材料
| Name | Company | Catalog Number | Comments |
| Microscope | Nikon | Ti-U | |
| sCMOS camera | Andor | Neo | |
| Spinning disk | Yokogawa | CSU X-1, 10,000 rpm | |
| High Power Monolithic Laser Combiner SP with 405, 488, 561 and 642 nm lasers. | Agilent | MLC400 | laser original powers & powers at the end of optical fiber) 405 nm: 15 mW & 13 mW; 488 nm: 45 mW & 42 mW; 561 nm: 45 mW & 40 mW; 640 nm: 35 mW & 16 mW. |
| 100X Objective | Nikon | APO 100X Oil, NA 1.49, WD 0.12 mm | |
| Nikon acquisition and analysis software (NIS Element) | Nikon | ||
| Matlab | MathWorks | ||
| Coverslip | Warner | 64-0714 | Round 18 mm coverslip, #1.5 |
| Fibronectin | Millipore | FC010-5MG | |
| Lipofectamin 3000 (transfection reagent) | Invitrogen | L3000-008 | |
| Glutaraldehyde | Electron Microscopy Science | #16120 | |
| PI(4,5)P2 1st antibody | Santa Cruz | sc-53412 | |
| secondary antibody F(ab’)2-goat-anti-mouse Alexa Fluor 647 | Invitrogen | A-21237 | |
| Tetraspeck beads | Invitrogen | T7279 | |
| magnetic quick release imaging chamber | Warner Instruments | Cat#641994 | |
| temperature controller | Warner Instruments | TC-344C | |
| Poly-D-Lysine | Sigma | P6407 | |
| Phosphate buffer saline | Sigma | P4417-100TAB | |
| EGTA | Sigma | 3780 | |
| NH4Cl | Sigma | A0171 | |
| Goat serum | Sigma | G9023 | |
| bovine serum albumin | Sigma | A7906 | |
| NaCl | Sigma | S5886 | |
| KCl | Sigma | P5405 | |
| CaCl2•2H2O | Sigma | 223506 | |
| MgCl2•6H2O | Sigma | M9272 | |
| Glucose | Sigma | G7021 | |
| HEPES | Sigma | H4034 | |
| Paraformaldyhyde | Sigma | P6148 |
参考文献
- Di Paolo, G., De Camilli, P. Phosphoinositides in cell regulation and membrane dynamics. Nature. 443, 651-657 (2006).
- Hammond, G. R. V., et al. PI4P And PI(4,5)P(2) Are Essential But Independent Lipid Determinants Of Membrane Identity. Science. 337, 727-730 (2012).
- Nakatsu, F., et al. PtdIns4P synthesis by PI4KIIIalpha at the plasma membrane and its impact on plasma membrane identity. J Cell Biol. 199, 1003-1016 (2012).
- Cantley, L. C. The phosphoinositide 3-kinase pathway. Science. 296, 1655-1657 (2002).
- Czech, M. P. Dynamics of phosphoinositides in membrane retrieval and insertion. Annu Rev Physiol. 65, 791-815 (2003).
- Spira, F., et al. Patchwork organization of the yeast plasma membrane into numerous coexisting domains. Nat Cell Biol. 14, 640-648 (2012).
- Barg, S., Knowles, M. K., Chen, X., Midorikawa, M., Almers, W. Syntaxin clusters assemble reversibly at sites of secretory granules in live cells. Proc Natl Acad Sci U S A. 107, 20804-20809 (2010).
- Sieber, J. J., et al. Anatomy and dynamics of a supramolecular membrane protein cluster. Science. 317, 1072-1076 (2007).
- Knowles, M. K., et al. Single secretory granules of live cells recruit syntaxin-1 and synaptosomal associated protein 25 (SNAP-25) in large copy numbers. Proc Natl Acad Sci U S A. 107, 20810-20815 (2010).
- Milosevic, I., et al. Plasmalemmal phosphatidylinositol-4,5-bisphosphate level regulates the releasable vesicle pool size in chromaffin cells. J Neurosci. 25, 2557-2565 (2005).
- van Rheenen, J., Jalink, K. Agonist-induced PIP(2) hydrolysis inhibits cortical actin dynamics: regulation at a global but not at a micrometer scale. Mol Biol Cell. 13 (2), 3257-3267 (2002).
- Hammond, G., Schiavo, G., Irvine, R. Immunocytochemical techniques reveal multiple, distinct cellular pools of PtdIns4P and PtdIns (4, 5) P2. Biochem J. 422, 23-35 (2009).
- Huang, S., et al. Phosphatidylinositol-4,5-bisphosphate-rich plasma membrane patches organize active zones of endocytosis and ruffling in cultured adipocytes. Mol Cell Biol. 24, 9102-9123 (2004).
- James, D. J., Khodthong, C., Kowalchyk, J. A., Martin, T. F. Phosphatidylinositol 4,5-bisphosphate regulates SNARE-dependent membrane fusion. J Cell Biol. 182, 355-366 (2008).
- Laux, T., et al. GAP43, MARCKS, CAP23 modulate PI(4,5)P(2) at plasmalemmal rafts, and regulate cell cortex actin dynamics through a common mechanism. J Cell Biol. 149, 1455-1472 (2000).
- Aoyagi, K., et al. The activation of exocytotic sites by the formation of phosphatidylinositol 4,5-bisphosphate microdomains at syntaxin clusters. J Biol Chem. 280, 17346-17352 (2005).
- Kabachinski, G., Yamaga, M., Kielar-Grevstad, D. M., Bruinsma, S., Martin, T. F. CAPS and Munc13 utilize distinct PIP2-linked mechanisms to promote vesicle exocytosis. Mol Biol Cell. 25, 508-521 (2014).
- Wang, J., Richards, D. A. Segregation of PIP2 and PIP3 into distinct nanoscale regions within the plasma membrane. Biol Open. 1, 857-862 (2012).
- Hell, S. W., Wichmann, J. Breaking the diffraction resolution limit by stimulated emission: stimulated-emission-depletion fluorescence microscopy. Opt Lett. 19, 780-782 (1994).
- van den Bogaart, G., et al. Membrane protein sequestering by ionic protein-lipid interactions. Nature. 479, 552-555 (2011).
- van Rheenen, J., Achame, E. M., Janssen, H., Calafat, J., Jalink, K. PIP2 signaling in lipid domains: a critical re-evaluation. Embo J. 24, 1664-1673 (2005).
- Sato, K., et al. Differential requirements for clathrin in receptor-mediated endocytosis and maintenance of synaptic vesicle pools. Proc Natl Acad Sci U S A. 106, 1139-1144 (2009).
- Ji, C., Zhang, Y., Xu, P., Xu, T., Lou, X. Nanoscale Landscape of Phosphoinositides Revealed by Specific Pleckstrin Homology (PH) Domains Using Single-molecule Superresolution Imaging in the Plasma Membrane. J of Biol Chem. 290, 26978-26993 (2015).
- Betzig, E., et al. Imaging intracellular fluorescent proteins at nanometer resolution. Science. 313, 1642-1645 (2006).
- Hess, S. T., Girirajan, T. P., Mason, M. D. Ultra-high resolution imaging by fluorescence photoactivation localization microscopy. Biophys J. 91, 4258-4272 (2006).
- Rust, M. J., Bates, M., Zhuang, X. Sub-diffraction-limit imaging by stochastic optical reconstruction microscopy (STORM). Nat Methods. 3, 793-795 (2006).
- Xu, K., Zhong, G., Zhuang, X. Actin, spectrin, and associated proteins form a periodic cytoskeletal structure in axons. Science. 339, 452-456 (2013).
- Wombacher, R., et al. Live-cell super-resolution imaging with trimethoprim conjugates. Nat Methods. 7, 717-719 (2010).
- Szymborska, A., et al. Nuclear pore scaffold structure analyzed by super-resolution microscopy and particle averaging. Science. 341, 655-658 (2013).
- Pertsinidis, A., et al. Ultrahigh-resolution imaging reveals formation of neuronal SNARE/Munc18 complexes in situ. Proc Natl Acad Sci U S A. 110, 2812-2820 (2013).
- Shim, S. -. H., et al. Super-resolution fluorescence imaging of organelles in live cells with photoswitchable membrane probes. Proc Natl Acad Sci. 109, 13978-13983 (2012).
- Huang, F., et al. Video-rate nanoscopy using sCMOS camera-specific single-molecule localization algorithms. Nat Methods. 10, 653-658 (2013).
- Balla, T., Várnai, P. Visualization of Cellular Phosphoinositide Pools with GFP-Fused Protein-Domains. Curr Protoc Cell Biol. 24, 24 (2009).
- Xu, C., Watras, J., Loew, L. M. Kinetic analysis of receptor-activated phosphoinositide turnover. J Cell Biol. 161, 779-791 (2003).
- Subach, F. V., et al. Photoactivatable mCherry for high-resolution two-color fluorescence microscopy. Nat Methods. 6, 153-159 (2009).
- Filonov, G. S., et al. Bright and stable near infra-red fluorescent protein for in vivo imaging. Nature Biotechnol. 29, 757-761 (2011).
- Zhang, M., et al. Rational design of true monomeric and bright photoactivatable fluorescent proteins. Nat Methods. 9, 727-729 (2012).
- Hohmeier, H. E., et al. Isolation of INS-1-derived cell lines with robust ATP-sensitive K+ channel-dependent and -independent glucose-stimulated insulin secretion. Diabetes. 49, 424-430 (2000).
- Dyachok, O., Isakov, Y., Sågetorp, J., Tengholm, A. Oscillations of cyclic AMP in hormone-stimulated insulin-secreting β-cells. Nature. 439, 349-352 (2006).
- Nan, X., et al. Single-molecule superresolution imaging allows quantitative analysis of RAF multimer formation and signaling. Proc Natl Acad Sci U S A. 110, 18519-18524 (2013).
- Sengupta, P., et al. Probing protein heterogeneity in the plasma membrane using PALM and pair correlation analysis. Nat Methods. 8, 969-975 (2011).
- Morone, N., et al. Three-dimensional reconstruction of the membrane skeleton at the plasma membrane interface by electron tomography. J Cell Biol. 174, 851-862 (2006).
- Peters, K. R., Carley, W. W., Palade, G. E. Endothelial plasmalemmal vesicles have a characteristic striped bipolar surface structure. J Cell Biol. 101, 2233-2238 (1985).
- Fujita, A., Cheng, J., Tauchi-Sato, K., Takenawa, T., Fujimoto, T. A distinct pool of phosphatidylinositol 4,5-bisphosphate in caveolae revealed by a nanoscale labeling technique. Proc Natl Acad Sci U S A. 106, 9256-9261 (2009).
- Durisic, N., Laparra-Cuervo, L., Sandoval-Álvarez, &. #. 1. 9. 3. ;., Borbely, J. S., Lakadamyali, M. Single-molecule evaluation of fluorescent protein photoactivation efficiency using an in vivo nanotemplate. Nat Methods. 11, 156-162 (2014).
- Thomas, C. L., Steel, J., Prestwich, G. D., Schiavo, G. Generation of phosphatidylinositol-specific antibodies and their characterization. Biochem Soc Trans. 27, 648-652 (1999).
- Várnai, P., Balla, T. Live cell imaging of phosphoinositides with expressed inositide binding protein domains. Methods. 46, 167-176 (2008).
- Honigmann, A., et al. Phosphatidylinositol 4,5-bisphosphate clusters act as molecular beacons for vesicle recruitment. Nature Struct Mol Biol. 20, 679-686 (2013).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。