Method Article
Single-molécula de super-resolución de imagen de fosfatidilinositol 4,5-bisfosfato en la membrana plasmática con la novela fluorescentes Sondas
En este artículo
Resumen
PI (4,5) P 2 regula diversas funciones celulares, pero su organización nanoescala en la membrana plasmática de la célula es poco conocido. Por PI etiquetado (4,5) P 2 con una sonda fluorescente de dos colores fusionado con el dominio de homología Pleckstrin, se describe un nuevo enfoque para estudiar la PI (4,5) P 2 distribución espacial en la membrana plasmática en la escala nanométrica .
Resumen
Phosphoinositides in the cell membrane are signaling lipids with multiple cellular functions. Phosphatidylinositol 4,5-bisphosphate (PI(4,5)P2) is a determinant phosphoinositide of the plasma membrane (PM), and it is required to modulate ion channels, actin dynamics, exocytosis, endocytosis, intracellular signaling, and many other cellular processes. However, the spatial organization of PI(4,5)P2 in the PM is controversial, and its nanoscale distribution is poorly understood due to the technical limitations of research approaches. Here by utilizing single molecule localization microscopy and the Pleckstrin Homology (PH) domain based dual color fluorescent probes, we describe a novel method to visualize the nanoscale distribution of PI(4,5)P2 in the PM in fixed membrane sheets as well as live cells.
Introducción
Fosfoinosítidos contribuyen a una pequeña porción del total de lípidos de membrana, pero juegan un papel crítico en una variedad de procesos celulares. Se incluyen siete miembros derivadas de la fosforilación reversible o desfosforilación de los anillos de inositol en el 3 °, 4 ° y 5 posiciones de TH1. Fosfatidilinositol 4-fosfato (PI4P) y fosfatidilinositol 4,5-bifosfato (PI (4,5) P2) son dos de los principales fosfoinosítidos que funcionan de forma relativamente independiente como los determinantes de los lípidos de la membrana plasmática celular (PM) 2,3. Fosfatidilinositol (3,4,5) -trisphosphate (PIP 3) es mucho menos abundante que PI4P y PI (4,5) P 2, pero tiene funciones únicas en diferentes procesos celulares, incluyendo el cáncer y la diabetes 4 5. Estos lípidos tienen interacciones moleculares complejas con sus efectores y muchas otras proteínas. Por lo tanto, es crucial para entender la organización espacial de estos phosphoinositides en la PM en la escala nanométrica.
La creciente evidencia ha demostrado que los complejos de proteínas o grupos de moléculas en las áreas confinadas PM pueden servir como puntos de acceso 6 de señalización. Por ejemplo, sintaxina 1a, una proteína clave que regula la fusión de membranas 7-9, muestra las agrupaciones en el PM. A diferencia de la visión de consenso de la organización grupo de sintaxina 1A, la distribución espacial de fosfoinosítidos en el PM es controvertido. Patrones de PI (4,5) P2 distribución uniforme van desde 10-12, grandes manchas 13,14, a densos racimos de 14-18, dependiendo de los tipos de células y métodos experimentales utilizados. La organización espacial de PI (4,5) P2 en una resolución más alta es también incompatible. Un estudio usando estimulada por emisión de agotamiento (STED) microscopía 19 ha revelado un gran número de densa PI (4,5) P 2 nano-clusters (~ 73 nm de diámetro) en las hojas de PM de PC 12 células 20 . Este resultado es diferente de los estudios que utilizaron microscopía electrónica de congelación rápida (EM) 21,22, un enfoque que conserva intacta la estructura PM de células vivas mucho mejor que la fijación química. Este último mostró distintas piscinas de PI (4,5) P2; PI relativamente concentrada (4,5) P 2 en caveolas y recubiertos pozos, así como una distribución uniforme en la región plana PM. Por otra parte, PI nanoescala (4,5) P 2 organización en láminas de membrana puede ser diferente en células vivas y fijadas. Nuestro trabajo reciente investigó este tema en las células INS-1, tanto fijos y en directo mediante una sola molécula de microscopía de localización (SMLM) 23.
SMLM se basa en estocásticamente de encender solamente un pequeño subconjunto de fluoróforos en un momento dado de manera que los fluoróforos individuales se pueden localizar con gran precisión. Muchos enfoques de imagen super-resolución se han desarrollado utilizando principios similares a superar el límite de difracción de microscopía de luz convencional, como unas fotoactivación microscopía de localización (PALM) 24, la microscopía de fluorescencia fotoactivación localización (FPALM) 25, estocástico microscopía óptica de reconstrucción (Storm) 26,27 y la tormenta directa (dSTORM) 28. Con la foto-conmutable o fluoróforos (colorantes fotoactivables o proteínas fluorescentes), técnicas SMLM permiten a los científicos a las estructuras biológicas de las imágenes a resolución nanométrica 24,29,30 con vídeo de velocidad en las células vivas 31,32.
El uso de PI (4,5) P2 como un ejemplo, hemos introducido el enfoque SMLM para estudiar la distribución de nanoescala fosfoinosítidos en la PM. El dominio PH de PLCδ1 (fosfolipasa C δ1) que se une específicamente a PI (4,5) P 2 es una sonda bien establecido para la formación de imágenes PI distribución y la dinámica sub-celular (4,5) P 2 33,34 en el PM . Hemos marcado genéticamente este dominio con dos proteínas fluorescentes, PAmCherry1 35 y 36 IRFP para producir una proteína de fusión de dos colores (IRFP-PAmCherry1-PH PLCδ1) (Figura 1A-B). PAmCherry1 sirve como la sonda fotoactivable del dominio PH de palma y IRFP sirve como un indicador general para identificar las células transfectadas antes de la adquisición PALM . Aplicamos esta sonda fluorescente de dos colores para imágenes SMLM en las láminas de membrana fijas. Para imágenes PALM vivo, marcamos mEOS3 37 en lugar de PAmCherry1 al dominio PH PLCδ1 para generar la sonda PLCδ1 mEOS3.1-PH para su mejor eficiencia de fotones y el brillo (Figura 1C-D).
Formación de imágenes SMLM con estas nuevas sondas en el PM de INS-1 células secretoras de insulina 38 ha descubierto etiquetado homogénea de PI (4,5) P 2 en la mayoría de las regiones de PM así como PI concentrado (4,5) P 2 microdominios que están entremezclados con baja densidad en el plano de la tarde y algunas estructuras de tipo filopodios 23. Entonces unnoScale distribución de PI (4,5) P2 proporciona una base estructural para repensar cómo funciona en las células vivas.
Protocolo
1. Hoja de Preparación de membrana y fijación
- Preparar hojas de membrana marcadas con IRFP-PAmCherry1-PH PLC δ1
- Prepare el ADN plásmido que codifica IRFP-PAmCherry1-PH PLC δ1 23 usando técnicas de biología molecular convencionales.
- Las células en 1,5 Cultura # 1 INS-18 mm cubreobjetos redondos pre-recubierto con 30 mg / ml de fibronectina a 50-70% de confluencia siguiente INS-1 protocolos estándar de cultivo celular 38,39. Transfectar las células un día después de que se alcanza de 50 a 70% de confluencia.
- Transfectar células con IRFP-PAmCherry1-PH PLC δ1 usando el reactivo de transfección de liposomas siguiendo los protocolos del fabricante. Después de la transfección, permiten que las células crezcan durante 48 horas.
- En el día del experimento, los cubreobjetos de la capa (en un lado) con ~ 0,5 a 1 ml de 500 mg / ml de poli-D-lisina (PDL; diluyeron en dH 2 O) durante 1-2 horas. A continuación, escurrir PDL colocando un pañuelo de papel enel borde del cubreobjetos. Coloque el cubreobjetos en un (C 4 °) placa de metal enfriado previamente para su uso posterior.
- Lavar las células INS-1 pre-transfectadas que crecen en cubreobjetos con 0,5 ~ - solución salina tamponada con fosfato 1 ml de hielo frío (PBS) que contiene EGTA 1 mM. Repita el lavado tres veces y drenar PBS.
- Coloque los cubreobjetos con células cultivadas (células del lado mirando hacia abajo) sobre los cubreobjetos revestidos con PDL en una placa de metal pre-refrigerada con un par de pinzas. Deja la placa en un refrigerador (4 ° C) durante 7 - 10 minutos para permitir que las células se unan a los cubreobjetos recubiertos-PDL (Figura 2).
NOTA: El tiempo de incubación debería estar en el intervalo de 7-10 min para una mejor unión de las células a la superficie recubierta-PDL. El entorno refrigerador es seco y la incubación no debe ser demasiado largo. - Retire la placa metálica de la nevera. Despegue suavemente el portaobjetos que contiene las células pre-transfectadas utilizando pinzas. Esto produce una capa fina de lámina de membrana celular en elcubreobjetos PDL-revestido. Lave suavemente las hojas de membrana con ~ 0.5 - 1 ml de hielo frío PBS y luego fijar con ~ 0.5 - 1 ml de hielo-fría% de paraformaldehído al 4 (PFA) + 0,2% de glutaraldehído (GA) en PBS durante 15 min a 4 ° C.
Precaución: El paraformaldehído y glutaraldehído son tóxicos. Manejarlos en una campana extractora con la piel y los ojos. - Después de la fijación, la imagen de las hojas de membrana inmediatamente (ver sección 3) o almacenar en ~ 0.5 - 1 ml de PBS a 4 ° C.
Nota: después de la fijación de la lámina de membrana, no habrá unión de las sondas de pH del citosol a la PI (4,5) P 2 equilibrio. Las sondas de pH unidas se disocian gradualmente a partir de la hoja de la membrana y se difunden en la solución (aunque podría tomar días o semanas). Por lo tanto, se recomienda a la imagen las muestras fijadas justo después de la preparación de muestras.
- Preparar láminas de membrana para PI (4,5) P etiquetado anticuerpo específico 2
- Cultura INS-1 en las células de # 1.5, 18 mm cubreobjetos redondos pre-recubiertas con 30 &# 181; g / ml de fibronectina al 50% -70% de confluencia. transfectar células con ADN de plásmido al día siguiente, como se describe en el paso 1.1.3.
- Repetir los pasos desde 1.1.4 a 1.1.7 como se describe anteriormente.
NOTA: Realice los siguientes procedimientos a 4 ° C. - Lavar los cubreobjetos que contienen hojas fijas PM tres veces con ~ 0.5 - 1 ml de PBS enfriado con hielo que contiene 50 mM NH4Cl. Saciar las hojas con 0,5 ~ - borohidruro de sodio 1 ml de 0,1% en PBS durante 7 minutos, y lavar con ~ 0,5 - 1 ml de PBS (sin 50 mM NH 4 Cl).
- Bloquear las muestras con ~ 0,5 - 1 ml de solución de bloqueo (solución de PBS que contiene 5% (v / v) suero normal de cabra, 5% (v / v) de albúmina de suero bovino y 50 mM NH 4 Cl) durante 45 min. A continuación, se incuba con ~ 0,5 - 1 ml PI primaria (4,5) P 2 anticuerpo (dilución 1: 300) en solución de bloqueo durante 1 hr. Lavar tres veces (10 min cada vez) con ~ 0,5 - 1 ml de PBS que contenía 50 mM NH4Cl.
- Incubar las muestras con ~ 0,5 - 1 ml secundario F (ab ') 2 de cabra-anti-ratónanticuerpo conjugado con fluoróforos (1: 300) en tampón de bloqueo durante 1 hr. Lavar tres veces con ~ 0.5 - 1 ml de PBS.
- muestras post-fix con 4% PFA + 0,2% GA durante 15 min, a continuación, lavar las muestras tres veces con PBS (7 min cada vez). Proceda a la Sección 3 para obtener imágenes o almacenar en ~ 0,5 ~ 1 ml de PBS a 4 ° C para su uso posterior.
NOTA: Preparar las muestras a 4 ° C. Utilice PFA al 4% + 0,2% GA fijador para preservar la distribución fisiológica de fosfoinosítidos en la PM. Preparación RT o fijación con 4% PFA solo pueden causar artefactos significativos (Figura 4).
2. Cultivo de células Preparación de Células vivas imágenes con mEOS3.1-PH PLC δ1
- Preparar el plásmido de ADN que codifica la δ1 mEOS3.1-PH PLC como se describió anteriormente 23.
- Cultura INS-1 en las células de # 1.5 18 mm cubreobjetos ronda pre-recubierto con 30 mg / ml de fibronectina hasta que alcanzan el 50% y el 70% confluency siguiente estándar INS-1 protocolos de cultivo celular 38,39.
- El día siguiente, transfectar células INS-1 con el mEOS3.1-PH PLC δ1 plásmido de ADN usando el reactivo de transfección de liposomas siguiendo el protocolo del fabricante. Incubar durante 48 horas antes de exponer.
3. PALM Adquisición de imágenes de láminas de membrana y las células vivas
- PALM adquisición de imágenes de hojas de membrana
NOTA: Aquí, un sistema SMLM fluorescencia de reflexión total interna (TIRF) microscopio base (aceite de 100X, APO, NA = 1,49, WD 0,12 mm) 23 se utiliza para toda la adquisición de imagen.- Antes de imágenes, diluir 1 l de solución de bolas fluorescentes en 10 ml de PBS + 50 mM MgCl 2. Añadir 200 l solución diluida en las muestras de células cámara de imágenes que contienen (de pasos 1.1.8 / 1.2.6) para 10 min. A continuación, lavar con PBS tres veces.
- Iniciar el sistema de imágenes de palma. En el software de imagen asociado, seleccione el "canal IRFP y# 34; botón (642 nm de excitación láser, 700/75 nm de emisión). Encuentra la membrana celular que expresa las sondas de pH en el canal IRFP.
NOTA: La lámina de membrana debe tener una perla fluorescente cerca. Esto es necesario para la corrección de la deriva después. - Utilice el botón "Capture" para recoger una imagen TIRF convencional de la membrana celular en el canal IRFP como referencia para la futura reconstrucción de la imagen. Establecer un ángulo TIRF normal (es decir, después de alcanzar el ángulo crítico, a su vez otros 1,5 grados) escribiendo en 2140 en el ajuste de ángulo de imagen TIRF. Utilice esta configuración para todos los pasos salvo indicación en contrario ángulo.
NOTA: En el sistema TIRF se describe aquí, 3.500 es el ángulo vertical hacia arriba, 2.200 es el ángulo crítico TIRF, y 2140 es el ángulo TIRF normal, que es de 1,5 grados más después de TIRF ángulo crítico. El ángulo TIRF estrecho se menciona a continuación en 3.2.3 es 2,120, que es otro grado 2 después de alcanzar ángulo crítico TIRF. - Cambiar al canal PAmCherry1 haciendo clic THe Botón de canal RFP (561 nm de excitación, 600/50 filtro de emisión nm). Ajuste la barra de desplazamiento en la almohadilla "AOTF" todo el camino hacia la derecha para tener iluminación potencia de láser de 561 nm durante 10-20 segundos para blanquear la fluorescencia de fondo de la membrana.
- Ponga el ajuste óptimo de la cámara (binning 2x2) en la pestaña "Formato" y el protocolo de adquisición rápida en la pestaña "ND adquisición de secuencia" (típicamente 10.000-40.000 imágenes a 20 Hz).
- Iniciar la adquisición de imágenes PAmCherry1 (561 nm láser a plena potencia, 50 ms / frame) con la activación simultánea de láser de 405 nm en un nivel bajo (0,1% - 1%) haciendo clic en el botón "Ejecutar ahora". Ajustar la intensidad de 405 nm láser de modo que los puntos individuales espacialmente aisladas de cada cuadro son fácilmente identificables.
NOTA: El número de moléculas PAmCherry1 activables disminuye gradualmente durante la adquisición. 405 nm intensidad del láser debe aumentarse gradualmente para mantener la densidad óptima de las señales de moléculas individuales en cadamarco. - Continuar la adquisición de imágenes hasta que se active ninguna señal PAmCherry1 sola molécula.
- PALM imágenes de células vivas
- Antes de imágenes, diluir perlas fluorescentes en la cámara de imagen durante 10 minutos como se describe en el paso 3.1.1. A continuación, iniciar la imagen PALM abriendo el software de imagen asociada.
NOTA: Utilice una cámara de imágenes de liberación rápida magnética para obtener imágenes de células vivas. Mantener el centro del campo de la imagen a 35 ° C con un controlador de temperatura bajo perfusión constante con tampón extracelular (extracelular Solución: NaCl 135 mM, KCl 5,6 mM, 2,6 mM CaCl 2, 1,2 mM MgCl 2, glucosa 3 mM y 20 mM HEPES; pH = 7,3). - Elija el botón de canal GFP (525/50 nm de emisión). Identificar la membrana celular que expresa sondas fluorescentes basado en fluorescente verde de mEOS3 bajo excitación láser 488 nm. Asegúrese de que las perlas fluorescentes En las cercanías también se incluyen durante la exploración, ya que se requiere más adelante para fuera de línea dricorrección de pies.
- Haga clic en el botón de "captura" para recoger una imagen TIRF de la membrana celular en mEOS3 canal (verde) como imagen de referencia. Use un evanescente iluminación de excitación de onda superficial (después de alcanzar el ángulo crítico, a su vez otros 2 grados) escribiendo en 2120 en el ajuste de imágenes de células vivas ángulo TIRF.
NOTA: Esto minimiza la fluorescencia de la no unida mEos3-PH en el adyacente citosol a la membrana plasmática. - Cambiar al "canal de RFP" botón (561 nm de excitación, emisión de 600/50 nm). Usa el poder de láser 561 nm completa para blanquear la fluorescencia de fondo de las hojas de membrana de 10 ~ 20 segundos con la barra de desplazamiento en el "cojín AOTF" (ver 3.1.4).
- Iniciar la adquisición de la imagen haciendo clic en el botón "Ejecutar ahora" en el canal rojo (561 nm plena potencia, fijado en 10 ms / marco de la "cámara" ajuste de pestaña) con la activación simultánea de láser de 405 nm. Ajustar la intensidad del láser de 405 nm para activar puntos separados espacialmenteen cada trama.
NOTA: A medida que avanza la adquisición, ONU-convertido-PH mEOS3.1 PLC δ1 número molécula disminuye lentamente. Poco a poco aumentar la potencia del láser de 405 nm a optimizar la señal de una sola molécula. La longitud de adquisición de imágenes depende de la finalidad experimental. Adquirir imágenes de forma continua durante 5 min en condiciones normales. Si se requiere una adquisición más largo, recoger múltiples pilas de imágenes en lugar de un único gran pila, imagen. El tamaño de archivo de cada imagen pila no debe superar los 4 GB o afectará el análisis posterior del software.
- Antes de imágenes, diluir perlas fluorescentes en la cámara de imagen durante 10 minutos como se describe en el paso 3.1.1. A continuación, iniciar la imagen PALM abriendo el software de imagen asociada.
4. SMLM Procesamiento de Imágenes y Reconstrucción
- La transferencia de los archivos de imagen (.tif pilas) a una estación de análisis de imágenes. El lanzamiento del programa de reconstrucción de imágenes (a medida escrito) en Matlab como se ha descrito previamente 37 y cargar la pila de imágenes haciendo clic en la pestaña "Archivo" en el menú principal, luego "abrir", luego "archivo nuevo".
- Identificar y locaLIZE eventos moleculares individuales de cada cuadro. Establecer el filtrado de umbral de intensidad con un número de umbral (1-10) en la "onda". Compruebe los ajustes de los parámetros óptimos para la detección del punto visual antes de la reconstrucción. A continuación, vaya a la pestaña "PALM" y haga clic en "un proceso paso" para comenzar la reconstrucción de imágenes.
NOTA: La intensidad umbral para la detección de punto es arbitraria y depende de la experiencia personal. Varios ensayos pueden ser necesarios para generar un umbral de detección óptima que ni recoge demasiados no cualificado (DIM) puntos ni filtra los demasiados puntos calificados (brillantes). Ajustar otros parámetros para optimizar el análisis de datos. En este caso, la distancia vecindario (puntos de fluorescencia en los marcos de vecinos dentro de una distancia son combinados) se establece como 65 nm (1/2 ancho de píxel) e instalado de forma una sola molécula. marcos Gap (eventos de moléculas individuales que se produjeron dentro de estos marcos y barrio distancia se combinaron y se monta como un evento único molécula) esestablecer como 26 marcos (1,3 seg) para imágenes PAmCherry1 40. Ajuste estos parámetros de acuerdo con las propiedades de las sondas de una sola molécula y la tasa de adquisición para evitar la sobre-contando 40 en SMLM. Aplicar corrección de la deriva con perlas fluorescentes durante las reconstrucciones.- Para obtener imágenes de las láminas de membrana fijas marcadas por IRFP-PAmCherry1-PH PLC δ1, reconstruir el conjunto de pilas de imágenes a partir de la misma lámina de membrana de una sola imagen de super-resolución en 37.
- Para las muestras de células vivas marcadas por mEOS3.1-PH PLC δ1, separar toda la pila de imágenes en varios lotes más pequeños de 1.000 fotogramas de forma que la pila de 1,000 consecutiva marco se reconstruye una sola imagen de super-resolución, que tiene una resolución temporal de tan 10 seg. Al final, se combinan todas las imágenes de la serie de tiempo en la pila de series de tiempo final de 23.
NOTA: En las imágenes en vivo de células PALM, un pequeño número de sondas activadas puede mover o disociarsede PI (4,5) P2 en la tarde antes del blanqueo. Para tener en cuenta el sobremuestreo de las sondas, combinar señales de moléculas individuales en las tramas de vecinos dentro de 130 nm (en lugar de 65 nm) en un suceso de emisión única durante el análisis de la imagen.
- Después de la obtención de las imágenes reconstruidas, llevar a cabo un análisis más detallado de imagen con el programa personalizado escrito en Matlab para cuantificar la densidad de la molécula, la densidad de micro-dominio tamaño, y análisis / cluster con par-41 de correlación.
Resultados
La incertidumbre de localización (σ) de nuestro sistema de super-resolución es de 14,73 nm 23. Las comparaciones directas entre TIRF y las imágenes PALM demostraron una mejora significativa de la resolución espacial. Figura 3A-B muestra la PI representante (4,5) P 2 imágenes TIRF marcadas con PI (4,5) P2-anticuerpo y IRFP PAmCherry1 PH-PLC δ1 en láminas de membrana típicos y células vivas. Las imágenes con microscopía TIRF convencional en láminas de membrana son notablemente similares a los de las células vivas intactas marcadas con la proteína de fluorescencia verde potenciada (EGFP) etiquetada dominios PH (EGFP-PH PLCδ1) (Figura 3C). Todas las muestras mostraron una distribución uniforme de sondas. En contraste, la fijación no óptima de las muestras resultó en PI densa agudo (4,5) P 2 clusters y una disminución en la intensidad de la señal (Figura 4). En condiciones óptimas de fijación, tél imágenes super-resolución de PI (4,5) P 2 en células fijadas (Figura 5) reveló una distribución homogénea de sondas en una porción significativa de la PM, con sólo gradientes de concentración limitados. Algunos parches de membrana enriquecidos con PI (4,5) P2 sondas fueron escasamente distribuida y tenía varios tamaños. Células vivas imágenes PALM muestran una distribución espacial similar a las células fijas (Figura 6). El análisis detallado de PI (4,5) P 2 señales en el tiempo resulta en la dinámica rápida en áreas locales, sin cambios significativos de su abundancia en áreas amplias.
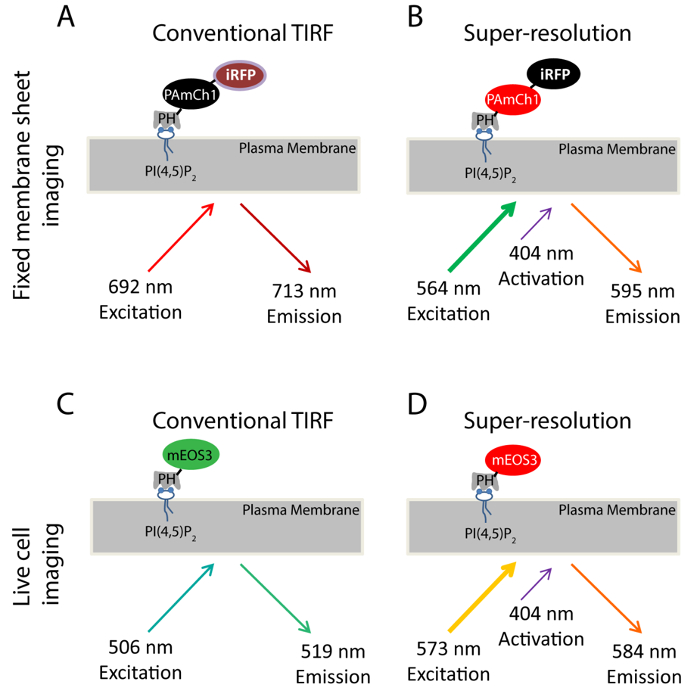
Figura 1. Esquema para sondas fluorescentes utilizadas en este estudio. Sonda (AB) IRFP-PAmCherry1-PH PLC δ1 utilizado en los experimentos lámina de membrana fija. Durante una imagen TIRF convencional (A), un 640 nm láser se utiliza para excitar el IRFP (Ex: 692 nm; Em: 713 nm). Imagen TIRF tomada en esta condición sirve una imagen de referencia para la formación de imágenes TIRF super-resolución obtenida mediante formación de imágenes PALM (B) como. Un láser de 405 nm se utiliza para la foto-activar el fluoróforo PAmCherry1 y un láser de 561 nm se utiliza para excitar PAmCherry1 (Ex: 564 nm; Em: 595 nm) para obtener imágenes de palma. (CD) de la sonda PLCδ1 mEos3.1-PH utilizada en los experimentos de células vivas. (C) Durante una imagen TIRF convencional, un láser de 488 nm se utiliza para excitar mEOS3.1 (Ex: 506 nm; Em: 519 nm). (D) Después de fotoconversión por un láser de 405 nm, mEos3.1 se convierte en la forma roja (Ex: 573 nm; Em: 584 nm). Y un láser de 561 nm se utiliza para adquisiciones PALM Haga clic aquí para ver una versión más grande de esta figura.
s / ftp_upload / 54466 / 54466fig2.jpg "/>
Figura 2. Esquema para la preparación de lámina de membrana de las células INS-1. (A) Coloque el cubreobjetos con células cultivadas se enfrenta hacia abajo sobre un cubreobjetos recubierto con PDL y esperar a 7 ~ 10 min a 4 ° C para permitir la fijación de células a la PDL- cubreobjetos recubierto. (B) Despegar la parte superior cubreobjetos con unas pinzas y fijar la lámina de membrana unida al cubreobjetos pre-recubierto PDL. (C) Imagen de las muestras con TIRFM y la palma. Haga clic aquí para ver una versión más grande de esta figura.
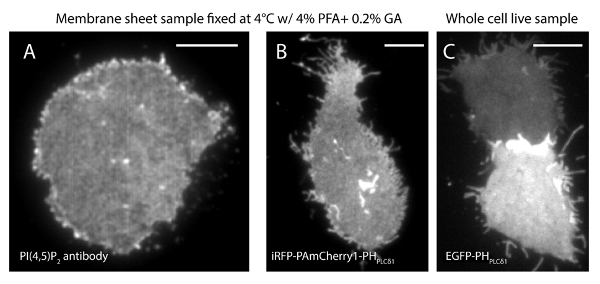
Figura 3. PI (4,5) P 2 organización espacial es similar entre las hojas de membrana y células vivas intactas bajo el microscopio TIRF convencional. (A) Aimagen TIRF típica de hojas de membrana fija en 4 ° C con 4% PFA y 0,2% GA. PI (4,5) P 2 se marcó con PI (4,5) P 2 de anticuerpos específicos. (B) Una lámina de membrana de la célula INS-1 que expresa IRFP-PAmCherry1-PH PLC δ1. Imagen (C) TIRF de dos células vivas intactas que expresan EGFP-PH PLCδ1 a diferentes niveles. Las barras de escala: (A): 3 m; (B) y (C):. 5 micras Haga clic aquí para ver una versión más grande de esta figura.
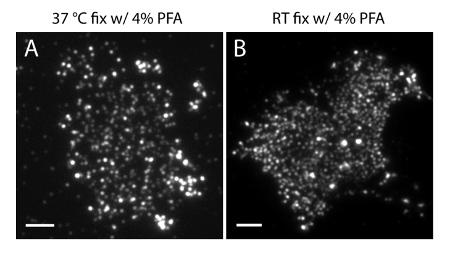
Figura 4. PI (4,5) P 2 organización espacial en láminas de membrana es sensible a las condiciones de fijación comunes. (A) láminas de membrana fija en 37 ° C con 4% PFA soloy se marcaron con PI (4,5) P 2 de anticuerpos específicos (como en la Figura 3A). Hoja (B) de membrana fija a TA con PFA solo y marcado con PI (4,5) P 2 de anticuerpos específicos. Tenga en cuenta que los densos racimos de PI (4,5) P 2 sondas son claramente visibles bajo el microscopio TIRF, a diferencia de las imágenes incluso mucho más de fluorescencia mostrados en la Figura 3A. Las barras de escala: AB:. 3 micras Haga clic aquí para ver una versión más grande de esta figura.
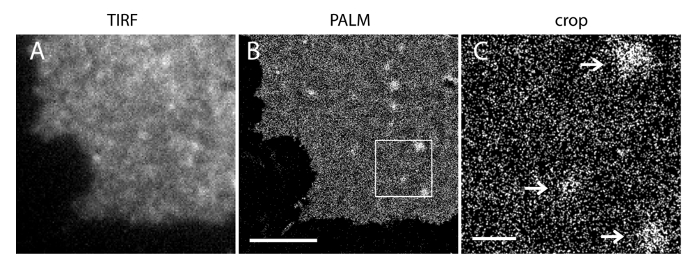
Figura 5. PALM imágenes de PI (4,5) P 2 sondas revela su distribución a escala nanométrica en un PM INS-1 células. (A) Imagen IRFP TIRF de una hoja de membrana de una célula INS-1 que expresan las IRFP-PAmCherry1-PH SOCIEDAD ANÓNIMAδ1. (B) Imagen palma de PM correspondiente en la misma región basado en la reconstrucción de la señal PAmCherry1. Tenga en cuenta la PI homogénea (4,5) P2 distribución espacial en las principales regiones de la tarde y varios PI (4,5) P2 microdominios. (C) una vista ampliada de la región en caja en (B). Las flechas indican la escasamente distribuidas microdominios PM enriquecidos con PI (4,5) P 2 sondas. Las barras de escala: A y B: 3 m; C: 500 nm. Haga clic aquí para ver una versión más grande de esta figura.
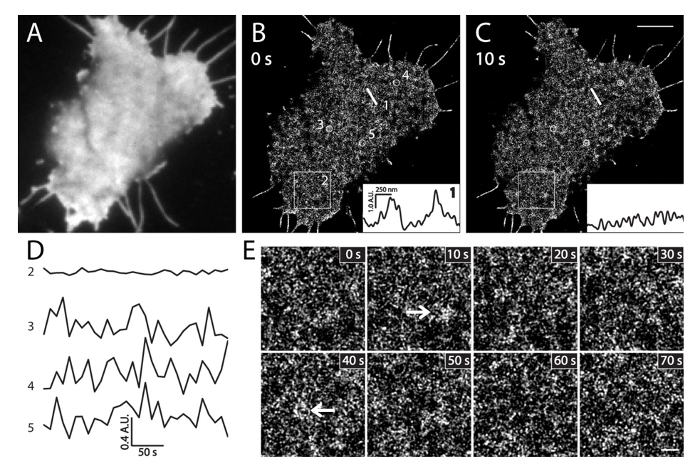
Figura 6. PALM imágenes in vivo células INS-1. (A) Imagen TIRF de PI (4,5) P2 en un vivo de células INS-1 que expresan las mEos3.1 PH-PLCδ1. La imagen fue adquirida rápidamente en el canal verde antes de la adquisición de palma (35 ° C). (B) células vivas imágenes secuenciales de la palma en el intervalo de 10 seg. El recuadro muestra los perfiles de intensidad de la densidad local de IP (4,5) P 2 a lo largo de la misma posición de la línea recta 1 en diferentes momentos en (B) y (C). Tenga en cuenta sus grandes cambios de intensidad locales dentro de 10 seg. (D) Evolución temporal de las tasas medias de variación de intensidad de PI (4,5) P2 en el área grande (caja2, 3x3 m) y los círculos pequeños (3, 4, y 5, 500 nm de diámetro) en (B) durante 5 min de imágenes PALM (marco / 10 seg). Tenga en cuenta las fluctuaciones de intensidad rápidos de PI local (4,5) P 2 sondas (círculo de 3, 4 y 5) en comparación con cambios muy pequeños en el área amplia (cuadro 2). Imágenes (E) ampliada palma de la región caja2 en (B) en los tiempos indicados. Las flechas indican PI (4,5) P 2 parches de membrana enriquecidos en virtud physiological condiciones. Las barras de escala: C: 3 m; E: 500 nm. Haga clic aquí para ver una versión más grande de esta figura.
Discusión
Para solucionar problemas, dos procesos necesitan más atención: la producción de láminas de membrana y la fijación de la muestra. Como se describe en el protocolo, el tiempo de incubación de los cubreobjetos en el paso 1.1.6 es importante para la producción de lámina de membrana. Tiempo de incubación óptimo en nuestra condición experimental es de 7-10 minutos (Figura 2). Más de 10 minutos de incubación va a producir células intactas en lugar de las láminas de membrana en cubreobjetos PDL y de incubación más corto dará lugar a ninguna láminas de membrana sobre los cubreobjetos recubiertos-PDL o menos. Como se describe en el protocolo, los fijadores y la temperatura durante la fijación son críticos para el mantenimiento de la PI (4,5) P2 distribución en el PM. La fijación a temperatura ambiente o el uso de un 4% -PFA por sí sola podría distorsionar la distribución normal de los lípidos en el PM.
Mediante la aplicación de la microscopía PALM a la membrana lipídica de investigación, somos capaces de observar la distribución a escala nanométrica de PI (4,5) P2, una fosfoinositida clave que media mlas actividades celulares fundamentales. Esta distribución espacial de PI (4,5) P2 con gradientes de concentración limitadas en las células INS-1 proporciona un marco para repensar las interacciones lípido-proteína de señalización y eventos locales de PI (4,5) P2 en estas células. Por otra parte, los métodos desarrollados en este trabajo también se pueden aplicar a otras investigaciones de fosfolípidos de membrana con sondas adecuadas, por lo tanto, ofrece nuevas herramientas para estudiar fosfoinosítidos en los procesos biológicos.
El uso de láminas de membrana en este trabajo no pasa por dos preocupaciones principales en los estudios morfológicos de fosfolípidos: tratamiento con detergente y contaminación potencial de señal desde el citosol. Detergentes a menudo causan la agrupación y la pérdida significativa de la señal de fosfolípidos PM. La contaminación de la señal citosólica es particularmente problemático en el caso de fosfoinosítidos baja abundancia en la PM 23, tales como PI (3,4,5) P 3 y PI (3,4) P 2. muestras de láminas de membrana son capaces de circumvent estos problemas sin interrumpir significativamente estructuras asociadas con la membrana plasmática, tales como malla de actina cortical y depresiones revestidas de clatrina 42,43. La distribución homogénea relativa de PI (4,5) P2 en el PM es en buena concordancia con otros estudios de congelación rápida EM utilizando sondas δ1 GST-PH PLC en la membrana de fibroblastos 44.
Es importante tener en cuenta que las condiciones de procesamiento de muestras inadecuadas pueden generar resultados erróneos. En primer lugar, es crítico para llevar a cabo los pasos de fijación a una temperatura más baja (4 ° C) y utilizar el fijador GA para la producción de lámina de membrana. Como se muestra en la Figura 3, la temperatura de calentamiento y la fijación PFA sin GA no es suficiente para fijar fosfoinosítidos en PM celular. Esto podría distorsionar la PI intacta (4,5) P 2 distribución y generar grupos afilados que no se observan en células vivas en condiciones fisiológicas. En segundo lugar, el uso de PAmCherry1 comola sonda SMLM, en lugar de otras sondas, es fundamental para la formación de imágenes PALM cuantitativa. El beneficio de la aplicación PAmCherry1 proviene de sus propiedades bien caracterizados individuales moleculares foto-35,40,45 física, como el brillo, alta eficiencia de la foto-activación y sobre todo, muy limitado foto-parpadear. Estas propiedades nos permiten eliminar los posibles artefactos de racimo de foto-parpadear y analizar cuantitativamente la densidad molecular de la membrana PI (4,5) P2.
Este enfoque también tiene sus limitaciones. En primer lugar, el método de lámina de membrana utilizada en este estudio no puede simular plenamente la distribución fisiológica de PI (4,5) P 2 porque la célula se interrumpe antes de formación de imágenes. Sin embargo, nuestra imagen en vivo PALM muestra la distribución relativamente homogénea similar de PI (4,5) P2, el apoyo a los resultados observados con muestras de láminas de membrana. En segundo lugar, como ya comentamos en nuestro trabajo anterior 23, SMLM requiere experiencia y formación de imágenes extra enTention para evitar artefactos de imagen que pudieran surgir de los diferentes procesos, incluyendo las sondas utilizadas, preparación de muestras y de fijación, de muestreo y reconstrucción de imágenes. Por último, aunque sondas basadas El dominio PH y anticuerpos han sido ampliamente utilizados en estudios phosphoinositide 46,47 sigue siendo posible que no todos PI (4,5) P 2 en la membrana puede ser detectada por este enfoque. Por ejemplo, PI (4,5) P 2 obligado por otras proteínas endógenas puede no ser accesible a sondas de pH o anticuerpos, y esto puede causar una subestimación de PI (4,5) P 2 debido al impedimento espacio de la sonda de sí mismos. Una forma alternativa de etiquetado PI (4,5) P2 estaría utilizando Top-Fluor PI (4,5) P2 48, un IP pre-marcado (4,5) P2 analógico con una modificación en la cola de originales PI (4,5) P2. Sin embargo, se puede convertir rápidamente en otros subtipos phosphoinositide por rápido metabolismo de las células en vivo desde su anillo de inositol es el mismo que endogenous PI (4,5) P2. Esto plantea el problema de si esta PI pre-marcado (4,5) P2 analógica en células vivas puede representar fielmente PI (4,5) P2 en vez de sus productos metabólicos. Por lo tanto, a pesar de algunas limitaciones, sondas basadas dominio PH siguen estando entre las mejores sondas que han sido ampliamente utilizados para controlar la distribución de PI (4,5) P2 y la dinámica de la PM de las células.
La futura aplicación de esta metodología se puede extender a otros estudios phosphoinositide, como PI (3,4,5) P3 y PI (3,4) P2. En resumen, el enfoque SMLM novela utilizado aquí abre nuevas formas de estudiar phosphoinositide en las células. El uso de PI (4,5) P2 como ejemplo, que demuestran las propiedades únicas de formación de imágenes de palma en el estudio morfológico y cuantitativo de las moléculas de la membrana celular, así como sus inconvenientes. Este enfoque puede ser adaptado a otras moléculas de interés, y tendrá amplias aplicaciones en la biología celular.
Divulgaciones
The authors have nothing to disclose.
Agradecimientos
This work is supported by the National Institutes of Health (NIH) grants R01DK093953 (X.L.), P30NS069271, BRFSG-2014-07 (X.L.). C.J. is partially supported by American Heart Associate pre-doctoral fellowship (14PRE20380168, to C.J.).
Materiales
| Name | Company | Catalog Number | Comments |
| Microscope | Nikon | Ti-U | |
| sCMOS camera | Andor | Neo | |
| Spinning disk | Yokogawa | CSU X-1, 10,000 rpm | |
| High Power Monolithic Laser Combiner SP with 405, 488, 561 and 642 nm lasers. | Agilent | MLC400 | laser original powers & powers at the end of optical fiber) 405 nm: 15 mW & 13 mW; 488 nm: 45 mW & 42 mW; 561 nm: 45 mW & 40 mW; 640 nm: 35 mW & 16 mW. |
| 100X Objective | Nikon | APO 100X Oil, NA 1.49, WD 0.12 mm | |
| Nikon acquisition and analysis software (NIS Element) | Nikon | ||
| Matlab | MathWorks | ||
| Coverslip | Warner | 64-0714 | Round 18 mm coverslip, #1.5 |
| Fibronectin | Millipore | FC010-5MG | |
| Lipofectamin 3000 (transfection reagent) | Invitrogen | L3000-008 | |
| Glutaraldehyde | Electron Microscopy Science | #16120 | |
| PI(4,5)P2 1st antibody | Santa Cruz | sc-53412 | |
| secondary antibody F(ab’)2-goat-anti-mouse Alexa Fluor 647 | Invitrogen | A-21237 | |
| Tetraspeck beads | Invitrogen | T7279 | |
| magnetic quick release imaging chamber | Warner Instruments | Cat#641994 | |
| temperature controller | Warner Instruments | TC-344C | |
| Poly-D-Lysine | Sigma | P6407 | |
| Phosphate buffer saline | Sigma | P4417-100TAB | |
| EGTA | Sigma | 3780 | |
| NH4Cl | Sigma | A0171 | |
| Goat serum | Sigma | G9023 | |
| bovine serum albumin | Sigma | A7906 | |
| NaCl | Sigma | S5886 | |
| KCl | Sigma | P5405 | |
| CaCl2•2H2O | Sigma | 223506 | |
| MgCl2•6H2O | Sigma | M9272 | |
| Glucose | Sigma | G7021 | |
| HEPES | Sigma | H4034 | |
| Paraformaldyhyde | Sigma | P6148 |
Referencias
- Di Paolo, G., De Camilli, P. Phosphoinositides in cell regulation and membrane dynamics. Nature. 443, 651-657 (2006).
- Hammond, G. R. V., et al. PI4P And PI(4,5)P(2) Are Essential But Independent Lipid Determinants Of Membrane Identity. Science. 337, 727-730 (2012).
- Nakatsu, F., et al. PtdIns4P synthesis by PI4KIIIalpha at the plasma membrane and its impact on plasma membrane identity. J Cell Biol. 199, 1003-1016 (2012).
- Cantley, L. C. The phosphoinositide 3-kinase pathway. Science. 296, 1655-1657 (2002).
- Czech, M. P. Dynamics of phosphoinositides in membrane retrieval and insertion. Annu Rev Physiol. 65, 791-815 (2003).
- Spira, F., et al. Patchwork organization of the yeast plasma membrane into numerous coexisting domains. Nat Cell Biol. 14, 640-648 (2012).
- Barg, S., Knowles, M. K., Chen, X., Midorikawa, M., Almers, W. Syntaxin clusters assemble reversibly at sites of secretory granules in live cells. Proc Natl Acad Sci U S A. 107, 20804-20809 (2010).
- Sieber, J. J., et al. Anatomy and dynamics of a supramolecular membrane protein cluster. Science. 317, 1072-1076 (2007).
- Knowles, M. K., et al. Single secretory granules of live cells recruit syntaxin-1 and synaptosomal associated protein 25 (SNAP-25) in large copy numbers. Proc Natl Acad Sci U S A. 107, 20810-20815 (2010).
- Milosevic, I., et al. Plasmalemmal phosphatidylinositol-4,5-bisphosphate level regulates the releasable vesicle pool size in chromaffin cells. J Neurosci. 25, 2557-2565 (2005).
- van Rheenen, J., Jalink, K. Agonist-induced PIP(2) hydrolysis inhibits cortical actin dynamics: regulation at a global but not at a micrometer scale. Mol Biol Cell. 13 (2), 3257-3267 (2002).
- Hammond, G., Schiavo, G., Irvine, R. Immunocytochemical techniques reveal multiple, distinct cellular pools of PtdIns4P and PtdIns (4, 5) P2. Biochem J. 422, 23-35 (2009).
- Huang, S., et al. Phosphatidylinositol-4,5-bisphosphate-rich plasma membrane patches organize active zones of endocytosis and ruffling in cultured adipocytes. Mol Cell Biol. 24, 9102-9123 (2004).
- James, D. J., Khodthong, C., Kowalchyk, J. A., Martin, T. F. Phosphatidylinositol 4,5-bisphosphate regulates SNARE-dependent membrane fusion. J Cell Biol. 182, 355-366 (2008).
- Laux, T., et al. GAP43, MARCKS, CAP23 modulate PI(4,5)P(2) at plasmalemmal rafts, and regulate cell cortex actin dynamics through a common mechanism. J Cell Biol. 149, 1455-1472 (2000).
- Aoyagi, K., et al. The activation of exocytotic sites by the formation of phosphatidylinositol 4,5-bisphosphate microdomains at syntaxin clusters. J Biol Chem. 280, 17346-17352 (2005).
- Kabachinski, G., Yamaga, M., Kielar-Grevstad, D. M., Bruinsma, S., Martin, T. F. CAPS and Munc13 utilize distinct PIP2-linked mechanisms to promote vesicle exocytosis. Mol Biol Cell. 25, 508-521 (2014).
- Wang, J., Richards, D. A. Segregation of PIP2 and PIP3 into distinct nanoscale regions within the plasma membrane. Biol Open. 1, 857-862 (2012).
- Hell, S. W., Wichmann, J. Breaking the diffraction resolution limit by stimulated emission: stimulated-emission-depletion fluorescence microscopy. Opt Lett. 19, 780-782 (1994).
- van den Bogaart, G., et al. Membrane protein sequestering by ionic protein-lipid interactions. Nature. 479, 552-555 (2011).
- van Rheenen, J., Achame, E. M., Janssen, H., Calafat, J., Jalink, K. PIP2 signaling in lipid domains: a critical re-evaluation. Embo J. 24, 1664-1673 (2005).
- Sato, K., et al. Differential requirements for clathrin in receptor-mediated endocytosis and maintenance of synaptic vesicle pools. Proc Natl Acad Sci U S A. 106, 1139-1144 (2009).
- Ji, C., Zhang, Y., Xu, P., Xu, T., Lou, X. Nanoscale Landscape of Phosphoinositides Revealed by Specific Pleckstrin Homology (PH) Domains Using Single-molecule Superresolution Imaging in the Plasma Membrane. J of Biol Chem. 290, 26978-26993 (2015).
- Betzig, E., et al. Imaging intracellular fluorescent proteins at nanometer resolution. Science. 313, 1642-1645 (2006).
- Hess, S. T., Girirajan, T. P., Mason, M. D. Ultra-high resolution imaging by fluorescence photoactivation localization microscopy. Biophys J. 91, 4258-4272 (2006).
- Rust, M. J., Bates, M., Zhuang, X. Sub-diffraction-limit imaging by stochastic optical reconstruction microscopy (STORM). Nat Methods. 3, 793-795 (2006).
- Xu, K., Zhong, G., Zhuang, X. Actin, spectrin, and associated proteins form a periodic cytoskeletal structure in axons. Science. 339, 452-456 (2013).
- Wombacher, R., et al. Live-cell super-resolution imaging with trimethoprim conjugates. Nat Methods. 7, 717-719 (2010).
- Szymborska, A., et al. Nuclear pore scaffold structure analyzed by super-resolution microscopy and particle averaging. Science. 341, 655-658 (2013).
- Pertsinidis, A., et al. Ultrahigh-resolution imaging reveals formation of neuronal SNARE/Munc18 complexes in situ. Proc Natl Acad Sci U S A. 110, 2812-2820 (2013).
- Shim, S. -. H., et al. Super-resolution fluorescence imaging of organelles in live cells with photoswitchable membrane probes. Proc Natl Acad Sci. 109, 13978-13983 (2012).
- Huang, F., et al. Video-rate nanoscopy using sCMOS camera-specific single-molecule localization algorithms. Nat Methods. 10, 653-658 (2013).
- Balla, T., Várnai, P. Visualization of Cellular Phosphoinositide Pools with GFP-Fused Protein-Domains. Curr Protoc Cell Biol. 24, 24 (2009).
- Xu, C., Watras, J., Loew, L. M. Kinetic analysis of receptor-activated phosphoinositide turnover. J Cell Biol. 161, 779-791 (2003).
- Subach, F. V., et al. Photoactivatable mCherry for high-resolution two-color fluorescence microscopy. Nat Methods. 6, 153-159 (2009).
- Filonov, G. S., et al. Bright and stable near infra-red fluorescent protein for in vivo imaging. Nature Biotechnol. 29, 757-761 (2011).
- Zhang, M., et al. Rational design of true monomeric and bright photoactivatable fluorescent proteins. Nat Methods. 9, 727-729 (2012).
- Hohmeier, H. E., et al. Isolation of INS-1-derived cell lines with robust ATP-sensitive K+ channel-dependent and -independent glucose-stimulated insulin secretion. Diabetes. 49, 424-430 (2000).
- Dyachok, O., Isakov, Y., Sågetorp, J., Tengholm, A. Oscillations of cyclic AMP in hormone-stimulated insulin-secreting β-cells. Nature. 439, 349-352 (2006).
- Nan, X., et al. Single-molecule superresolution imaging allows quantitative analysis of RAF multimer formation and signaling. Proc Natl Acad Sci U S A. 110, 18519-18524 (2013).
- Sengupta, P., et al. Probing protein heterogeneity in the plasma membrane using PALM and pair correlation analysis. Nat Methods. 8, 969-975 (2011).
- Morone, N., et al. Three-dimensional reconstruction of the membrane skeleton at the plasma membrane interface by electron tomography. J Cell Biol. 174, 851-862 (2006).
- Peters, K. R., Carley, W. W., Palade, G. E. Endothelial plasmalemmal vesicles have a characteristic striped bipolar surface structure. J Cell Biol. 101, 2233-2238 (1985).
- Fujita, A., Cheng, J., Tauchi-Sato, K., Takenawa, T., Fujimoto, T. A distinct pool of phosphatidylinositol 4,5-bisphosphate in caveolae revealed by a nanoscale labeling technique. Proc Natl Acad Sci U S A. 106, 9256-9261 (2009).
- Durisic, N., Laparra-Cuervo, L., Sandoval-Álvarez, &. #. 1. 9. 3. ;., Borbely, J. S., Lakadamyali, M. Single-molecule evaluation of fluorescent protein photoactivation efficiency using an in vivo nanotemplate. Nat Methods. 11, 156-162 (2014).
- Thomas, C. L., Steel, J., Prestwich, G. D., Schiavo, G. Generation of phosphatidylinositol-specific antibodies and their characterization. Biochem Soc Trans. 27, 648-652 (1999).
- Várnai, P., Balla, T. Live cell imaging of phosphoinositides with expressed inositide binding protein domains. Methods. 46, 167-176 (2008).
- Honigmann, A., et al. Phosphatidylinositol 4,5-bisphosphate clusters act as molecular beacons for vesicle recruitment. Nature Struct Mol Biol. 20, 679-686 (2013).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados