Method Article
소설 형광 프로브와 플라즈마 막에서 포스파티딜 이노시톨 -4,5- 비스 포스페이트의 단일 분자 슈퍼 해상도 이미징
요약
PI (4,5) P (2)는 다양한 세포 기능을 조절하지만, 세포 세포막에서의 나노 조직 잘못 이해된다. 라벨 PI 플렉스 트린 상동 도메인에 융합 된 이중 색상 형광 프로브 (4,5) P (2)에 의해, 우리는 나노 미터 스케일에서 (4,5) P 원형질막 2 공간 분포를 PI를 연구하는 새로운 방법을 기술 .
초록
Phosphoinositides in the cell membrane are signaling lipids with multiple cellular functions. Phosphatidylinositol 4,5-bisphosphate (PI(4,5)P2) is a determinant phosphoinositide of the plasma membrane (PM), and it is required to modulate ion channels, actin dynamics, exocytosis, endocytosis, intracellular signaling, and many other cellular processes. However, the spatial organization of PI(4,5)P2 in the PM is controversial, and its nanoscale distribution is poorly understood due to the technical limitations of research approaches. Here by utilizing single molecule localization microscopy and the Pleckstrin Homology (PH) domain based dual color fluorescent probes, we describe a novel method to visualize the nanoscale distribution of PI(4,5)P2 in the PM in fixed membrane sheets as well as live cells.
서문
Phosphoinositides 총 막 지질의 일부에 기여하지만, 셀룰러 다양한 공정에서 중요한 역할을한다. 그들은 제 3의 이노시톨 반지의 가역적 인산화 또는 탈 인산화에서 파생 된 일곱 멤버, 4 번째와 5 번째 위치 (1)을 포함한다. 포스파티딜 이노시톨 4 포스페이트 (PI4P) 및 포스파티딜 이노시톨 4,5- 비스 포스페이트 (PI (4,5) P 2)는 세포 원형질막 (PM)의 2,3- 행렬식 지질 비교적 독립적으로 기능 두 가지 phosphoinositides이다. 포스파티딜 이노시톨 (3,4,5) -trisphosphate (PIP 3) 훨씬 덜 풍부한 PI4P 및 PI (4,5) P 2 이상이지만, 암 (4)과 당뇨병 (5) 등 다양한 세포 과정에 고유 한 기능을 가지고있다. 이러한 지질는 이펙터 및 다른 많은 단백질과 복잡한 분자 상호 작용을 가지고있다. 따라서, 이러한 포의 공간적 구성을 이해하기 위해 중요나노 미터 스케일에서 오후에 sphoinositides.
장착 증거는 제한 PM 분야에서 단백질 복합체 또는 분자 클러스터가 핫스팟 (6) 신호 역할을 할 수 있음을 보여 주었다. 예를 들어, 신택의 1A, 막 융합 7-9를 조절하는 중요한 단백질은 오후에 클러스터 조직을 표시합니다. 신택 (1a)의 클러스터 조직의 합의 뷰에서 고유의 오후에 phosphoinositides의 공간 분포는 논쟁의 여지가있다. PI (4,5) P 2 분포 패턴을 사용하는 클러스터 14-18, 세포 유형에 따라 실험 방법을 조밀하기 위해, 균일 10-12, 큰 패치 13, 14 이르기까지 다양합니다. 높은 해상도에서 PI (4,5) P (2)의 공간 조직은 일치하지 않습니다. 자극 방출-고갈을 사용하는 연구는 (STED) 현미경 (19)는 조밀 한 PI (4,5) P (2) 나노 클러스터의 큰 숫자를 공개했다 (~ 직경 73 nm의) PC-12 세포 (20)의 PM 시트에 입니다. 이러한 결과는 신속한 동결 전자 현미경 (EM) 21, 22, 화학적 고정화보다 훨씬 생균의 손상 PM 구조를 유지 접근법을 사용하는 연구와 다르다. 후자는 PI (4,5) P (2)의 별개의 풀을 보여 주었다; 상대적으로 집중 PI (4,5) 카베 올래 및 코팅 된 구덩이에서 P 2뿐만 아니라 평면 PM 영역에 균일 한 분포. 또한, 멤브레인 시트에 나노 PI (4,5) P (2) 조직은 라이브와 고정 된 세포에서 다를 수 있습니다. 우리의 최근의 연구는 단일 분자 현지화 현미경 (SMLM) (23)를 사용하여 두 고정 사는 INS-1 세포에서이 문제를 조사 하였다.
SMLM 개별 형광이 높은 정밀도로 현지화 될 수 있도록 확률 적 주어진 시간에 형광의 작은 하위 집합에 전환을 기반으로합니다. 많은 초해 촬상 방법은 종래의 광학 현미경의 회절 한계를 능가하는 유사한 원리를 사용하여 개발되었다 이러한님의 photoactivation 현지화 현미경 (PALM) (24), 형광 photoactivation 현지화 현미경 (FPALM) (25), 확률 적 광 재건 현미경 (STORM) 26, 27 및 직접 STORM (dSTORM) 28. 사진 전환 또는 광활성 형광 물질 (염료 또는 형광 단백질)로, SMLM 기술은 살아있는 세포 (31, 32)에 비디오 속도 나노 미터 해상도 24,29,30에서 이미지 생물학적 구조에 과학자를 할 수 있습니다.
예를 들어 PI (4,5) P 2를 사용하여, 우리는 오후에 phosphoinositides의 나노 크기의 분포를 연구하기 SMLM 방식을 도입했다. 특히 PI에 결합 PLCδ1 (포스 C의 δ1)의 PH 도메인 (4,5) P 2는 오후에 영상 PI (4,5) P (2) 하위 세포 분포 및 역학 33, 34에 대한 잘 확립 된 프로브입니다 . 우리는 유 전적으로 두 형광 단백질, PAmCherry1 35 IRFP (36)이 도메인을 태그 한 이중 색상 융합 단백질 (IRFP-PAmCherry1-PH PLCδ1)를 생성하기 위하여 (도 1A-B는). PAmCherry1 손바닥위한 PH 도메인의 광활성 프로브로서 기능하고 IRFP는 PALM 취득 전에 형질 감염된 세포를 식별하는 일반적인 지표 역할 . 우리는 고정 된 멤브레인 시트에 SMLM 영상이 듀얼 컬러 형광 프로브를 적용합니다. 라이브 PALM 촬상을 위해, 우리는 더 나은 광자 효율 및 휘도 (도 1C-D)에 대한 mEOS3.1-PH의 PLCδ1 프로브를 생성 PH의 PLCδ1 도메인 mEOS3 37 대신 PAmCherry1 태그.
인슐린 분비 INS-1 세포 (38)의 PM 이러한 새로운 프로브 SMLM 영상은 PI (4,5)에 오후 지역의 대부분에서 P 2뿐만 아니라 진한 PI (4,5) P (2)의 균일 한 라벨을 발견했다 드문 드문 평면 오후 일부 filopodia 같은 구조 (23)에 혼합되어 마이크로 도메인. 개구PI (4,5) P (2)의 noScale로 분포는 살아있는 세포에서 기능하는 방법을 다시 생각하기위한 구조적 기반을 제공합니다.
프로토콜
1. 멤브레인 시트 준비 및 고정
- IRFP-PAmCherry1-PH PLC의 δ1으로 표시 막 시트를 준비
- 플라스미드 DNA를 인코딩 IRFP PAmCherry1-PH-PLC는 표준 분자 생물학 기술을 이용하여 23 δ1 준비한다.
- 문화 INS-1 # 1.5에 세포 18mm 라운드 커버 슬립 표준 INS-1 세포 배양 프로토콜 (38, 39) 다음 50~70%의 컨 플루 30 μg의 / ㎖ 피브로넥틴 미리 코팅. 50 내지 70 %의 컨 플루 언시에 도달 한 후, 세포를 형질 하루.
- IRFP PAmCherry1-PH-PLC로 형질 감염 세포를 제조자의 프로토콜을 다음 리포좀 형질 감염 시약을 이용 δ1. 형질 감염 후, 세포를 48 시간 동안 성장하는 것을 허용한다.
- 실험 당일 ~ 0.5 코팅 된 커버 (한 쪽) - 500 μg의 / ㎖ 폴리 D 라이신 1 ㎖ 1-2 시간 동안 (PDL은 DH 2 O로 희석). 그런 다음에 티슈 페이퍼를 배치하여 PDL 드레인커버 슬립의 가장자리. 나중에 사용하기 위해 미리 냉장 (4 ℃로) 금속판에 커버 슬립을 놓습니다.
- 1 mM의 EGTA를 포함하는 1 ML의 얼음처럼 차가운 인산 완충 식염수 (PBS) - ~ 0.5으로 된 커버에 성장 사전 형질 INS-1 세포를 씻으십시오. 세척을 세 번 반복 PBS 드레인.
- 핀셋으로 미리 냉장 금속 접시에 PDL 코팅 커버 슬립에 배양 된 세포 (세포면이 아래를 향하도록)으로 된 커버를 놓습니다. 세포가 PDL 코팅 된 커버 (그림 2)에 부착 할 수 있도록 10 분 - 7 냉장고 (4 ℃)에서 접시를 둡니다.
주의 : 항온 처리 시간 (7)의 범위 내에 있어야 - PDL 코팅 표면에 세포를 잘 부착되도록 10 분. 냉장고 환경은 건조 및 배양 너무 오래 안됩니다. - 냉장고에서 금속판을 제거합니다. 부드럽게 핀셋을 사용하여 미리 형질 감염된 세포를 함유하는 커버 슬립을 벗겨. 이것은 셀에 막 시트를 얇게 만들어커버 슬립을 PDL은 코팅. 부드럽게 ~ 0.5으로 막 시트를 세척 - 1 ml를 빙냉 PBS 후 ~ 0.5으로 고정 - 1 ml의 빙냉 4 % 파라 포름 알데히드 (PFA) + 4 ℃에서 15 분 동안 PBS에서 0.2 % 글루 타르 알데히드 (GA).
주의 : 파라 포름 알데히드와 글루 타르 알데히드는 독성이. 피부와 눈 보호 흄 후드를 처리합니다. - 고정 후, 이미지 멤브레인 시트는 즉시 (3 절 참조) 또는 ~ 0.5 저장 - 4 ° C에서 1 ml의 PBS를.
참고 : 막 시트를 고정 후, 세포질에서 PI (4,5) P (2) PH 프로브의 결합에는 평형이 없습니다. 결합 된 PH 프로브는 점차적으로 막 시트에서 해리와 (이 주에 일이 걸릴 수도 있지만) 솔루션으로 확산됩니다. 따라서, 우측 시료 전처리 후 이미지를 고정 샘플을 권장한다.
- PI (4,5) P (2) 특정 항체 라벨링에 대한 멤브레인 시트를 준비
- 문화 INS-1 # 1.5에 셀, 30 미리가 코팅 된 18mm 라운드 커버 슬립# 181; g / ㎖ 피브로넥틴 50 % -70 %의 합류. 단계 1.1.3에 기재된 DNA와 형질 세포 다음날 플라스미드.
- 상술 한 바와 같이 1.1.7에 1.1.4에서 단계를 반복합니다.
참고 : 4 ° C에서 다음 절차를 수행합니다. - 1 ml의 얼음처럼 차가운 PBS의 50 mM NH 4 CL을 포함하는 - ~ 0.5로 고정 오후 시트를 세 번 포함 된 커버를 씻으십시오. ~ 0.5, 시트 담금질 - 7 분 동안 PBS 1 ml의 0.1 % 수소화 붕소 나트륨과 함께 세탁 ~ 0.5 - 1ml를 PBS (50 mM의 NH 4 CL없이).
- 차단 용액 1 mL를 45 분 동안 (5 % (v / v)의 정상 염소 혈청, 5 % (v / v)의 소 혈청 알부민의 50 mM NH 4 CL 함유 PBS 용액) - ~ 0.5 샘플 블록. 1 시간 동안 차단 솔루션에 : (300 희석 1) 1 ml의 차 PI 2 항체 (4,5) P - 그럼 ~ 0.5로 품어. 1 ㎖의 PBS의 50 mM NH4Cl 등을 포함 - ~ 0.5로 세 번 (10 분마다) 세척 하였다.
- 1 ml의 보조 F (AB ') 2 - 염소 - 항 - 마우스 - ~ 0.5로 샘플을 품어1 시간 동안 블로킹 완충액에서 : 형광체 (300 1)와 접합 된 항체. 1 ml의 PBS - ~ 0.5로 3 회 씻는다.
- 포스트 픽스 샘플을 4 % PFA + 0.2 % GA 15 분 후 PBS (7 분마다)로 샘플을 세 번 세척 하였다. 영상에 대한 제 3 항에 진행하거나 나중에 사용하기 위해 4 ° C에서 ~ 0.5 ~ 1 ml의 PBS를에 저장합니다.
참고 : 4 ° C에서 샘플을 준비합니다. 는 PM에 phosphoinositides의 생리 학적 분포를 유지하기 위해 4 % PFA + 0.2 % GA 정착액을 사용합니다. 혼자 4 % PFA와 RT 준비 또는 고정 상당한 유물 (그림 4)의 원인이 될 수 있습니다.
mEOS3.1-PH PLC의 δ1와 라이브 셀 이미징 2. 세포 배양 준비
- 앞서 설명한 바와 같이 23 mEOS3.1 PH-PLC의 δ1을 코딩하는 DNA 플라스미드를 준비한다.
- # 1.5 18mm에 문화 INS-1 세포 라운드가 된 커버 30 μg의 / ㎖ 피브로넥틴가 도달 할 때까지 50 % -70 %의 confl 사전 코팅표준 INS-1 세포 배양 프로토콜 (38, 39)을 다음 uency.
- 다음 날, DNA 플라스미드 제조의 프로토콜 다음 리포좀 형질 전환 시약을 사용하여 δ1 mEOS3.1-PH PLC와 INS-1 세포를 형질. 촬영 전에 48 시간 동안 품어.
멤브레인 시트 및 라이브 세포의 3 PALM 이미지 획득
- 막 시트 PALM 화상 취득
주 : 여기에서, 전반사 형광 (TIRF) 현미경 SMLM 기반 시스템 (100X 오일, APO, NA = 1.49이 WD 0.12 mm) (23)가 모든 화상 획득에 사용된다.- 촬영하기 전에, 10 ml의 PBS + 50 밀리미터의 MgCl 2 형광 구슬 솔루션 1 μl를 희석. 10 분 동안 (단계 1.1.8 / 1.2.6)에서 이미징 챔버 포함하는 세포 샘플로 솔루션을 희석 200 μl를 추가합니다. 그 후, PBS로 3 회 세척 하였다.
- 손바닥 이미징 시스템을 시작합니다. 관련 이미징 소프트웨어,은 "IRFP 채널 선택# 34; 버튼 (642 nm의 레이저 여기, 75분의 700 nm의 발광). IRFP 채널 PH 프로브를 발현시키는 세포막을 찾는다.
주 : 멤브레인 시트 근처 형광 구슬이 있어야합니다. 이것은 나중에 드리프트 보정이 필요합니다. - 미래 화상 재구성을위한 기준으로서 IRFP 채널에서 세포막의 종래 TIRF 화상을 수집하기 위해 "촬영"버튼을 사용한다. 이미징 설정 TIRF 각도에 2140를 입력하여 일반 TIRF 각도 (즉, 중요한 각도에 도달 한 후, 또 다른 150도 회전)를 설정합니다. 별도로 명시하지 않는 한 모든 단계에 대한 설정이 각도를 사용합니다.
주 : 여기에서 설명한 TIRF 시스템에서, 3500은 2200의 TIRF 임계각이며, 2140 TIRF 임계각 후 1.5 정도 이상 정상 TIRF 각도 인, 업 직각이다. 3.2.3 아래 언급 된 좁은 TIRF 각도는 TIRF 중요한 각도에 도달 한 후 다른 2 정도 인 2120입니다. - 일을 클릭하여 PAmCherry1 채널로 전환전자 RFP 채널 버튼 (561 nm의 여기, 50분의 600 nm의 방출 필터). 배경 막 형광 표백제에 10 ~ 20 초 동안 561 nm의 레이저의 전체 전력 조명을 오른쪽으로 "AOTF"패드에 모든 방법을 스크롤 막대를 조정합니다.
- '형식'탭과 'ND 시퀀스 획득 "탭의 빠른 획득 프로토콜에 최적의 카메라 설정 (2 × 2 비닝 (binning))를 설정 (일반적으로 20 Hz에서 10,000-40,000 이미지).
- "지금 실행"버튼을 클릭하여 - 낮은 수준 (1 %, 0.1 %)에서 동시에 405 nm의 레이저 활성화에 PAmCherry1 이미지 (전체 전력에서 561 nm의 레이저, 50 밀리 초 / 프레임)의 인수를 시작합니다. 각 프레임이 공간적으로 고립 된 개인 점을 쉽게 식별 할 수 있도록 405 nm의 레이저의 강도를 조절합니다.
참고 : 기동 PAmCherry1 분자의 수는 획득하는 동안 점차적으로 감소한다. 405 nm의 레이저 강도가 서서히 각 개별 분자 신호의 최적의 농도를 유지하기 위해 증가되어야틀. - 더 PAmCherry1 단일 분자 신호가 활성화되지 않을 때까지 이미지를 획득 계속합니다.
- 살아있는 세포에서 PALM 영상
- 단계 3.1.1에 기재된 촬상 전에 10 분 동안 촬상 챔버 내로 형광 비드 희석. 그런 다음 관련 이미징 소프트웨어를 열어 PALM 영상을 시작합니다.
참고 : 라이브 세포 이미징을위한 자기 조정기 영상 실을 사용합니다. 135 mM의 염화나트륨, 5.6 mM의 KCl을 2.6 mM의 CaCl2를 1.2 밀리미터의 MgCl 2, 3 mM의 글루코오스, 20 MM : 외 완충액 (세포 외 용액으로 일정한 관류하에 온도 컨트롤러 35 ° C에서의 촬상 영역의 중심을 유지 HEPES, pH는 7.3). - GFP의 채널 버튼 (50분의 525 nm의 발광)을 선택합니다. 488 nm의 레이저 여기에서 mEOS3에서 녹색 형광을 기반으로 형광 프로브를 표현하는 세포막을 확인합니다. 근처의이 같은 영상 중에 포함 된 형광 구슬이 오프라인 건조기가 나중에 필요하다는 것을 확인하십시오피트 보정.
- 참조 화상으로서 mEOS3 (녹색) 채널에서의 세포막의 TIRF 화상을 수집하기 위해 "캡처"버튼을 클릭한다. 라이브 세포 이미징을위한 설정 TIRF 각도에 2120을 입력하여 (임계각에 도달 한 후, 다른 2도 회전) 얕은 소멸 파 여기 조명을 사용합니다.
참고 :이 세포막에 세포질 인접한에서 언 바운드 mEos3-PH에서 형광을 최소화 할 수 있습니다. - 은 "RFP 채널"버튼 (561 nm의 여기, 50분의 600 nm의 방출)로 전환합니다. (3.1.4 참조) "AOTF 패드"의 스크롤 10 ~ 20 초 동안 멤브레인 시트의 배경 형광 표백제 전체 전력 561 nm의 레이저를 사용합니다.
- 동시에 405 nm의 레이저 활성화에 (이하 "카메라"설정 탭에서 10 밀리 초 / 프레임 설정 561 nm의 최대 전력) 빨강 채널에서 "지금 실행"버튼을 클릭하여 이미지 수집을 시작합니다. 공간적으로 분리 된 지점을 활성화하기 위해 405 nm의 레이저 강도를 조정각각의 프레임이다.
주 : 분자 수는 서서히 감소 mEOS3.1 PH-PLC 미 변환 δ1 취득 진행됨. 점차적으로 단일 분자 신호를 최적화하기 위해 405 nm의 레이저 파워를 증가시킨다. 촬상 수집 길이는 실험 목적에 따라 달라진다. 정상적인 조건에서 5 분 동안 연속적으로 이미지를 획득. 장기간 취득이 필요한 경우, 그 대신 하나의 큰 이미지 스택의 여러 이미지 스택을 모은다. 각 이미지 스택의 파일 크기는 4GB를 초과하지 않아야하거나 나중에 소프트웨어 분석에 영향을 미칠 것이다.
- 단계 3.1.1에 기재된 촬상 전에 10 분 동안 촬상 챔버 내로 형광 비드 희석. 그런 다음 관련 이미징 소프트웨어를 열어 PALM 영상을 시작합니다.
4. SMLM 이미지 처리 및 재건
- 화상 분석 스테이션, 화상 파일 (화상이 .tif 스택)를 옮긴다. 다음, 다음 "새 파일"을 "열기"이전 37 설명 된대로 매트랩 이미지 재건 프로그램 (사용자 정의 작성)를 실행하고 메인 메뉴에서 "파일"탭을 클릭하여 이미지 스택을로드합니다.
- 확인하고 삶을각 프레임에서 개별 분자 이벤트를 발자. 은 "웨이브 렛"의 임계 수 (1-10)과 강도 임계치를 필터링 설정한다. 시각적 재구성 전에 점 검출을위한 최적의 파라미터 설정을 확인한다. 그런 다음 "PALM"탭으로 이동하여 이미지 재구성을 시작합니다 "한 단계 프로세스"를 클릭합니다.
참고 : 포인트 검출을위한 강도 임계 값이 임의이며, 개인적인 경험에 따라 달라집니다. 여러 임상 시험은 둘 다 너무 많은 규정되지 않은 (흐리게) 포인트를 집어하지 않고 너무 많은 자격 (밝은) 점을 필터링하는 것이 최적의 검출 임계 값을 생성해야 할 수 있습니다. 데이터 분석을 최적화하는 다른 매개 변수를 조정합니다. 여기, 동네 거리 (결합되는 거리에 인접 프레임의 형광 점) 65 나노 (1/2 픽셀 폭)로 설정하고 단일 분자로 장착되어 있습니다. 갭 프레임 (결합과 단일 분자 이벤트로 장착 된이 프레임과 주변 거리 내에서 발생한 개별 분자 이벤트)입니다PAmCherry1 영상 (40) 26 프레임 (1.3 초)로 설정합니다. SMLM 40를 계산 오버 방지하기 위해 단일 분자 프로브 및 수집 속도의 특성에 따라 이러한 매개 변수를 조정합니다. 복원 자료 중 형광 구슬 드리프트 보정을 적용합니다.- IRFP PAmCherry1-PH-PLC를 δ1로 표시된 고정 된 멤브레인 시트 이미징 단일 수퍼 - 해상도 이미지 (37)에 동일한 막 시트로부터 화상 전체 스택을 재구성.
- mEOS3.1-PH PLC를 δ1로 표시된 생균 샘플 1,000 프레임 여러 작은 스택으로 화상 전체 스택을 분리 1000 연속 프레임 스택의 시간 해상도를 가지고 하나의 초 해상도 영상으로 복원되도록 10 초. 결국 최종 시계열 스택 (23)에 모두 시계열 화상을 결합한다.
참고 : 라이브 세포 PALM 영상에서 활성화 프로브 적은 수의 이동 또는 해리 할 수있다표백 전에 오후에 PI (4,5) P 2에서. 프로브의 오버 샘플링을 설명하기 위해 이미지 분석에서 단일 방사 이벤트로 (대신에 65 nm 인) 130 nm의 인접 프레임 내의 개별 분자 신호를 결합한다.
- 재구성 된 화상을 취득 한 후, 한 쌍의 상관 (41)의 분자 밀도 마이크로 도메인 밀도 / 크기, 클러스터 분석 정량화 매트랩 맞춤 작성 프로그램에 상기 이미지 분석을 수행한다.
결과
우리의 슈퍼 해상도 시스템의 현지화 불확실성 (σ)는 14.73 내지 23이다. TIRF와 PALM 이미지 사이의 직접 비교는 공간 해상도의 상당한 개선을 보여 주었다. 그림 3A-B는 PI (4,5) P (2) 항체 및 IRFP-PAmCherry1-PH PLC 레이블을 대표 PI (4,5) P 2 TIRF의 이미지를 보여줍니다 일반적인 멤브레인 시트와 살아있는 세포에서 δ1. 멤브레인 시트에 기존의 TIRF 현미경과 이미지가 강화 된 녹색 형광 단백질 표지 그대로 살아있는 세포의 것과 매우 유사하다 (EGFP)는 (그림 3C) (EGFP-PH PLCδ1) PH 도메인 태그. 모든 샘플 프로브의 고른 분포를 보였다. 대조적으로, 샘플의 비 최적 정착 날카로운 조밀 PI (4,5) P (2) 클러스터 및 신호 강도의 저하 (도 4)였다. 최적의 고정 조건 하에서 t그는 PI 고정 된 세포에서 (4,5) P (2) (그림 5)의 슈퍼 해상도의 이미지는 제한된 농도 구배와 PM의 상당 부분에서 프로브의 균일 한 분포를 밝혔다. PI (4,5) P 2 프로브와 풍부한 일부 막 패치는 띄엄 띄엄 분산 및 다양한 크기를 가지고 있었다. 라이브 셀 PALM 이미지 (그림 6) 고정 된 세포와 유사한 공간 분포를 표시합니다. 폭 넓은 분야에서의 풍부한의 큰 변화없이 PI (4,5) P 로컬 영역에서 빠른 역학에서 시간의 결과를 통해이 신호의 상세 분석.
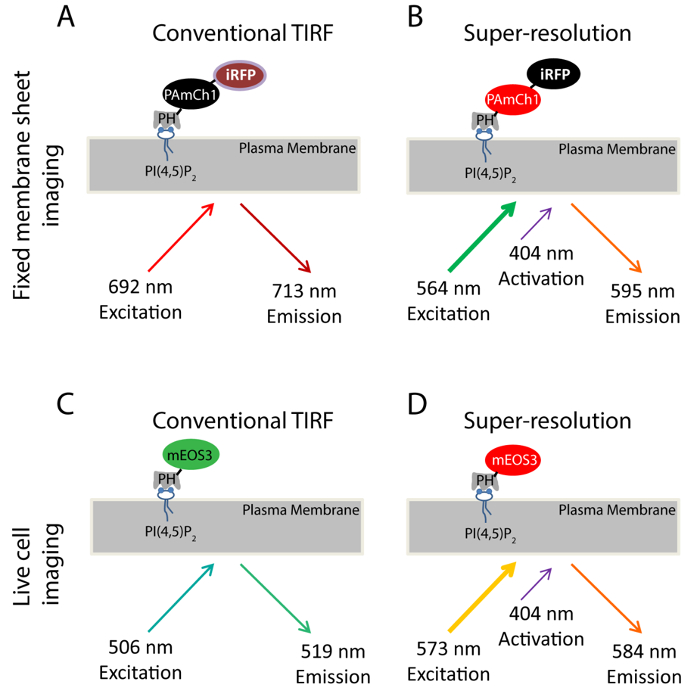
본 연구에 사용 된 형광 프로브 그림 1. 계획. 고정 막 시트 실험에 사용 (AB) IRFP-PAmCherry1-PH PLC δ1 프로브. 종래 TIRF 영상 (A), 640 nm의 중 레이저는 IRFP 자극하는 데 사용됩니다 (예 : 692 nm의, 엠 : 713 ㎚). 이 상태에서 촬영 TIRF 이미지 PALM 영상 (B)에 의해 얻어진 초 해상도 영상 TIRF 대한 참조 화상으로서 역할을한다. 405 나노 레이저에 사용되는 PAmCherry1의 형광을 사진 활성화 및 561 nm의 레이저는 PAmCherry1 자극하는 데 사용됩니다 (예를 : 564 nm의, 엠 : 595 ㎚) PALM 이미징을. (CD) 생균 실험에 사용 mEos3.1-PH의 PLCδ1 프로브. 종래 TIRF 촬상 중에 (C)이, 488 nm의 레이저 mEOS3.1 (:; 519 내지 506 nm의 엠 예)를 자극하기 위해 사용된다. (: 573 nm의, 엠 : 예 584 ㎚) 405 nm의 레이저에 의한 광 변환 후 (D)는 mEos3.1는 빨간색 형태로 변합니다. PALM 인수에 사용하고, 561 nm의 레이저 의 더 큰 버전을 보려면 여기를 클릭하십시오 이 그림.
S / ftp_upload / 54466 / 54466fig2.jpg "/>
INS-1 세포에서 막 시트 준비를위한 그림 2. 계획. (A)는 PDL 코팅 커버 슬립에 아래로 향하게 배양 된 세포와 커버 슬립을 놓고 PDL-에 세포 부착 할 수 있도록 4 ° C에서 7 ~ 10 분 동안 기다립니다 코팅 된 커버 슬립. (B) 핀셋 상단 커버 슬립을 벗겨과 PDL 사전 코팅 커버 슬립에 부착 된 멤브레인 시트를 고정합니다. (C) 이미지 TIRFM과 PALM와 샘플을. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
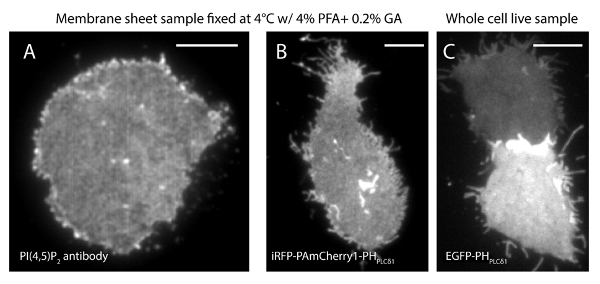
그림 3. PI (4,5) P (2) 공간 조직이 기존의 TIRF 현미경으로 막 시트와 그대로 살아있는 세포와 유사하다. (A)막 시트의 전형적인 TIRF 이미지는 4 % PFA 0.2 % GA와 4 ° C로 고정. PI (4,5) P (2)는 PI (4,5) P (2) 특정 항체로 표지 하였다. (B) IRFP PAmCherry1-PH-PLC의 δ1을 발현하는 INS-1 세포로부터의 막 시트. 서로 다른 수준에서 EGFP-PH의 PLCδ1 표현이 그대로 살아있는 세포의 (C) TIRF 이미지입니다. 스케일 바 : (A) : 3 μm의; (B)와 (C). 5 μm의 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
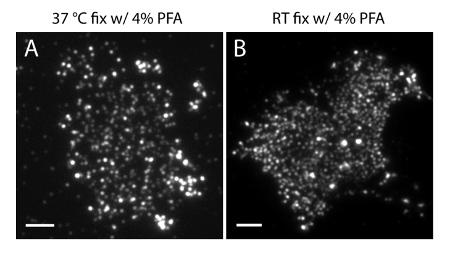
그림 4. PI 막 시트 2 공간 조직이 일반적인 고정 조건에 민감하다 (4,5) P. (A) 멤브레인 시트는 혼자 4 % PFA 37 ° C로 고정및 (그림 3A에서와 같이) PI (4,5) P (2) 특이 항체로 표지. (B) 멤브레인 시트 혼자 PFA와 RT에 고정 및 PI (4,5) P (2) 특이 항체로 표지. PI의 밀집이 (4,5) P (2) 프로브는도 3a에 도시 된 더에도 형광 화상 달리 TIRF 현미경으로 명확하게 볼 수 있습니다. 스케일 바 : AB :. 3 μm의 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
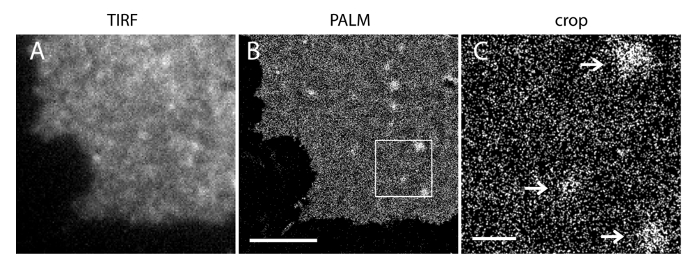
PI 그림 5. PALM 이미징 (4,5) P 2 프로브는 INS-1 세포 오후 자신의 나노 미터 크기 분포를 알 수있다. (A) IRFP-PAmCherry1-PH를 표현한 INS-1 세포에서 막 시트의 IRFP TIRF 이미지를 PLCPAmCherry1 신호 재구성을 기반으로 같은 지역에 오후의 PALM 이미지를 해당 δ1. (B). 균일 한 PI (4,5) P 주요 PM 지역과 여러 PI (4,5) P 2 마이크로 도메인 2 공간 분포를합니다. (C) (B)의 박스 부분의 확대도. 화살표 띄엄 띄엄 PI (4,5) P 2 프로브 풍부 오후 마이크로 도메인을 배포 나타냅니다. 스케일 바 : A와 B : 3 μm의; C : 500 nm의. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
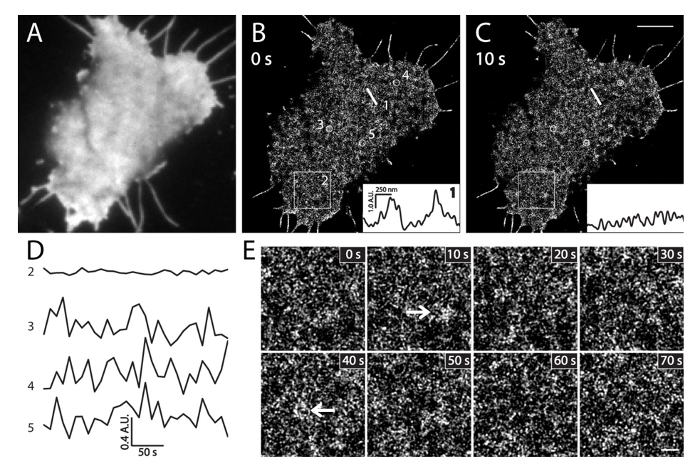
라이브 INS-1 세포에서 그림 6. PALM 영상. (A) mEos3.1-PH PLC를 표현하는 라이브 INS-1 세포에서 PI (4,5) P (2)의 TIRF 이미지δ1. 이미지가 빠르게 PALM 수집 (35 °에 C) 전에 녹색 채널에 인수되었다. (B) 10 초 간격으로 연속 라이브 셀 PALM 이미지. 세트는 로컬 PI (4,5) P 2 (B)에 서로 다른 시간에 동일 직선을 따라 위치 1 밀도 (C)의 강도 프로파일을 도시한다. 10 초 내에서 큰 지역의 강도를 변경합니다. (D) PI의 평균 강도의 변화 시간 경과 (4,5) (B)의 넓은 영역 (BOX2, 3 × 3 μm의) 작은 서클 (3, 4, 5, 500 nm의 직경)의 P 2~5 중 PALM 영상의 분 (프레임 / 10 초). 로컬 PI (4,5) P (2) 프로브의 급격한 강도 변동 주 (3 원, 4, 5)를 넓은 면적 박스 (2)의 매우 작은 변화에 비해. 지정된 시간에 (B)에서 BOX2 영역 (E) 확대 PALM 이미지. 화살표 페이지에서 PI (4,5) P (2) 농축 막 패치를 표시hysiological 조건. 스케일 바 : C : 3 μm의; E : 500 nm의. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
토론
멤브레인 시트 생산 및 샘플 고정 : 문제 해결을 위해이 프로세스는 특별한주의가 필요합니다. 프로토콜에 기재된 바와 같이, 단계 1.1.6의 커버 슬립의 배양 시간은 막 시트 생산을 위해 중요하다. 우리의 실험 조건에서 최적의 배양 시간은 7-10 분 (그림 2)입니다. 10 분 배양 이상은 작거나 PDL 코팅 된 커버에 아무런 멤브레인 시트로 이어질 것 대신 PDL의 커버 슬립 짧은 배양에 막 시트의 손상 세포를 생성합니다. 프로토콜에서 설명한 바와 같이, 고정시 고정 제와 온도는 PM의 PI (4,5) P (2) 분포를 유지하기 위해 중요합니다. RT에서 고정 또는 단독 4 % -PFA의 사용은 PM의 정상 지질 분포를 왜곡 할 수있다.
지질 연구를 막 PALM 현미경을 적용하여, 우리는 (4,5) P (2), m을 매개 키 포스 PI의 나노 미터 크기의 분포를 관찰 할 수있다근본적인 세포 활동. INS-1 세포에서의 제한 농도 구배와 PI (4,5) P (2)이 공간적 분포는 지질 단백질 상호 작용 및 PI 이러한 세포에서 (4,5) P (2) 지역 신호 이벤트를 다시 생각하기위한 프레임 워크를 제공합니다. 더욱이, 본 연구에서 개발 된 방법은 또한 생물학적 과정에서 phosphoinositides을 연구하는 새로운 도구를 제공함으로써, 적절한 프로브 다른 막 인지질 연구에 적용될 수있다.
세제 처리 및 세포질에서 잠재적 인 신호 오염이 작품에 막 시트의 사용은 인지질 형태 학적 연구에서 두 가지 주요 문제를 무시합니다. 세제는 종종 클러스터링 및 오후 인지질 신호의 상당한 손실을 야기한다. 세포질 신호의 오염은 PI (3,4,5) P (3) 및 PI (3,4) P (2)와 PM (23)에 둘러 풍부한 phosphoinositides의 경우에 특히 문제가된다. 멤브레인 시트 샘플은 새로운 Circu 할 수 있습니다그러한 상당히 피질 액틴 그물 세공 및 클라 코팅 피트 42,43 아니라 세포막과 연결된 구조를 방해하지 않고 이러한 문제를 mvent. 된 PM의 PI (4,5) P (2)의 상대적으로 균일 한 분포가 섬유 아세포 성 멤브레인 (44)에 GST-PH PLC δ1의 프로브를 사용하여 다른 빠른 냉동 EM 연구와 잘 일치한다.
이 부적절한 시료 처리 조건이 잘못된 결과를 생성 할 수 있다는 것을 주목하는 것이 중요하다. 첫째, 저온 (4 ℃)에서 고정 단계를 수행하고, 막 시트의 생산을위한 정착액 GA를 사용하는 것이 중요하다. 도 3에 도시 된 바와 같이, GA없는 따뜻한 온도 PFA 고정 셀의 PM phosphoinositides를 해결하기에 충분하지 않다. 이 그대로 PI (4,5) P (2) 분포를 왜곡하고 생리 학적 조건에서 살아있는 세포에서 관찰되지 않는 날카로운 클러스터를 생성 할 수 있습니다. 둘째, PAmCherry1 사용로서SMLM 프로브는, 오히려 다른 프로브보다 양적 PALM 이미징을위한 중요한 것입니다. PAmCherry1 응용 프로그램의 장점은 밝기, 높은 광 활성화 효율성과 무엇보다도, 매우 제한된 사진 - 깜박이는 등의 잘 특성화 단일 분자 광 물리적 특성 35,40,45에서 온다. 이러한 속성은 사진 깜박 잠재적 클러스터 아티팩트를 제거하고 정량적으로 막 PI (4,5) P (2)의 분자 밀도를 분석 할 수있게.
이러한 접근 방식은 또한 한계가있다. 셀 촬상 전에 중단되기 때문에 먼저, 본 연구에 사용 된 멤브레인 시트 법 완전히 PI (4,5) P (2)의 생체 분포를 흉내낼 수있다. 그러나, 우리의 라이브 PALM 영상은 멤브레인 시트 샘플 관찰 결과를 지원하는 PI (4,5) P (2)의 유사 상대적으로 균일 한 분포를 보여줍니다. 우리는 우리의 이전 작업 (23)에 설명 된대로 둘째, SMLM 이미징 전문 지식과 추가로 필요합니다의 장력은 사용 된 프로브, 샘플 준비 및 고정, 이미지 샘플링 및 재구성 등 다양한 공정에서 발생할 수있는 이미지 아티팩트를 방지 할 수 있습니다. 산도 도메인 기반 프로브 및 항체 널리 포스 공부 (46, 47)에 사용되어 왔지만 마지막으로, 상기 멤브레인의 모든 PI (4,5) P (2)는이 방법에 의해 검출 될 수있는 가능성이 남아있다. 예를 들어, 다른 내인성 단백질에 의해 구속 PI (4,5) P (2) PH 프로브 또는 항체에 액세스 할 수 없습니다 수 있으며,이 때문에 자신을 프로브의 공간 방해에 PI (4,5) P (2)의 과소 평가의 원인이 될 수 있습니다. 라벨 PI (4,5) P (2) 다른 방법은 원래의 꼬리에 수정과 정상 플 루어 PI (4,5) P 2 (48), 미리 라벨링 PI (4,5) P (2) 아날로그를 사용하는 것 PI (4,5) P (2). 그 이노시톨 링 endogenou와 동일하기 때문에, 그것은 빠르게 생균 대사에 의하여 다른 포스 아형으로 빠르게 변환 될 수있다님의 PI (4,5) P (2). 이것은 살아있는 세포에서이 미리 라벨링 PI (4,5) P (2) 아날로그 충실 PI (4,5) P (2)보다는 대사 제품을 대표 할 수 있는지 우려를 제기한다. 따라서, 일부 제한에도 불구하고, PH 도메인 기반 프로브 널리 세포의 PM에 PI (4,5) P (2) 분포와 역학을 모니터하기 위해 사용 된 가장 프로브 중 계속된다.
이 방법론의 미래 애플리케이션은 PI (3,4,5) P (3) 및 PI (3,4) P (2)와 같은 다른 포스 연구로 확장 될 수있다. 요약하면, 여기에 사용되는 새로운 SMLM 접근 방식은 세포에서 포스를 연구 할 수있는 새로운 방법을 엽니 다. 예를 들어 PI (4,5) P (2)를 사용하여, 우리는 고유 세포막 분자의 형태 및 정량 연구 PALM 영상의 특성뿐만 아니라, 그 단점을 보여준다. 이 방법은 관심의 다른 분자에 적용 할 수 있으며, 세포 생물학의 다양한 응용 프로그램을 제공합니다.
공개
The authors have nothing to disclose.
감사의 말
This work is supported by the National Institutes of Health (NIH) grants R01DK093953 (X.L.), P30NS069271, BRFSG-2014-07 (X.L.). C.J. is partially supported by American Heart Associate pre-doctoral fellowship (14PRE20380168, to C.J.).
자료
| Name | Company | Catalog Number | Comments |
| Microscope | Nikon | Ti-U | |
| sCMOS camera | Andor | Neo | |
| Spinning disk | Yokogawa | CSU X-1, 10,000 rpm | |
| High Power Monolithic Laser Combiner SP with 405, 488, 561 and 642 nm lasers. | Agilent | MLC400 | laser original powers & powers at the end of optical fiber) 405 nm: 15 mW & 13 mW; 488 nm: 45 mW & 42 mW; 561 nm: 45 mW & 40 mW; 640 nm: 35 mW & 16 mW. |
| 100X Objective | Nikon | APO 100X Oil, NA 1.49, WD 0.12 mm | |
| Nikon acquisition and analysis software (NIS Element) | Nikon | ||
| Matlab | MathWorks | ||
| Coverslip | Warner | 64-0714 | Round 18 mm coverslip, #1.5 |
| Fibronectin | Millipore | FC010-5MG | |
| Lipofectamin 3000 (transfection reagent) | Invitrogen | L3000-008 | |
| Glutaraldehyde | Electron Microscopy Science | #16120 | |
| PI(4,5)P2 1st antibody | Santa Cruz | sc-53412 | |
| secondary antibody F(ab’)2-goat-anti-mouse Alexa Fluor 647 | Invitrogen | A-21237 | |
| Tetraspeck beads | Invitrogen | T7279 | |
| magnetic quick release imaging chamber | Warner Instruments | Cat#641994 | |
| temperature controller | Warner Instruments | TC-344C | |
| Poly-D-Lysine | Sigma | P6407 | |
| Phosphate buffer saline | Sigma | P4417-100TAB | |
| EGTA | Sigma | 3780 | |
| NH4Cl | Sigma | A0171 | |
| Goat serum | Sigma | G9023 | |
| bovine serum albumin | Sigma | A7906 | |
| NaCl | Sigma | S5886 | |
| KCl | Sigma | P5405 | |
| CaCl2•2H2O | Sigma | 223506 | |
| MgCl2•6H2O | Sigma | M9272 | |
| Glucose | Sigma | G7021 | |
| HEPES | Sigma | H4034 | |
| Paraformaldyhyde | Sigma | P6148 |
참고문헌
- Di Paolo, G., De Camilli, P. Phosphoinositides in cell regulation and membrane dynamics. Nature. 443, 651-657 (2006).
- Hammond, G. R. V., et al. PI4P And PI(4,5)P(2) Are Essential But Independent Lipid Determinants Of Membrane Identity. Science. 337, 727-730 (2012).
- Nakatsu, F., et al. PtdIns4P synthesis by PI4KIIIalpha at the plasma membrane and its impact on plasma membrane identity. J Cell Biol. 199, 1003-1016 (2012).
- Cantley, L. C. The phosphoinositide 3-kinase pathway. Science. 296, 1655-1657 (2002).
- Czech, M. P. Dynamics of phosphoinositides in membrane retrieval and insertion. Annu Rev Physiol. 65, 791-815 (2003).
- Spira, F., et al. Patchwork organization of the yeast plasma membrane into numerous coexisting domains. Nat Cell Biol. 14, 640-648 (2012).
- Barg, S., Knowles, M. K., Chen, X., Midorikawa, M., Almers, W. Syntaxin clusters assemble reversibly at sites of secretory granules in live cells. Proc Natl Acad Sci U S A. 107, 20804-20809 (2010).
- Sieber, J. J., et al. Anatomy and dynamics of a supramolecular membrane protein cluster. Science. 317, 1072-1076 (2007).
- Knowles, M. K., et al. Single secretory granules of live cells recruit syntaxin-1 and synaptosomal associated protein 25 (SNAP-25) in large copy numbers. Proc Natl Acad Sci U S A. 107, 20810-20815 (2010).
- Milosevic, I., et al. Plasmalemmal phosphatidylinositol-4,5-bisphosphate level regulates the releasable vesicle pool size in chromaffin cells. J Neurosci. 25, 2557-2565 (2005).
- van Rheenen, J., Jalink, K. Agonist-induced PIP(2) hydrolysis inhibits cortical actin dynamics: regulation at a global but not at a micrometer scale. Mol Biol Cell. 13 (2), 3257-3267 (2002).
- Hammond, G., Schiavo, G., Irvine, R. Immunocytochemical techniques reveal multiple, distinct cellular pools of PtdIns4P and PtdIns (4, 5) P2. Biochem J. 422, 23-35 (2009).
- Huang, S., et al. Phosphatidylinositol-4,5-bisphosphate-rich plasma membrane patches organize active zones of endocytosis and ruffling in cultured adipocytes. Mol Cell Biol. 24, 9102-9123 (2004).
- James, D. J., Khodthong, C., Kowalchyk, J. A., Martin, T. F. Phosphatidylinositol 4,5-bisphosphate regulates SNARE-dependent membrane fusion. J Cell Biol. 182, 355-366 (2008).
- Laux, T., et al. GAP43, MARCKS, CAP23 modulate PI(4,5)P(2) at plasmalemmal rafts, and regulate cell cortex actin dynamics through a common mechanism. J Cell Biol. 149, 1455-1472 (2000).
- Aoyagi, K., et al. The activation of exocytotic sites by the formation of phosphatidylinositol 4,5-bisphosphate microdomains at syntaxin clusters. J Biol Chem. 280, 17346-17352 (2005).
- Kabachinski, G., Yamaga, M., Kielar-Grevstad, D. M., Bruinsma, S., Martin, T. F. CAPS and Munc13 utilize distinct PIP2-linked mechanisms to promote vesicle exocytosis. Mol Biol Cell. 25, 508-521 (2014).
- Wang, J., Richards, D. A. Segregation of PIP2 and PIP3 into distinct nanoscale regions within the plasma membrane. Biol Open. 1, 857-862 (2012).
- Hell, S. W., Wichmann, J. Breaking the diffraction resolution limit by stimulated emission: stimulated-emission-depletion fluorescence microscopy. Opt Lett. 19, 780-782 (1994).
- van den Bogaart, G., et al. Membrane protein sequestering by ionic protein-lipid interactions. Nature. 479, 552-555 (2011).
- van Rheenen, J., Achame, E. M., Janssen, H., Calafat, J., Jalink, K. PIP2 signaling in lipid domains: a critical re-evaluation. Embo J. 24, 1664-1673 (2005).
- Sato, K., et al. Differential requirements for clathrin in receptor-mediated endocytosis and maintenance of synaptic vesicle pools. Proc Natl Acad Sci U S A. 106, 1139-1144 (2009).
- Ji, C., Zhang, Y., Xu, P., Xu, T., Lou, X. Nanoscale Landscape of Phosphoinositides Revealed by Specific Pleckstrin Homology (PH) Domains Using Single-molecule Superresolution Imaging in the Plasma Membrane. J of Biol Chem. 290, 26978-26993 (2015).
- Betzig, E., et al. Imaging intracellular fluorescent proteins at nanometer resolution. Science. 313, 1642-1645 (2006).
- Hess, S. T., Girirajan, T. P., Mason, M. D. Ultra-high resolution imaging by fluorescence photoactivation localization microscopy. Biophys J. 91, 4258-4272 (2006).
- Rust, M. J., Bates, M., Zhuang, X. Sub-diffraction-limit imaging by stochastic optical reconstruction microscopy (STORM). Nat Methods. 3, 793-795 (2006).
- Xu, K., Zhong, G., Zhuang, X. Actin, spectrin, and associated proteins form a periodic cytoskeletal structure in axons. Science. 339, 452-456 (2013).
- Wombacher, R., et al. Live-cell super-resolution imaging with trimethoprim conjugates. Nat Methods. 7, 717-719 (2010).
- Szymborska, A., et al. Nuclear pore scaffold structure analyzed by super-resolution microscopy and particle averaging. Science. 341, 655-658 (2013).
- Pertsinidis, A., et al. Ultrahigh-resolution imaging reveals formation of neuronal SNARE/Munc18 complexes in situ. Proc Natl Acad Sci U S A. 110, 2812-2820 (2013).
- Shim, S. -. H., et al. Super-resolution fluorescence imaging of organelles in live cells with photoswitchable membrane probes. Proc Natl Acad Sci. 109, 13978-13983 (2012).
- Huang, F., et al. Video-rate nanoscopy using sCMOS camera-specific single-molecule localization algorithms. Nat Methods. 10, 653-658 (2013).
- Balla, T., Várnai, P. Visualization of Cellular Phosphoinositide Pools with GFP-Fused Protein-Domains. Curr Protoc Cell Biol. 24, 24 (2009).
- Xu, C., Watras, J., Loew, L. M. Kinetic analysis of receptor-activated phosphoinositide turnover. J Cell Biol. 161, 779-791 (2003).
- Subach, F. V., et al. Photoactivatable mCherry for high-resolution two-color fluorescence microscopy. Nat Methods. 6, 153-159 (2009).
- Filonov, G. S., et al. Bright and stable near infra-red fluorescent protein for in vivo imaging. Nature Biotechnol. 29, 757-761 (2011).
- Zhang, M., et al. Rational design of true monomeric and bright photoactivatable fluorescent proteins. Nat Methods. 9, 727-729 (2012).
- Hohmeier, H. E., et al. Isolation of INS-1-derived cell lines with robust ATP-sensitive K+ channel-dependent and -independent glucose-stimulated insulin secretion. Diabetes. 49, 424-430 (2000).
- Dyachok, O., Isakov, Y., Sågetorp, J., Tengholm, A. Oscillations of cyclic AMP in hormone-stimulated insulin-secreting β-cells. Nature. 439, 349-352 (2006).
- Nan, X., et al. Single-molecule superresolution imaging allows quantitative analysis of RAF multimer formation and signaling. Proc Natl Acad Sci U S A. 110, 18519-18524 (2013).
- Sengupta, P., et al. Probing protein heterogeneity in the plasma membrane using PALM and pair correlation analysis. Nat Methods. 8, 969-975 (2011).
- Morone, N., et al. Three-dimensional reconstruction of the membrane skeleton at the plasma membrane interface by electron tomography. J Cell Biol. 174, 851-862 (2006).
- Peters, K. R., Carley, W. W., Palade, G. E. Endothelial plasmalemmal vesicles have a characteristic striped bipolar surface structure. J Cell Biol. 101, 2233-2238 (1985).
- Fujita, A., Cheng, J., Tauchi-Sato, K., Takenawa, T., Fujimoto, T. A distinct pool of phosphatidylinositol 4,5-bisphosphate in caveolae revealed by a nanoscale labeling technique. Proc Natl Acad Sci U S A. 106, 9256-9261 (2009).
- Durisic, N., Laparra-Cuervo, L., Sandoval-Álvarez, &. #. 1. 9. 3. ;., Borbely, J. S., Lakadamyali, M. Single-molecule evaluation of fluorescent protein photoactivation efficiency using an in vivo nanotemplate. Nat Methods. 11, 156-162 (2014).
- Thomas, C. L., Steel, J., Prestwich, G. D., Schiavo, G. Generation of phosphatidylinositol-specific antibodies and their characterization. Biochem Soc Trans. 27, 648-652 (1999).
- Várnai, P., Balla, T. Live cell imaging of phosphoinositides with expressed inositide binding protein domains. Methods. 46, 167-176 (2008).
- Honigmann, A., et al. Phosphatidylinositol 4,5-bisphosphate clusters act as molecular beacons for vesicle recruitment. Nature Struct Mol Biol. 20, 679-686 (2013).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유