Method Article
新規蛍光プローブと形質膜におけるホスファチジルイノシトール4,5-ビスリン酸の単分子超解像イメージング
要約
PI(4,5)P 2は、様々な細胞機能を調節するが、細胞の原形質膜でのナノスケール組織はあまり理解されています。標識PI(4,5)プレクストリン相同ドメインに融合された二重色蛍光プローブとP 2によって、我々はナノメートルスケールでの原形質膜中のP 2空間分布(4,5)PIを研究するための新規な方法を記載します。
要約
Phosphoinositides in the cell membrane are signaling lipids with multiple cellular functions. Phosphatidylinositol 4,5-bisphosphate (PI(4,5)P2) is a determinant phosphoinositide of the plasma membrane (PM), and it is required to modulate ion channels, actin dynamics, exocytosis, endocytosis, intracellular signaling, and many other cellular processes. However, the spatial organization of PI(4,5)P2 in the PM is controversial, and its nanoscale distribution is poorly understood due to the technical limitations of research approaches. Here by utilizing single molecule localization microscopy and the Pleckstrin Homology (PH) domain based dual color fluorescent probes, we describe a novel method to visualize the nanoscale distribution of PI(4,5)P2 in the PM in fixed membrane sheets as well as live cells.
概要
ホスホイノシチドは、総膜脂質の小部分に寄与するが、様々な細胞プロセスにおいて重要な役割を果たしています。彼らは、 第3のイノシトール環の可逆的リン酸化または脱リン酸化由来7のメンバー、4 番目と5 番目の位置1を含みます。ホスファチジルイノシトール-4-リン酸(PI4P)およびホスファチジルイノシトール4,5-ビスホスフェート(PI(4,5)P 2)は、細胞の原形質膜(PM)2,3の行列脂質のような比較的独立して機能する2つの主要なホスホイノシチドです。ホスファチジルイノシトール(3,4,5)-trisphosphate(PIP 3)はるかに少ない豊富PI4PとPI(4,5)P 2よりもですが、それは癌4や糖尿病5を含む様々な細胞プロセスでユニークな機能を持っています。これらの脂質は、それらのエフェクターおよび多くの他のタンパク質との複雑な分子間相互作用を持っています。したがって、これらのフォーの空間的構成を理解することが重要ですナノメートルスケールでのPMでsphoinositides。
証拠は、閉じ込められたPMの領域におけるタンパク質複合体または分子のクラスタがホットスポット6シグナルとして働くことができることを示しています。例えば、シンタキシン1aと、膜融合7-9を調節する重要なタンパク質は、PMのクラスタ構成を表示します。シンタキシン1aのクラスタ組織の一致した見解とは異なる、PM中のホスホイノシチドの空間分布は、議論の余地があります。 PI(4,5)P 2分布パターンは、使用する細胞の種類および実験方法に依存して、クラスタ14~18を密ために、均一10-12、大きなパッチ13,14の範囲です。より高解像度でのPI(4,5)P 2の空間的な組織も矛盾しています。誘導放出枯渇(STED)顕微鏡19を用いた研究では、PC-12細胞20のPMシートに密なPI多数の(4,5)P 2ナノクラスター(直径〜73 nm)を明らかにしましたアップ。この結果は、急速凍結電子顕微鏡(EM)21,22、化学固定よりもはるかに優れ、生細胞の無傷のPM構造を維持アプローチを用いた研究とは異なります。後者は、PI(4,5)P 2の異なるプールを示しました。比較的濃縮さPI(4,5)カベオラとコーティングされたピット中のP 2と同様にフラットPM領域上に均一に分布。また、膜シートにおけるナノスケールPI(4,5)P 2組織は、ライブおよび固定された細胞では異なる場合があります。私たちの最近の研究は、単一分子の局在顕微鏡(SMLM)23を使用して、両方の固定と暮らすINS-1細胞では、この問題を調査しました。
SMLMは、個々のフルオロフォアを高精度にローカライズすることができるように確率的に任意の時点で蛍光体の小さなサブセットのみをスイッチオンに基づいています。多くの超解像画像化のアプローチは、従来の光学顕微鏡の回折限界を超えるために同様の原理を用いて開発されているようなsの光活性化ローカライゼーション顕微鏡(PALM)24、蛍光光活性化ローカライゼーション顕微鏡(FPALM)25、確率的光学再構成顕微鏡(STORM)26,27と直接STORM(dSTORM)28。フォト切り替え可能または光活性化蛍光団(色素または蛍光タンパク質)で、SMLM技術が生きている細胞31,32にビデオレートでのナノメートルの分解能24,29,30の画像の生物学的構造への科学者を可能にします。
一例として、PI(4,5)P 2を用いて、我々は、PM上のホスホイノシチドのナノスケールの分布を研究するためにSMLMアプローチを導入しました。具体的には、PI(4,5)に結合するPLCδ1(ホスホリパーゼCのδ1)のPHドメインP 2は、PMの撮像PI(4,5)P 2のサブ細胞分布とダイナミクス33,34のための十分に確立されたプローブであります。我々は遺伝的に2蛍光タンパク質、PAmCherry1 35とiRFP 36でこのドメインをタグ付けされていますデュアルカラー融合タンパク質(iRFP-PAmCherry1-PHPLCδ1)( 図1A-B)を製造するためのsup。PAmCherry1はPALM用のPHドメインの光活性化プローブとしての役割を果たし、iRFPはPALM取得する前に、トランスフェクトされた細胞を同定するための一般的な指標となります。我々は、固定膜シートでSMLMイメージングのため、このデュアルカラー蛍光プローブを適用します。ライブPALMイメージングのために、私たちはその優れた光子効率と明るさ( 図1C-D)用にmEOS3.1-PHPLCδ1プローブを生成するために、PHPLCδ1ドメインに代わりPAmCherry1のmEOS3 37のタグ付き。
インスリン分泌INS-1細胞38の PMにおけるこれらの新規プローブとSMLMイメージングは、PI(4,5)PM領域の大部分において、P 2と同様に濃縮されたPI(4,5)P 2の均質な標識を発見しましたまばらフラットPMといくつかの糸状仮足様構造23で混合されるマイクロドメイン。ナPI(4,5)P 2のnoScaleに分布が、それは生きた細胞内で機能する方法を再考するための構造的基盤を提供します。
プロトコル
1.メンブレンシートの準備と固定
- iRFP-PAmCherry1-PH のPLCδ1で標識された膜シートを準備します
- DNAをコードするプラスミドiRFP-PAmCherry1-PH PLCは 、標準的な分子生物学的技術を使用して23を δ1準備します。
- 標準INS-1細胞培養プロトコルに従って50から70までパーセントの密集度に30 / mlのフィブロネクチン38,39でプレコーティング#1.5 18ミリメートルラウンドのカバースリップ上の培養INS-1細胞。 50〜70%の集密度に達した後、細胞を一日にトランスフェクト。
- 製造者のプロトコルに従ってリポソームトランスフェクション試薬を使用してδ1iRFP-PAmCherry1-PH PLCで細胞をトランスフェクトします。トランスフェクション後、細胞を48時間成長させます。
- 実験の日に、〜0.5とコートカバースリップ(1-側) - 500 / mlのポリ-D-リジンの1ミリリットル、1〜2時間(PDLは、DH 2 Oで希釈します)。その後にティッシュペーパーを配置することによって、PDLドレインカバーガラスの縁。後で使用するために予備冷却(4℃)金属板にカバースリップを置きます。
- 1mMのEGTAを含有する1 mlの氷冷リン酸緩衝生理食塩水(PBS) - 事前トランスフェクトINS-1細胞は、〜0.5でカバーガラス上で成長洗います。洗浄を3回繰り返し、PBSを排出。
- ピンセットであらかじめ冷却金属板上のPDLコートしたカバーガラス上で培養した細胞(下を向いセル側)にカバースリップを置きます。細胞はPDLコートしたカバースリップ( 図2)にアタッチできるようにするために10分- 7冷蔵庫(4℃)でプレートを残します。
注: - PDLでコーティングされた表面への細胞のより良好な付着のために10分のインキュベーション時間は、7の範囲であるべきです。冷蔵庫の環境が乾燥しているとのインキュベーションが長すぎてはなりません。 - 冷蔵庫から金属プレートを取り外します。静かにピンセットを使用して、事前にトランスフェクトした細胞を含むカバースリップを剥がします。これは、上の細胞膜シートの薄い層を生成しますPDLコートしたカバースリップ。穏やか〜0.5で膜シート洗浄1 - mlの氷冷PBSを、次いで〜0.5で固定 - 4℃で15分間、PBS中の1 mlの氷冷4%パラホルムアルデヒド(PFA)+ 0.2%グルタルアルデヒド(GA)。
注意:パラホルムアルデヒドおよびグルタルアルデヒドは毒性があります。皮膚や眼の保護とヒュームフードでそれらを扱います。 - 固定後、画像膜シートはすぐに(セクション3を参照)、または〜0.5で保存する - 4℃で1 mlのPBSを。
注:メンブレンシートを固定した後、細胞質ゾルからのPI(4,5)P 2にPHプローブの結合は全く均衡は存在しません。 (それは数日から数週間かかるかもしれませんが)に結合したPHプローブは徐々に膜シートから解離し、溶液中に拡散します。したがって、それは右の試料調製後の画像に固定されたサンプルをお勧めします。
- PI(4,5)P 2特異的抗体標識に膜シートを準備
- #1.5上での培養INS-1細胞、30&でプレコーティング18ミリメートルラウンドカバースリップ#181; 50%-70%のコンフルエンスまでグラム/ mlのフィブロネクチン。ステップ1.1.3で説明したようにDNAによるトランスフェクト細胞は翌日プラスミド。
- 上記のように1.1.4から1.1.7までの手順を繰り返します。
注:4°Cで次の手順を実行します。 - 50mMのNH 4 Cl を含有1ミリリットルの氷冷PBS - 〜0.5で固定PMシートを含むカバースリップを3回洗浄します。 〜0.5でシートをクエンチ- 7分間、PBS中の1ミリリットルの0.1%の水素化ホウ素ナトリウム、および〜0.5で洗浄- (50mMのNH 4 Cl をせずに)1ミリリットルPBS。
- ブロッキング溶液1 mlの45分間(5%(v / v)の正常ヤギ血清、5%(v / v)のウシ血清アルブミンおよび50mMのNH 4 Cl を含有PBS溶液) - 〜0.5を有する試料をブロックします。 1時間ブロッキング溶液中で:(300倍希釈)1ミリリットルのプライマリPI(4,5)P 2抗体-そして、〜0.5でインキュベートします。 50mMのNH 4 Cl を含有1mlのPBS - 〜0.5で3回(10分毎に)洗浄します。
- 1ミリリットル二のF(ab ')2ヤギ抗マウス - 〜0.5でサンプルをインキュベート1時間ブロッキングバッファー中:蛍光団(300 1)とコンジュゲートした抗体。 1mlのPBS - 〜0.5で3回洗浄します。
- ポストフィックスサンプルを4%PFA + 0.2%GAで15分間、その後PBS(7分毎に)で試料を3回洗浄します。イメージングのために、セクション3に進んで以降の使用のために4℃で〜0.5〜1mlのPBSを中に格納します。
注:4°Cでサンプルを準備します。 PM中のホスホイノシチドの生理的な分布を維持するために、4%PFA + 0.2%GAの固定剤を使用してください。一人で4%PFAを用いたRTの準備または固定は重要な成果物( 図4)を引き起こす可能性があります。
mEOS3.1-PH PLCδ1とのライブセルイメージング用2.細胞培養の準備
- 以前23記載されているようmEOS3.1-PH のPLCδ1 をコードするDNAプラスミドを準備します。
- 30 / mlのフィブロネクチンでプレコート#1.5 18ミリメートルラウンドカバースリップ上で培養INS-1細胞を、彼らは50%-70%のconflに達するまで標準INS-1細胞培養プロトコル38,39次uency。
- 次の日は、製造者のプロトコルに従って、リポソームトランスフェクション試薬を用いてmEOS3.1-PH PLCδ1DNAプラスミドとINS-1細胞をトランスフェクション。撮影前に48時間インキュベートします。
メンブレンシートと生細胞の3 PALM画像取得
- 膜シートのPALM画像取得
注記:ここでは、全内部反射蛍光(TIRF)顕微鏡ベースSMLMシステム(100X油、APO、NA = 1.49、WD 0.12 mm)を23全ての画像取得のために使用されます。- 撮影前に、10mlのPBS + 50のMgCl 2に蛍光ビーズ溶液1μlを希釈。 10分間(ステップ1.1.8 / 1.2.6から)細胞試料を含む画像化チャンバへの溶液を希釈した200μlのを追加します。その後、PBSで3回洗浄します。
- PALMイメージングシステムを起動します。関連するイメージングソフトウェアでは、「iRFPチャンネルを選択"ボタン(642 nmのレーザー励起、75分の700 nmの発光)。 iRFPチャネルでPHプローブを発現する細胞膜を検索します。
注:メンブレンシートは、近くの蛍光ビーズを持っている必要があります。これは、後にドリフト補正のために必要とされます。 - 将来の画像再構成のための基準としてiRFPチャネルにおける細胞膜の従来のTIRF画像を収集するために、「取得」ボタンを使用します。イメージングの設定TIRF角度に2140を入力して( すなわち 、臨界角に達した後、さらに1.5度回転)、通常の全反射角を設定します。特に断りのない限り、すべてのステップの設定この角度を使用してください。
注:ここで説明するTIRFシステムにおいて、3500は最大垂直角度であり、2200はTIRF臨界角であり、2140年はTIRF臨界角後より1.5度である通常のTIRF角、です。 3.2.3で下記の狭いTIRF角がTIRF臨界角に達した後に、別の2度である、2120年です。 - 目をクリックしてPAmCherry1チャンネルに切り替え電子RFPのチャンネルボタン(561 nm励起、50分の600 nmの発光フィルター)。背景膜蛍光を漂白するために10から20秒間、561 nmレーザーのフルパワー照明を持つように右に「AOTF」パッド内のすべての方法を、スクロールバーを調整します。
- 「フォーマット」タブと「ND系列の取得」タブの高速取得プロトコルに最適なカメラの設定(2×2ビニング)を設定します(通常は20 Hzで10,000-40,000画像)。
- 「今すぐ実行」ボタンをクリックして - 低レベル(1%、0.1%)で同時405 nmのレーザー活性化とPAmCherry1画像(フルパワーで561 nmレーザー、50ミリ秒/フレーム)の取得を開始します。各フレーム内の空間的に分離された個々の点ように405 nmのレーザーの強度を調整し、容易に識別可能です。
注:活性化PAmCherry1分子の数は、取得中に徐々に減少します。 405 nmのレーザー強度は徐々にそれぞれの個々の分子信号の最適な濃度を維持するために増加されるべきですフレーム。 - 何PAmCherry1単一分子信号が活性化されなくなるまで画像を取得続けます。
- 生きた細胞中のPALMイメージング
- ステップ3.1.1で説明したように、撮像前に、10分間の撮像チャンバ内に蛍光ビーズを希釈します。そして、関連したイメージングソフトウェアを開いてPALM撮影を開始します。
注:生細胞イメージングのための磁気クイックリリース撮像チャンバを使用します。細胞外バッファー(細胞外溶液と一定灌流下の温度コントローラーを35℃での撮像領域の中心を維持:135のNaCl、5.6のKCl、2.6 mMのCaCl 2を、1.2のMgCl 2、3 mMグルコース、および20mM HEPES; pH値= 7.3)。 - GFPのチャンネルボタン(50分の525 nmの発光)を選択します。 488nmのレーザー励起下mEOS3からの緑色蛍光に基づいて蛍光プローブを発現する細胞膜を特定します。これはオフラインDRIのために、後に必要とされるような蛍光ビーズが近くの撮像中にも含まれていることを確認しますフィート補正。
- 参照画像としてmEOS3(緑)チャネルにおける細胞膜のTIRF画像を収集するために、「取得」ボタンをクリックします。ライブセルイメージングの設定TIRF角度に2120を入力して(臨界角に達した後、別の2度回転)浅いエバネッセント波励起照明を使用してください。
注:これは、原形質膜に隣接する細胞質ゾル中の非結合mEos3-PHからの蛍光を最小限に抑えることができます。 - 「RFPチャネル」ボタン(561 nm励起、50分の600 nmの発光)に切り替えます。 (3.1.4を参照)、「AOTFパッド」で、スクロールバーを持つ10〜20秒間膜シートのバックグラウンド蛍光を漂白するためにフルパワー561 nmのレーザーを使用してください。
- 同時405 nmのレーザー活性化(「カメラ」設定タブで10ミリ秒/フレームに設定さ561 nmのフルパワー、)赤チャンネルで「今すぐ実行」ボタンをクリックすることで、画像取得を開始します。空間的に分離されたポイントを有効にするには405 nmのレーザー強度を調整します各フレームインチ
注:買収が進行し、未変換mEOS3.1-PH PLCδ1として分子の数は緩やかに減少します。徐々に単一分子信号を最適化するために、405nmのレーザパワーを増大させます。画像取得の長さは、実験の目的によって異なります。通常の条件下で5分間連続して画像を取得します。より長い取得が必要な場合、代わりに単一の大きな画像スタックの複数の画像スタックを収集します。各画像スタックのファイルサイズが4ギガバイトを超えてはならないか、それは以降のソフトウェアの分析に影響を与えます。
- ステップ3.1.1で説明したように、撮像前に、10分間の撮像チャンバ内に蛍光ビーズを希釈します。そして、関連したイメージングソフトウェアを開いてPALM撮影を開始します。
4. SMLM画像処理と復興
- イメージ分析ステーションに画像ファイル(.TIF画像スタック)を転送します。前述のように37 MATLABで画像再構成プログラム(カスタム書かれた)を起動し、その後、その後、「新しいファイル」「開く」、メインメニューの「ファイル」タブをクリックすることで、画像スタックをロードします。
- 特定し、ロカ各フレームから個々の分子のイベントを平安大町。 「ウェーブレット」のしきい値数(1-10)で強度閾値をフィルタリング設定します。視覚的に再構築する前に、ポイント検出のための最適なパラメータ設定を確認します。そして、「PALM」タブに移動し、画像再構成を開始するには、「1段階プロセス」をクリックします。
注:ポイント検出のための強度閾値は任意であり、個人的な経験に依存します。いくつかの試験はどちらがあまりにも多くの修飾されていない(dim)はポイントをピックアップすることも、あまりにも多くの修飾(明)ポイントをフィルタリングすることを最適な検出閾値を生成するために必要とすることができます。データ分析を最適化するために他のパラメータを調整します。ここでは、近傍距離(結合された距離内で隣接するフレーム内の蛍光点)が65 nmの(1/2ピクセル幅)として設定し、単一分子として装着されています。ギャップフレーム(これらのフレームと近傍距離内で発生した個々の分子のイベントは、単一分子イベントとして組み合わされ、適合させた)であり、PAmCherry1画像40用の26フレーム(1.3秒)として設定します。 SMLMで40を数えるオーバーを避けるために単一分子プローブ及び取得レートの特性に応じてこれらのパラメータを調整します。再建中の蛍光ビーズでドリフト補正を適用します。- iRFP-PAmCherry1-PH のPLCδ1によって標識固定膜シートを画像化するために、シングル超解像37に同じ膜シートから全体画像スタックを再構築します。
- 1000個の連続フレームスタックはの時間分解能を有する単一の超解像画像として再構築されるようにmEOS3.1-PH のPLCδ1によって標識された生細胞のサンプルについて1000フレームのいくつかの小さなスタックに画像全体のスタックを分離します10秒。最後に、最終的な時系列スタック23内のすべての時系列画像を組み合わせます。
注:生細胞PALMイメージングでは、活性化プローブの数が少ない移動または解離することができます漂白前のPMにおけるPI(4,5)P 2から。プローブのオーバーサンプリングを説明するために、画像解析時に単一の発光イベントに(代わりに65nmの)130nmの範囲内の隣接フレーム内の個々の分子の信号を合成します。
- 再構成画像を取得した後、ペア相関41を有する分子密度、マイクロドメインの密度/サイズ、およびクラスタ分析を定量化するためのMatlabでカスタム作成のプログラムとのさらなる画像分析を行います。
結果
当社の超解像システムのローカライズの不確実性(σ)は14.73 nmの23です。 TIRFとPALM画像間の直接の比較は、空間分解能の大幅な改善を示した。 図3A-Bは、PI(4,5)P 2抗体とiRFP-PAmCherry1-PH PLCで標識された代表的なPI(4,5)P 2 TIRF画像を示します典型的な膜シートと生細胞中δ1。膜シートにおける従来のTIRF顕微鏡の画像は、PHドメインを(EGFP-PHPLCδ1)( 図3C)を強化緑色蛍光タンパク質(EGFP)で標識された無傷の生細胞のものと著しく類似タグ付けされています。全ての試料は、プローブの均一な分布を示しました。対照的に、サンプルの非最適な固定が鋭い密PI(4,5)P 2のクラスタと、信号強度の減少( 図4)を生じました。最適な定着条件の下で、T固定した細胞( 図5)におけるPI(4,5)P 2の彼の超解像画像が限られた濃度勾配でPMの大部分におけるプローブの均一な分布を明らかにしました。 PI(4,5)P 2のプローブで強化されたいくつかの膜パッチがまばらに分布し、様々なサイズを有していました。ライブセルPALMイメージが固定された細胞( 図6)と同様の空間分布を表示します。幅広い分野での豊富さの大幅な変更を加えることなく、PI(4,5)P地方における高速ダイナミクスにおける時間の結果の上に2つの信号の詳細な分析、。
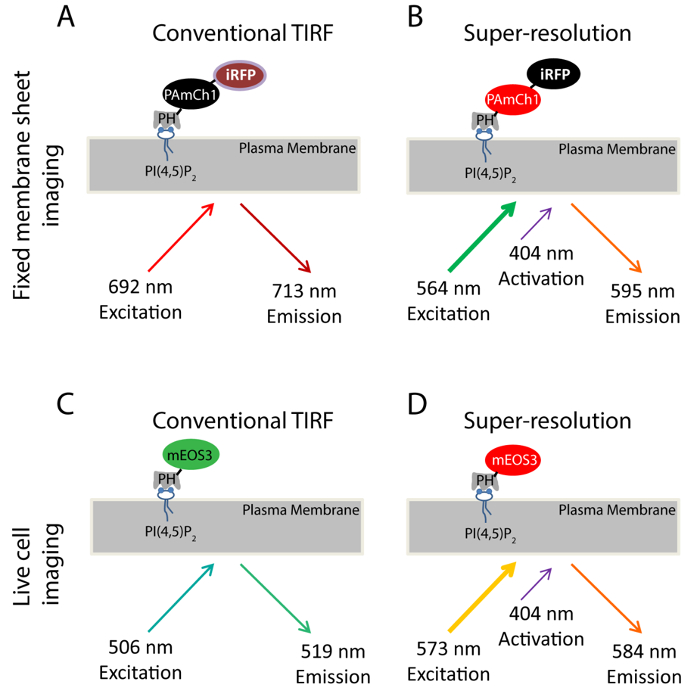
本研究で用いた蛍光プローブについては、図1のスキーム。固定膜シートの実験で使用した(AB)iRFP-PAmCherry1-PH PLCδ1プローブ。従来のTIRFイメージング(A)、640nmの間にレーザーはiRFP励起するために使用されます(例:692 nmのを、エム:713 nm)を。この状態で撮影TIRF画像はPALM画像(B)によって得られた超解像画像化のためにTIRF基準画像として機能します。 PALMイメージングのために:;:(595 nmのエム564 nmの例)405 nmのレーザーは、光活性化するPAmCherry1蛍光団と561 nmのレーザーをPAmCherry1を励起するために使用されるために使用されます。生細胞実験に使用した(CD)mEos3.1-PHのPLCδ1プローブ 。 (:、:519 nmのエム506 nmの例)従来のTIRF撮像中(C)は 、488nmレーザーをmEOS3.1を励起するために使用されます。 405nmのレーザーによる光変換した後、(D)、mEos3.1は赤の形に変わります(例:573 nmの;エム:584 nm)を。と561 nmのレーザーをPALMの買収のために使用されているの拡大版をご覧になるにはこちらをクリックしてください。この図。
S / ftp_upload / 54466 / 54466fig2.jpg "/>
INS-1細胞からの膜シート製剤については、図2のスキーム。(A)PDLコートしたカバーガラス上に下向きに培養細胞を用いたカバーガラスを配置し、PDL-への細胞接着を可能にするために4℃で7〜10分待ちますコーティングされたカバースリップ。 (B)ピンセットでトップカバースリップをはがしおよびPDL予備被覆したカバーガラスに付着した膜シートを固定します。 (C)画像TIRFMとPALMのサンプル。 この図の拡大版をご覧になるにはこちらをクリックしてください。
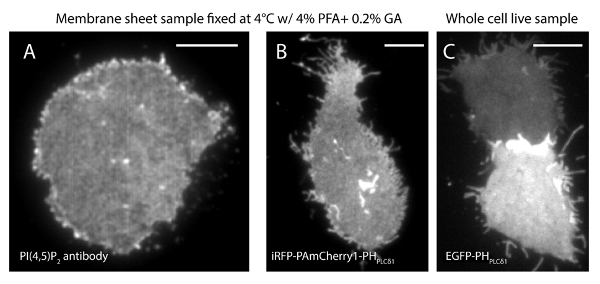
図3. PI(4,5)P 2 の空間組織は、従来のTIRF顕微鏡下での膜シートと無傷の生細胞との間で同様である。(A)A膜シートの典型的なTIRF画像は、4%PFAおよび0.2%のGAを用いて4℃で固定しました。 PI(4,5)P 2を PI(4,5)P 2に特異的な抗体で標識しました。 (B)iRFP-PAmCherry1-PH のPLCδ1 を発現している INS-1細胞からの膜シート。 (C)異なるレベルでEGFP-PHPLCδ1を表す2無傷の生細胞のTIRFイメージ。スケールバー:(A):3ミクロン; (B)及び(C):5μmで、この図の拡大版をご覧になるにはこちらをクリックしてください。
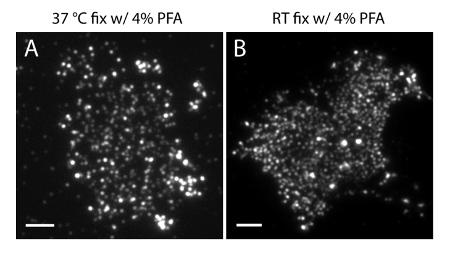
図4 PI膜シート2の空間的組織は、共通の固定条件に敏感である(4,5)P(A)膜シートは、単独で、4%PFAで37℃に固定しそして、( 図3Aにおけるように)、PI(4,5)P 2に特異的な抗体で標識されました。 (B)メンブレンシートは、単独で、PFAで室温で固定し、PI(4,5)P 2に特異的な抗体で標識されました。 PI(4,5)P 2のプローブの密なクラスタは、図3(a)に示すはるかにでも蛍光イメージとは対照的に、TIRF顕微鏡で明瞭に見えることに注意してください。スケールバー:AB:3ミクロン、この図の拡大版をご覧になるにはこちらをクリックしてください。
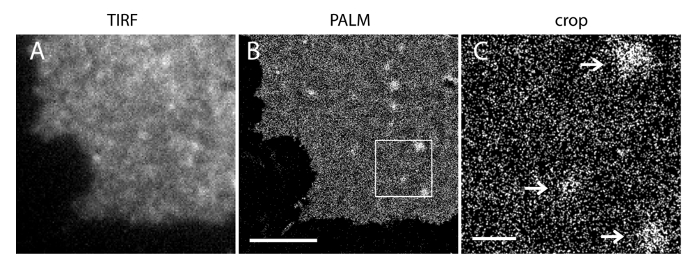
PIの図5. PALMイメージング(4,5)P 2のプローブは、INS-1細胞PMでのナノメートルスケールの分布を明らかにした。INS-1細胞由来の膜シートの(A)iRFP TIRFイメージiRFP-PAmCherry1-PHを表現PLCδ1。(B)PAmCherry1の信号再構成に基づいて、同じ領域におけるPMのPALM画像を対応します。主要なPM領域およびいくつかのPI(4,5)P 2マイクロドメインにおける均質PI(4,5)P 2空間分布を注意してください。 (C)(B)中の四角で囲まれた領域の拡大図。矢印は、PI(4,5)P 2のプローブで富化まばらPMマイクロドメインを示しています。スケールバー:AとB:3ミクロン; C:500 nmの。 この図の拡大版をご覧になるにはこちらをクリックしてください。
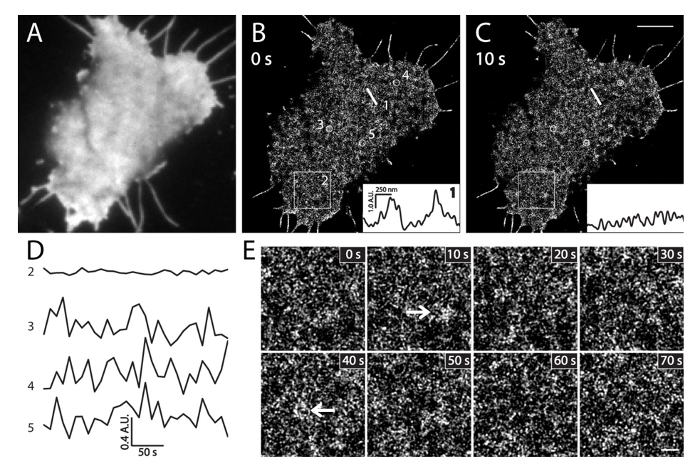
ライブINS-1細胞における図6 PALMイメージング。(A)mEos3.1-PH PLCを表現するライブINS-1細胞におけるPI(4,5)P 2のTIRF画像δ1。イメージは急速にPALM取得(35°C)の前に緑のチャンネルで取得しました。 (B)10秒間隔で連続生細胞PALM画像。挿入図は、同一直線1(B)中の異なる時点での位置及び(C)に沿って局所PI(4,5)P 2濃度の強度プロファイルを示します。 10秒以内にそれらの大きな局所的な強度の変化に注意してください。 (D)PIの平均強度変化の時間経過(4,5)、(B)に大きな面積(BOX2、3×3ミクロン)及び小円(3、4、5、500 nmの直径)でP 2 5時PALM画像(フレーム/ 10秒)の分。広いエリア(ボックス2)の非常に小さい変化に比べてローカルPI(4,5)P 2のプローブ(丸3、4および5)の急速な強度変動に注意してください。示された時間での(B)におけるBOX2領域の(E)拡大PALM画像。矢印は、pの下で、PI(4,5)P 2に富む膜パッチを示していますhysiological条件。スケールバー:C:3ミクロン; E:500 nmの。 この図の拡大版をご覧になるにはこちらをクリックしてください。
ディスカッション
メンブレンシートの製造およびサンプル固定:トラブルシューティングについては、2つのプロセスが余分な注意が必要です。プロトコールに記載されるように、ステップ1.1.6でカバースリップのインキュベーション時間は、膜シートの製造のために重要です。我々の実験条件の下での最適なインキュベーション時間は7-10分( 図2)です。より長い10分のインキュベーションではなく、PDLのカバースリップ上の膜シートの無傷の細胞を生成し、より短いインキュベーションは、PDLでコーティングされたカバースリップ上の少ない、あるいは全く膜シートにつながります。プロトコールに記載されるように、固定時の固定剤及び温度は、PMにおけるPI(4,5)P 2分布を維持するために重要です。 RT単独4%-PFAの使用での固定は、PMにおける通常の脂質分布を歪める可能性があります。
脂質研究を膜にPALM顕微鏡を適用することにより、我々は、(4,5)P 2、メートルを媒介する主要なホスホイノシチドPIのナノメートルスケールの分布を観察することができますいずれかの基本的な細胞活動。 INS-1細胞中の限定された濃度勾配を持つPIのこの空間分布(4,5)P 2は、脂質-タンパク質相互作用およびこれらの細胞におけるPI(4,5)P 2のローカルシグナル伝達事象を再考するためのフレームワークを提供します。また、この研究で開発された方法はまた、生物学的プロセスでホスホイノシチドを研究するための新規なツールを提供し、それによって、適切なプローブを用いて他の膜リン脂質の研究に適用することができます。
界面活性剤処理および細胞質ゾルからの電位信号汚染:この作品での膜シートの使用は、リン脂質の形態学的研究における二つの主要な懸念をバイパスします。界面活性剤は、多くの場合、クラスタリングやPMのリン脂質信号の重大な損失を引き起こします。細胞質ゾル信号の汚染は、PI(3,4,5)P 3およびPI(3,4)P 2としてPM 23上に少量のホスホイノシチドの場合に特に問題です。メンブレンシートのサンプルはcircuすることができます大幅にこのような皮質アクチン網目構造とクラスリン被覆ピット42,43として、原形質膜に関連付けられている構造を、中断することなく、これらの問題をmvent。 PMにおけるPI(4,5)P 2の相対的な均一な分布は、線維芽細胞膜44にGST-PH のPLCδ1 プローブを使用して他の急速冷凍のEM研究とよく一致しています。
不適切な試料処理条件が誤った結果を生成することができることに注意することは重要です。まず、より低い温度(4℃)で固定手順を実行し、メンブレンシートの製造のための固定GAを使用することが重要です。 図3に示すように 、GAのない暖かい温度とPFAの固定は、細胞PMでホスホイノシチドを固定するのに十分ではありません。これは、無傷のPI(4,5)P 2分布を歪曲し、生理学的条件下で生細胞で観察されていないシャープなクラスタを生成することができます。第二に、PAmCherry1の使用などSMLMプローブは、むしろ他のプローブよりも、定量的なPALMイメージングのための極めて重要です。 PAmCherry1アプリケーションの利点は、輝度、高光活性化効率とすべてのほとんどの、非常に限られた写真は、点滅などのよく特徴付けられた単一の分子の光物理的特性35,40,45、から来ています。これらの特性は、光の点滅から潜在的なクラスタ・アーチファクトを排除し、定量的に膜PI(4,5)P 2の分子密度を分析することが可能となります。
このアプローチは、その限界を有します。セルが撮影前に破壊されるので、まず、本研究で用いたメンブレンシート法は、完全にPI(4,5)P 2の生理的分布を模倣しないことがあります。しかし、私たちの生PALM画像は、メンブレンシート試料で観察された結果を支持し、PI(4,5)P 2の同様の比較的均一な分布を示しています。我々は以前の研究23で説明したように、第2、SMLMは、イメージングの専門知識とに余分が必要です使用されるプローブ、試料調製及び固定、画像サンプリングおよび再構築などの異なるプロセスから生じる可能性のあるイメージング・アーチファクトを回避するためのテンション。最後に、PHドメインベースのプローブおよび抗体が広く46,47ホスホイノシチド研究で使用されてきたけれども、それは、膜内の全てPI(4,5)P 2は、このアプローチによって検出することができる可能性のままです。例えば、他の内因性タンパク質によって結合されたPI(4,5)P 2は、pHプローブまたは抗体にアクセスできない可能性があり、これが原因で、それ自体をプローブの空間障害にPI(4,5)P 2の過小評価を引き起こす可能性があります。ラベリングPI(4,5)P 2の別の方法は、元の尾部に修正を加えてトップフルーアPI(4,5)P 2 48、予め標識PI(4,5)P 2アナログを使用することになりますPI(4,5)P 2。そのイノシトール環がendogenouと同じであるので、それは速い生細胞の代謝によって他のホスホイノシチドサブタイプに迅速に変換することができますSのPI(4,5)P 2。これは、生細胞におけるこの前標識PI(4,5)P 2アナログを忠実にPI(4,5)P 2よりもむしろその代謝産物を表すことができるかどうか懸念を提起します。したがって、いくつかの制限にもかかわらず、PHドメインベースのプローブは、広く細胞のPMにPI(4,5)P 2分布とダイナミクスを監視するために使用されてきた最高のプローブの間ではまだです。
この方法の将来のアプリケーションは、PI(3,4,5)P 3およびPI(3,4)P 2のような他のホスホイノシチド研究、に拡張することができます。要約すると、ここで使用される新規SMLMアプローチは、細胞中のホスホイノシチドを研究する新しい方法を開きます。一例として、PI(4,5)P 2を用いて、固有の細胞膜分子の形態学的および定量的な研究でPALM画像の性質、ならびにその欠点を示します。このアプローチは、関心の他の分子に適応することができ、細胞生物学における広い用途を有するであろう。
開示事項
The authors have nothing to disclose.
謝辞
This work is supported by the National Institutes of Health (NIH) grants R01DK093953 (X.L.), P30NS069271, BRFSG-2014-07 (X.L.). C.J. is partially supported by American Heart Associate pre-doctoral fellowship (14PRE20380168, to C.J.).
資料
| Name | Company | Catalog Number | Comments |
| Microscope | Nikon | Ti-U | |
| sCMOS camera | Andor | Neo | |
| Spinning disk | Yokogawa | CSU X-1, 10,000 rpm | |
| High Power Monolithic Laser Combiner SP with 405, 488, 561 and 642 nm lasers. | Agilent | MLC400 | laser original powers & powers at the end of optical fiber) 405 nm: 15 mW & 13 mW; 488 nm: 45 mW & 42 mW; 561 nm: 45 mW & 40 mW; 640 nm: 35 mW & 16 mW. |
| 100X Objective | Nikon | APO 100X Oil, NA 1.49, WD 0.12 mm | |
| Nikon acquisition and analysis software (NIS Element) | Nikon | ||
| Matlab | MathWorks | ||
| Coverslip | Warner | 64-0714 | Round 18 mm coverslip, #1.5 |
| Fibronectin | Millipore | FC010-5MG | |
| Lipofectamin 3000 (transfection reagent) | Invitrogen | L3000-008 | |
| Glutaraldehyde | Electron Microscopy Science | #16120 | |
| PI(4,5)P2 1st antibody | Santa Cruz | sc-53412 | |
| secondary antibody F(ab’)2-goat-anti-mouse Alexa Fluor 647 | Invitrogen | A-21237 | |
| Tetraspeck beads | Invitrogen | T7279 | |
| magnetic quick release imaging chamber | Warner Instruments | Cat#641994 | |
| temperature controller | Warner Instruments | TC-344C | |
| Poly-D-Lysine | Sigma | P6407 | |
| Phosphate buffer saline | Sigma | P4417-100TAB | |
| EGTA | Sigma | 3780 | |
| NH4Cl | Sigma | A0171 | |
| Goat serum | Sigma | G9023 | |
| bovine serum albumin | Sigma | A7906 | |
| NaCl | Sigma | S5886 | |
| KCl | Sigma | P5405 | |
| CaCl2•2H2O | Sigma | 223506 | |
| MgCl2•6H2O | Sigma | M9272 | |
| Glucose | Sigma | G7021 | |
| HEPES | Sigma | H4034 | |
| Paraformaldyhyde | Sigma | P6148 |
参考文献
- Di Paolo, G., De Camilli, P. Phosphoinositides in cell regulation and membrane dynamics. Nature. 443, 651-657 (2006).
- Hammond, G. R. V., et al. PI4P And PI(4,5)P(2) Are Essential But Independent Lipid Determinants Of Membrane Identity. Science. 337, 727-730 (2012).
- Nakatsu, F., et al. PtdIns4P synthesis by PI4KIIIalpha at the plasma membrane and its impact on plasma membrane identity. J Cell Biol. 199, 1003-1016 (2012).
- Cantley, L. C. The phosphoinositide 3-kinase pathway. Science. 296, 1655-1657 (2002).
- Czech, M. P. Dynamics of phosphoinositides in membrane retrieval and insertion. Annu Rev Physiol. 65, 791-815 (2003).
- Spira, F., et al. Patchwork organization of the yeast plasma membrane into numerous coexisting domains. Nat Cell Biol. 14, 640-648 (2012).
- Barg, S., Knowles, M. K., Chen, X., Midorikawa, M., Almers, W. Syntaxin clusters assemble reversibly at sites of secretory granules in live cells. Proc Natl Acad Sci U S A. 107, 20804-20809 (2010).
- Sieber, J. J., et al. Anatomy and dynamics of a supramolecular membrane protein cluster. Science. 317, 1072-1076 (2007).
- Knowles, M. K., et al. Single secretory granules of live cells recruit syntaxin-1 and synaptosomal associated protein 25 (SNAP-25) in large copy numbers. Proc Natl Acad Sci U S A. 107, 20810-20815 (2010).
- Milosevic, I., et al. Plasmalemmal phosphatidylinositol-4,5-bisphosphate level regulates the releasable vesicle pool size in chromaffin cells. J Neurosci. 25, 2557-2565 (2005).
- van Rheenen, J., Jalink, K. Agonist-induced PIP(2) hydrolysis inhibits cortical actin dynamics: regulation at a global but not at a micrometer scale. Mol Biol Cell. 13 (2), 3257-3267 (2002).
- Hammond, G., Schiavo, G., Irvine, R. Immunocytochemical techniques reveal multiple, distinct cellular pools of PtdIns4P and PtdIns (4, 5) P2. Biochem J. 422, 23-35 (2009).
- Huang, S., et al. Phosphatidylinositol-4,5-bisphosphate-rich plasma membrane patches organize active zones of endocytosis and ruffling in cultured adipocytes. Mol Cell Biol. 24, 9102-9123 (2004).
- James, D. J., Khodthong, C., Kowalchyk, J. A., Martin, T. F. Phosphatidylinositol 4,5-bisphosphate regulates SNARE-dependent membrane fusion. J Cell Biol. 182, 355-366 (2008).
- Laux, T., et al. GAP43, MARCKS, CAP23 modulate PI(4,5)P(2) at plasmalemmal rafts, and regulate cell cortex actin dynamics through a common mechanism. J Cell Biol. 149, 1455-1472 (2000).
- Aoyagi, K., et al. The activation of exocytotic sites by the formation of phosphatidylinositol 4,5-bisphosphate microdomains at syntaxin clusters. J Biol Chem. 280, 17346-17352 (2005).
- Kabachinski, G., Yamaga, M., Kielar-Grevstad, D. M., Bruinsma, S., Martin, T. F. CAPS and Munc13 utilize distinct PIP2-linked mechanisms to promote vesicle exocytosis. Mol Biol Cell. 25, 508-521 (2014).
- Wang, J., Richards, D. A. Segregation of PIP2 and PIP3 into distinct nanoscale regions within the plasma membrane. Biol Open. 1, 857-862 (2012).
- Hell, S. W., Wichmann, J. Breaking the diffraction resolution limit by stimulated emission: stimulated-emission-depletion fluorescence microscopy. Opt Lett. 19, 780-782 (1994).
- van den Bogaart, G., et al. Membrane protein sequestering by ionic protein-lipid interactions. Nature. 479, 552-555 (2011).
- van Rheenen, J., Achame, E. M., Janssen, H., Calafat, J., Jalink, K. PIP2 signaling in lipid domains: a critical re-evaluation. Embo J. 24, 1664-1673 (2005).
- Sato, K., et al. Differential requirements for clathrin in receptor-mediated endocytosis and maintenance of synaptic vesicle pools. Proc Natl Acad Sci U S A. 106, 1139-1144 (2009).
- Ji, C., Zhang, Y., Xu, P., Xu, T., Lou, X. Nanoscale Landscape of Phosphoinositides Revealed by Specific Pleckstrin Homology (PH) Domains Using Single-molecule Superresolution Imaging in the Plasma Membrane. J of Biol Chem. 290, 26978-26993 (2015).
- Betzig, E., et al. Imaging intracellular fluorescent proteins at nanometer resolution. Science. 313, 1642-1645 (2006).
- Hess, S. T., Girirajan, T. P., Mason, M. D. Ultra-high resolution imaging by fluorescence photoactivation localization microscopy. Biophys J. 91, 4258-4272 (2006).
- Rust, M. J., Bates, M., Zhuang, X. Sub-diffraction-limit imaging by stochastic optical reconstruction microscopy (STORM). Nat Methods. 3, 793-795 (2006).
- Xu, K., Zhong, G., Zhuang, X. Actin, spectrin, and associated proteins form a periodic cytoskeletal structure in axons. Science. 339, 452-456 (2013).
- Wombacher, R., et al. Live-cell super-resolution imaging with trimethoprim conjugates. Nat Methods. 7, 717-719 (2010).
- Szymborska, A., et al. Nuclear pore scaffold structure analyzed by super-resolution microscopy and particle averaging. Science. 341, 655-658 (2013).
- Pertsinidis, A., et al. Ultrahigh-resolution imaging reveals formation of neuronal SNARE/Munc18 complexes in situ. Proc Natl Acad Sci U S A. 110, 2812-2820 (2013).
- Shim, S. -. H., et al. Super-resolution fluorescence imaging of organelles in live cells with photoswitchable membrane probes. Proc Natl Acad Sci. 109, 13978-13983 (2012).
- Huang, F., et al. Video-rate nanoscopy using sCMOS camera-specific single-molecule localization algorithms. Nat Methods. 10, 653-658 (2013).
- Balla, T., Várnai, P. Visualization of Cellular Phosphoinositide Pools with GFP-Fused Protein-Domains. Curr Protoc Cell Biol. 24, 24 (2009).
- Xu, C., Watras, J., Loew, L. M. Kinetic analysis of receptor-activated phosphoinositide turnover. J Cell Biol. 161, 779-791 (2003).
- Subach, F. V., et al. Photoactivatable mCherry for high-resolution two-color fluorescence microscopy. Nat Methods. 6, 153-159 (2009).
- Filonov, G. S., et al. Bright and stable near infra-red fluorescent protein for in vivo imaging. Nature Biotechnol. 29, 757-761 (2011).
- Zhang, M., et al. Rational design of true monomeric and bright photoactivatable fluorescent proteins. Nat Methods. 9, 727-729 (2012).
- Hohmeier, H. E., et al. Isolation of INS-1-derived cell lines with robust ATP-sensitive K+ channel-dependent and -independent glucose-stimulated insulin secretion. Diabetes. 49, 424-430 (2000).
- Dyachok, O., Isakov, Y., Sågetorp, J., Tengholm, A. Oscillations of cyclic AMP in hormone-stimulated insulin-secreting β-cells. Nature. 439, 349-352 (2006).
- Nan, X., et al. Single-molecule superresolution imaging allows quantitative analysis of RAF multimer formation and signaling. Proc Natl Acad Sci U S A. 110, 18519-18524 (2013).
- Sengupta, P., et al. Probing protein heterogeneity in the plasma membrane using PALM and pair correlation analysis. Nat Methods. 8, 969-975 (2011).
- Morone, N., et al. Three-dimensional reconstruction of the membrane skeleton at the plasma membrane interface by electron tomography. J Cell Biol. 174, 851-862 (2006).
- Peters, K. R., Carley, W. W., Palade, G. E. Endothelial plasmalemmal vesicles have a characteristic striped bipolar surface structure. J Cell Biol. 101, 2233-2238 (1985).
- Fujita, A., Cheng, J., Tauchi-Sato, K., Takenawa, T., Fujimoto, T. A distinct pool of phosphatidylinositol 4,5-bisphosphate in caveolae revealed by a nanoscale labeling technique. Proc Natl Acad Sci U S A. 106, 9256-9261 (2009).
- Durisic, N., Laparra-Cuervo, L., Sandoval-Álvarez, &. #. 1. 9. 3. ;., Borbely, J. S., Lakadamyali, M. Single-molecule evaluation of fluorescent protein photoactivation efficiency using an in vivo nanotemplate. Nat Methods. 11, 156-162 (2014).
- Thomas, C. L., Steel, J., Prestwich, G. D., Schiavo, G. Generation of phosphatidylinositol-specific antibodies and their characterization. Biochem Soc Trans. 27, 648-652 (1999).
- Várnai, P., Balla, T. Live cell imaging of phosphoinositides with expressed inositide binding protein domains. Methods. 46, 167-176 (2008).
- Honigmann, A., et al. Phosphatidylinositol 4,5-bisphosphate clusters act as molecular beacons for vesicle recruitment. Nature Struct Mol Biol. 20, 679-686 (2013).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved