Method Article
Roman Floresan Probları Plazma Membran Fosfatidilinositol 4,5-bisfosfatın tek molekül Süper çözünürlüklü görüntüleme
Bu Makalede
Özet
PI (4,5) P2 çeşitli hücresel fonksiyonlarını düzenler, ancak hücre plazma zarı kendi nano örgütü tam olarak anlaşılamamıştır. Etiketleme PI pleckstrin homoloji alanı ile kaynaşmış bir çift renkli flüoresan sonda ile (4,5) P2, biz nanometre ölçeğinde (4,5) p plazma membranında 2 dağılımını PI incelemek için yeni bir yaklaşım tarif .
Özet
Phosphoinositides in the cell membrane are signaling lipids with multiple cellular functions. Phosphatidylinositol 4,5-bisphosphate (PI(4,5)P2) is a determinant phosphoinositide of the plasma membrane (PM), and it is required to modulate ion channels, actin dynamics, exocytosis, endocytosis, intracellular signaling, and many other cellular processes. However, the spatial organization of PI(4,5)P2 in the PM is controversial, and its nanoscale distribution is poorly understood due to the technical limitations of research approaches. Here by utilizing single molecule localization microscopy and the Pleckstrin Homology (PH) domain based dual color fluorescent probes, we describe a novel method to visualize the nanoscale distribution of PI(4,5)P2 in the PM in fixed membrane sheets as well as live cells.
Giriş
Fosfoinosititler toplam membran lipidlerine küçük bir kısmı katkıda hücresel süreçlerin çeşitli kritik roller oynar. Onlar 3 rd inositol halkaların geri dönüşümlü fosforilasyon veya defosforilasyonundan türetilen yedi üye, 4 th ve 5. pozisyonları 1 bulunmaktadır. Fosfatidilinositol 4-fosfat (PI4P) ve fosfatidilinositol 4,5-bifosfat (PI (4,5) P2) hücre plazma zarı (PM) 2,3 belirleyici lipidler gibi nispeten bağımsız işlev iki büyük fosfoinositidler vardır. Fosfatidilinositol (3,4,5) -trisphosphate (PIP 3) daha az bol PI4P ve PI (4,5) P2 daha, ancak kanser 4 ve diyabet 5 dahil olmak üzere farklı hücresel süreçleri benzersiz işlevleri vardır. Bu lipidler kendi etkileyiciler ve birçok diğer proteinler ile kompleks moleküler etkileşimler vardır. Nedenle, bu pho mekansal organizasyonunu anlamak için çok önemlidirnanometre ölçeğinde PM sphoinositides.
Montaj kanıtlar sınırlı PM alanlarında protein kompleksleri veya molekül kümeleri noktaları 6 sinyal olarak hizmet verebilir göstermiştir. Örneğin, sintaksin 1a, membran füzyon 7-9 düzenleyen önemli bir protein PM küme organizasyonunu gösterir. sintaksin 1a küme organizasyonunun uzlaşma görünümünden ayrı, PM fosfoinositidlerde mekansal dağılımı tartışmalıdır. PI (4,5) P2 dağılımları kullanılan kümeleri 14-18, hücre türlerine bağlı olarak ve deneysel yöntemler yoğun üzere, üniforma 10-12, büyük yamalar 13,14 arasında değişmektedir. Yüksek çözünürlükte PI (4,5) P2 mekansal organizasyonu da tutarsızdır. Uyarılmış emisyon-tükenmesi ile bir çalışma (STED) mikroskopi 19 yoğun PI (4,5) P2 nano kümeleri çok sayıda ortaya koymuştur (~ çapı 73 nm) PC-12 hücrelerinde 20 PM levhalar Yukarı. Bu sonuç, hızlı dondurma elektron mikroskobu (EM) 21,22, kimyasal sabitleme çok daha iyi, canlı hücrelerin sağlam PM yapısını koruyan bir yaklaşım kullanarak çalışmalardan farklıdır. İkinci PI (4,5) P2 belirgin havuzu gösterdi; Nispeten konsantre PI (4,5) kaveolanın ve kaplamalı çukurlara P 2 yanı sıra düz PM bölgeye homojen dağılımı. Ayrıca, membran yaprak nano PI (4,5) P2 organizasyon, canlı ve sabit hücrelerde farklılık gösterebilir. Bizim son çalışma tek-molekül yerelleştirme mikroskobu (SMLM) 23 kullanılarak hem sabit hem de canlı INS-1 hücrelerinde bu sorunu araştırdık.
SMLM bağımsız flüoroforlar, yüksek hassasiyet ile lokalize edilebilir ve böylece stokastik herhangi bir zamanda florofor yalnızca küçük bir bölümünde devreye dayanır. Birçok süper çözünürlüklü görüntüleme yaklaşımları, geleneksel ışık mikroskobu kırınım limitini aşmak için benzer ilkeleri kullanarak geliştirilmiştir böyle birs fotoaktivasyon yerelleştirme mikroskobu (PALM) 24, floresan fotoaktivasyon yerelleştirme mikroskobu (FPALM) 25, stokastik optik rekonstrüksiyon mikroskobu (Fırtına) 26,27 ve doğrudan STORM (dSTORM) 28. Foto-değiştirilebilir veya ışıkla fluorophores (boyalar veya floresan proteinleri) ile, SMLM teknikleri canlı hücreler 31,32 video-oranı ile nanometre çözünürlükte 24,29,30 de görüntü biyolojik yapıları bilim adamları sağlar.
Örnek olarak PI (4,5) P 2 kullanarak, ÖS fosfoinositidlerde ve nano ölçekli dağılımını incelemek için SMLM bir yaklaşım getirdi. Özellikle PI bağlanan PLCδ1 (fosfolipaz C δ1) PH alanı (4,5) P2 PM görüntüleme PI (4,5) P2 alt hücresel dağılımı ve dinamikleri 33,34 için köklü bir sonda olduğu . Biz genetik olarak iki floresan proteinleri, PAmCherry1 35 ve iRFP 36 Bu etki alanını etiketledi çift renkli füzyon proteininin (iRFP-PAmCherry1-PH PLCδ1) üretilmesi için (Şekil 1A-B). PAmCherry1 PALM PH alanının fotoaktıfleştırılebılır prob olarak hizmet vermekte ve iRFP PALM satın önce transfekte edilmiş hücrelerin belirlenmesi için genel bir göstergesi olarak hizmet veren . Biz sabit zar tabaka halinde SMLM görüntüleme için bu iki renkli floresan prob geçerlidir. Canlı PALM görüntüleme için, onun daha iyi foton verimliliği ve parlaklık (Şekil 1C-D) mEOS3.1-PH PLCδ1 probu oluşturmak için PH PLCδ1 etki mEOS3 37 yerine PAmCherry1 etiketledi.
Insülin salgılayan INS-1 hücreleri 38 PM bu yeni problarla SMLM görüntüleme PI (4,5) ayarlanmıştır bölgelerin çoğunda P2 hem de konsantre PI (4,5) P2 homojen etiketleme ortaya çıkardı seyrek düz PM ve bazı filopodia benzeri yapıların 23 intermixed olan mikro bölgeler. Sonra birPI (4,5) P 2 noScale dağılımı o canlı hücrelerin nasıl işlediğini yeniden düşünmek için bir yapısal temel sağlar.
Protokol
1. Membran Sac Hazırlama ve Fiksasyon
- IRFP-PAmCherry1-PH PLC δ1 ile etiketlenmiş zar levhaları hazırlanması
- DNA plazmid kodlayan iRFP-PAmCherry1-PH PLC, standart moleküler biyoloji teknikleri kullanılarak 23 δ1 hazırlayın.
- Kültür INS-1 # 1.5 ile hücreler 18 mm yuvarlak lamelleri standart INS-1 hücre kültürü protokolleri 38,39, aşağıdaki% 50-70 konflüansa 30 | ig / ml fibronektin ile önceden kaplanmış. 50 ila 70% konfluansa ulaştığında sonra hücreler bir gün transfekte.
- IRFP-PAmCherry1-PH PLC ile transfekt hücreleri, üretici protokollerine göre lipozom transfeksiyon ayıracı kullanılarak δ1. Transfeksiyondan sonra, hücreler 48 saat için büyümeye olanak sağlar.
- Deney gününde, ~ 0.5 ile kat lamelleri (tek tarafında) - 500 ug / mL poli-D-lizin, 1 ml, 1-2 saat süre ile (PDL dH 2 O seyreltilmiş). Sonra bir kağıt mendil koyarak PDL tahliyelamel kenarı. daha sonra kullanılmak üzere bir önceden soğutulmuş (4 ° C) metal levha üzerine lamelleri yerleştirin.
- 1 mM EGTA ihtiva eden 1 ml buz gibi soğuk fosfat tamponlu salin (PBS) -, 0,5 lamelleri artan ön-transfekte edilen INS-1 hücreleri yıkayın. yıkandıkları üç kez tekrarlayın ve PBS boşaltın.
- cımbız ile önceden soğutulmuş metal levha üzerine PDL kaplı lamelleri kültüre hücreleri (hücre tarafı aşağı bakacak şekilde) ile lamelleri yerleştirin. Hücreler PDL kaplı lamelleri (Şekil 2) takmak için izin 10 dakika - 7 buzdolabında (4 ° C) plaka bırakın.
Not: kuluçka süresi 7 aralığında olmalıdır - PDL kaplı yüzeye hücrelerin daha bağlanması için 10 dakika. buzdolabı ortamı kuru ve inkübasyon çok uzun olmamalıdır. - buzdolabından metal plaka çıkarın. Yavaşça cımbız kullanarak ön-transfekte hücreleri içeren lamel soyulabilir. Bu hücre zarı tabakanın ince bir tabaka oluştururlamel PDL kaplı. Yavaşça ~ 0.5 membran yaprak yıkama - 1 mi buz gibi soğuk PBS ve sonra ~ 0,5 tamir - 1 ml buz gibi soğuk% 4 paraformaldehit (PFA) + 4 ° C'de 15 dakika boyunca PBS içinde% 0.2 glutaraldehid (GA).
Dikkat: formaldehit ve glütaraldehit zehirlidir. cilt ve göz koruması ile bir davlumbaz onları idare. - Tespit edildikten sonra, resim zar levhaları hemen (bölüm 3) ya da ~ 0.5 depolamak - 4 ° C'de 1 ml PBS.
Not: Membran tabaka çözdükten sonra sitoplazmada PI (4,5) P2 PH probları bağlama herhangi bir denge olacaktır. bağlı PH sondaları kademeli olarak membran tabakasından ayırmak ve (o hafta gün sürebilir rağmen) çözeltisi içine yayılır. Bu nedenle, doğru numune hazırlandıktan sonra görüntüye sabit örnekleri tavsiye edilir.
- PI (4,5) P2 özel antikor etiketleme için membran sayfaları hazırlamak
- Kültür INS-1 # 1.5 ile ilgili hücreler, 30 'ile önceden kaplanmış 18 mm yuvarlak lamelleri# 181; g / ml fibronektin 50 ila% -70% izdiham. Aşama 1.1.3 tarif edildiği gibi DNA ile transfekt hücre Ertesi gün plazmit.
- Yukarıda açıklandığı gibi 1.1.7 için 1.1.4 den adımları tekrarlayın.
NOT: 4 ° C'de aşağıdaki prosedürleri uygulayın. - 1 ml buz gibi soğuk PBS, 50 mM NH4CI ihtiva eden - ~ 0.5 olan sabit PM levhaları üç kez ihtiva lamelleri yıkayın. ~ 0.5 olan yaprak söndürün - 7 dakika boyunca PBS içinde 1 ml% 0.1 sodyum borohidrid ve yıkayın ~ 0,5-1 ml PBS (50 mM NH4CI olmadan).
- Bloke etme çözeltisi, 1 ml, 45 dakika (% 5 (hacim / hacim) normal keçi serumu,% 5 (h / h) sığır serum albümini ve 50 mM NH4CI ihtiva eden PBS çözeltisi) -, 0,5 örnekleri bloke. 1 saat için çözüm engelleme: (300 seyreltme 1) 1 ml primer PI 2 antikoru (4,5) P - Sonra, ~ 0.5 ile kuluçkaya yatmaktadır. 1 ml PBS, 50 mM NH4CI ihtiva eden - ~ 0.5 ile üç kez (10 dakika, her zaman) yıkayın.
- 1 mi sekonder F (ab ') 2 keçi anti-fare - ~ 0.5 olan örnekleri inkübe1 saat süre ile blokaj tamponu: florofor (300 1) ile konjuge antikor. 1 ml PBS - ~ 0.5 ile üç kere yıkanır.
- post-düzeltme örnekleri% 4 PFA +% 0.2, GA, 15 dakika boyunca, daha sonra, PBS (7 dakika, her zaman) olan numuneler, üç kez yıkayın. Görüntüleme için, Bölüm 3 geçin veya daha sonra kullanılmak üzere 4 ° C ± 0.5 ~ 1 ml PBS içinde depolar.
Not: 4 ° C'de numune hazırlayın. PM fosfoinositidlerde fizyolojik dağılımını korumak için% 4 PFA +% 0.2 GA fiksatif kullanın. Yalnız% 4 PFA ile RT hazırlanması veya tespit önemli eserler (Şekil 4) neden olabilir.
MEOS3.1-PH PLC δ1 ile Canlı hücre Görüntüleme için 2. Hücre Kültürü Hazırlanması
- Daha önce tarif edildiği gibi 23 mEOS3.1-PH PLC δ1 kodlayan DNA plazmid hazırlayın.
- # 1,5 18 mm Kültür INS-1 hücreleri yuvarlak lamelleri 30 mg / ml fibronektin onlar ulaşana kadar% 50 -70% confl ile önceden kaplanmışStandart INS-1 hücre kültürü protokolleri 38,39 aşağıdaki uency.
- Ertesi gün, DNA, plazmid üreticinin protokolü takip lipozom transfeksiyon ayıracı kullanılarak δ1 mEOS3.1-PH PLC INS-1 hücreleri transfekte. görüntüleme önce 48 saat süreyle inkübe edin.
Membran Sheets ve Canlı Hücre 3. PALM Image Acquisition
- Membran levhalar PALM görüntü elde etme
NOT: Burada, bir toplam iç yansıma floresan (TIRF) mikroskop tabanlı SMLM sistemi (100X yağı, APO, NA = 1.49, WD 0.12 mm) 23 tüm görüntü elde etmek için kullanılır.- Görüntüleme önce, 10 ml PBS + 50 mM MgCl2 floresan boncuk çözeltisi 1 ul seyreltilir. 10 dakika boyunca (adımlarda 1.1.8 / 1.2.6 itibaren) görüntüleme odası içeren hücre örneklerinin içine çözüm seyreltilmiş 200 ul ekleyin. Daha sonra, PBS ile üç kez yıkanır.
- PALM görüntüleme sistemi başlatın. ilişkili görüntüleme yazılımı olarak, & "iRFP kanalını seçin# 34; düğmesi (642 nm lazer uyarma, 700/75 nm emisyon). iRFP kanal pH probları eksprese eden hücre membranı Bul.
NOT: Membran levha yakın bir floresan boncuk olmalıdır. Bu, daha sonra kayma düzeltme için gereklidir. - Gelecekteki görüntü rekonstrüksiyon için bir referans olarak iRFP kanalında hücre zarının geleneksel TIRF görüntü toplamak için "Yakalama" düğmesini kullanın. Görüntüleme ayarı TIRF açısı 2140 yazarak normal TIRF açısı (yani, kritik açı ulaştıktan sonra, başka bir 1.5 derece dönüş) ayarlayın. Aksi belirtilmediği sürece tüm adımlar için ayarı bu açıyı kullanın.
NOT: Burada anlatılan TIRF sisteminde, 3,500 2,200 TIRF kritik açı ve 2140 TIRF kritik açı sonra 1.5 derece daha normal TIRF açısı olduğunu, yukarı dikey açısıdır. 3.2.3 aşağıda belirtilen dar TIRF açısı TIRF kritik açı ulaştıktan sonra başka bir 2 derece olan 2120 olduğunu. - th tıklayarak PAmCherry1 kanalına geçine RFP kanal düğmesi (561 nm uyarma, 600/50 nm emisyon filtresi). Arka plan membran floresan ağartmak için 10-20 saniye boyunca 561 nm lazer tam güç aydınlatmaya sahip sağa "AOTF" pad tüm yol kaydırma çubuğunu ayarlayın.
- "Format" sekmesine ve "ND dizisi edinme" sekmesinde hızlı alım protokolünde optimum kamera ayarı (2x2 binning) Set (tipik olarak 20 Hz 10,000-40,000 görüntü).
- "Şimdi Çalıştır" butonuna tıklayarak - düşük seviyede (% 1% 0.1) de eş zamanlı 405 nm lazer aktivasyonu ile PAmCherry1 görüntüleri (tam güçte 561 nm lazer, 50 milisaniye / çerçeve) edinimini başlatın. Her karede o uzamsal izole bireysel noktaları kolayca tanımlanabilir böylece 405 nm lazer yoğunluğunu ayarlayın.
NOT: aktive edilebilir PAmCherry1 moleküllerinin sayısının alımı sırasında yavaş yavaş azalır. 405 nm lazer yoğunluğu tedricen her ayrı molekül sinyallerinin uygun yoğunluğunu tutmak için artırılmalıdırçerçeve. - Hiçbir PAmCherry1 tek molekül sinyali devreye kadar görüntü almak devam edin.
- canlı hücrelerde PALM görüntüleme
- Aşama 3.1.1 tarif edildiği gibi görüntüleme önce, 10 dakika süre ile görüntüleme odasına flüoresan boncuklar seyreltin. Sonra ilişkili görüntüleme yazılımı açarak PALM görüntüleme başlayın.
NOT: canlı hücre görüntüleme için manyetik hızlı çıkarma görüntüleme odası kullanın. 135 mM NaCI, 5.6 mM KCI, 2.6 mM CaCl2, 1.2 mM MgCl2, 3 mM glukoz ve 20 mM: hücre dışı tamponu (hücre-dışı çözelti sürekli perfüzyon altında bir ısı kontrol 35 ° C'de görüntüleme alanının merkezine sahip HEPES, pH = 7.3). - GFP kanal düğmesine (525/50 nm emisyon) seçin. 488 nm lazer uyarma altında mEOS3 yeşil floresan dayalı flüoresan millerini ifade hücre zarı tanımlayın. Yakın zamanda bu şekilde görüntüleme sırasında yer almaktadır floresan boncuk çevrimdışı Sondaj için daha sonra gerekli olduğundan emin olunft düzeltme.
- Bir referans görüntü olarak mEOS3 (yeşil) kanal hücre zarının bir TIRF görüntü toplamak için "Yakalama" butonuna tıklayın. canlı hücre görüntüleme ayarı TIRF açısı 2120 yazarak (kritik açı ulaştıktan sonra, başka bir 2 derece dönüş) sığ kaybolan dalga uyarma aydınlatma kullanın.
Not: Bu, plazma zarına sitosol bitişik bağlanmamış mEos3-PH floresan en aza indirir. - "RFP kanalı" düğmesi (561 nm uyarma, 600/50 nm emisyon) geçin. (3.1.4 bakınız) "AOTF pad" in kaydırma çubuğu ile 10 ~ 20 saniye boyunca membran yaprak arka plan floresan beyazlatmak tam güç 561 nm lazer kullanın.
- eşzamanlı 405 nm lazer aktivasyonu ile ( "kamera" sekme ayar 10 milisaniye / karede set 561 nm tam güç) kırmızı kanalda "Şimdi Çalıştır" butonuna tıklayarak görüntü alımı başlatabilirsiniz. mekansal ayrılmış noktaları aktive etmek için 405 nm lazer yoğunluğunu ayarlayınher çerçeve içinde.
NOT: molekül sayısı yavaş yavaş azalır mEOS3.1-PH PLC un dönüştürülmüş δ1 edinme ilerledikçe olarak. Yavaş yavaş tek bir molekülün sinyalini optimize etmek için 405 nm lazer gücünü artırmak. Görüntüleme edinme uzunluğu deneysel amacına bağlıdır. Normal koşullar altında, 5 dakika boyunca sürekli olarak görüntüler elde. Daha uzun bir satın alma gerekiyorsa, bunun yerine tek bir büyük görüntü yığının birden fazla görüntü yığınları toplamak. Her görüntü yığını dosya boyutu 4 GB geçmemelidir veya daha sonra yazılım analizi etkileyecektir.
- Aşama 3.1.1 tarif edildiği gibi görüntüleme önce, 10 dakika süre ile görüntüleme odasına flüoresan boncuklar seyreltin. Sonra ilişkili görüntüleme yazılımı açarak PALM görüntüleme başlayın.
4. SMLM Görüntü İşleme ve Yeniden
- Bir görüntü analizi istasyonuna görüntü dosyaları (.tif görüntü yığınları) aktarın. Daha sonra "yeni bir dosya" "açık", daha önce 37 açıklandığı gibi Matlab görüntü oluşturma programı (özel yazılmış) başlatın ve ana menüde "Dosya" sekmesini tıklayarak Görüntü yığını yükleyin.
- Belirlemek ve locaher çerçeve tek tek moleküler olayları lize. "Dalgacık" bir eşik sayısı (1-10) ile yoğunluk eşik filtreleme ayarlayın. görsel yeniden önce nokta tespiti için en uygun parametre ayarlarını doğrulayın. Ardından "PALM" sekmesine gidin ve görüntü yeniden başlatmak için "bir adım süreci" tıklayın.
NOT: nokta tespiti için Yoğunluk eşiği keyfi ve kişisel deneyime bağlıdır. Birkaç çalışmalar ne çok sayıda niteliksiz (dim) puan alır ne de çok sayıda nitelikli (parlak) noktaları filtreler olduğunu optimal algılama eşiğini üretmek için gerekli olabilir. veri analizi optimize etmek için diğer parametreleri ayarlayın. Burada, mahalle mesafesi (kombine bir mesafede komşu karelerde floresan puan) 65 nm (1/2 piksel genişlik) olarak ayarlanmış ve tek bir molekül takılmıştır. Gap çerçeveleri (kombine ve tek bir molekül olayı olarak monte edilen bu çerçeveleri ve mahalle mesafesinde meydana gelen bireysel molekül olaylar) 'dirPAmCherry1 görüntüleme 40 26 kare (1.3 sn) olarak ayarlayın. SMLM içinde 40 sayım aşırı önlemek için tek bir molekül prob ve alma hızı özelliklerine göre bu parametreyi ayarlayın. rekonstrüksiyon sırasında floresan boncuklar ile sürüklenme düzeltme uygulayın.- IRFP-PAmCherry1-PH PLC δ1 etiketli sabit membran yaprak görüntüleme için tek bir süper çözünürlüklü görüntüye 37 içine aynı membran levhadan tüm görüntü yığınlarını yeniden.
- MEOS3.1-PH PLC δ1 etiketli canlı hücre örnekleri, 1000 kare birkaç küçük yığınlarının içine bütün görüntü yığını ayrı 1.000-ardışık kare yığını bir zamansal çözünürlüğe sahip tek bir süper çözünürlüklü görüntü olarak yeniden böylece 10 sn. Sonunda, nihai zaman serisi yığınına 23 içine tüm zaman serisi görüntüleri birleştirir.
NOT: canlı hücre PALM görüntülemede, aktif prob az sayıda taşıma veya ayırmak olabilirağartma önce PM PI (4,5) P 2. prob oversampling hesaba katmak için, görüntü analizi sırasında tek bir emisyon olay haline (yerine 65 nm) 130 nm içinde komşu çerçeveler bireysel molekül sinyallerini birleştirir.
- Yeniden görüntüler elde ettikten sonra, çift-korelasyon 41 ile molekül yoğunluğu, mikro etki yoğunluğu / boyutunu ve küme analizi ölçmek için Matlab özel olarak yazılmış bir program ile daha fazla görüntü analizi yürütmek.
Sonuçlar
Bizim süper çözünürlük sisteminin yerelleştirme belirsizlik (σ) 14.73 nm 23 olduğunu. TIRF ve PALM görüntüler arasında doğrudan karşılaştırmalar uzaysal çözünürlüğü önemli bir gelişme gösterdi. Şekil 3A-B PI (4,5) P2 antikoru ve iRFP-PAmCherry1-PH PLC ile etiketlenmiş temsili PI (4,5) P2 TIRF görüntüleri gösterir tipik membran yaprak ve canlı hücrelerde δ1. Membran levhalar konvansiyonel TIRF mikroskopi ile görüntüleri gelişmiş yeşil floresan protein etiketli sağlam canlı hücrelerde olanlara oldukça benzer olan (EGFP) (Şekil 3C) (EGFP-PH PLCδ1) PH etki etiketledi. Tüm numuneler problar eşit dağılıma sahip olduğunu göstermiştir. Bunun aksine, numunelerin optimum olmayan sabitleme keskin yoğun PI (4,5) P2 kümeleri ve sinyal yoğunluğundaki bir azalma (Şekil 4) ile sonuçlanmıştır. optimum sabitleme koşulları altında, tO PI sabit hücrelerde (4,5) P2 (Şekil 5) süper çözünürlüklü görüntüler sadece sınırlı konsantrasyon geçişlerini ile PM önemli bir kısmında prob homojen dağılımını ortaya koydu. PI (4,5) P2 prob ile zenginleştirilmiş bazı zar yamalar seyrek dağıtılan ve çeşitli boyutlarda vardı. Canlı hücre PALM görüntüleri (Şekil 6) sabit hücreler olarak benzer bir mekansal dağılımını gösterir. Geniş alanlarda bolluk önemli değişiklikler olmadan PI (4,5) P yerel alanlarda hızlı dinamikleri zaman sonuçları üzerinden 2 sinyal ayrıntılı analizi.
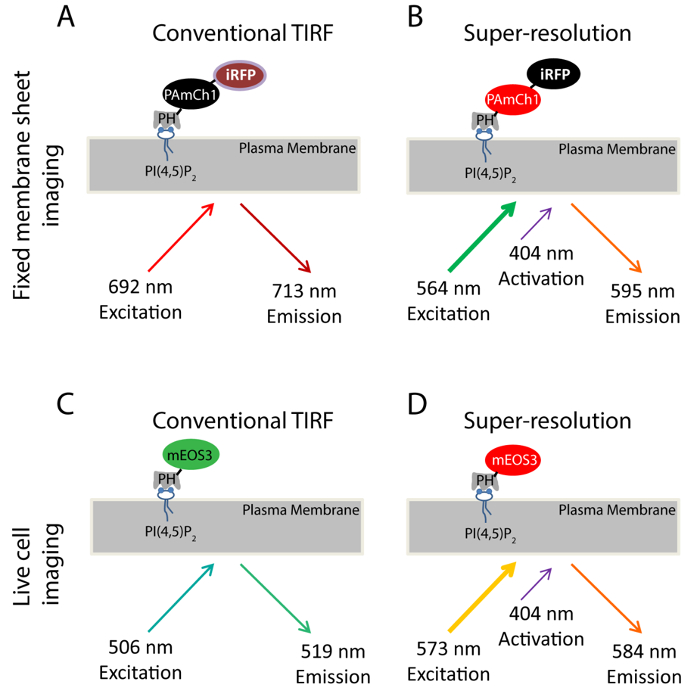
Bu çalışmada kullanılan floresan probları Şekil 1. Şema. Sabit membran tabaka deneylerinde kullanılan (AB) iRFP-PAmCherry1-PH PLC δ1 prob. Geleneksel TIRF görüntüleme (A), 640 mil boyunca Lazer iRFP heyecanlandırmak için kullanılır (Örn: 692 nm; Em: 713 nm). Bu durumda alınan TIRF görüntü PALM görüntüleme (B) ile elde edilen süper çözünürlüklü görüntüleme için bir TIRF referans görüntü olarak hizmet vermektedir. A 405 nm lazer için kullanılan PAmCherry1 fluorofor foto-etkinleştirmek ve bir 561 nm lazer PAmCherry1 heyecanlandırmak için kullanılır (Ex: 564 nm; Em: 595 nm) PALM görüntüleme için. (CD) canlı hücre deneylerinde kullanılan mEos3.1-PH PLCδ1 sonda. Geleneksel TIRF görüntüleme sırasında (C), bir 488 nm lazer mEOS3.1 (:;: 519 nm Em 506 nm Ex) heyecanlandırmak için kullanılır. (: 573 nm; Em: Ex 584 nm) 405 nm lazer ile Fotoçevrim sonra (D), mEos3.1 kırmızı forma dönüşür. PALM satın almalar için kullanılır ve bir 561 nm lazer büyük halini görmek için tıklayınız bu figür.
s / ftp_upload / 54466 / 54466fig2.jpg "/>
INS-1 hücreleri membran levha hazırlanması için Şekil 2. Şema (A). Bir PDL kaplı lamel üzerine aşağı bakacak şekilde kültürlenmiş hücreler ile lamel yerleştirin ve PDL- hücre bağlanmasına olanak sağlamak üzere, 4 ° C 'de 7 ~ 10 dakika bekleyin kaplanmış lamel. (B) cımbız ile üst lamel soyun ve PDL önceden kaplanmış lamel bağlı membran sayfasını düzeltmek. (C) Görüntü TIRFM ve PALM ile numune. Bu rakamın büyük halini görmek için lütfen buraya tıklayınız.
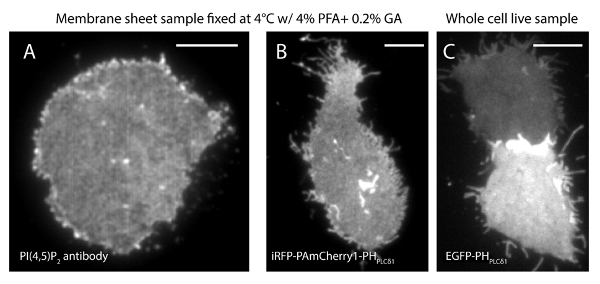
Şekil 3. PI (4,5) P2 mekansal organizasyon geleneksel TIRF mikroskop altında membran çarşaf ve sağlam canlı hücreler arasındaki benzer. (A)zar levhaları tipik TIRF görüntüsü% 4 PFA ve% 0.2 GA ile 4 ° C 'de sabit. PI (4,5) P2 PI (4,5) P2 spesifik antikor ile etiketlenmiştir. (B) iRFP-PAmCherry1-PH PLC δ1 ifade INS-1 hücreden bir zar tabaka. Farklı seviyelerde EGFP-PH PLCδ1 ifade iki tam canlı hücre (C) TIRF görüntüsü. Ölçek çubukları: (A): 3 um; (B) ve (C):. 5 mikron bu rakamın daha büyük bir versiyonunu görmek için lütfen buraya tıklayınız.
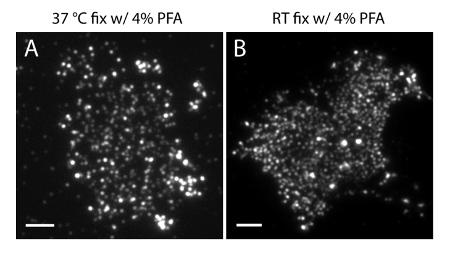
Şekil 4. PI zar levhaları 2 mekansal organizasyon ortak sabitleme koşulları duyarlıdır (4,5), s. (A) zar levhaları tek% 4 PFA ile 37 ° C 'de sabit bir(Şekil 3A'da gibi) PI (4,5) P2, belirli bir antikor ile işaretlenmişlerdir. (B) Membran levha yalnız PFA oda sıcaklığında sabit ve PI (4,5) P2 spesifik antikor ile etiketlenmiş. PI yoğun kümeleri (4,5) P2 probları Şekil 3A'da gösterilen daha da floresans görüntüleri aksine, TIRF mikroskop altında açıkça görülebilir olduğuna dikkat edin. Ölçek çubukları: AB:. 3 mikron bu rakamın daha büyük bir versiyonunu görmek için lütfen buraya tıklayınız.
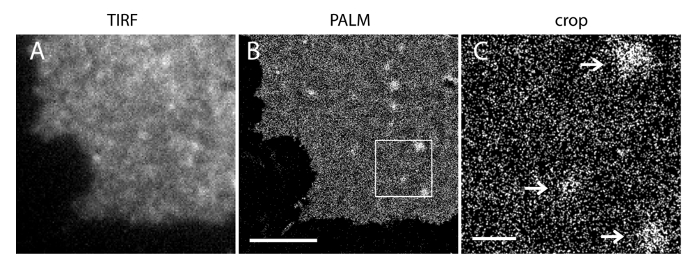
PI Şekil 5. PALM görüntüleme (4,5) P 2 sondaları INS-1 hücre PM kendi nanometre ölçekli dağılımını ortaya koymaktadır. (A) iRFP-PAmCherry1-PH ifade INS-1 hücreden bir zar tabakasının iRFP TIRF görüntü PLCPAmCherry1 sinyali yeniden dayalı aynı bölgede PM PALM görüntüsünü İlgili δ1. (B). Homojen PI (4,5) P majör PM bölgeler ve çeşitli PI (4,5) P2 mikro bölgeler 2 mekansal dağılımı unutmayın. (C) (b) 'de kutulu bölgesinin büyütülmüş bir görünüşüdür. Oklar seyrek PI (4,5) P2 sondaları ile zenginleştirilmiş PM mikro bölgesini dağıtılan göstermektedir. Ölçek çubukları: A ve B: 3 um; C: 500 nm. Bu rakamın büyük halini görmek için lütfen buraya tıklayınız.
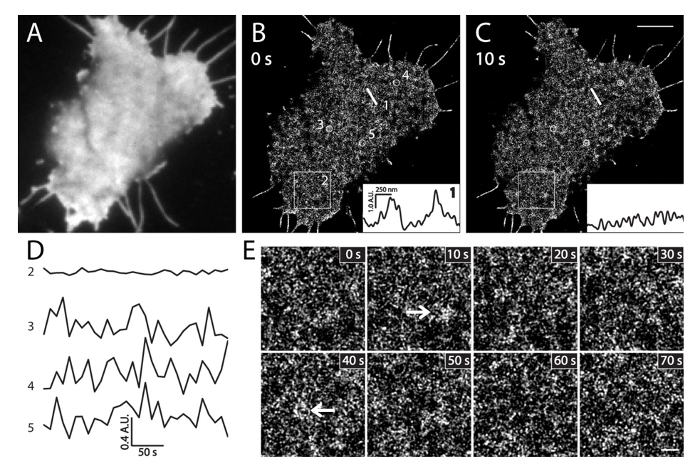
Canlı INS-1 hücreleri Şekil 6. PALM görüntüleme (A). MEos3.1-PH PLC eksprese eden bir canlı INS-1 hücre PI (4,5) P2 ve TIRF resmiδ1. Görüntü hızla PALM edinme (35 ° C) daha önce yeşil kanal satın alındı. (B) 10 sn aralıklarla Sıralı canlı hücre PALM görüntüler. Insets yerel PI (4,5) P2 (B) farklı zamanlarda aynı düz çizgi 1 pozisyon boyunca yoğunluk ve (C) yoğunluk profillerini göstermektedir. 10 saniye içinde onların büyük yerel yoğunluk değişiklikleri unutmayın. (D) PI ortalama yoğunluğu değişikliklerin zaman seyri (4,5), (B) 'de geniş bir alana (box2, 3x3 mm) ve küçük daire (3, 4 ve 5, 500 nm çapında) içinde p 2 5 içinde PALM görüntüleme dak (kare / sn 10). Yerel PI (4,5) P2 sondaları hızlı yoğunluk dalgalanmaları Not (daire 3, 4 ve 5) geniş bir alana (kutu 2) çok küçük değişikliklere göre. Belirtilen zamanlarda (B) 'de box2 bölgesinde (E) Genişletilmiş palmiye ve görüntüler. Oklar p altında PI (4,5) P2 zenginleştirilmiş membran yamaları gösterirhysiological koşullar. Ölçek çubukları: C: 3 um; E: 500 nm. Bu rakamın büyük halini görmek için lütfen buraya tıklayınız.
Tartışmalar
membran levha üretimi ve örnek tespit: Sorun giderme için, iki işlem ekstra dikkat gerekir. protokolde tarif edildiği gibi aşama 1.1.6 lamelleri inkübasyon süresi membran levha üretimi için önemlidir. Bizim deneysel koşullar altında optimum inkübasyon süresi 7-10 dakika (Şekil 2). 10 dakika inkübasyon daha uzun veya daha az PDL kaplı lamelleri üzerinde hiçbir zar yaprak yol açacaktır yerine PDL lamelleri ve kısa inkübasyon üzerine membran levhalar sağlam hücreler üretecek. Protokolde tarif edildiği gibi, tespit sırasında fiksatif ve sıcaklık PM PI (4,5) P2 dağılımının muhafaza edilmesi için çok önemlidir. Oda sıcaklığında Fiksasyon ya da tek başına% 4 -PFA kullanımı PM normal lipit dağılımını bozar olabilir.
Lipid araştırma membran PALM mikroskopi uygulayarak, biz (4,5) P2, m aracılık önemli bir fosfoinositid PI nanometre ölçekli dağılımını gözlemlemek mümkünherhangi bir temel hücre etkinliklerini. INS-1 hücrelerinde sınırlı konsantrasyon geçişlerini PI (4,5) P 2 Bu mekansal dağılımı, lipid-protein etkileşimleri ve PI bu hücrelerde (4,5) P2 yerel sinyal olaylarını yeniden düşünmek için bir çerçeve sunmaktadır. Ayrıca, bu işin geliştirilen yöntemler, biyolojik süreçlerde Fosfoinosititler çalışma yeni araçlarla sağlar ve böylece, uygun problar diğer zar fosfolipid araştırma uygulanabilir.
Deterjan tedavi ve sitoplazmada potansiyel sinyal kirliliği: Bu çalışmada membran tabakaların kullanılması fosfolipid morfolojik çalışmalarda iki önemli endişeleri atlar. Deterjanlar genellikle kümeleme ve PM fosfolipid sinyali anlamlı kaybına neden olurlar. Sitozolik sinyalin kirlenme gibi PI (3,4,5) P3 ve PI (3,4) P2 olarak PM 23 düşük bolluk fosfoinositidlerde durumunda özellikle sorunludur. Membran tabaka numuneleri Circu edebiliyoruzönemli ölçüde kortikal aktin ağ ve klatrin kaplı çukurlar 42,43 plazma membranı ile bağlantılı yapılar, bozmadan bu sorunları mvent. PM PI (4,5) P2 göreceli homojen dağılım fibroblast zarında 44 GST-PH PLC δ1 problar kullanılarak diğer şoklama EM çalışmaları ile iyi bir anlaşma olduğunu.
Yanlış örnek işleme koşulları yanıltıcı sonuçlar üretebilir dikkat etmek önemlidir. İlk olarak, daha düşük bir sıcaklıkta (4 ° C) 'de tespit adımları ve membran levha üretimi için sabitleyici GA kullanımı için çok önemlidir. Şekil 3'te gösterildiği gibi, GA olmayan sıcak sıcaklık ve PFC sabitleme hücre PM Fosfoinosititler düzeltmek için yeterli değildir. Bu sağlam PI (4,5) P2 dağılımını bozar ve fizyolojik koşullar altında, canlı hücrelerde gözlenen olmayan keskin kümeleri oluşturabilir. İkinci olarak, PAmCherry1 olarak kullanımıSMLM probu, yerine başka problar daha nicel PALM görüntüleme için çok önemlidir. PAmCherry1 uygulamasının yararı parlaklık, yüksek foto-aktivasyon verimliliği ve en önemlisi, çok sınırlı fotoğraf yanıp sönen olarak iyi karakterize tek bir moleküler fotoğraf fiziksel özellikleri 35,40,45, geliyor. Bu özellikler foto-yanıp sönen potansiyel küme eserler ortadan kaldırmak ve kantitatif membran PI (4,5) P2 moleküler yoğunluğunu analiz etmemizi sağlar.
Bu yaklaşım aynı zamanda sınırlamaları vardır. Hücre görüntüleme önce bozulur, çünkü Birincisi, bu çalışmada kullanılan membran levha yöntemi tamamen PI (4,5) P2 fizyolojik dağılımını taklit olmayabilir. Ancak, bizim canlı PALM görüntüleme membran levha örnekleri ile gözlemlenen sonuçları destekleyen, PI (4,5) P2 benzer görece homojen dağılımını göstermektedir. Daha önceki çalışmalarında 23 tartışıldığı gibi İkincisi, SMLM görüntüleme uzmanlık ve ekstra olarak gerektirirTENTION kullanılan sondalar, örnek hazırlama ve fiksasyon, görüntü örnekleme ve yeniden yapılanma gibi farklı süreçler, doğabilecek görüntüleme eserler önlemek için. PH alanı göre sondalar ve antikorlar yaygın fosfoinositid çalışmalarında 46,47 kullanılmıştır da Son olarak, zarda tüm PI (4,5) P2, bu yaklaşım ile tespit etmek mümkündür kalır. Örneğin, diğer endojen proteinlerin bağlı PI (4,5) P2 PH prob veya antikorlar için erişilebilir olmayabilir ve bu durum kendilerini prob uzay engel için PI (4,5) P2 bir küçümsenmesi neden olabilir. Etiketleme PI (4,5) P2 alternatif bir yol orijinal kuyruk bir değişiklik ile En Fluor PI (4,5) P2 48, bir ön-etiketli PI (4,5) P2 analog kullanarak olurdu PI (4,5) P2. onun inositol halka endogenou aynı olduğundan Ancak, hızlı canlı hücre metabolizması diğer fosfoinositid alt tiplere hızla dönüştürülebilirs PI (4,5) P2. Bu canlı hücrelerde bu ön-etiketli PI (4,5) P2 analog sadakatle PI (4,5) P 2 ziyade metabolik ürünlerini temsil edip endişe uyandırmaktadır. Bu nedenle, bazı sınırlamalara rağmen, PH alanı tabanlı sondalar yaygın hücrelerin PM PI (4,5) P2 dağıtım ve dinamiklerini izlemek için kullanılan en iyi prob arasında devam etmektedir.
Bu metodolojinin gelecekteki uygulama böyle PI (3,4,5) P3 ve PI (3,4) P2 gibi diğer fosfoinositid çalışmaları, kadar uzatılabilir. Özetle, burada kullanılan yeni SMLM yaklaşımı hücrelerinde fosfoinositid incelemek için yeni yollar açar. Örneğin, PI (4,5), p, 2 kullanarak, özel hücre membran moleküllerinin morfolojik ve nicel çalışma PALM görüntüleme özelliklerinin yanı sıra sakıncaları göstermektedir. Bu yaklaşım çıkarlarının diğer moleküllere adapte edilebilir ve hücre biyolojisi geniş bir uygulama olacaktır.
Açıklamalar
The authors have nothing to disclose.
Teşekkürler
This work is supported by the National Institutes of Health (NIH) grants R01DK093953 (X.L.), P30NS069271, BRFSG-2014-07 (X.L.). C.J. is partially supported by American Heart Associate pre-doctoral fellowship (14PRE20380168, to C.J.).
Malzemeler
| Name | Company | Catalog Number | Comments |
| Microscope | Nikon | Ti-U | |
| sCMOS camera | Andor | Neo | |
| Spinning disk | Yokogawa | CSU X-1, 10,000 rpm | |
| High Power Monolithic Laser Combiner SP with 405, 488, 561 and 642 nm lasers. | Agilent | MLC400 | laser original powers & powers at the end of optical fiber) 405 nm: 15 mW & 13 mW; 488 nm: 45 mW & 42 mW; 561 nm: 45 mW & 40 mW; 640 nm: 35 mW & 16 mW. |
| 100X Objective | Nikon | APO 100X Oil, NA 1.49, WD 0.12 mm | |
| Nikon acquisition and analysis software (NIS Element) | Nikon | ||
| Matlab | MathWorks | ||
| Coverslip | Warner | 64-0714 | Round 18 mm coverslip, #1.5 |
| Fibronectin | Millipore | FC010-5MG | |
| Lipofectamin 3000 (transfection reagent) | Invitrogen | L3000-008 | |
| Glutaraldehyde | Electron Microscopy Science | #16120 | |
| PI(4,5)P2 1st antibody | Santa Cruz | sc-53412 | |
| secondary antibody F(ab’)2-goat-anti-mouse Alexa Fluor 647 | Invitrogen | A-21237 | |
| Tetraspeck beads | Invitrogen | T7279 | |
| magnetic quick release imaging chamber | Warner Instruments | Cat#641994 | |
| temperature controller | Warner Instruments | TC-344C | |
| Poly-D-Lysine | Sigma | P6407 | |
| Phosphate buffer saline | Sigma | P4417-100TAB | |
| EGTA | Sigma | 3780 | |
| NH4Cl | Sigma | A0171 | |
| Goat serum | Sigma | G9023 | |
| bovine serum albumin | Sigma | A7906 | |
| NaCl | Sigma | S5886 | |
| KCl | Sigma | P5405 | |
| CaCl2•2H2O | Sigma | 223506 | |
| MgCl2•6H2O | Sigma | M9272 | |
| Glucose | Sigma | G7021 | |
| HEPES | Sigma | H4034 | |
| Paraformaldyhyde | Sigma | P6148 |
Referanslar
- Di Paolo, G., De Camilli, P. Phosphoinositides in cell regulation and membrane dynamics. Nature. 443, 651-657 (2006).
- Hammond, G. R. V., et al. PI4P And PI(4,5)P(2) Are Essential But Independent Lipid Determinants Of Membrane Identity. Science. 337, 727-730 (2012).
- Nakatsu, F., et al. PtdIns4P synthesis by PI4KIIIalpha at the plasma membrane and its impact on plasma membrane identity. J Cell Biol. 199, 1003-1016 (2012).
- Cantley, L. C. The phosphoinositide 3-kinase pathway. Science. 296, 1655-1657 (2002).
- Czech, M. P. Dynamics of phosphoinositides in membrane retrieval and insertion. Annu Rev Physiol. 65, 791-815 (2003).
- Spira, F., et al. Patchwork organization of the yeast plasma membrane into numerous coexisting domains. Nat Cell Biol. 14, 640-648 (2012).
- Barg, S., Knowles, M. K., Chen, X., Midorikawa, M., Almers, W. Syntaxin clusters assemble reversibly at sites of secretory granules in live cells. Proc Natl Acad Sci U S A. 107, 20804-20809 (2010).
- Sieber, J. J., et al. Anatomy and dynamics of a supramolecular membrane protein cluster. Science. 317, 1072-1076 (2007).
- Knowles, M. K., et al. Single secretory granules of live cells recruit syntaxin-1 and synaptosomal associated protein 25 (SNAP-25) in large copy numbers. Proc Natl Acad Sci U S A. 107, 20810-20815 (2010).
- Milosevic, I., et al. Plasmalemmal phosphatidylinositol-4,5-bisphosphate level regulates the releasable vesicle pool size in chromaffin cells. J Neurosci. 25, 2557-2565 (2005).
- van Rheenen, J., Jalink, K. Agonist-induced PIP(2) hydrolysis inhibits cortical actin dynamics: regulation at a global but not at a micrometer scale. Mol Biol Cell. 13 (2), 3257-3267 (2002).
- Hammond, G., Schiavo, G., Irvine, R. Immunocytochemical techniques reveal multiple, distinct cellular pools of PtdIns4P and PtdIns (4, 5) P2. Biochem J. 422, 23-35 (2009).
- Huang, S., et al. Phosphatidylinositol-4,5-bisphosphate-rich plasma membrane patches organize active zones of endocytosis and ruffling in cultured adipocytes. Mol Cell Biol. 24, 9102-9123 (2004).
- James, D. J., Khodthong, C., Kowalchyk, J. A., Martin, T. F. Phosphatidylinositol 4,5-bisphosphate regulates SNARE-dependent membrane fusion. J Cell Biol. 182, 355-366 (2008).
- Laux, T., et al. GAP43, MARCKS, CAP23 modulate PI(4,5)P(2) at plasmalemmal rafts, and regulate cell cortex actin dynamics through a common mechanism. J Cell Biol. 149, 1455-1472 (2000).
- Aoyagi, K., et al. The activation of exocytotic sites by the formation of phosphatidylinositol 4,5-bisphosphate microdomains at syntaxin clusters. J Biol Chem. 280, 17346-17352 (2005).
- Kabachinski, G., Yamaga, M., Kielar-Grevstad, D. M., Bruinsma, S., Martin, T. F. CAPS and Munc13 utilize distinct PIP2-linked mechanisms to promote vesicle exocytosis. Mol Biol Cell. 25, 508-521 (2014).
- Wang, J., Richards, D. A. Segregation of PIP2 and PIP3 into distinct nanoscale regions within the plasma membrane. Biol Open. 1, 857-862 (2012).
- Hell, S. W., Wichmann, J. Breaking the diffraction resolution limit by stimulated emission: stimulated-emission-depletion fluorescence microscopy. Opt Lett. 19, 780-782 (1994).
- van den Bogaart, G., et al. Membrane protein sequestering by ionic protein-lipid interactions. Nature. 479, 552-555 (2011).
- van Rheenen, J., Achame, E. M., Janssen, H., Calafat, J., Jalink, K. PIP2 signaling in lipid domains: a critical re-evaluation. Embo J. 24, 1664-1673 (2005).
- Sato, K., et al. Differential requirements for clathrin in receptor-mediated endocytosis and maintenance of synaptic vesicle pools. Proc Natl Acad Sci U S A. 106, 1139-1144 (2009).
- Ji, C., Zhang, Y., Xu, P., Xu, T., Lou, X. Nanoscale Landscape of Phosphoinositides Revealed by Specific Pleckstrin Homology (PH) Domains Using Single-molecule Superresolution Imaging in the Plasma Membrane. J of Biol Chem. 290, 26978-26993 (2015).
- Betzig, E., et al. Imaging intracellular fluorescent proteins at nanometer resolution. Science. 313, 1642-1645 (2006).
- Hess, S. T., Girirajan, T. P., Mason, M. D. Ultra-high resolution imaging by fluorescence photoactivation localization microscopy. Biophys J. 91, 4258-4272 (2006).
- Rust, M. J., Bates, M., Zhuang, X. Sub-diffraction-limit imaging by stochastic optical reconstruction microscopy (STORM). Nat Methods. 3, 793-795 (2006).
- Xu, K., Zhong, G., Zhuang, X. Actin, spectrin, and associated proteins form a periodic cytoskeletal structure in axons. Science. 339, 452-456 (2013).
- Wombacher, R., et al. Live-cell super-resolution imaging with trimethoprim conjugates. Nat Methods. 7, 717-719 (2010).
- Szymborska, A., et al. Nuclear pore scaffold structure analyzed by super-resolution microscopy and particle averaging. Science. 341, 655-658 (2013).
- Pertsinidis, A., et al. Ultrahigh-resolution imaging reveals formation of neuronal SNARE/Munc18 complexes in situ. Proc Natl Acad Sci U S A. 110, 2812-2820 (2013).
- Shim, S. -. H., et al. Super-resolution fluorescence imaging of organelles in live cells with photoswitchable membrane probes. Proc Natl Acad Sci. 109, 13978-13983 (2012).
- Huang, F., et al. Video-rate nanoscopy using sCMOS camera-specific single-molecule localization algorithms. Nat Methods. 10, 653-658 (2013).
- Balla, T., Várnai, P. Visualization of Cellular Phosphoinositide Pools with GFP-Fused Protein-Domains. Curr Protoc Cell Biol. 24, 24 (2009).
- Xu, C., Watras, J., Loew, L. M. Kinetic analysis of receptor-activated phosphoinositide turnover. J Cell Biol. 161, 779-791 (2003).
- Subach, F. V., et al. Photoactivatable mCherry for high-resolution two-color fluorescence microscopy. Nat Methods. 6, 153-159 (2009).
- Filonov, G. S., et al. Bright and stable near infra-red fluorescent protein for in vivo imaging. Nature Biotechnol. 29, 757-761 (2011).
- Zhang, M., et al. Rational design of true monomeric and bright photoactivatable fluorescent proteins. Nat Methods. 9, 727-729 (2012).
- Hohmeier, H. E., et al. Isolation of INS-1-derived cell lines with robust ATP-sensitive K+ channel-dependent and -independent glucose-stimulated insulin secretion. Diabetes. 49, 424-430 (2000).
- Dyachok, O., Isakov, Y., Sågetorp, J., Tengholm, A. Oscillations of cyclic AMP in hormone-stimulated insulin-secreting β-cells. Nature. 439, 349-352 (2006).
- Nan, X., et al. Single-molecule superresolution imaging allows quantitative analysis of RAF multimer formation and signaling. Proc Natl Acad Sci U S A. 110, 18519-18524 (2013).
- Sengupta, P., et al. Probing protein heterogeneity in the plasma membrane using PALM and pair correlation analysis. Nat Methods. 8, 969-975 (2011).
- Morone, N., et al. Three-dimensional reconstruction of the membrane skeleton at the plasma membrane interface by electron tomography. J Cell Biol. 174, 851-862 (2006).
- Peters, K. R., Carley, W. W., Palade, G. E. Endothelial plasmalemmal vesicles have a characteristic striped bipolar surface structure. J Cell Biol. 101, 2233-2238 (1985).
- Fujita, A., Cheng, J., Tauchi-Sato, K., Takenawa, T., Fujimoto, T. A distinct pool of phosphatidylinositol 4,5-bisphosphate in caveolae revealed by a nanoscale labeling technique. Proc Natl Acad Sci U S A. 106, 9256-9261 (2009).
- Durisic, N., Laparra-Cuervo, L., Sandoval-Álvarez, &. #. 1. 9. 3. ;., Borbely, J. S., Lakadamyali, M. Single-molecule evaluation of fluorescent protein photoactivation efficiency using an in vivo nanotemplate. Nat Methods. 11, 156-162 (2014).
- Thomas, C. L., Steel, J., Prestwich, G. D., Schiavo, G. Generation of phosphatidylinositol-specific antibodies and their characterization. Biochem Soc Trans. 27, 648-652 (1999).
- Várnai, P., Balla, T. Live cell imaging of phosphoinositides with expressed inositide binding protein domains. Methods. 46, 167-176 (2008).
- Honigmann, A., et al. Phosphatidylinositol 4,5-bisphosphate clusters act as molecular beacons for vesicle recruitment. Nature Struct Mol Biol. 20, 679-686 (2013).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır