Method Article
הדמיה סופר-רזולוציה מולקולה בודדת של 4,5-bisphosphate phosphatidylinositol בקרום פלזמה עם רומן פלורסנט בדיקות
In This Article
Summary
PI (4,5) P 2 מסדיר פונקציות סלולריות שונות, אך הארגון ננו שלה בקרום פלזמת התא הוא הבין היטב. על ידי PI תיוג (4,5) P 2 עם בדיקה ניאון כפול צבע התמזגו תחום Pleckstrin הומולוגיה, אנו מתארים גישה חדשנית ללמוד את PI (4,5) P 2 הפריסה המרחבית בקרום פלזמה ב ננומטר סולם .
Abstract
Phosphoinositides in the cell membrane are signaling lipids with multiple cellular functions. Phosphatidylinositol 4,5-bisphosphate (PI(4,5)P2) is a determinant phosphoinositide of the plasma membrane (PM), and it is required to modulate ion channels, actin dynamics, exocytosis, endocytosis, intracellular signaling, and many other cellular processes. However, the spatial organization of PI(4,5)P2 in the PM is controversial, and its nanoscale distribution is poorly understood due to the technical limitations of research approaches. Here by utilizing single molecule localization microscopy and the Pleckstrin Homology (PH) domain based dual color fluorescent probes, we describe a novel method to visualize the nanoscale distribution of PI(4,5)P2 in the PM in fixed membrane sheets as well as live cells.
Introduction
Phosphoinositides לתרום חלק קטן של ליפידים קרום מוחלטים, אבל תפקיד קריטי במגוון של תהליכים תאיים. הם כוללים שבעה חברים נגזרו זירחון הפיך או dephosphorylation של הטבעות אינוסיטול על 3 rd, 4 וה 5 עמדות ה 1. Phosphatidylinositol 4-פוספט (PI4P) ו 4,5-bisphosphate phosphatidylinositol (PI (4,5) P 2) הם שני phosphoinositides העיקריים שפועלים יחסית באופן עצמאי כמו שומנים הקובע של קרום התא התא (PM) 2,3. Phosphatidylinositol (3,4,5) -trisphosphate (PIP 3) הוא הרבה פחות בשפע מאשר PI4P ו PI (4,5) P 2, אבל יש לו פונקציות ייחודיות בתהליכים תאיים שונים כולל סרטן 4 וסוכרת 5. יש שומנים אלו אינטראקציות מולקולריות מורכבות עם effectors שלהם וחלבונים רבים אחרים. לכן, חשוב להבין את הארגון המרחבי של Pho אלהsphoinositides ב PM על בקנה מידה ננומטרי.
ראיות מצטברות הראו כי קומפלקסי חלבונים או אשכולות מולקולה בתחומי PM המוקפים יכולים לשמש איתות 6 נקודות חמות. לדוגמה, 1a syntaxin, חלבון מפתח המווסת היתוך קרום 7-9, מציג ארגון מצרר PM. להבדיל מן הקונצנזוס של ארגון אשכול 1a syntaxin, הפריסה המרחבית של phosphoinositides ב PM שנויה במחלוקת. PI (4,5) דפוסי התפוצה P 2 נע בין אחיד 10-12, כתמים גדולים 13,14, כדי צפוף אשכולות 14-18, תלוי סוגי תאים ושיטות הניסוי נעשה שימוש. הארגון המרחבי של PI (4,5) P 2 ברזולוציה גבוהה יותר הוא גם לא עקבי. מחקר באמצעות מגורה פליטת-דלדול (STED) מיקרוסקופיה 19 חשף מספר רב של PI צפופה (4,5) P 2 ננו-אשכולות (~ 73 ננומטר קוטר) בין הסדינים PM של PC-12 תאים 20 . תוצאה זו שונה ממחקרים באמצעות מיקרוסקופ אלקטרוני הקפאה מהירים (EM) 21,22, גישה השומרת על מבנה PM השלם של תאי חיים הרבה יותר טוב מאשר קיבוע כימי. הלה הראה בריכות נפרדות של PI (4,5) P 2; PI המרוכז יחסית (4,5) P 2 בבורות caveolae ומצופות וכן התפלגות אחידה על אזור PM השטוח. יתר על כן, PI ננומטריים (4,5) P 2 ארגון בסדינים הממברנה עשוי להיות שונה בתאי חיים קבועים. העבודה האחרונה שלנו הנושא הזה חקר בשני תאים קבועים ולחיות INS-1 באמצעות מיקרוסקופ לוקליזציה מולקולה בודדת (SMLM) 23.
SMLM מבוסס על stochastically מיתוג בקבוצה קטנה בלבד של fluorophores בכל זמן נתון, כך יכול להיות מקומי fluorophores פרט עם דיוק גבוה. רבים גישות הדמיה סופר-רזולוציה פותחו באמצעות עקרונות דומים לעלות לגבול השתברות של מיקרוסקופ אור קונבנציונלי, כזהים photoactivation מיקרוסקופיה לוקליזציה (PALM) 24, הקרינה מיקרוסקופיה לוקליזציה photoactivation (FPALM) 25, מיקרוסקופיה אופטית שחזור סטוכסטיים (STORM) 26,27 ו STORM ישירה (dSTORM) 28. עם תמונה להחלפה או fluorophores photoactivatable (צבעים או חלבוני ניאון), טכניקות SMLM לאפשר למדענים מבנים ביולוגיים תמונה ברזולוציה ננומטר 24,29,30 עם וידאו שער בתאים חיים 31,32.
באמצעות PI (4,5) P 2 כדוגמה, הצגנו את הגישה SMLM לחקור את הפיזור ננומטריים של phosphoinositides על PM. התחום PH של PLCδ1 (δ1 פוספוליפאז C) שקושר במיוחד כדי PI (4,5) P 2 הוא בדיקה ומבוססת עבור PI הדמיה (4,5) P 2 חלוקת המשנה הסלולר דינמיקה 33,34 ב PM . גנטיים אנחנו תייגנו תחום זה עם שני חלבוני ניאון, PAmCherry1 35 iRFP 36 לייצר חלבון היתוך כפול צבע (iRFP-PAmCherry1-PH PLCδ1) (איור 1A-B). PAmCherry1 משמש החללית photoactivatable של תחום PH עבור דקל iRFP משמש כאינדיקטור בכלל לזהות תאים transfected לפני רכישת PALM . אנחנו מיישמים בדיקת ניאון כפול צבע זה הדמית SMLM בין סדיני הממברנה הקבועים. עבור הדמית PALM חייה, אנו מתויגים mEOS3 37 במקום PAmCherry1 לתחום PH PLCδ1 ליצור חללית mEOS3.1-PH PLCδ1 ליעילות ובהירויות הפוטון הטוב שלו (איור 1 ג-ד).
הדמיה SMLM עם בדיקות הרומן אלה ראש ממשלת מפרישי אינסולין INS-1 תאים 38 חשף תיוג הומוגנית של PI (4,5) P 2 ברוב האזורים PM וכן PI מרוכז (4,5) P 2 microdomains כי מתערבבים בדלילות בתחומים PM שטוח וכמה מבנים דמויי filopodia 23. נההפצת noscale של PI (4,5) P 2 מספקת בסיס מבני חשיבה מחודש כיצד הוא מתפקד בתאים חיים.
Protocol
1. גיליון ממברנה הכנה קיבוע
- הכן גליונות קרום שכותרתו עם iRFP-PAmCherry1-PH PLC δ1
- הכן את קידוד פלסמיד דנ"א iRFP-PAmCherry1-PH PLC δ1 23 תוך שימוש בטכניקות ביולוגיה מולקולריות סטנדרטיות.
- תרבות INS-1 תאים על # 1.5 18 מ"מ עגול coverslips מראש מצופה 30 מיקרוגרם / מ"ל פיברונקטין כדי 50-70% confluency הבאים פרוטוקולים תרבית תאים INS-1 תקן 38,39. Transfect התאים יום לאחר 50 עד 70% confluency הוא הגיע.
- תאים Transfect עם iRFP-PAmCherry1-PH PLC δ1 באמצעות מגיב transfection ליפוזום הבאים פרוטוקולים של היצרן. לאחר transfection, לאפשר לתאים לגדול במשך 48 שעות.
- ביום הניסוי, coverslips מעיל (על-צד אחד) עם ~ 0.5 - 1 מ"ל של 500 מיקרוגרם / Poly-D- ליזין מ"ל (PDL; מדולל ב DH 2 O) במשך 1-2 שעות. ואז לנקז PDL על ידי הצבת נייר טישו עלבקצה coverslip. מניחים את coverslips על צלחת מתכת מראש צונן (4 ° C) לשימוש מאוחר יותר.
- שטפו תאים טרום טרנספקציה INS-1 גדל על coverslips עם ~ 0.5 - 1 מ"ל קר כקרח בופר פוספט מלוחים (PBS) המכיל 1 מ"מ EGTA. חזור על לשטוף שלוש פעמים ומסננים PBS.
- מניחים את coverslips עם תאים בתרבית (תא בצד פונה כלפי מטה) על coverslips מצופה PDL על צלחת מתכת מראש צונן עם פינצטה. השאירו את הצלחת במקרר (4 מעלות צלזיוס) במשך 7 - 10 דקות כדי לאפשר לתאים לצרף את coverslips מצופה PDL (איור 2).
הערה: זמן הדגירה צריך להיות בטווח של 7 - 10 דקות עבור התקשרות טובה יותר של התאים על פני השטח מצופה PDL. סביבת המקרר יבשה דגירה לא צריכה להיות ארוכה מדי. - הסר את לוחית המתכת מהמקרר. לקלף בעדינות את coverslip המכיל את התאים מראש transfected באמצעות פינצטה. זה מייצר שכבה דקה של גיליון קרום התא עלPDL מצופה coverslip. לשטוף בעדינות את הסדינים הממברנה עם ~ 0.5 - 1 מ"ל קר כקרח PBS ולאחר מכן לתקן עם ~ 0.5 - 1 מ"ל קר כקרח 4% paraformaldehyde (PFA) + 0.2 glutaraldehyde% (GA) ב PBS במשך 15 דקות ב 4 ° C.
זהירות: Paraformaldehyde ו glutaraldehyde רעילים. לטפל בהם במנדף עם העור ומשקפי מגן. - לאחר קיבוע, תמונה הסדינים קרום מיד (ראה סעיף 3) או לאחסן ב ~ 0.5 - 1 מ"ל PBS ב 4 ° C.
הערה: לאחר תיקון גיליון הקרום, לא תהיה שיווי משקל מחייב של בדיקות PH מ cytosol ו- PI (4,5) P 2. בדיקות PH כבול תהיינה לנתק בהדרגה מגיליון הממברנה מפוזר לתוך התמיסה (למרות שזה עלול לקחת ימים עד שבועות). לכן, מומלץ תמונת הדגימות הקבועות מייד אחרי הכנת מדגם.
- הכן גליונות קרום עבור PI (4,5) P 2 תיוג נוגדן ספציפי
- תרבות INS-1 תאים על 1.5 #, 18 מ"מ עגול coverslips מראש מצופה 30 &# 181; g / ml פיברונקטין 50% מפגש -70%. תאים Transfect עם DNA פלסמיד למחרת כמתואר בשלב 1.1.3.
- חזור על שלבים מ 1.1.4 ל 1.1.7 כמתואר לעיל.
הערה: בצע את ההליכים הבאים ב 4 ° C. - שטפו את coverslips המכיל גיליונות PM קבוע שלוש פעמים עם ~ 0.5 - 1 מ"ל קר כקרח PBS המכיל 50 מ"מ NH 4 Cl. להרוות את הסדינים עם ~ 0.5 - 1 מ"ל borohydride נתרן 0.1% ב PBS במשך 7 דקות, ולשטוף עם ~ 0.5 - 1 מ"ל PBS (ללא 50 מ"מ NH 4 Cl).
- חסום את דגימות עם ~ 0.5 - 1 מ"ל חסימת פתרון (פתרון PBS המכיל 5% (v / v) בסרום עז נורמלי, 5% (v / v אלבומין בסרום שור) ו -50 מ"מ NH 4 Cl) במשך 45 דקות. ואז, דגירה עם ~ 0.5 - 1 מ"ל העיקרי PI (4,5) P 2 נוגדנים (1: 300 דילול) בחסימת פתרון עבור שעה 1. לשטוף שלוש פעמים (10 דקות בכל פעם) עם ~ 0.5 - 1 מ"ל PBS המכיל 50 מ"מ NH 4 Cl.
- דגירה דגימות עם ~ 0.5 - 1 מ"ל משני F (ab ') ועכבר 2-עז-אנטינוגדן מצומדות עם fluorophores (1: 300) בחסימת המאגר עבור שעה 1. לשטוף שלוש פעמים עם ~ 0.5 - 1 מ"ל PBS.
- דגימות פוסט לתקן עם PFA 4% + 0.2% GA במשך 15 דקות, ולאחר מכן לשטוף דגימות שלוש פעמים עם PBS (7 דקות בכל פעם). המשך לסעיף 3 הדמיה או לאחסן ב ~ 0.5 ~ 1 מ"ל PBS ב 4 ° C לשימוש מאוחר יותר.
הערה: הכן דגימות ב 4 מעלות צלזיוס. השתמש 4% PFA + 0.2% מקבע GA לשמר את החלוקה הפיזיולוגית של phosphoinositides ב PM. הכנה או קיבעון RT עם 4% PFA בלבד עלולה לגרום להפרעות משמעותיות (איור 4).
2. הכנת תרבית תאים עבור Live- תא הדמיה עם δ1 mEOS3.1-PH PLC
- הכן את פלסמיד דנ"א המקודד את δ1 mEOS3.1-PH PLC כפי שתואר לעיל 23.
- תרבות INS-1 תאים על 1.5 18 מ"מ # עגולים coverslips מראש מצופה 30 מיקרוגרם / מ"ל פיברונקטין עד שהם מגיעים 50% -70% confluency בא פרוטוקולי תרבית תאי INS-1 תקן 38,39.
- למחרת, transfect תאים INS-1 עם PLC mEOS3.1-PH δ1 פלסמיד דנ"א באמצעות מגיב transfection ליפוזום בעקבות פרוטוקול של ייצור. דגירה במשך 48 שעות לפני ההדמיה.
3. PALM רכישת תמונה של פחים ממברנות בתאים חיים
- רכישת התמונה PALM של גליונות הממברנה
הערה: כאן, הקרינה השתקפות פנימית מוחלטת (TIRF) מיקרוסקופ מערכת מבוססת SMLM (שמן 100X, APO, NA = 1.49, WD 0.12 מ"מ) 23 משמש לכל רכישת התמונה.- לפני הדמיה, לדלל 1 μl של פתרון חרוז ניאון ב 10 מ"ל PBS + 50 מ"מ MgCl 2. הוסף 200 μl מדולל פתרון לתוך תא הדמיה דגימות תאים המכילים (בצעדיו 1.1.8 / 1.2.6) במשך 10 דקות. לאחר מכן, לשטוף עם PBS שלוש פעמים.
- הפעל את מערכת הדמיה PALM. בשנת תוכנת ההדמיה הקשורה, בחר "בערוץ iRFP &# 34; כפתור (642 ננומטר לייזר עירור, 700/75 ננומטר פליטה). מצא קרום התא להביע בדיקות PH בערוץ iRFP.
הערה: גיליון הממברנה צריך חרוז ניאון בקרבת מקום. זה נדרש עבור תיקון להיסחף אחר כך. - השתמש בלחצן "הלכיד" לאסוף תמונת TIRF קונבנציונלית של קרום התא בערוץ iRFP כהפניה לשיקום דמותה עתידי. הגדרת זווית TIRF נורמלית (כלומר, לאחר שהגיע הזווית הקריטית, להפוך -1.5 מעלות) על ידי הקלדת 2140 בזווית TIRF הגדרת הדמיה. השתמש זווית הגדרה זו עבור כל השלבים אלא אם צוין אחרת.
הערה: במערכת TIRF המתוארת כאן, 3,500 היא הזווית האנכית עד 2,200 הוא הזווית הקריטית TIRF, ואת 2140 היא הזווית הנורמלית TIRF, המהווה 1.5 תואר יותר לאחר זווית קריטית TIRF. זווית TIRF הצרה שהוזכרה להלן ב 3.2.3 היא בגודל 2120, המהווה 2 אחר תואר לאחר שהגיע זווית קריטית TIRF. - לעבור לערוץ PAmCherry1 ידי לחיצה הכפתור ערוץ דואר RFP (561 ננומטר עירור, 600/50 ננומטר מסנן פליטה). התאם את פס הגלילה בפנקס "AOTF" כל הדרך בצד ימין יש תאורה מלוא העוצמה של לייזר 561 ננומטר במשך 10-20 שניות כדי להלבין את הקרינה קרום ברקע.
- הגדר את הגדרת המצלמה האופטימלית (binning 2x2) בלשונית "פורמט" ואת פרוטוקול הרכישה מהיר בלשונית "ND רצף הרכישה" (בדרך כלל 10,000-40,000 תמונות ב 20 הרץ).
- התחל רכישת תמונות PAmCherry1 (561 ננומטר לייזר בהספק מלא, 50 msec / מסגרת) עם הפעלת לייזר סימולטני 405 ננומטר ברמה נמוכה (0.1% - 1%) על ידי לחיצה על כפתור "הפעל כעת". התאם את עוצמת ליזר 405 ננומטר כדי שנקודות פרט מבודדות מרחבית בכל מסגרת ניתנות לזיהוי בקלות.
הערה: מספר PAmCherry1 מולקולות activatable פוחת בהדרגה במהלך רכישה. 405 עוצמת ליזר ננומטר צריכה להיות בהדרגה כדי לשמור על הצפיפות האופטימלית של אותות מולקולה בודדים בכלמִסגֶרֶת. - המשך רכישת תמונות עד אין אות מולקולת PAmCherry1 יחידה הופעל.
- הדמית PALM בתאים חיים
- לפני ההדמיה, לדלל חרוזי ניאון לתוך תא ההדמיה למשך 10 דקות כמתוארות בשלב 3.1.1. ואז להתחיל הדמית PALM ידי פתיחת תוכנת ההדמיה הקשורה.
הערה: השתמש תא הדמיה מגנטית שחרור מהיר עבור דימות תאים חיים. לשמור על מרכז השדה הדמיה ב 35 ° C עם בקר טמפרטורה מתחת זלוף מתמיד עם חיץ תאיים (פתרון תאיים: 135 mM NaCl, 5.6 KCl מ"מ, 2.6 מ"מ CaCl 2, 1.2 מ"מ MgCl 2, 3 גלוקוז מ"מ, 20 מ"מ HEPES; pH = 7.3). - בחר בלחצן ערוץ GFP (525/50 ננומטר פליטה). זהה את קרום התא להביע בדיקות ניאון מבוסס על ניאון ירוק mEOS3 תחת 488 עירור לייזר ננומטר. ודא כי חרוזי ניאון בקרבת מקום גם כלולים במהלך ההדמיה, שכן הוא נדרש מאוחר יותר עבור DRI מחוברתיקון רגל.
- לחצו על כפתור "לכידת" לאסוף תמונה TIRF של קרום התא mEOS3 ערוץ (ירוק) כדימוי התייחסות. השתמש תאורת עירור רדודה גל חולפת (לאחר שהגיע הזווית הקריטית, להפוך עוד 2 מעלות) על ידי הקלדת 2120 בזווית TIRF הגדרת הדמית תא חי.
הערה: זו מקטינה את הקרינה מן mEos3-PH מאוגד ב cytosol סמוך קרום הפלזמה. - Switch to "ערוץ RFP" כפתור (561 ננומטר עירור, 600/50 ננומטר פליטה). השתמש ליזר ננומטר מלא כוח 561 אקונומיקת קרינת רקע של סדיני הקרום עבור 10 ~ 20 שניות עם הגלילה של "כרית AOTF" (ראה 3.1.4).
- התחל רכישת התמונה על ידי לחיצה על כפתור "הפעל כעת" בערוץ אדום (561 ננומטר מלוא העוצמה, שקיעה ב- 10 msec / מסגרת של "המצלמה" הגדרת טאב) עם הפעלת לייזר סימולטני 405 ננומטר. התאם את עוצמת הלייזר 405 ננומטר להפעיל נקודות מופרדים מרחביתבכל מסגרת.
הערה: ככל התמורה לרכישה, un-המרה mEOS3.1-PH PLC δ1 מספר מולקולה לאט פוחתת. בהדרגה להגדיל את כוח לייזר 405 ננומטר כדי לייעל את האות מולקולה בודדת. אורך רכישת ההדמיה תלוי במטרת הניסוי. לרכוש תמונות ברציפות במשך 5 דקות בתנאים רגילים. אם רכישה יותר נדרשת, לאסוף ערימות תמונה מרובות במקום ערימת תמונה אחת, גדולה. גודל הקובץ של כל ערימת תמונה לא יעלה על 4 GB או שזה ישפיע אנליזת תוכנה מאוחר יותר.
- לפני ההדמיה, לדלל חרוזי ניאון לתוך תא ההדמיה למשך 10 דקות כמתוארות בשלב 3.1.1. ואז להתחיל הדמית PALM ידי פתיחת תוכנת ההדמיה הקשורה.
4. עיבוד תמונה SMLM ושיקום
- מעביר את קבצי תמונה (.tif ערימות תמונה) לתחנת ניתוח תמונה. הפעל את התוכנית שחזור תמונה (שנכתב מותאם אישית) ב- Matlab כפי שתואר לעיל 37 ו טען את ערימת התמונה על ידי לחיצה על הכרטיסייה "קובץ" בתפריט הראשי, ולאחר מכן "פתח", ואז "קובץ חדש".
- זיהוי locaLize אירועים מולקולריים בודדים מכל מסגרת. הגדר סינון סף עוצמת עם מספר הסף (1-10) ב "אדוה". בדוק את הגדרות פרמטר האופטימליות לגילוי נקודת ראייה לפני השחזור. לאחר מכן עבור אל הכרטיסייה "PALM" ולחץ על "תהליך צעד אחד" להתחיל שחזור תמונה.
הערה: עוצמת סף לגילוי נקודה הוא שרירותי ובלתי תלוי על ניסיון אישי. מספר מחקרים עשויים להידרש ליצור סף זיהוי אופטימלי כי לא מרימים מדי מוסמכות (DIM) נקודות ולא מסננת יותר מדי נקודות מוסמכות (בהירות). התאם ופרמטרים נוספים כדי לייעל ניתוח נתונים. כאן, מרחק בשכונה (נקודות קרינה במסגרות שהכנות במרחק משולבות) מוגדר 65 ננומטר (1/2 רוחב פיקסל) ותאים כמו מולקולה בודדת. מסגרות גאפ (אירועי מולקולה בודדים שהתרחשו במרחק מסגרות ושכונה אלה אוחדו מצויד כאירוע מולקולה בודד) הןלהגדיר כמו 26 מסגרות (1.3 שניות) עבור הדמיה PAmCherry1 40. התאם פרמטר אלה על פי המאפיינים של בדיקות מולקולה בודדות רכישה בשיעור להימנע יתר לספור 40 SMLM. לשים תיקון להיסחף עם חרוזי ניאון במהלך השחזורים.- הדמית סדיני הממברנה הקבועים שכותרתו ידי iRFP-PAmCherry1-PH PLC δ1, לשחזר את ערימות תמונה כולה מאותו גיליון קרום לתמונה סופר-רזולוציה יחידה 37.
- לקבלת דוגמיות תא החיות שכותרתו ידי mEOS3.1-PH PLC δ1, להפריד את ערימת התמונה כולה לתוך כמה ערמות קטנות של 1,000 מסגרות כך שניתן 1,000 רצופת מסגרת מחסנית משוחזרת כתמונת סופר-רזולוציה יחידה, אשר בעל רזולוציה זמנית של 10 שניות. בסופו של דבר, לשלב את כל התמונות בסדרה פעם לתוך ערימה בסדרת הגמר זמן 23.
הערה: הדמית PALM לחיות תאים, מספר קטן של בדיקות מופעלות אסור לזוז או לניתקמ PI (4,5) P 2 PM לפני הלבנה. כדי להסביר את דגימת היתר של החלליות, לשלב אותות מולקולה בודדים במסגרות השכנה בתוך 130 ננומטר (במקום 65 ננומטר) לתוך אירוע פליטת יחיד במהלך ניתוח תמונה.
- לאחר קבלת התמונות המשוחזרות, לבצע ניתוח תמונה עוד יותר עם התכנית האישית נכתב Matlab לכמת צפיפות מולקולה, צפיפות מייקרו-תחום / גודל, וניתוח אשכול עם מתאם זוג 41.
תוצאות
חוסר הוודאות לוקליזציה (σ) של מערכת סופר-רזולוציה שלנו הוא 14.73 23 ננומטר. השוואה ישירה בין TIRF ותמונות PALM הפגינו שיפור משמעותי של רזולוציה מרחבית. איור 3 א-ב 'מראה את התמונות PI (4,5) P 2 TIRF נציג שכותרתו עם PI (4,5) נוגדן P 2 ו iRFP-PAmCherry1-PH PLC δ1 בסדינים קרום טיפוסי תאים חיים. התמונות עם מיקרוסקופיה TIRF קונבנציונאלי בסדינים קרום דומות להפליא לאלה תאים שלמים חיים שכותרתו עם חלבון פלואורסצנטי ירוק משופרת (EGFP) מתויג תחומים PH (EGFP-PH PLCδ1) (איור 3 ג). כל הדגימות הראו חלוקה שווה של בדיקות. לעומת זאת, קיבעון הלא אופטימלי של הדגימות הביא PI הצפופה החדה (4,5) P 2 אשכולות וירידה בעוצמת אות (איור 4). בתנאי קיבעון אופטימליים, tהוא תמונות ברזולוצית סופר של PI (4,5) P 2 תאים קבועים (איור 5) חשף חלוקה הומוגנית של בדיקות ב חלק ניכר של אחר הצהריים עם מילויי ריכוז מוגבלים בלבד. כמה תיקוני קרום מועשרים PI (4,5) P 2 בדיקות חולקו בדלילות היו בגדלים שונים. תמונות PALM תא חי להציג חלוקה מרחבית דומה לזו של תאים קבועים (איור 6). ניתוח מפורט של PI (4,5) P 2 אותות מעל תוצאות בזמן בדינמיקה מהירה באזורים מקומיים, ללא שינויים משמעותיים השפע שלהם באזורים רחבים.
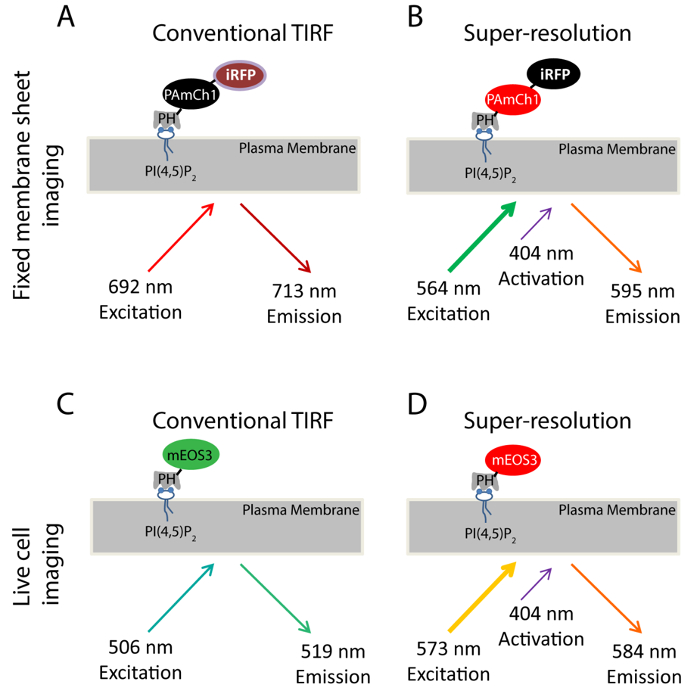
Scheme באיור 1. עבור בדיקות ניאון נעשה שימוש במחקר זה. (AB) iRFP-PAmCherry1-PH החללית δ1 PLC המשמשים בניסויים גיליון הממברנה קבוע. במהלך הדמיה TIRF קונבנציונאלי (א), 640 ננומטר לייזר משמש כדי לעורר את iRFP (Ex: ננומטר 692; Em: 713 ננומטר). תמונה TIRF נלקח במצב זה משמש כתמונת התייחסות TIRF הדמיה סופר-רזולוציה מתקבל על ידי הדמיה PALM (B). לייזר 405 ננומטר משמש צילום להפעיל את fluorophore PAmCherry1 ו לייזר 561 ננומטר משמש כדי להלהיב PAmCherry1 (Ex: 564 ננומטר; Em: 595 ננומטר) עבור הדמיה PALM. (CD) mEos3.1-PH חללית PLCδ1 המשמש בניסויי התא החיים. (ג) במהלך הדמיה TIRF קונבנציונאלי, לייזר 488 ננומטר משמש כדי להלהיב mEOS3.1 (Ex: 506 ננומטר; Em: 519 ננומטר). (ד) לאחר photoconversion ידי ליזר 405 ננומטר, mEos3.1 הופך בצורה האדומה (Ex: 573 ננומטר; Em: 584 ננומטר). ו ליזר 561 ננומטר משמש לרכישות PALM אנא לחץ כאן כדי להציג גרסה גדולה יותר של נתון זה.
s / ftp_upload / 54,466 / 54466fig2.jpg "/>
Scheme איור 2. להכנת גיליון קרום מ INS-1 תאים. (א) מניחים את coverslip עם תאים בתרבית פונה כלפי מטה על coverslip מצופה PDL ולחכות 7 ~ 10 דקות ב 4 ° C כדי לאפשר התקשרות התא אל PDL- coverslip מצופה. (ב) לקלף את coverslip העליון עם פינצטה ולתקן את גיליון הקרום מצורף coverslip מראש צופה PDL. (C) תמונה הדגימות עם TIRFM ופאלם. אנא לחץ כאן כדי לצפות בגרסה גדולה יותר של דמות זו.
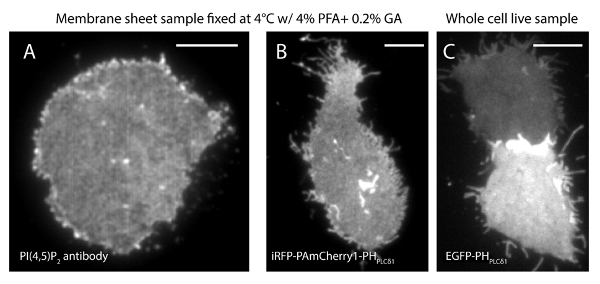
PI איור 3. (4,5) P 2 הארגון המרחבי דומה בין הסדינים הממברנה בתאים חיים שלמים תחת מיקרוסקופ TIRF קונבנציונאלי. (א)תמונת TIRF הטיפוסית של גיליונות הממברנה קבוע ב 4 ° C עם PFA 4% 0.2% GA. PI (4,5) P 2 סומן עם PI (4,5) P 2 נוגדן ספציפי. (ב) גיליון קרום מהתא INS-1 להביע iRFP-PAmCherry1-PH δ1 PLC. (C) תמונה TIRF של שני תאים שלמים לחיות להביע PLCδ1 EGFP-PH ברמות שונות. ברי סולם: (א): 3 מיקרומטר; (ב) ו- (ג):. 5 מיקרומטר אנא לחץ כאן כדי לצפות בגרסה גדולה יותר של דמות זו.
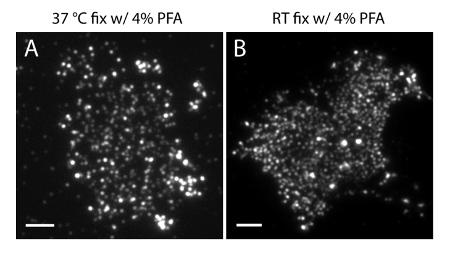
איור 4. PI (4,5) P 2 ארגון המרחבי בסדיני קרום רגיש לתנאי קיבעון משותפים. (א) גיליונות ממברנה קבועים על 37 מעלות צלזיוס עם 4% PFA לבדומסומן עם PI (4,5) P 2 נוגדנים ספציפיים (כמו באיור 3 א). (ב) ממברנה גיליון קבוע ב RT עם PFA לבד ומסומן עם PI (4,5) P 2 נוגדן ספציפי. ראוי לציין, כי אשכולות צפופים של PI (4,5) בדיקות P 2 גלויים לעין תחת מיקרוסקופ TIRF, בניגוד תמונות הקרינה אפילו הרבה יותר לראות באיור 3 א. ברי סולם: AB:. 3 מיקרומטר אנא לחץ כאן כדי לצפות בגרסה גדולה יותר של דמות זו.
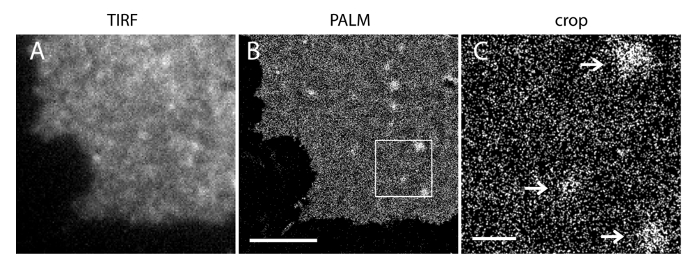
איור 5. PALM הדמיה של PI (4,5) P 2 בדיקות מגלה הפצה בקנה מידה ננומטרי שלהם בתוך PM תא INS-1. (א) התמונה iRFP TIRF של גיליון קרום מתא INS-1 להביע iRFP-PAmCherry1-PH PLCδ1. (ב) מקביל תמונה בכף PM באותו האזור המבוסס על שחזור אות PAmCherry1. שימו לב PI הומוגנית (4,5) P 2 הפריסה המרחבית באזורים PM הגדולות וכמה PI (4,5) P 2 microdomains. (ג) תצוגה מוגדלת של האזור התאגרף (B). החצים מצביעים בדלילות microdomains PM מועשר PI (4,5) P 2 בדיקות. ברי סולם: A ו- B: 3 מיקרומטר; C: 500 ננומטר. אנא לחץ כאן כדי לצפות בגרסה גדולה יותר של דמות זו.
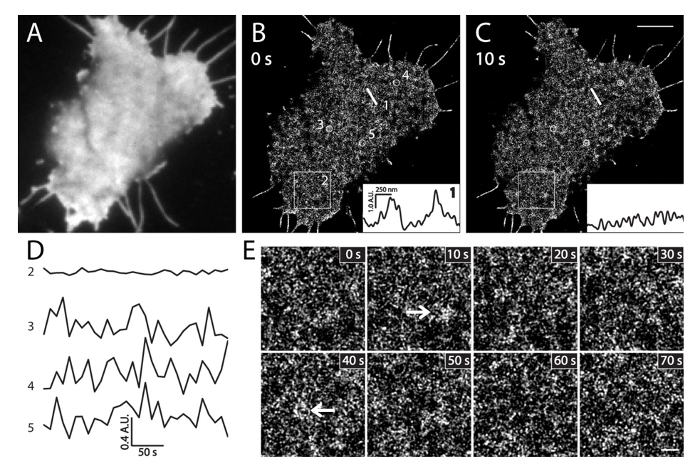
איור 6. הדמיה PALM בתאים INS-1 בשידור חי. (א) TIRF תמונה של PI (4,5) P 2 בתוך תא חי INS-1 להביע mEos3.1-PH PLCδ1. התמונה נרכשה במהירות במסלול הירוק לפני רכישת PALM (35 מעלות צלזיוס). (ב) Sequential לחיות תאים תמונות PALM ב -10 מרווח שניות. ריבועי להראות את הפרופילים העוצמים PI המקומי (4,5) צפיפות P 2 יחד באותה התנוחה ישר קו 1 במועדים שונים (ב) ו- (ג). הערת השינויים בעוצמת המקומית הגדולים שלהם בתוך 10 שניות. (ד) זמן כמובן של שינויי העצמה הממוצעים של PI (4,5) P 2 באזור הגדול (BOX2, מיקרומטר 3x3) ו עיגולים קטנים (3, 4, ו -5, 500 בקוטר ננומטר) ב (ב) במהלך 5 דקות של הדמית PALM (מסגרת / 10 שניות). הערת התנודות העוצמות המהירות של PI המקומי (4,5) P 2 בדיקות (עיגול 3, 4 ו -5) לעומת שינויים קטנים מאוד בתחום הרחב (התיבה 2). (ה) תמונות PALM המוגדל של אזור BOX2 (ב '), במועדים מצוינים. החצים מצביעים PI (4,5) P 2 טלאים קרום מועשר לחץ ליצתנאי hysiological. ברי סולם: C: 3 מיקרומטר; E: 500 ננומטר. אנא לחץ כאן כדי לצפות בגרסה גדולה יותר של דמות זו.
Discussion
לפתרון בעיות, שני תהליכים צריכים תשומת לב נוספת: ייצור גיליון הממברנה קיבעון מדגם. כפי שתואר בפרוטוקול, זמן הדגירה של coverslips בשלב 1.1.6 חשוב לייצור גיליון הממברנה. זמן דגירה אופטימלית תחת תנאי הניסוי שלנו הוא 7-10 דקות (איור 2). זמן רב יותר מאשר דגירת 10 דקות יהיה לייצר תאים שלמים במקום סדיני הקרום על coverslips PDL ו דגירה קצרה יוביל פחות או סדינים לא קרום על coverslips מצופה PDL. כפי שתואר בפרוטוקול, את fixatives וטמפרטורה במהלך קיבעון הם קריטיים לשמירה על חלוקת PI (4,5) P 2 PM. קיבוע ב RT או שימוש 4% -PFA לבדו יכול לעוות את חלוקת השומנים נורמלי PM.
על ידי יישום מיקרוסקופיה PALM קרום לחקר ליפידים, אנו מסוגלים לקיים את חלוקת בקנה מידה ננומטרי של PI (4,5) P 2, phosphoinositide מפתח שמתווך מכל יסוד פעילות הסלולר. פריסה המרחבית זה של PI (4,5) P 2 עם מילויי ריכוז מוגבלים בתאי INS-1 מספקת מסגרת חשיבה מחודשת אינטראקציות שומני חלבון ואירועי איתות מקומיות של PI (4,5) P 2 בתאים אלה. יתר על כן, על פי שיטה בעבודה זו יכולה לחול גם על מחקר פוספוליפידים בממברנה אחר עם בדיקות נכונות, ובכך, מתן כלי רומן ללמוד phosphoinositides בתהליכים ביולוגיים.
שימוש יריעות קרום בעבודה זו עוקף שני נושאים עיקריים מחקרים מורפולוגיים פוספוליפידים: טיפול דטרגנט וזיהום אות פוטנציאל מן cytosol. דטרגנטים לעיתים קרובות לגרום אשכולות ו אובדן משמעותי של אות פוספוליפידים PM. הזיהום של אות cytosolic הוא בעייתי במיוחד במקרה של phosphoinositides שפע הנמוך על 23 PM, כגון PI (3,4,5) P 3 ו PI (3,4) P 2. דגימות גיליון ממברנה מסוגלות circumvent הבעיות הללו מבלי לשבש מבנים משמעותיים הקשורים קרום הפלזמה, כגון meshwork יקטינו קליפת המוח ובורות מצופה clathrin 42,43. ההתפלגות הומוגנית היחסית של PI (4,5) P 2 PM היא בהסכם טוב עם מחקרי EM ההקפאה מהירים אחרים באמצעות GST-PH PLC בדיקות δ1 בקרום פיברובלסטים 44.
חשוב לציין כי תנאי עיבוד מדגם פסולים יכולים לייצר תוצאות מטעות. ראשית, חשוב לבצע את פעולות קיבעון בטמפרטורה נמוכה יותר (4 ° C) ולהשתמש מקבע GA לייצור גיליון הממברנה. כפי שניתן לראות בתרשים 3, טמפרטורה חמה קיבעון PFA ללא GA אינה מספיקה כדי לתקן phosphoinositides ב PM התא. זה יכול לעוות את PI בשלמותה (4,5) P 2 הפצה וליצור אשכולות חדו כי לא נצפו בתאים חיים בתנאים פיסיולוגיים. שנית, השימוש של PAmCherry1 כמולחקור את SMLM, ולא בדיקות אחרות, הוא מכריע הדמיה PALM כמותית. היתרון של יישום PAmCherry1 מגיע מנכסים צילום פיזי מולקולרי יחיד היטב מאופיין שלה 35,40,45, כגון בהירות, יעילות צילום הפעלה גבוהה יותר מכל, מוגבלת מאוד צילום מהבהב. מאפיינים אלה מאפשרים לנו לחסל חפצי אשכול פוטנציאליים צילום המהבהב וכמותית לנתח את הצפיפות המולקולרית של PI הממברנה (4,5) P 2.
גישה זו גם יש מגבלות. ראשית, שיטת גיליון הקרום השתמשה במחקר זה לא תחקה את חלוקת פיזיולוגיים מלאה של PI (4,5) P 2 כי התא מופר לפני ההדמיה. עם זאת, הדמית PALM לחיות שלנו מציגה את חלוקת הומוגנית יחסית דומה של PI (4,5) P 2, תומכות התוצאות שנצפו עם דגימות וכו הממברנה. שנית, כפי שדנו בעבודה הקודמת שלנו 23, SMLM דורש מומחיות הדמיה מיותר על חיפושtention להימנע חפצי הדמיה שעלולה להתעורר מתהליכים שונים, כוללים הבדיקות בשימוש, הכנת מדגם קיבעון, דגימת תמונה ושחזור. לבסוף, על פי בדיקות המבוססות על תחומי PH ונוגדנים היו בשימוש נרחב במחקרי phosphoinositide 46,47 אפשריים עדיין לא שכל PI (4,5) P 2 בקרום ניתן לאתרם באמצעות גישה זו. לדוגמא, PI (4,5) P 2 מחויבי חלבונים אנדוגניים אחרים עשוי לא להיות נגיש בדיקות PH או נוגדנים, וזה עלול לגרום הערכה נמוכה מדי של PI (4,5) P 2 בשל הפרעת השטח של לחקור את עצמם. דרך חלופית של PI תיוג (4,5) P 2 תהיה באמצעות Top-פלואוריד PI (4,5) P 2 48, אנלוגי P 2 מראש שכותרתו PI (4,5) עם שינוי על הזנב של המקורי PI (4,5) P 2. עם זאת, ניתן להמיר במהירות לתוך תת phosphoinositide אחרות של חילוף החומרים בתא חי מהר מאז טבעת אינוסיטול שלה זהה endogenouPI של (4,5) P 2. זה מעלה את החשש אם PI מראש שכותרתו זה (4,5) אנלוגי P 2 בתאים חיים יכול לייצג נאמנה PI (4,5) P 2 ולא מוצרים מטבולית שלה. לכן, למרות מספר מגבלות, בדיקות המבוססות על תחומי PH עדיין בין הבדיקות הטובות ביותר כי כבר בשימוש נרחב כדי לפקח PI (4,5) הפצת P 2 ודינמיקה על ראש ממשלת תאים.
היישום העתידי של מתודולוגיה זו ניתן להרחיב את לימודי phosphoinositide אחרים, כגון PI (3,4,5) P 3 ו PI (3,4) P 2. לסיכום, גישת SMLM הרומן משמשת כאן פותחת דרכים חדשות ללמוד phosphoinositide בתאים. באמצעות PI (4,5) P 2 כדוגמה, אנחנו מדגימים את המאפיינים הייחודיים של הדמיה PALM במחקר מורפולוגי וכמותית של מולקולות קרום התא, כמו גם חסרונות. גישה זו ניתן להתאים מולקולות אחרות של אינטרסים יהיו יישומים רחבים בביולוגיה של תא.
Disclosures
The authors have nothing to disclose.
Acknowledgements
This work is supported by the National Institutes of Health (NIH) grants R01DK093953 (X.L.), P30NS069271, BRFSG-2014-07 (X.L.). C.J. is partially supported by American Heart Associate pre-doctoral fellowship (14PRE20380168, to C.J.).
Materials
| Name | Company | Catalog Number | Comments |
| Microscope | Nikon | Ti-U | |
| sCMOS camera | Andor | Neo | |
| Spinning disk | Yokogawa | CSU X-1, 10,000 rpm | |
| High Power Monolithic Laser Combiner SP with 405, 488, 561 and 642 nm lasers. | Agilent | MLC400 | laser original powers & powers at the end of optical fiber) 405 nm: 15 mW & 13 mW; 488 nm: 45 mW & 42 mW; 561 nm: 45 mW & 40 mW; 640 nm: 35 mW & 16 mW. |
| 100X Objective | Nikon | APO 100X Oil, NA 1.49, WD 0.12 mm | |
| Nikon acquisition and analysis software (NIS Element) | Nikon | ||
| Matlab | MathWorks | ||
| Coverslip | Warner | 64-0714 | Round 18 mm coverslip, #1.5 |
| Fibronectin | Millipore | FC010-5MG | |
| Lipofectamin 3000 (transfection reagent) | Invitrogen | L3000-008 | |
| Glutaraldehyde | Electron Microscopy Science | #16120 | |
| PI(4,5)P2 1st antibody | Santa Cruz | sc-53412 | |
| secondary antibody F(ab’)2-goat-anti-mouse Alexa Fluor 647 | Invitrogen | A-21237 | |
| Tetraspeck beads | Invitrogen | T7279 | |
| magnetic quick release imaging chamber | Warner Instruments | Cat#641994 | |
| temperature controller | Warner Instruments | TC-344C | |
| Poly-D-Lysine | Sigma | P6407 | |
| Phosphate buffer saline | Sigma | P4417-100TAB | |
| EGTA | Sigma | 3780 | |
| NH4Cl | Sigma | A0171 | |
| Goat serum | Sigma | G9023 | |
| bovine serum albumin | Sigma | A7906 | |
| NaCl | Sigma | S5886 | |
| KCl | Sigma | P5405 | |
| CaCl2•2H2O | Sigma | 223506 | |
| MgCl2•6H2O | Sigma | M9272 | |
| Glucose | Sigma | G7021 | |
| HEPES | Sigma | H4034 | |
| Paraformaldyhyde | Sigma | P6148 |
References
- Di Paolo, G., De Camilli, P. Phosphoinositides in cell regulation and membrane dynamics. Nature. 443, 651-657 (2006).
- Hammond, G. R. V., et al. PI4P And PI(4,5)P(2) Are Essential But Independent Lipid Determinants Of Membrane Identity. Science. 337, 727-730 (2012).
- Nakatsu, F., et al. PtdIns4P synthesis by PI4KIIIalpha at the plasma membrane and its impact on plasma membrane identity. J Cell Biol. 199, 1003-1016 (2012).
- Cantley, L. C. The phosphoinositide 3-kinase pathway. Science. 296, 1655-1657 (2002).
- Czech, M. P. Dynamics of phosphoinositides in membrane retrieval and insertion. Annu Rev Physiol. 65, 791-815 (2003).
- Spira, F., et al. Patchwork organization of the yeast plasma membrane into numerous coexisting domains. Nat Cell Biol. 14, 640-648 (2012).
- Barg, S., Knowles, M. K., Chen, X., Midorikawa, M., Almers, W. Syntaxin clusters assemble reversibly at sites of secretory granules in live cells. Proc Natl Acad Sci U S A. 107, 20804-20809 (2010).
- Sieber, J. J., et al. Anatomy and dynamics of a supramolecular membrane protein cluster. Science. 317, 1072-1076 (2007).
- Knowles, M. K., et al. Single secretory granules of live cells recruit syntaxin-1 and synaptosomal associated protein 25 (SNAP-25) in large copy numbers. Proc Natl Acad Sci U S A. 107, 20810-20815 (2010).
- Milosevic, I., et al. Plasmalemmal phosphatidylinositol-4,5-bisphosphate level regulates the releasable vesicle pool size in chromaffin cells. J Neurosci. 25, 2557-2565 (2005).
- van Rheenen, J., Jalink, K. Agonist-induced PIP(2) hydrolysis inhibits cortical actin dynamics: regulation at a global but not at a micrometer scale. Mol Biol Cell. 13 (2), 3257-3267 (2002).
- Hammond, G., Schiavo, G., Irvine, R. Immunocytochemical techniques reveal multiple, distinct cellular pools of PtdIns4P and PtdIns (4, 5) P2. Biochem J. 422, 23-35 (2009).
- Huang, S., et al. Phosphatidylinositol-4,5-bisphosphate-rich plasma membrane patches organize active zones of endocytosis and ruffling in cultured adipocytes. Mol Cell Biol. 24, 9102-9123 (2004).
- James, D. J., Khodthong, C., Kowalchyk, J. A., Martin, T. F. Phosphatidylinositol 4,5-bisphosphate regulates SNARE-dependent membrane fusion. J Cell Biol. 182, 355-366 (2008).
- Laux, T., et al. GAP43, MARCKS, CAP23 modulate PI(4,5)P(2) at plasmalemmal rafts, and regulate cell cortex actin dynamics through a common mechanism. J Cell Biol. 149, 1455-1472 (2000).
- Aoyagi, K., et al. The activation of exocytotic sites by the formation of phosphatidylinositol 4,5-bisphosphate microdomains at syntaxin clusters. J Biol Chem. 280, 17346-17352 (2005).
- Kabachinski, G., Yamaga, M., Kielar-Grevstad, D. M., Bruinsma, S., Martin, T. F. CAPS and Munc13 utilize distinct PIP2-linked mechanisms to promote vesicle exocytosis. Mol Biol Cell. 25, 508-521 (2014).
- Wang, J., Richards, D. A. Segregation of PIP2 and PIP3 into distinct nanoscale regions within the plasma membrane. Biol Open. 1, 857-862 (2012).
- Hell, S. W., Wichmann, J. Breaking the diffraction resolution limit by stimulated emission: stimulated-emission-depletion fluorescence microscopy. Opt Lett. 19, 780-782 (1994).
- van den Bogaart, G., et al. Membrane protein sequestering by ionic protein-lipid interactions. Nature. 479, 552-555 (2011).
- van Rheenen, J., Achame, E. M., Janssen, H., Calafat, J., Jalink, K. PIP2 signaling in lipid domains: a critical re-evaluation. Embo J. 24, 1664-1673 (2005).
- Sato, K., et al. Differential requirements for clathrin in receptor-mediated endocytosis and maintenance of synaptic vesicle pools. Proc Natl Acad Sci U S A. 106, 1139-1144 (2009).
- Ji, C., Zhang, Y., Xu, P., Xu, T., Lou, X. Nanoscale Landscape of Phosphoinositides Revealed by Specific Pleckstrin Homology (PH) Domains Using Single-molecule Superresolution Imaging in the Plasma Membrane. J of Biol Chem. 290, 26978-26993 (2015).
- Betzig, E., et al. Imaging intracellular fluorescent proteins at nanometer resolution. Science. 313, 1642-1645 (2006).
- Hess, S. T., Girirajan, T. P., Mason, M. D. Ultra-high resolution imaging by fluorescence photoactivation localization microscopy. Biophys J. 91, 4258-4272 (2006).
- Rust, M. J., Bates, M., Zhuang, X. Sub-diffraction-limit imaging by stochastic optical reconstruction microscopy (STORM). Nat Methods. 3, 793-795 (2006).
- Xu, K., Zhong, G., Zhuang, X. Actin, spectrin, and associated proteins form a periodic cytoskeletal structure in axons. Science. 339, 452-456 (2013).
- Wombacher, R., et al. Live-cell super-resolution imaging with trimethoprim conjugates. Nat Methods. 7, 717-719 (2010).
- Szymborska, A., et al. Nuclear pore scaffold structure analyzed by super-resolution microscopy and particle averaging. Science. 341, 655-658 (2013).
- Pertsinidis, A., et al. Ultrahigh-resolution imaging reveals formation of neuronal SNARE/Munc18 complexes in situ. Proc Natl Acad Sci U S A. 110, 2812-2820 (2013).
- Shim, S. -. H., et al. Super-resolution fluorescence imaging of organelles in live cells with photoswitchable membrane probes. Proc Natl Acad Sci. 109, 13978-13983 (2012).
- Huang, F., et al. Video-rate nanoscopy using sCMOS camera-specific single-molecule localization algorithms. Nat Methods. 10, 653-658 (2013).
- Balla, T., Várnai, P. Visualization of Cellular Phosphoinositide Pools with GFP-Fused Protein-Domains. Curr Protoc Cell Biol. 24, 24 (2009).
- Xu, C., Watras, J., Loew, L. M. Kinetic analysis of receptor-activated phosphoinositide turnover. J Cell Biol. 161, 779-791 (2003).
- Subach, F. V., et al. Photoactivatable mCherry for high-resolution two-color fluorescence microscopy. Nat Methods. 6, 153-159 (2009).
- Filonov, G. S., et al. Bright and stable near infra-red fluorescent protein for in vivo imaging. Nature Biotechnol. 29, 757-761 (2011).
- Zhang, M., et al. Rational design of true monomeric and bright photoactivatable fluorescent proteins. Nat Methods. 9, 727-729 (2012).
- Hohmeier, H. E., et al. Isolation of INS-1-derived cell lines with robust ATP-sensitive K+ channel-dependent and -independent glucose-stimulated insulin secretion. Diabetes. 49, 424-430 (2000).
- Dyachok, O., Isakov, Y., Sågetorp, J., Tengholm, A. Oscillations of cyclic AMP in hormone-stimulated insulin-secreting β-cells. Nature. 439, 349-352 (2006).
- Nan, X., et al. Single-molecule superresolution imaging allows quantitative analysis of RAF multimer formation and signaling. Proc Natl Acad Sci U S A. 110, 18519-18524 (2013).
- Sengupta, P., et al. Probing protein heterogeneity in the plasma membrane using PALM and pair correlation analysis. Nat Methods. 8, 969-975 (2011).
- Morone, N., et al. Three-dimensional reconstruction of the membrane skeleton at the plasma membrane interface by electron tomography. J Cell Biol. 174, 851-862 (2006).
- Peters, K. R., Carley, W. W., Palade, G. E. Endothelial plasmalemmal vesicles have a characteristic striped bipolar surface structure. J Cell Biol. 101, 2233-2238 (1985).
- Fujita, A., Cheng, J., Tauchi-Sato, K., Takenawa, T., Fujimoto, T. A distinct pool of phosphatidylinositol 4,5-bisphosphate in caveolae revealed by a nanoscale labeling technique. Proc Natl Acad Sci U S A. 106, 9256-9261 (2009).
- Durisic, N., Laparra-Cuervo, L., Sandoval-Álvarez, &. #. 1. 9. 3. ;., Borbely, J. S., Lakadamyali, M. Single-molecule evaluation of fluorescent protein photoactivation efficiency using an in vivo nanotemplate. Nat Methods. 11, 156-162 (2014).
- Thomas, C. L., Steel, J., Prestwich, G. D., Schiavo, G. Generation of phosphatidylinositol-specific antibodies and their characterization. Biochem Soc Trans. 27, 648-652 (1999).
- Várnai, P., Balla, T. Live cell imaging of phosphoinositides with expressed inositide binding protein domains. Methods. 46, 167-176 (2008).
- Honigmann, A., et al. Phosphatidylinositol 4,5-bisphosphate clusters act as molecular beacons for vesicle recruitment. Nature Struct Mol Biol. 20, 679-686 (2013).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved