Method Article
Única molécula-Super-Resolution Imaging da fosfatidilinositol 4,5-bifosfato na membrana plasmática com o romance fluorescentes Sondas
Neste Artigo
Resumo
PI (4,5) P 2 regula várias funções celulares, mas a sua organização em nanoescala na membrana plasmática da célula é mal compreendida. Por rotulagem PI (4,5) P 2 com uma sonda fluorescente de duas cores fundido com o domínio de homologia plecstrina, descrevemos uma nova abordagem para estudar o PI (4,5) P 2 em distribuição espacial da membrana plasmática em escala nanométrica .
Resumo
Phosphoinositides in the cell membrane are signaling lipids with multiple cellular functions. Phosphatidylinositol 4,5-bisphosphate (PI(4,5)P2) is a determinant phosphoinositide of the plasma membrane (PM), and it is required to modulate ion channels, actin dynamics, exocytosis, endocytosis, intracellular signaling, and many other cellular processes. However, the spatial organization of PI(4,5)P2 in the PM is controversial, and its nanoscale distribution is poorly understood due to the technical limitations of research approaches. Here by utilizing single molecule localization microscopy and the Pleckstrin Homology (PH) domain based dual color fluorescent probes, we describe a novel method to visualize the nanoscale distribution of PI(4,5)P2 in the PM in fixed membrane sheets as well as live cells.
Introdução
Fosfoinositídeos contribuir para uma pequena porção de lípidos total da membrana, mas desempenham papéis críticos numa grande variedade de processos celulares. Eles incluem sete membros derivados de fosforilação reversível ou desfosforilação dos anéis de inositol no dia 3, 4 e 5 de posições 1. Fosfatidilinositol 4-fosfato (PI4P) e fosfatidilinositol 4,5-bifosfato (PI (4,5) P 2) são duas fosfoinositidos principais que funcionam de forma relativamente independente como os lípidos determinantes da membrana plasmática da célula (PM) 2,3. Fosfatidilinositol (3,4,5) -trisphosphate (PIP 3) é muito menos abundante do que PI4P e PI (4,5) P 2, mas tem funções únicas em diferentes processos celulares, incluindo câncer e diabetes 4 5. Estes lípidos têm interacções moleculares complexas, com os seus efectores e muitas outras proteínas. Portanto, é crucial para compreender a organização espacial desses phosphoinositides na PM em escala nanométrica.
Evidências crescentes tem mostrado que complexos de proteínas ou aglomerados de moléculas nas áreas PM confinados podem servir como sinalização hotspots 6. Por exemplo, sintaxina 1A, uma proteína-chave que regula a fusão da membrana 7-9, exibe organização cluster no PM. Distinta da visão de consenso da organização aglomerado de sintaxina 1A, a distribuição espacial dos fosfoinositídeos na PM é controversa. Padrões de distribuição PI (4,5) P 2 variam de uniforme 10-12, grandes manchas 13,14, a denso clusters de 14-18, dependendo de tipos de células e métodos experimentais utilizados. A organização espacial de PI (4,5) P 2 em maior resolução também é inconsistente. Um estudo utilizando estimulada pela emissão de depleção (STED) microscopia de 19 revelou um grande número de PI densa (4,5) P 2 nano-clusters (~ 73 nm de diâmetro) nas folhas de PM de PC 12 células 20 . Este resultado é diferente de estudos usando microscopia eletrônica de congelamento rápido (EM) 21,22, uma abordagem que preserva a estrutura PM intacta de células vivas muito melhor do que a fixação química. Este último mostrou piscinas distintas de PI (4,5) P 2; PI relativamente concentrada (4,5) P 2 em caveolae e revestidos poços, bem como uma distribuição uniforme na região PM plana. Além disso, PI nanoescala (4,5) P 2 organização em folhas de membrana pode ser diferente em células vivas e fixas. Nosso trabalho recente investigou esta questão em células INS-1 tanto fixas e ao vivo usando microscopia localização única molécula (SMLM) 23.
SMLM baseia-se estocasticamente ligar apenas um pequeno subconjunto de fluoróforos, em determinado momento, para que fluoróforos individuais pode ser localizada com alta precisão. Muitas abordagens de imagem de super-resolução têm sido desenvolvidos usando princípios semelhantes para superar o limite de difração de microscopia de luz convencional, como ummicroscopia s fotoativação localização (PALM) 24, microscopia de fluorescência fotoativação localização (FPALM) 25, estocástico microscopia óptica reconstrução (STORM) 26,27 e STORM direto (dSTORM) 28. Com photo-comutável ou fluoróforos fotoactiv�eis (corantes ou proteínas fluorescentes), técnicas SMLM permitir aos cientistas estruturas biológicas imagem com resolução nanométrica 24,29,30 com taxa de vídeo em células vivas 31,32.
Usando PI (4,5) P 2, como um exemplo, que introduzido a abordagem SMLM para estudar a distribuição nanoescala de fosfoinositidos na PM. O domínio PH de PLCδ1 (fosfolipase C δ1) que se liga especificamente ao PI (4,5) P 2 é uma sonda bem estabelecido para PI imagiologia de distribuição sub-celular (4,5) P 2 e dinâmica 33,34 no PM . Temos geneticamente marcado neste domínio com duas proteínas fluorescentes, PAmCherry1 35 e 36 IRFP para produzir uma proteína de fusão de duas cores (IRFP-PAmCherry1-PH PLCδ1) (Figura 1A-B). PAmCherry1 serve como sonda fotoactiv�el de domínio PH para PALM e IRFP serve como um indicador geral para identificar as células transfectadas antes da aquisição PALM . Nós aplicar esta sonda fluorescente de duas cores para a imagem latente SMLM nas folhas de membrana fixas. Para imagiologia PALM vivo, que marcaram mEOS3 37 em vez de PAmCherry1 para o domínio PH PLCδ1 para gerar a sonda PLCδ1 mEOS3.1-PH para a sua melhor eficiência de fotões e o brilho (Figura 1C-D).
Imagiologia SMLM com estas novas sondas no MP de INS-1 38 células secretoras de insulina descobriu rotulagem homogénea de PI (4,5) P 2 em que a maioria das regiões PM, bem como PI concentrado (4,5) P 2 microdomínios que são escassamente misturados na PM plano e algumas estruturas filopódios-like 23. Então umadistribuição noScale de PI (4,5) P 2 fornece uma base estrutural para repensar como ele funciona em células vivas.
Protocolo
1. Folha de Membrana Preparação e Fixação
- Prepare folhas de membrana marcadas com IRFP-PAmCherry1-PH PLC δ1
- Prepara-se o ADN de plasmídeo que codifica IRFP-PAmCherry1-PH PLC δ1 23 utilizando técnicas padrão de biologia molecular.
- Cultura INS-1 células em # 1.5 18 mm lamínulas redondas pré-revestidas com 30 ug / ml de fibronectina para 50-70% de confluência seguindo protocolos de cultura de células padrão INS-1 38,39. Transfectar as células de um dia depois de 50 a 70% de confluência é atingido.
- Transfectar células com IRFP-PAmCherry1-PH PLC δ1 usando o reagente de transfecção de lipossomas seguindo os protocolos do fabricante. Após a transfecção, permitir que as células a crescer durante 48 horas.
- No dia da experiência, lamelas de revestimento (em um só lado) com ~ 0,5-1 ml de 500 ug / ml de poli-D-lisina (PDL; diluído em dH 2 O) durante 1-2 horas. Em seguida, escorra PDL colocando um lenço de papel naa extremidade da lamela. Coloque as lamelas em um (C 4 °) placa de metal pré-arrefecido para uma utilização posterior.
- Lave as células INS-1 pré-transfectadas que crescem em lamelas com ~ 0,5 - solução salina tamponada com fosfato 1 ml gelada (PBS) contendo 1 mM de EGTA. Repetir a lavagem três vezes e drenar PBS.
- Coloque as lamelas com as células em cultura (células do lado voltado para baixo) sobre as lamelas revestidas com PDL sobre uma placa de metal pré-refrigerada com um par de pinças. Deixar a placa no frigorífico (4 ° C) durante 7 - 10 min para permitir que as células para anexar as lamelas revestidas com PDL (Figura 2).
NOTA: O tempo de incubação deve estar na gama de 7 - 10 min para uma melhor fixação das células à superfície PDL-revestido. O ambiente de refrigerador é seco e incubação não deve ser demasiado longo. - Remova a placa de metal a partir do frigorífico. Retire com cuidado a lamela contendo as células pré-transfectadas usando uma pinça. Isso produz uma camada fina de folha de membrana de célula nalamela PDL revestido. Lavar suavemente as folhas de membrana com ~ 0,5 - PBS 1 ml de gelo-frio e, em seguida, fixar com ~ 0,5 - 1 ml de gelo-frio 4% de paraformaldeído (PFA) + 0,2% de glutaraldeído (GA) em PBS durante 15 min a 4 ° C.
Cuidado: paraformaldeído e glutaraldeído são tóxicos. Segurá-los em um exaustor com a pele e proteção para os olhos. - Após a fixação, a imagem das folhas de membrana imediatamente (ver secção 3) ou armazenar em ~ 0,5-1 ml PBS a 4 ° C.
NOTA: Depois de fixar a folha de membrana, não haverá nenhuma ligação de sondas de pH do citossol para a PI (4,5) P 2 equilíbrio. As sondas de pH ligada irá dissociar gradualmente a partir da folha de membrana e difundem-se para a solução (embora possa levar dias ou semanas). Portanto, recomenda-se a imagem das amostras fixas logo após a preparação da amostra.
- Prepare folhas de membrana para o PI (4,5) P 2 rotulagem anticorpo específico
- Cultura INS-1 células em # 1.5, 18 mm Lamelas redondos pré-revestidas com 30 &# 181; g / ml de f ibronectina e 50% -70% de confluência. transfectar as células com ADN de plasmídeo no dia seguinte, conforme descrito no passo 1.1.3.
- Repetir os passos de 1.1.4 a 1.1.7, como descrito acima.
NOTA: Execute os seguintes procedimentos a 4 ° C. - Lavam-se as lamelas contendo folhas PM fixos três vezes com ~ 0,5-1 ml de PBS gelado contendo 50 mM de NH 4 Cl. Extingue-se a folhas com ~ 0,5 - boro-hidreto de sódio a 1 ml de 0,1% em PBS durante 7 minutos, e lava-se com ~ 0,5 - 1 ml de PBS (sem 50 mM de NH 4 Cl).
- Bloquear as amostras com ~ 0,5 - 1 ml de solução de bloqueamento (solução de PBS contendo soro a 5% (v / v) de cabra normal de, 5% (v / v) de albumina de soro de bovino e 50 mM de NH 4 Cl), durante 45 min. Em seguida, incubar com ~ 0,5 - 1 ml primária PI (4,5) P 2 do anticorpo (diluição 1: 300) em solução de bloqueio durante 1 h. Lavar três vezes (10 min de cada vez) com ~ 0,5 - 1 ml de PBS contendo 50 mM de NH 4 Cl.
- Incubar as amostras com ~ 0,5 - 1 ml secundário F (ab ') 2 de cabra-anti-ratinhoanticorpo conjugado com fluoróforos (1: 300) em tampão de bloqueio durante 1 h. Lavar três vezes com ~ 0,5-1 ml de PBS.
- amostras pós-fix com PFA a 4% + 0,2% de GA durante 15 min, em seguida, lavar as amostras três vezes com PBS (7 min de cada vez). Vá para a Seção 3 para geração de imagens ou armazenar em ~ 0,5 ~ 1 ml PBS a 4 ° C para uso posterior.
NOTA: Preparar as amostras a 4 ° C. Use PFA a 4% + 0,2% de GA fixador para preservar a distribuição fisiológica de fosfoinositidos na PM. Preparação RT ou fixação com PFA a 4% sozinho pode causar artefactos significativos (Figura 4).
2. Cultura de Células Preparação para criação de imagens de células vivas com mEOS3.1-PH PLC δ1
- Prepara-se o plasmídeo de ADN que codifica o δ1 mEOS3.1 PH-PLC, como descrito anteriormente 23.
- Cultura INS-1 células em # 1.5 18 milímetros rodada lamelas pré-revestidas com 30 ug / ml de fibronectina até atingirem 50% -70% confluency seguindo protocolos de cultura de células padrão INS-1 38,39.
- No dia seguinte, transfectar células INS-1 com o mEOS3.1-PH PLC δ1 plasmídeo de ADN utilizando o reagente de transfecção de lipossomas seguindo o protocolo do fabricante. Incubar durante 48 horas antes de imagem.
3. PALM Aquisição de imagens de folhas de membrana e células vivas
- PALM aquisição de imagem de folhas de membrana
NOTA: Aqui, um sistema SMLM de reflexão total interna de fluorescência (TIRF) microscópio com base (óleo 100X, APO, NA = 1,49, WD 0,12 mm) 23 é usado para todo aquisição da imagem.- Antes de imagiologia, dilui-se 1 ml de solução de grânulo fluorescente em 10 ml de PBS + MgCl2 50 mM. Adicionar 200 ul de solução diluída nas amostras de células contendo câmara de imagem (a partir de passos 1.1.8 / 1.2.6) durante 10 min. Em seguida, lava-se com PBS três vezes.
- Inicie o sistema de imagem PALM. No software de imagem associado, selecione o "canal IRFP &# 34; botão (642 a laser nm de excitação, 700/75 nm de emissão). Encontre a membrana celular que expressa sondas de pH no canal IRFP.
NOTA: A folha de membrana deve ter um cordão fluorescente próxima. Isso é necessário para correção de desvio mais tarde. - Use o botão "Capture" para recolher uma imagem TIRF convencional da membrana celular no canal IRFP como uma referência para a futura reconstrução da imagem. Como definir um ângulo TIRF normal (ou seja, depois de atingir o ângulo crítico, vire mais 1,5 graus), escrevendo em 2140 no ângulo TIRF definição de imagem. Use essa configuração para todas as etapas salvo indicação em contrário ângulo.
NOTA: No sistema TIRF aqui descrito, 3500 é o ângulo vertical para cima, 2.200 é o ângulo crítico TIRF e 2140 é o ângulo TIRF normal, que é de 1,5 grau mais depois ângulo crítico TIRF. O ângulo TIRF estreita abaixo mencionado no ponto 3.2.3 é 2120, que é outro dos 2 graus depois de alcançar TIRF ângulo crítico. - Mudar para canal PAmCherry1 clicando the botão de canal RFP (561 nm de excitação, 600/50 nm filtro de emissão). Ajuste a barra de rolagem no bloco "AOTF" todo o caminho para a direita para ter iluminação plena potência do laser de 561 nm para 10-20 seg para branquear a fluorescência de membrana de fundo.
- Defina a configuração da câmera ideal (binning 2x2) no separador "Format" e o protocolo de aquisição rápido na aba "ND seqüência de aquisição" (tipicamente 10,000-40,000 imagens em 20 Hz).
- Comece aquisição de imagens PAmCherry1 (561 nm do laser na potência máxima, 50 ms / quadro) com activação laser 405 nm simultânea em um nível baixo (0,1% - 1%), clicando no botão "Executar agora". Ajuste a intensidade de 405 nm do laser para que os pontos individuais espacialmente isoladas em cada quadro são facilmente identificáveis.
NOTA: O número de moléculas PAmCherry1 activatable diminui gradualmente durante a aquisição. 405 nm intensidade do laser deve ser aumentada gradualmente para manter a densidade óptima dos sinais individuais em cada moléculaquadro. - Continuar adquirindo imagens até nenhum sinal PAmCherry1 única molécula é ativado.
- imaging PALM em células vivas
- Antes de imagiologia, dilui-se contas fluorescentes para a câmara de imagem durante 10 min, tal como descrito no passo 3.1.1. Então comece a imagem PALM abrindo o software de imagem associado.
NOTA: Use uma câmara de imagem de liberação rápida magnética para imagens de células vivas. Manter o centro do campo de imagem, a 35 ° C com um controlador de temperatura sob perfusão constante com tampão extracelular (Extracelular Solução: NaCl 135 mM, KCl 5,6 mM, CaCl2 2,6, MgCl2 1,2, glucose a 3 mM, e 20 mM HEPES, pH = 7,3). - Escolha o botão de canal de GFP (525/50 nm de emissão). Identificar a membrana celular que expressa sondas fluorescentes baseados em verde fluorescente de mEOS3 sob 488 excitação laser nm. Certifique-se que partículas fluorescentes nas proximidades também estão incluídos durante o exame que tal seja necessário mais tarde para dri off-linecorrecção ft.
- Clique no botão de "captura" para recolher uma imagem TIRF da membrana celular em mEOS3 canal (verde) como uma imagem de referência. Use um evanescente iluminação onda de excitação rasas (depois de atingir o ângulo crítico, vire mais 2 graus), escrevendo em 2120 no ângulo TIRF definição para imagens de células vivas.
NOTA: Este minimiza a fluorescência do não ligado mEos3-PH no adjacente citosol para a membrana plasmática. - Mudar para o "canal RFP" botão (561 nm de excitação, 600/50 nm de emissão). Use o poder do laser 561 nm completa para branquear fluorescência das folhas de membrana para 10 ~ 20 segundos com a barra de rolagem no "pad AOTF" background (ver 3.1.4).
- Comece a aquisição da imagem, clicando no botão "Run Now" no canal vermelho (561 nm potência total, fixado em 10 ms / frame na "câmera" guia configuração) com a ativação do laser 405 nm simultânea. Ajuste a intensidade do laser de 405 nm para ativar pontos separadas espacialmenteem cada quadro.
NOTA: Como rendimentos de aquisição, não-convertido mEOS3.1-PH PLC δ1 número molécula diminui lentamente. Aumentar gradualmente a potência do laser 405 nm a optimizar o sinal de molécula única. O comprimento de aquisição de imagem depende da finalidade experimental. Adquirir imagens continuamente durante 5 min em condições normais. Se a aquisição for mais necessário, recolher várias pilhas de imagem em vez de um único grande pilha, imagem. O tamanho do arquivo de cada pilha de imagens não deve exceder 4 GB ou ele vai afetar a análise de software mais tarde.
- Antes de imagiologia, dilui-se contas fluorescentes para a câmara de imagem durante 10 min, tal como descrito no passo 3.1.1. Então comece a imagem PALM abrindo o software de imagem associado.
Processamento de Imagens 4. SMLM e Reconstrução
- Transfira os arquivos de imagem (.tif pilhas de imagens) a uma estação de análise de imagem. O lançamento do programa de reconstrução de imagem (custom-escrita), em Matlab, como descrito anteriormente 37 e carregar a pilha de imagens clicando na guia "Arquivo" no menu principal, em seguida, "aberto", então "novo arquivo".
- Identificar e locaLizé eventos moleculares individuais a partir de cada quadro. Definir filtragem limiar de intensidade com um número limite (1-10) no "wavelet". Verifique os ajustes dos parâmetros ideais para a detecção de ponto visualmente antes da reconstrução. Em seguida, vá até a aba "PALM" e clique em "um processo passo" para iniciar a reconstrução da imagem.
NOTA: limiar de intensidade para a detecção de ponto é arbitrária e depende da experiência pessoal. Vários estudos podem ser necessários para gerar um limiar de detecção ideal que nem pega muitos não qualificados (dim) pontos nem filtra muitos pontos qualificados (brilhante). Ajustar outros parâmetros para optimizar a análise de dados. Aqui, a distância vizinhança (pontos de fluorescência nos quadros vizinhos dentro de uma distância são combinados) é definido como 65 nm (1/2 largura de pixel) e montado por uma única molécula. quadros Gap (eventos de moléculas individuais que ocorreram dentro destes quadros e bairro distância foram combinados e equipado como um único evento molécula) édefinido como 26 quadros (1,3 seg) para imagiologia PAmCherry1 40. Ajuste estes parâmetros de acordo com as propriedades de sondas de moléculas individuais e taxa de aquisição de evitar a contagem de 40 em SMLM. Aplicar a correção de deriva com partículas fluorescentes durante as reconstruções.- For Imaging as folhas de membrana fixos marcados por IRFP-PAmCherry1-PH PLC δ1, reconstruir todo o pilhas de imagens da mesma folha de membrana para uma única imagem de super-resolução 37.
- Para as amostras de células vivas marcadas por mEOS3.1-PH PLC δ1, separar toda a pilha de imagens em várias pilhas mais pequenas de 1000 quadros de modo que a pilha de 1.000 consecutivo-quadro é reconstruído como uma imagem de super-resolução única, que tem uma resolução temporal 10 seg. No final, todas as combinar as imagens da série tempo para o empilhamento em série de tempo final de 23.
NOTA: Na geração de imagens PALM-célula viva, um pequeno número de sondas ativadas pode mover-se ou dissociarde PI (4,5) P 2 na PM antes do branqueamento. Para ter em conta o sobre-amostragem das sondas, combinar sinais de moléculas individuais nos quadros vizinhos numa distância de 130 nm (em vez de 65 nm) em um único evento de emissão durante a análise de imagem.
- Após a obtenção das imagens reconstruídas, realizar uma análise mais aprofundada de imagem com o programa personalizado escrito em Matlab para quantificar a densidade molécula, / tamanho, e análise de cluster densidade de micro-domínio com o par correlação 41.
Resultados
A incerteza de localização (σ) do nosso sistema de super-resolução é 14,73 nm 23. Comparações directas entre TIRF e imagens PALM demonstrou uma melhoria significativa de resolução espacial. Figura 3A-B mostra o PI representante (4,5) P 2 imagens TIRF marcadas com PI (4,5) P 2 anticorpo e IRFP-PAmCherry1-PH PLC δ1 em folhas de membrana típicos e células vivas. As imagens por microscopia TIRF convencional em folhas de membrana são notavelmente semelhantes às de células vivas intactas marcadas com a proteína verde fluorescente melhorada (EGFP) com etiquetas domínios PH (PH-EGFP PLCδ1) (Figura 3C). Todas as amostras apresentaram uma distribuição uniforme das sondas. Em contraste, a fixação não ideal das amostras resultou em PI densa afiado (4,5) P 2 clusters e uma diminuição na intensidade do sinal (Figura 4). Sob condições óptimas de fixação, tele imagens de super-resolução de PI (4,5) P 2 em células fixadas (Figura 5) revelou uma distribuição homogénea das sondas numa porção significativa do PM apenas com gradientes de concentração limitada. Alguns pedaços de membrana enriquecidas com PI (4,5) P 2 sondas esparsamente distribuídos e tinha vários tamanhos. Imagens PALM células vivas exibir uma distribuição espacial semelhante como células fixas (Figura 6). Análise detalhada de PI (4,5) P 2 sinais mais tempo resulta em uma dinâmica rápida em áreas locais, sem alterações significativas de sua abundância em áreas amplas.
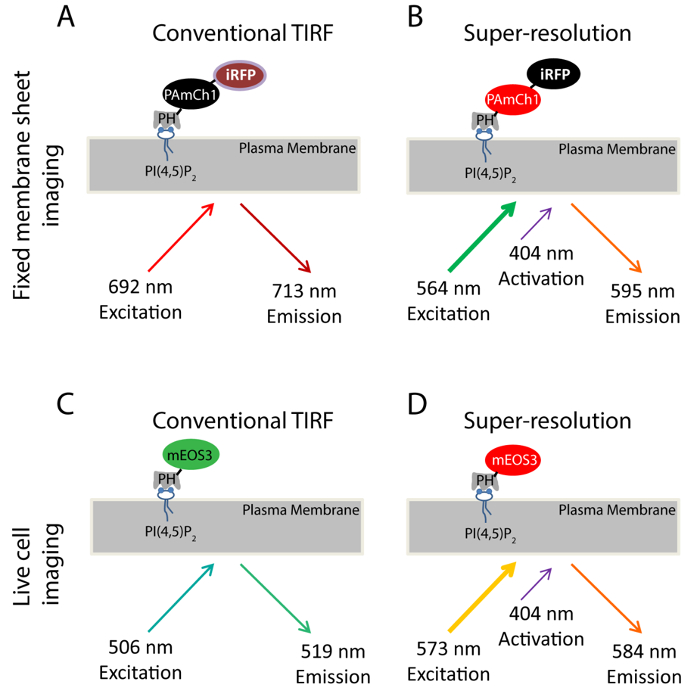
Figura 1. Esquema de sondas fluorescentes utilizadas neste estudo. Sonda (AB) IRFP-PAmCherry1-PH PLC δ1 utilizado nas experiências de folha de membrana fixa. Durante imagiologia TIRF convencional (A), um 640 nm laser é usado para excitar o IRFP (Ex: 692 nm; Em: 713 nm). TIRF imagem feita nesta condição serve como imagem de referência para o TIRF imagem de super-resolução obtida por imagiologia de palma (B). Um laser de 405 nm é usado para photo-activar o fluoróforo PAmCherry1 e um laser de 561 nm é utilizado para excitar PAmCherry1 (Ex: 564 nm; Em: 595 nm) para a imagem latente PALM. (CD) sonda PLCδ1 mEos3.1-PH utilizado nas experiências com células vivas. (C) Durante as imagens TIRF convencional, um laser de 488 nm é utilizado para excitar mEOS3.1 (Ex: 506 nm; Em: 519 nm). (D) Após fotoconversão por um laser de 405 nm, mEos3.1 se transforma em forma vermelha (Ex: 573 nm; Em: 584 nm). E um laser de 561 nm é utilizado para aquisições PALM Por favor clique aqui para ver uma versão maior esta figura.
s / ftp_upload / 54466 / 54466fig2.jpg "/>
Figura 2. Esquema para a preparação de folha de membrana a partir de células INS-1. (A) Colocar a lamela com células cultivadas voltados para baixo para uma lamela PDL-revestido e esperar por 7 ~ 10 min a 4 ° C para permitir a fixação de células à PDL- lamela revestido. (B) Retire a lamela superior com pinças e corrigir a folha de membrana ligado ao PDL lamela pré-revestido. (C) Imagem as amostras com TIRFM e PALM. Por favor clique aqui para ver uma versão maior desta figura.
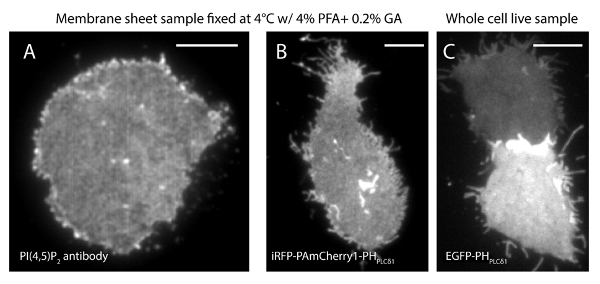
Figura 3. PI (4,5) P 2 organização espacial é semelhante entre as folhas da membrana de células vivas e intactas sob microscópio convencional TIRF. (A) ATIRF imagem típica de folhas de membrana fixado a 4 ° C com PFA a 4% e 0,2% de GA. PI (4,5) P 2 foi marcado com PI (4,5) P 2 de anticorpo específico. (B) Uma folha de membrana de célula INS-1 expressando IRFP-PAmCherry1-PH δ1 PLC. Imagem (C) TIRF de duas células vivas intactas que expressam EGFP-PH PLCδ1 em diferentes níveis. Barras de escala: (A): 3 m; (B) e (C):. 5 mm Por favor clique aqui para ver uma versão maior desta figura.
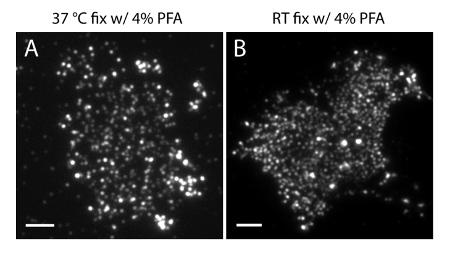
Figura 4. PI (4,5) P 2 organização espacial em folhas de membrana é sensível às condições de fixação comuns. (A) folhas de membrana fixa a 37 ° C com 4% de PFA sozinhose marcadas com anticorpos específicos 2 (4,5) P PI (como na Figura 3A). Folha (B) de membrana fixa à TA com PFA sozinhos e marcadas com PI (4,5) P 2 de anticorpo específico. Note-se que os conjuntos densos de PI (4,5) P 2 sondas são claramente visíveis sob microscópio TIRF, em contraste com as imagens de fluorescência muito mais estável mostrados na Figura 3A. Barras de escala: AB:. 3 mm Por favor clique aqui para ver uma versão maior desta figura.
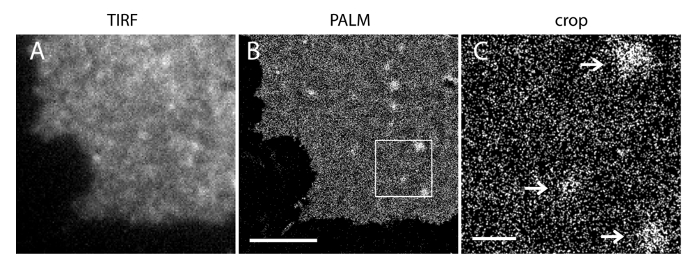
Figura 5. PALM imagem de PI (4,5) P 2 sondas revela sua distribuição escala nanométrica em um PM INS-1 célula. (A) imagem IRFP TIRF de uma folha de membrana de uma célula INS-1 expressando IRFP-PAmCherry1-PH PLCδ1. (B) da palma da PM correspondente na mesma região com base na reconstrução do sinal PAmCherry1. Observe o PI homogênea (4,5) P 2 distribuição espacial nas principais regiões pm e vários PI (4,5) P 2 microdomínios. (C) uma vista aumentada da região em caixa em (B). As setas indicam esparsamente distribuídos PM microdomínios enriquecidos com PI (4,5) P 2 sondas. Barras de escala: A e B: 3 mm; C: 500 nm. Por favor clique aqui para ver uma versão maior desta figura.
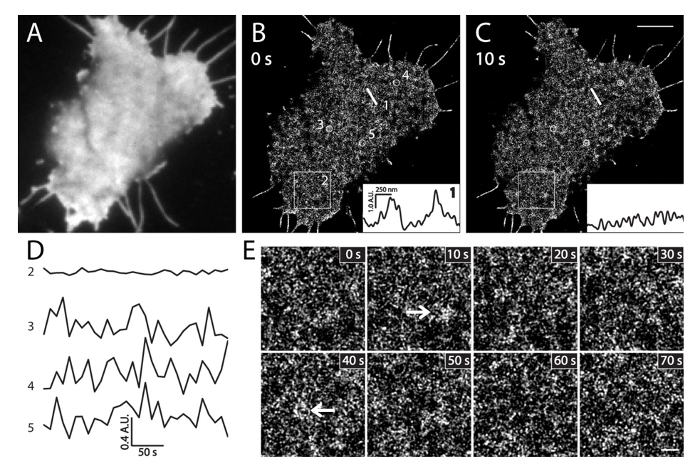
Figura de imagem 6. PALM em células vivas INS-1. (A) imagem TIRF de PI (4,5) P 2 em um show de células INS-1 expressando mEos3.1-PH PLCδ1. A imagem foi rapidamente adquirido no canal verde antes da aquisição PALM (35 ° C). (B) imagens sequenciais PALM em células vivas, no intervalo de 10 segundos. Inserções mostram os perfis de intensidade do local de IP (4,5) P 2 densidade ao longo da mesma linha recta posição 1 em momentos diferentes em (B) e (C). Observe os seus grandes mudanças de intensidade locais dentro de 10 seg. (D) Curso de tempo da média das mudanças de intensidade de PI (4,5) P 2 na grande área (box2, 3x3 mm) e círculos pequenos (3, 4 e 5, 500 nm de diâmetro) em (B) durante 5 min de imagens PALM (frame / 10 seg). Observe as flutuações de intensidade rápidas de PI local (4,5) P 2 sondas (círculo 3, 4 e 5) em comparação com mudanças muito pequenas na área ampla (Caixa 2). Imagens (E) alargada palma da região do box2 em (B) nos tempos indicados. As setas indicam (4,5) P 2 pedaços de membrana enriquecidas PI sob pcondições hysiological. Barras de escala: C: 3 mm; E: 500 nm. Por favor clique aqui para ver uma versão maior desta figura.
Discussão
Para solucionar o problema, dois processos precisam de atenção extra: a produção de folha de membrana e fixação da amostra. Tal como descrito no protocolo, o tempo de incubação das lamelas no passo 1.1.6 é importante para a produção de folha de membrana. Tempo de incubação ideal sob nossa condição experimental é 7-10 min (Figura 2). Mais do que 10 min de incubação vai produzir células intactas, em vez das folhas de membrana em lamelas PDL e mais curto de incubação levará a um menor ou nenhum folhas de membrana sobre as lamelas PDL-revestidos. Conforme descrito no protocolo, os fixadores e temperatura durante a fixação são essenciais para a manutenção da PI (4,5) distribuição de P 2 na PM. Fixação à temperatura ambiente ou a utilização de somente 4% -PFA poderia distorcer a distribuição normal de lipídios no PM.
Através da aplicação de microscopia PALM para a membrana lipídica pesquisa, somos capazes de observar a distribuição escala nanométrica de PI (4,5) P 2, um fosfoinositídeo chave que medeia mquaisquer atividades celulares fundamentais. Esta distribuição espacial de PI (4,5) P 2 com gradientes de concentração limitados em células INS-1 fornece uma estrutura para repensar interações lipídico em proteínas e eventos de sinalização locais de PI (4,5) P 2 nestas células. Além disso, os métodos desenvolvidos neste trabalho também pode ser aplicado a outras pesquisas fosfolípido de membrana com sondas apropriadas, desse modo, oferecendo novas ferramentas para estudar fosfoinositidos em processos biológicos.
O uso de folhas de membrana neste trabalho ignora duas preocupações principais em estudos morfológicos de fosfolipidos: tratamento com detergente e de contaminação potencial do sinal a partir do citosol. Detergentes muitas vezes causam clustering e perda significativa de sinal de fosfolipídios PM. A contaminação de sinal citosólica é particularmente problemática no caso de fosfoinositidos de infestação baixo sobre a PM 23, tais como PI (3,4,5) P 3 e PI (3,4) P 2. As amostras de folha de membrana são capazes de circumvent estes problemas sem perturbar significativamente estruturas associadas com a membrana do plasma, tais como malha de actina cortical e depressões revestidas de clatrina-42,43. A distribuição homogénea relativa de PI (4,5) P 2 na PM está em boa concordância com outros estudos congelamento EM rápidas utilizando sondas δ1 GST-PH PLC na membrana de fibroblastos 44.
É importante notar que as condições de processamento incorrecto das amostras pode gerar resultados enganadores. Primeiro, é essencial para realizar os passos de fixação a uma temperatura inferior (4 ° C) e usar o fixador GA para a produção de folha de membrana. Como mostrado na Figura 3, a temperatura quente e fixação sem PFA GA não são suficientes para fixar fosfoinositidos em PM célula. Isso poderia distorcer a PI intacta (4,5) P distribuição 2 e gerar grupos afiadas que não são observadas em células vivas em condições fisiológicas. Em segundo lugar, o uso de PAmCherry1 quantoa sonda SMLM, ao invés de outras sondas, é fundamental para a imagem latente PALM quantitativa. O benefício da aplicação PAmCherry1 vem de seus única foto-física propriedades moleculares bem caracterizados 35,40,45, como brilho, alta eficiência-ativação fotografia e, acima de tudo, muito limitado photo-piscar. Estas propriedades permitem-nos eliminar os artefatos de fragmentação potencial de foto-piscar e quantitativamente analisar a densidade molecular de PI membrana (4,5) P 2.
Esta abordagem também tem suas limitações. Em primeiro lugar, o método de folha de membrana utilizado no presente estudo não podem imitar completamente a distribuição fisiológica de PI (4,5) P 2 porque a célula é interrompida antes de imagem. No entanto, a nossa imagem PALM ao vivo mostra a distribuição relativamente homogênea semelhante de PI (4,5) P 2, apoiando os resultados observados com amostras de folha de membrana. Em segundo lugar, como vimos no nosso trabalho anterior 23, SMLM exige conhecimentos de imagem e extra emtention para evitar artefatos de imagem que possam surgir a partir de diferentes processos, incluindo as sondas utilizadas, preparação de amostra e de fixação, de amostragem de imagem e de reconstrução. Por fim, apesar de sondas baseadas o domínio PH e anticorpos têm sido amplamente usados em estudos Phosphoinositide 46,47 continua a ser possível que nem todo o PI (4,5) P 2 na membrana pode ser detectada por esta abordagem. Por exemplo, PI (4,5) P 2 vinculado por outras proteínas endógenas pode não ser acessível a sondas de pH ou anticorpos, e isto pode causar uma subestimação do PI (4,5) P 2, devido ao impedimento espacial de sondar-se. Uma forma alternativa de rotulagem PI (4,5) P 2 seria utilizando Top-Fluor PI (4,5) P 2 48, um PI pré-marcado (4,5) P 2 analógico com uma modificação na cauda de originais PI (4,5) P 2. No entanto, ele pode ser rapidamente convertido em outros subtipos fosfoinositida por metabolismo rápido de células vivas desde o seu anel de inositol é o mesmo que endogenous PI (4,5) P 2. Isto levanta a preocupação se este PI pré-marcado (4,5) P 2 analógico em células vivas pode representar fielmente PI (4,5) P 2, em vez de seus produtos metabólicos. Portanto, apesar de algumas limitações, as sondas baseadas em domínio PH ainda estão entre os melhores sondas que têm sido amplamente utilizados para monitorar a distribuição PI (4,5) P 2 e dinâmica na PM de células.
A futura aplicação desta metodologia pode ser estendida a outros estudos fosfoinositídeo, como PI (3,4,5) P 3 e PI (3,4) P 2. Em resumo, a abordagem aqui utilizada SMLM romance abre novas maneiras para estudo da fosfoinositida em células. Usando PI (4,5) P 2, como um exemplo, que demonstram as propriedades únicas de imagiologia de palma ao estudo morfológico e quantitativa de moléculas da membrana celular, bem como os seus inconvenientes. Esta abordagem pode ser adaptada a outras moléculas de interesse e vai ter amplas aplicações em biologia celular.
Divulgações
The authors have nothing to disclose.
Agradecimentos
This work is supported by the National Institutes of Health (NIH) grants R01DK093953 (X.L.), P30NS069271, BRFSG-2014-07 (X.L.). C.J. is partially supported by American Heart Associate pre-doctoral fellowship (14PRE20380168, to C.J.).
Materiais
| Name | Company | Catalog Number | Comments |
| Microscope | Nikon | Ti-U | |
| sCMOS camera | Andor | Neo | |
| Spinning disk | Yokogawa | CSU X-1, 10,000 rpm | |
| High Power Monolithic Laser Combiner SP with 405, 488, 561 and 642 nm lasers. | Agilent | MLC400 | laser original powers & powers at the end of optical fiber) 405 nm: 15 mW & 13 mW; 488 nm: 45 mW & 42 mW; 561 nm: 45 mW & 40 mW; 640 nm: 35 mW & 16 mW. |
| 100X Objective | Nikon | APO 100X Oil, NA 1.49, WD 0.12 mm | |
| Nikon acquisition and analysis software (NIS Element) | Nikon | ||
| Matlab | MathWorks | ||
| Coverslip | Warner | 64-0714 | Round 18 mm coverslip, #1.5 |
| Fibronectin | Millipore | FC010-5MG | |
| Lipofectamin 3000 (transfection reagent) | Invitrogen | L3000-008 | |
| Glutaraldehyde | Electron Microscopy Science | #16120 | |
| PI(4,5)P2 1st antibody | Santa Cruz | sc-53412 | |
| secondary antibody F(ab’)2-goat-anti-mouse Alexa Fluor 647 | Invitrogen | A-21237 | |
| Tetraspeck beads | Invitrogen | T7279 | |
| magnetic quick release imaging chamber | Warner Instruments | Cat#641994 | |
| temperature controller | Warner Instruments | TC-344C | |
| Poly-D-Lysine | Sigma | P6407 | |
| Phosphate buffer saline | Sigma | P4417-100TAB | |
| EGTA | Sigma | 3780 | |
| NH4Cl | Sigma | A0171 | |
| Goat serum | Sigma | G9023 | |
| bovine serum albumin | Sigma | A7906 | |
| NaCl | Sigma | S5886 | |
| KCl | Sigma | P5405 | |
| CaCl2•2H2O | Sigma | 223506 | |
| MgCl2•6H2O | Sigma | M9272 | |
| Glucose | Sigma | G7021 | |
| HEPES | Sigma | H4034 | |
| Paraformaldyhyde | Sigma | P6148 |
Referências
- Di Paolo, G., De Camilli, P. Phosphoinositides in cell regulation and membrane dynamics. Nature. 443, 651-657 (2006).
- Hammond, G. R. V., et al. PI4P And PI(4,5)P(2) Are Essential But Independent Lipid Determinants Of Membrane Identity. Science. 337, 727-730 (2012).
- Nakatsu, F., et al. PtdIns4P synthesis by PI4KIIIalpha at the plasma membrane and its impact on plasma membrane identity. J Cell Biol. 199, 1003-1016 (2012).
- Cantley, L. C. The phosphoinositide 3-kinase pathway. Science. 296, 1655-1657 (2002).
- Czech, M. P. Dynamics of phosphoinositides in membrane retrieval and insertion. Annu Rev Physiol. 65, 791-815 (2003).
- Spira, F., et al. Patchwork organization of the yeast plasma membrane into numerous coexisting domains. Nat Cell Biol. 14, 640-648 (2012).
- Barg, S., Knowles, M. K., Chen, X., Midorikawa, M., Almers, W. Syntaxin clusters assemble reversibly at sites of secretory granules in live cells. Proc Natl Acad Sci U S A. 107, 20804-20809 (2010).
- Sieber, J. J., et al. Anatomy and dynamics of a supramolecular membrane protein cluster. Science. 317, 1072-1076 (2007).
- Knowles, M. K., et al. Single secretory granules of live cells recruit syntaxin-1 and synaptosomal associated protein 25 (SNAP-25) in large copy numbers. Proc Natl Acad Sci U S A. 107, 20810-20815 (2010).
- Milosevic, I., et al. Plasmalemmal phosphatidylinositol-4,5-bisphosphate level regulates the releasable vesicle pool size in chromaffin cells. J Neurosci. 25, 2557-2565 (2005).
- van Rheenen, J., Jalink, K. Agonist-induced PIP(2) hydrolysis inhibits cortical actin dynamics: regulation at a global but not at a micrometer scale. Mol Biol Cell. 13 (2), 3257-3267 (2002).
- Hammond, G., Schiavo, G., Irvine, R. Immunocytochemical techniques reveal multiple, distinct cellular pools of PtdIns4P and PtdIns (4, 5) P2. Biochem J. 422, 23-35 (2009).
- Huang, S., et al. Phosphatidylinositol-4,5-bisphosphate-rich plasma membrane patches organize active zones of endocytosis and ruffling in cultured adipocytes. Mol Cell Biol. 24, 9102-9123 (2004).
- James, D. J., Khodthong, C., Kowalchyk, J. A., Martin, T. F. Phosphatidylinositol 4,5-bisphosphate regulates SNARE-dependent membrane fusion. J Cell Biol. 182, 355-366 (2008).
- Laux, T., et al. GAP43, MARCKS, CAP23 modulate PI(4,5)P(2) at plasmalemmal rafts, and regulate cell cortex actin dynamics through a common mechanism. J Cell Biol. 149, 1455-1472 (2000).
- Aoyagi, K., et al. The activation of exocytotic sites by the formation of phosphatidylinositol 4,5-bisphosphate microdomains at syntaxin clusters. J Biol Chem. 280, 17346-17352 (2005).
- Kabachinski, G., Yamaga, M., Kielar-Grevstad, D. M., Bruinsma, S., Martin, T. F. CAPS and Munc13 utilize distinct PIP2-linked mechanisms to promote vesicle exocytosis. Mol Biol Cell. 25, 508-521 (2014).
- Wang, J., Richards, D. A. Segregation of PIP2 and PIP3 into distinct nanoscale regions within the plasma membrane. Biol Open. 1, 857-862 (2012).
- Hell, S. W., Wichmann, J. Breaking the diffraction resolution limit by stimulated emission: stimulated-emission-depletion fluorescence microscopy. Opt Lett. 19, 780-782 (1994).
- van den Bogaart, G., et al. Membrane protein sequestering by ionic protein-lipid interactions. Nature. 479, 552-555 (2011).
- van Rheenen, J., Achame, E. M., Janssen, H., Calafat, J., Jalink, K. PIP2 signaling in lipid domains: a critical re-evaluation. Embo J. 24, 1664-1673 (2005).
- Sato, K., et al. Differential requirements for clathrin in receptor-mediated endocytosis and maintenance of synaptic vesicle pools. Proc Natl Acad Sci U S A. 106, 1139-1144 (2009).
- Ji, C., Zhang, Y., Xu, P., Xu, T., Lou, X. Nanoscale Landscape of Phosphoinositides Revealed by Specific Pleckstrin Homology (PH) Domains Using Single-molecule Superresolution Imaging in the Plasma Membrane. J of Biol Chem. 290, 26978-26993 (2015).
- Betzig, E., et al. Imaging intracellular fluorescent proteins at nanometer resolution. Science. 313, 1642-1645 (2006).
- Hess, S. T., Girirajan, T. P., Mason, M. D. Ultra-high resolution imaging by fluorescence photoactivation localization microscopy. Biophys J. 91, 4258-4272 (2006).
- Rust, M. J., Bates, M., Zhuang, X. Sub-diffraction-limit imaging by stochastic optical reconstruction microscopy (STORM). Nat Methods. 3, 793-795 (2006).
- Xu, K., Zhong, G., Zhuang, X. Actin, spectrin, and associated proteins form a periodic cytoskeletal structure in axons. Science. 339, 452-456 (2013).
- Wombacher, R., et al. Live-cell super-resolution imaging with trimethoprim conjugates. Nat Methods. 7, 717-719 (2010).
- Szymborska, A., et al. Nuclear pore scaffold structure analyzed by super-resolution microscopy and particle averaging. Science. 341, 655-658 (2013).
- Pertsinidis, A., et al. Ultrahigh-resolution imaging reveals formation of neuronal SNARE/Munc18 complexes in situ. Proc Natl Acad Sci U S A. 110, 2812-2820 (2013).
- Shim, S. -. H., et al. Super-resolution fluorescence imaging of organelles in live cells with photoswitchable membrane probes. Proc Natl Acad Sci. 109, 13978-13983 (2012).
- Huang, F., et al. Video-rate nanoscopy using sCMOS camera-specific single-molecule localization algorithms. Nat Methods. 10, 653-658 (2013).
- Balla, T., Várnai, P. Visualization of Cellular Phosphoinositide Pools with GFP-Fused Protein-Domains. Curr Protoc Cell Biol. 24, 24 (2009).
- Xu, C., Watras, J., Loew, L. M. Kinetic analysis of receptor-activated phosphoinositide turnover. J Cell Biol. 161, 779-791 (2003).
- Subach, F. V., et al. Photoactivatable mCherry for high-resolution two-color fluorescence microscopy. Nat Methods. 6, 153-159 (2009).
- Filonov, G. S., et al. Bright and stable near infra-red fluorescent protein for in vivo imaging. Nature Biotechnol. 29, 757-761 (2011).
- Zhang, M., et al. Rational design of true monomeric and bright photoactivatable fluorescent proteins. Nat Methods. 9, 727-729 (2012).
- Hohmeier, H. E., et al. Isolation of INS-1-derived cell lines with robust ATP-sensitive K+ channel-dependent and -independent glucose-stimulated insulin secretion. Diabetes. 49, 424-430 (2000).
- Dyachok, O., Isakov, Y., Sågetorp, J., Tengholm, A. Oscillations of cyclic AMP in hormone-stimulated insulin-secreting β-cells. Nature. 439, 349-352 (2006).
- Nan, X., et al. Single-molecule superresolution imaging allows quantitative analysis of RAF multimer formation and signaling. Proc Natl Acad Sci U S A. 110, 18519-18524 (2013).
- Sengupta, P., et al. Probing protein heterogeneity in the plasma membrane using PALM and pair correlation analysis. Nat Methods. 8, 969-975 (2011).
- Morone, N., et al. Three-dimensional reconstruction of the membrane skeleton at the plasma membrane interface by electron tomography. J Cell Biol. 174, 851-862 (2006).
- Peters, K. R., Carley, W. W., Palade, G. E. Endothelial plasmalemmal vesicles have a characteristic striped bipolar surface structure. J Cell Biol. 101, 2233-2238 (1985).
- Fujita, A., Cheng, J., Tauchi-Sato, K., Takenawa, T., Fujimoto, T. A distinct pool of phosphatidylinositol 4,5-bisphosphate in caveolae revealed by a nanoscale labeling technique. Proc Natl Acad Sci U S A. 106, 9256-9261 (2009).
- Durisic, N., Laparra-Cuervo, L., Sandoval-Álvarez, &. #. 1. 9. 3. ;., Borbely, J. S., Lakadamyali, M. Single-molecule evaluation of fluorescent protein photoactivation efficiency using an in vivo nanotemplate. Nat Methods. 11, 156-162 (2014).
- Thomas, C. L., Steel, J., Prestwich, G. D., Schiavo, G. Generation of phosphatidylinositol-specific antibodies and their characterization. Biochem Soc Trans. 27, 648-652 (1999).
- Várnai, P., Balla, T. Live cell imaging of phosphoinositides with expressed inositide binding protein domains. Methods. 46, 167-176 (2008).
- Honigmann, A., et al. Phosphatidylinositol 4,5-bisphosphate clusters act as molecular beacons for vesicle recruitment. Nature Struct Mol Biol. 20, 679-686 (2013).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados