需要订阅 JoVE 才能查看此. 登录或开始免费试用。
Method Article
液体中脉冲激光烧蚀制备金属纳米粒子:研究纳米粒子抗菌性能的工具
摘要
金属如铜和银的抗微生物性已经被认识了几个世纪。该协议描述了液体中的脉冲激光消融,一种合成金属纳米粒子的方法,其提供微调这些纳米颗粒的性能以优化其抗微生物效果的能力。
摘要
多药耐药细菌的出现是一个全球性的临床问题,导致一些人推测我们恢复了"抗生素"的药物时代。除了确定新型小分子抗微生物药物的努力之外,由于其抗微生物性质,使用金属纳米颗粒作为医疗器械,伤口敷料和消费者包装的涂层也引起关注。可用于纳米颗粒合成的多种方法导致广谱的化学和物理性质,其可以影响抗菌功效。该手稿描述了液体中的脉冲激光消融(PLAL)方法来产生纳米颗粒。该方法允许使用后照射方法以及加入表面活性剂或体积排除物来微调纳米颗粒尺寸,组成和稳定性。通过控制粒径和组成,金属纳米粒子的物理化学性质很大可以探索其可能有助于其抗微生物效力,从而为抗菌发展开辟新的途径。
引言
纳米颗粒(NP)通常被定义为具有至少一个尺寸小于100nm长度的颗粒。传统的化学NP合成方法通常需要危险的还原剂,如硼氢化物和肼。相比之下,浸没在液体介质(液体中的脉冲激光消融 - PLAL)中的固体金属靶的激光烧蚀为NP合成提供了一个满足绿色化学1,2的原则的所有12条的环保途径。在PLAL中,通过重复的激光脉冲照射浸没的金属靶。当激光烧蚀靶时,原子簇和蒸汽的致密羽流被释放到其中NPs快速聚结的液体介质中。由PLAL生产的NP细分散在水性介质中,NPs的尺寸,多分散性和组成可以通过改变水性消融液以及激光标准ameters 1,2,3,4,5,6。
可以通过调整激光参数的数量来调整纳米粒子特性,包括:注量,波长和脉冲持续时间(参考文献7 )。激光能量密度计算为脉冲能量除以目标表面上激光点的面积。能量密度对NPs大小和多分散性的精确影响有些争议。一般来说,已经表明,对于"长"和"超短"脉冲激光系统,存在低和高注射制度,分别产生负面和积极的趋势,分别为8,9,10,11。 NP尺寸分布可以使用诸如动态光散射和透射电子显微镜(TEM)之类的技术来经验性地测量。
激光波长的选择可以影响形成NP的物理机制。在较短的(紫外)波长下,高能光子能够断裂原子间键12 。这种光消融机制是自顶向下的NP合成的一个例子,因为它导致材料的超小碎片的释放,其倾向于在浸没液12,13,14中淬火时产生更大的多分散样品。相比之下,近红外消融(λ= 1,064nm)产生了由等离子体消融12主导的自下而上的合成机制。目标的激光吸收释放与电子碰撞并随后游离的电子。如c部分增加,材料被电离,从而点燃等离子体。周围液体限制等离子体,增强其稳定性,进一步增加吸收12 。当膨胀的等离子体被限制液体淬火时,NPs以各种几何形状4,12,15缩合。
激光脉冲持续时间的选择可进一步影响NP形成过程。常用的长脉冲激光器,脉冲持续时间大于几皮秒,包括所有毫,微,纳米和一些皮秒脉冲激光。在该脉冲宽度方案中,激光脉冲持续时间比电子 - 声子平衡时间长,通常在几皮秒4,16,17,18,19的数量级。这导致能量泄漏到周围的消融介质中,并通过诸如热离子发射,蒸发,沸腾和熔化的热机制形成NPs。
NPs的抗菌活性受粒径21,22,23,24的强烈影响。为了增强尺寸减小和单分散性,可以使用接近NP的表面等离子体共振(SPR)的波长的激光第二次照射NP。入射激光辐射被NP通过激发SPR吸收。 NP的碎裂可能通过热蒸发25,26或库仑爆炸27,28发生 。光激发提高了他的NP温度高于熔点,导致颗粒外层脱落。已经表明,向溶液中加入聚乙烯吡咯烷酮(PVP)或十二烷基硫酸钠(SDS)等添加剂可以大大提高后照射效果5 。在几个报告1,4,6中已经描述了添加各种溶质的影响。通过PLAL易于操作NP特性提供了开发新型NP型抗微生物剂的新方法。
研究方案
聚焦纳秒激光和测量流淌
- 通过在50 mL玻璃烧杯内放置磁力搅拌棒和多孔消融台来组装消融设备。
注意:消融阶段由3.81厘米直径,1.6毫米厚的不锈钢平台组成,具有十个0.65厘米直径的孔和六个0.50厘米直径的孔,以图1所示的图案钻出。这些孔的目的是允许液体移动穿过靶,使得颗粒不会立即在靶上方积聚。混合不充分导致激光与已经形成的颗粒之间的有害的相互作用。另外,三个#29(8-32)螺纹孔位于平台周边附近,以接受用作腿的固定螺钉,以提升平台并为磁力搅拌棒提供空间( 图1A )。- 将烧杯放在磁性上搅拌板并将搅拌板置于xy平移台上,以使得在烧蚀过程中靶材能够移动( 图1A )。
- 将Nd:YAG激光器设置为基波长为1,064 nm,脉冲持续时间为5 ns,脉冲重复频率为10 Hz。用激光功率和能量计测量每脉冲的能量。所需能量为240-250 mJ。
- 使用250mm焦距会聚透镜(NA = 0.05)将光束聚焦在消融台上的目标下方。
注意:输入光束的半径为4.025 mm,透镜高度为161 mm,可获得所需的光斑尺寸。经验确定最佳斑点大小。利用较大的光斑尺寸来减少溶液中存在的NPs的屏蔽效果。这是平衡的事实,增加斑点大小需要更高的能量以保持足够的能量密度。 - 通过放置金属靶来确定光斑尺寸(参见章节n 2)在舞台上并用几个激光脉冲进行消融。在装有CCD照相机的光学显微镜(4X物镜)上,用千分表滑块查看烧蚀目标以测量斑点尺寸( 图1A )。
注意:对于这里的设备,消融系统产生平均面积为5.51平方毫米的斑点大小。每次消融的斑点大小保持在此范围内。 - 通过将脉冲能量除以斑点面积来计算注量。对于这里的设备,注量为4.80J / cm 2 。
2.通过脉冲激光消融在液体中合成银纳米颗粒
- 使用微量天平称重平面银靶,以获得预消融块。
- 使用双面碳带将银目标粘附到多孔层。向烧杯中加入40 mL消融液( 图1A )。目标上方的液体高度为11 mm。
注意:典型的消融液液体是含有60mM SDS或2mM PVP的水溶液以增强单分散性。 - 在持续搅拌下,以0.42厘米/秒的速度将计算机控制的电动xy阶段以0.42厘米/秒的速度移动成椭圆形图案(尺寸:长轴= 2.09厘米,短轴= 0.956厘米,面积= 1.57厘米2 ),并烧制靶20-40分钟。
注意:NPs的浓度随着消融时间的延长而增加。确保搅拌充分活力,以保持NP浓度在整个溶液中均匀,以尽量减少屏蔽效果7 。
表征金属纳米粒子
- 通过倾析从烧杯收集纳米颗粒溶液。通过测量其紫外 - 可见光光谱(200-1100nm)来确认纳米颗粒的存在。
注意:NPs在表面等离子体共振(SPR)波长处具有峰值吸收。对于银,SPR以400nm为中心。高度集中的NP在测量UV-VIS光谱之前,溶液需要稀释,以确保吸光度读数保持在分光光度计的线性范围内。 - 通过动态光散射(DLS)利用数字分布分析法测量NPs的流体动力学直径29 。
- 在消融溶液中稀释NP溶液1:40,并将1mL移液到1cm塑料比色皿中。使用180°的测量角度,测量波长为633nm的光散射,以根据斯托克斯 - 爱因斯坦方程确定NP直径:
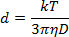
其中d是流体动力学半径,k是玻尔兹曼常数,T是绝对温度,η是粘度,D是布朗运动的平移扩散系数或速度。
- 在消融溶液中稀释NP溶液1:40,并将1mL移液到1cm塑料比色皿中。使用180°的测量角度,测量波长为633nm的光散射,以根据斯托克斯 - 爱因斯坦方程确定NP直径:
- 使用透射电子微粒确认NP尺寸和形状scopy(TEM) 30 。
注意:使用DLS测量的流体动力学直径大于由于围绕NP的溶剂层使用TEM测量的尺寸。- 在双蒸水中稀释NP溶液1:40以除去可能干扰成像的任何过量的添加剂( 例如 SDS或PVP)。将2μL溶液滴入预先涂有花边/薄碳膜(市售的参见材料清单)的铜TEM网格上,并在室温下在干燥器中真空干燥过夜。
- 对NP进行成像,以评估参考文献30所述的尺寸和形状。
- 为了计算NP浓度,通过将靶放置在含有蒸馏水的超声波水浴中1分钟,从烧蚀的金属靶上移除任何松散附着的NP(步骤2.3)。
- 在压缩空气流下将目标物干燥1分钟。测量ta的质量在微量天平上。将溶液中的NP的质量定量为消融前后的体重差异,这被认为是将金属纳米粒子喷射到溶液中的结果。
后照射
- 在2.2中使用的相同消融溶液中将NPs稀释至最大浓度为100μg/ mL。该浓度限制对于确保均匀照射至关重要。
- 将15-17 mL稀释的NPs转移到含有搅拌棒的石英比色杯中( 图1B )。将试管放在与进入的激光平行排列的磁力搅拌板上。
- 使用Nd:YAG激光系统产生25 ps 532 nm激光脉冲和75 mm焦距镜头,将激光对焦于溶液的中心。根据所需的尺寸将溶液照射30分钟至多个小时。
注意:所输送的总能量取决于溶液的浓度和t照射的ime可以在0.5mJ到3.5mJ的范围内。对于这里的装置,透明低浓度样品(<50μg/ mL)的后照射30分钟产生直径为10nm的银NP。
5.测量纳米颗粒的抗菌性能
注意:测试银NPs对革兰氏阳性( 枯草芽孢杆菌 )和革兰氏阴性( 大肠杆菌 )的毒性 31 。该方法易于适应任何物种;然而,有效剂量的纳米颗粒可能变化很大,必须根据经验确定。这里使用大肠杆菌作为描述该方法的模型系统。
- 在含有10g / L细菌胰蛋白胨,5g / L酵母提取物和10g / L氯化钠的Luria Broth(LB)中于37℃培养大肠杆菌培养物(菌株MG1655)过夜。将过夜培养物稀释至光密度(λ= 600nm)在新鲜LB中为0.01。
- 如果NPs在含有添加剂( 如 SDS或PVP)的消融介质中合成,则将相应的化学品加入到LB中,使得浓度在添加NP时保持恒定。
注意:例如,在典型的实验中,将银靶烧成60mM SDS溶液,得到100μg/ mL NPs溶液。如果培养基中NPs的最终浓度为10μg/ mL,则制备含有6mM SDS的LB( 即在消融液中的1/10浓度的SDS)。当使用这些浓度时,对细菌的生长没有负面影响。这在图3中的-AgNP控制中显示。 - 将NPs添加到稀释的培养物中,浓度范围为0-50μg/ mL,并在37℃振荡培养培养物2小时。作为毒性的阳性对照,用抗生素处理大肠杆菌 ( 例如 30μg/ mL卡那姆)霉素)。
- 孵育2小时后,将培养物样品1:10连续稀释成新鲜的LB,并将每个稀释液的10μL滴定于LB琼脂平板上。通常,10 4 -10 8倍稀释度足以看到单个菌落。
- 一旦液滴被吸收,培养板在37℃过夜,第二天早晨计数菌落形成单位(cfu)。
结果
使用银靶,上述激光参数和消融液中的60mM SDS,产生具有在SPR下的特征UV-VIS吸光度的银NP( 图2A )。 TEM和DLS测量显示在照射后约25nm的平均NP直径( 图2B )。银靶消融30分钟通常产生200μg/ mL的NP浓度。在评估银NPs的抗菌毒性时,15μg/ mL强烈抑制大肠杆菌生长( 图3 )。
讨论
NPs可重现的抗微生物作用需要生产具有相似尺寸和浓度的NPs。因此,标准化激光参数(包括注量,波长和脉冲持续时间)至关重要。虽然动态光散射是估算NP尺寸的一种简单而快速的方法,但尺寸分布的准确量化需要通过TEM直接测量。由于每个激光束在模式分布和散度方面具有不同的特征,因此使用经验过程产生目标上的最佳注量和液体高度是至关重要的。由于可以通过后照射来调节纳米粒子的?...
披露声明
作者没有什么可以披露的。
致谢
这项工作得到了国家科学基金会的支持(NSF向DB,CMMI-1300920,DB和S.O'M。,CMMI-1531789授予S.O'M。,DB和EAK)和a Busch生物医学研究资助EAK和S.O'M。
材料
| Name | Company | Catalog Number | Comments |
| Nanosecond Nd:YAG laser | Ekspla | NL303 | |
| Motorized xy scanning stage | Standa | 8MTF | |
| UV-VIS spectrophotometer | Agilent | Cary 60 | |
| Dynamic light scattering unit | Malvern | Zetasizer ZS 90 | |
| Microbalance | Maktek | TM 400 | |
| Transmission electron microscope | Zeiss | EM 902 | |
| Silver foil target | Alfa Aesar | 12127 | |
| 250 mm focal length lens | Edmund Optics | 69-624 | |
| Copper TEM grids | Pacific Grid-Tech | Cu-400LD | Lacey/thin film coated grid |
| E. coli MG1655 | ATCC | 47076 | |
| Bacto-tryptone | BD Biosciences | 211705 | |
| Yeast extract | BD Biosciences | 212750 | |
| Sodium chloride | Fisher Scientific | BP3581 | |
| Bacto-agar | BD Biosciences | 214010 | |
| Sodium dodecyl sulfate | Fisher Scientific | BP166-100 | |
| Polyvinylpyrrolidone | Fisher Scientific | BP431-100 | |
| Stainless steel disc (for ablation stage) | Metal Remnants, Inc. | N/A | 1.5 inch diameter, 16 gauge |
| Beaker | Fisher Scientific | 02-540G | |
| Magnetic stir bar | Fisher Scientific | 14-513-57 | |
| Magnetic stir plate | Fisher Scientific | 11-100-49SH | |
| Laser energy and power meter | Coherent | 1098579 | |
| Carbon tape | Shinto Chemitron Co. Ltd. | STR Tape | |
| Sonicating water bath | Branson | 1510 | |
| Air compressor | GMC | Syclone 3010 | For drying ablation target |
| 75 mm focal length lens | Edmund Optics | 34-096 | Focusing lens for post-irradiation |
| Quartz cuvette | Precision Cells Inc | 21UV40 | 50 mm light path (for post-irradiation) |
| Kanamycin | Fisher Scientific | BP906-5 | |
| Light microscope | Nikon | 50i | This microscope is used to focus the laser on the ablation stage. This particular model is no longer available, but any light microscope with a 4X objective will work. |
| CCD camera | AmScope | MT5000-CCD | |
| Micrometer slide | Ted Pella | 2280-70 |
参考文献
- Amendola, V., Meneghetti, M. What controls the composition and the structure of nanomaterials generated by laser ablation in liquid solution?. Phys Chem Chem Phys. 15 (9), 3027-3046 (2013).
- Anastas, P., Eghbali, N. Green chemistry: principles and practice. Chem Soc Rev. 39 (1), 301-312 (2010).
- Mafune, F., Kohno, J. Y., Takeda, Y., Kondow, T., Sawabe, H. Formation of Gold Nanoparticles by Laser Ablation in Aqueous Solution of Surfactant. J Phys Chem B. 105 (22), 5114-5120 (2001).
- Rao, S. V., Podagatlapalli, G. K., Hamad, S. Ultrafast laser ablation in liquids for nanomaterials and applications. J Nanosci Nanotechnol. 14 (2), 1364-1388 (2014).
- Tsuji, T., et al. Preparation of silver nanoparticles by laser ablation in polyvinylpyrrolidone solutions. Appl Surf Sci. 254 (16), 5224-5230 (2008).
- Zeng, H., et al. Nanomaterials via laser ablation/irradiation in liquid: a review. Adv Funct Mater. 22 (7), 1333-1353 (2012).
- Naddeo, J. J., et al. Antibacterial Properties of Nanoparticles: A Comparative Review of Chemically Synthesized and Laser-Generated Particles. Adv. Sci. Eng. Med. 7 (12), 1044-1057 (2015).
- Elsayed, K. A., Imam, H., Ahmed, M. A., Ramadan, R. Effect of focusing conditions and laser parameters on the fabrication of gold nanoparticles via laser ablation in liquid. Opt. & Laser Tech. 45, 495-502 (2013).
- Kabashin, A. V., Meunier, M. Synthesis of colloidal nanoparticles during femtosecond laser ablation of gold in water. J Appl Phys. 94 (12), 7941-7943 (2003).
- Nichols, W. T., Sasaki, T., Koshizaki, N. Laser ablation of a platinum target in water I. Ablation mechanisms. J Appl Phys. 100 (11), 114911 (2006).
- Povarnitsyn, M. E., Itina, T. E., Levashov, P. R., Khishchenko, K. V. Mechanisms of nanoparticle formation by ultra-short laser ablation of metals in liquid environment. Phys Chem Chem Phys. 15 (9), 3108-3114 (2013).
- Mortazavi, S. Z., Parvin, P., Reyhani, A., Golikand, A. N., Mirershadi, S. Effect of Laser Wavelength at IR (1064 nm) and UV (193 nm) on the Structural Formation of Palladium Nanoparticles in Deionized Water. J Phys Chem C. 115 (12), 5049-5057 (2011).
- Kim, J., Reddy, D. A., Ma, R., Kim, T. K. The influence of laser wavelength and fluence on palladium nanoparticles produced by pulsed laser ablation in deionized water. Solid State Sci. 37, 96-102 (2014).
- Mortazavi, S. Z., Parvin, P., Reyhani, A., Mirershadi, S., Sadighi-Bonabi, R. Generation of various carbon nanostructures in water using IR/UV laser ablation. J Phys D: Appl Phys. 46 (16), 165303 (2013).
- Hunter, B. M., et al. Highly active mixed-metal nanosheet water oxidation catalysts made by pulsed-laser ablation in liquids. J Am Chem Soc. 136 (38), 13118-13121 (2014).
- Momma, C., et al. Short-pulse laser ablation of solid targets. Opt Commun. 129 (1), 134-142 (1996).
- Sonntag, S., Roth, J., Gaehler, F., Trebin, H. R. Femtosecond laser ablation of aluminium. Appl Surf Sci. 255 (24), 9742-9744 (2009).
- Yamashita, Y., Yokomine, T., Ebara, S., Shimizu, A. Heat transport analysis for femtosecond laser ablation with molecular dynamics-two temperature model method. Fusion Eng Des. 81 (8), 1695-1700 (2006).
- Zhigilei, L. V., Lin, Z., Ivanov, D. S. Atomistic modeling of short pulse laser ablation of metals: connections between melting, spallation, and phase explosion. J Phys Chem C. 113 (27), 11892-11906 (2009).
- Schmidt, M., et al. Lasers in Manufacturing 2011 - Proceedings of the Sixth International WLT Conference on Lasers in Manufacturing Metal Ablation with Short and Ultrashort Laser Pulses. Physics Procedia. 12, 230-238 (2011).
- Azam, A., Ahmed, A. S., Oves, M., Khan, M. S., Memic, A. Size-dependent antimicrobial properties of CuO nanoparticles against Gram-positive and-negative bacterial strains. Int. J. Nanomed. 7, 3527-3535 (2012).
- Ivask, A., et al. Size-dependent toxicity of silver nanoparticles to bacteria, yeast, algae, crustaceans and mammalian cells in vitro. PLoS One. 9 (7), e102108 (2014).
- Kim, T. H., et al. Size-dependent cellular toxicity of silver nanoparticles. J Biomed Mater Res A. 100 (4), 1033-1043 (2012).
- Raghupathi, K. R., Koodali, R. T., Manna, A. C. Size-dependent bacterial growth inhibition and mechanism of antibacterial activity of zinc oxide nanoparticles. Langmuir. 27 (7), 4020-4028 (2011).
- Plech, A., Kotaidis, V., Gresillon, S., Dahmen, C., von Plessen, G. Laser-induced heating and melting of gold nanoparticles studied by time-resolved x-ray scattering. Phys Rev B. 70 (19), 195423 (2004).
- Takami, A., Kurita, H., Koda, S. Laser-Induced Size Reduction of Noble Metal Particles. J Phys Chem B. 103 (8), 1226-1232 (1999).
- Kamat, P. V., Flumiani, M., Hartland, G. V. Picosecond Dynamics of Silver Nanoclusters. Photoejection of Electrons and Fragmentation. J Phys Chem B. 102 (17), 3123-3128 (1998).
- Yamada, K., Tokumoto, Y., Nagata, T., Mafune, F. Mechanism of laser-induced size-reduction of gold nanoparticles as studied by nanosecond transient absorption spectroscopy. J Phys Chem B. 110 (24), 11751-11756 (2006).
- Pecora, R. Dynamic Light Scattering Measurement of Nanometer Particles in Liquids. J. Nanoparticle Res. 2 (2), 123-131 (2000).
- Pyrz, W. D., Buttrey, D. J. Particle size determination using TEM: a discussion of image acquisition and analysis for the novice microscopist. Langmuir. 24 (20), 11350-11360 (2008).
- Ratti, M., et al. Irradiation with visible light enhances the antibacterial toxicity of silver nanoparticles produced by laser ablation. Appl Phys A. 122 (4), 1-7 (2016).
- Sajti, C. L., Sattari, R., Chichkov, B. N., Barcikowski, S. Gram Scale Synthesis of Pure Ceramic Nanoparticles by Laser Ablation in Liquid. J Phys Chem C. 114 (6), 2421-2427 (2010).
- Streubel, R., Barcikowski, S., Gokce, B. Continuous multigram nanoparticle synthesis by high-power, high-repetition-rate ultrafast laser ablation in liquids. Opt Lett. 41 (7), 1486-1489 (2016).
- Streubel, R., Bendt, G., Gokce, B. Pilot-scale synthesis of metal nanoparticles by high-speed pulsed laser ablation in liquids. Nanotechnology. 27 (20), 205602 (2016).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。