È necessario avere un abbonamento a JoVE per visualizzare questo. Accedi o inizia la tua prova gratuita.
Method Article
Produzione di nanoparticelle metalliche mediante ablazione laser pulsata nei liquidi: uno strumento per studiare le proprietà antibatteriche delle nanoparticelle
In questo articolo
Riepilogo
Le proprietà antimicrobiche di metalli come il rame e l'argento sono stati riconosciuti per secoli. Questo protocollo descrive l'ablazione laser pulsata in liquidi, un metodo per sintetizzare nanoparticelle metalliche che fornisce la capacità di ottimizzare le proprietà di queste nanoparticelle per ottimizzare i loro effetti antimicrobici.
Abstract
L'emergere di batteri resistenti a multidrug è una preoccupazione clinica globale che porta a speculare il nostro ritorno ad un'epoca di medicina "pre-antibiotica". Oltre agli sforzi per identificare nuovi farmaci antimicrobici a piccole molecole, è stato molto interessato all'utilizzo di nanoparticelle metalliche come rivestimenti per dispositivi medici, medicazioni per la ferita e imballaggi al consumo, a causa delle loro proprietà antimicrobiche. L'ampia gamma di metodi disponibili per la sintesi di nanoparticelle provoca un ampio spettro di proprietà chimiche e fisiche che possono influenzare l'efficacia antibatterica. Questo manoscritto descrive l'ablazione laser pulsata in liquidi (PLAL) per creare nanoparticelle. Questo approccio consente di ottimizzare la dimensione, la composizione e la stabilità del nanoparticelle utilizzando metodi post-irraggiamento nonché l'aggiunta di tensioattivi o di esclusioni di volume. Controllando la dimensione e la composizione delle particelle, una vasta gamma di proprietà fisiche e chimiche della nanopartono metallicoPossono essere esplorati i quali possono contribuire alla loro efficacia antimicrobica aprendo così nuovi sentieri per lo sviluppo antibatterico.
Introduzione
Le nanoparticelle (NP) sono generalmente definite come particelle che hanno almeno una dimensione inferiore a 100 nm. Metodi tradizionali di sintesi chimici NP richiedono tipicamente gli agenti riducenti pericolosi, come borohidridi e idrazine. Al contrario, l'ablazione laser degli obiettivi metallici solidi immersi in un mezzo liquido (ablazione laser pulsata in liquidi - PLAL) fornisce un percorso ecologico per la sintesi di NP che soddisfa tutti i 12 principi della chimica verde 1 , 2 . Nel PLAL, un bersaglio metallico sommerso viene irradiato da impulsi laser ripetuti. Mentre il laser ablaccia il bersaglio, un fitto denso di cluster atomici e vapore viene rilasciato nel mezzo liquido in cui i NP si associano rapidamente. I NP prodotti dalla PLAL sono finemente dispersi in un mezzo acquoso e la dimensione, la polidispersione e la composizione dei NP possono essere facilmente controllati variando il liquido di ablazione acquosa così come il laser parAmeteri 1 , 2 , 3 , 4 , 5 , 6 .
Le caratteristiche della nanoparticola possono essere sintonizzate regolando un certo numero di parametri laser, tra cui: fluenza, lunghezza d'onda e durata dell'impulso (esaminati nel punto 7 ). La fluenza laser viene calcolata come energia di impulso divisa per l'area del punto laser sulla superficie di destinazione. Gli effetti precisi della fluenza sulla dimensione e sulla polidispersione dei NP sono un po 'controversi. In generale, è stato dimostrato che per i sistemi a pulsazione "lunghi" e "ultra-corti" sono presenti regimi di bassa e alta fluidità che producono tendenze negative e positive in termini di dimensione rispettivamente di 8 , 9 , 10 , 11 . Dimensione NP distribuitiPuò essere misurata empiricamente utilizzando tecniche come la dispersione della luce dinamica e la microscopia elettronica di trasmissione (TEM), come descritto di seguito.
La scelta della lunghezza d'onda laser può influenzare i meccanismi fisici con cui si formano i NP. A lunghezze d'onda più brevi (ultraviolette), i fotoni ad alta energia sono in grado di rompere i legami interatomici 12 . Questo meccanismo di foto-ablazione è un esempio di una sintesi NP-top-down perché provoca il rilascio di frammenti ultra-piccoli di materiale che tendono a produrre campioni di polidispersio più grandi quando si esauriscono nel liquido di immersione 12 , 13 , 14 . Al contrario, l'ablazione a infrarossi vicino (λ = 1.064 nm) produce un meccanismo di sintesi di livello inferiore, dominato dall'ablazione plasmatica 12 . L'assorbimento del laser dall'obiettivo libera gli elettroni che si scontrano con elettroni legati, e successivamente liberi. Come cLe forbici aumentano, il materiale viene ionizzato, accendendo così un plasma. Il liquido circostante confina il plasma, aumenta la sua stabilità e aumenta ulteriormente l'assorbimento 12 . Poiché il plasma espandente viene frenato dal liquido confinante, i NP sono condensati con varie geometrie 4 , 12 e 15 .
La scelta della durata dell'impulso laser può ulteriormente influenzare il processo di formazione di NP. I laser a lunga pulsazione comunemente usati, con durate di impulsi superiori a pochi picosecondi, comprendono tutti i milli, micro, nano e alcuni laser pulsati picosecondi. In questo regime di lunghezza d'impulso la durata dell'impulso laser è più lunga del tempo di equilibrazione elettronico-fonone, tipicamente nell'ordine di alcuni picosecondi 4 , 16 , 17 , 18 , 19. Ciò provoca la perdita di energia nel mezzo di ablazione circostante e la formazione di NP attraverso meccanismi termici quali emissione termica, vaporizzazione, ebollizione e fusione 1 , 20 .
L'attività antibatterica dei NP è fortemente influenzata dalla dimensione delle particelle 21 , 22 , 23 , 24 . Al fine di migliorare la riduzione della dimensione e la monodispersione, i NP possono essere irradiati una seconda volta utilizzando un laser di una lunghezza d'onda vicino alla risonanza plasmonica superficiale (SPR) del NP. La radiazione laser incidente viene assorbita dal NP attraverso l'eccitazione della SPR. La frammentazione del NP può avvenire tramite l'evaporazione termica 25 , 26 o l'esplosione Coulomb 27 , 28 . La photoexcitation solleva tLa temperatura del NP al di sopra del punto di fusione, con conseguente spargimento dello strato esterno della particella. È stato dimostrato che agenti aggiungenti come polivinilpirrolidone (PVP) o sodio dodecil solfato (SDS) alla soluzione possono aumentare notevolmente gli effetti post-irradianti 5 . L'impatto dell'aggiunta di diversi soluti è stato descritto in diverse relazioni 1 , 4 , 6 . La facilità di manipolazione delle caratteristiche NP da PLAL offre un nuovo metodo per sviluppare nuovi antimicrobici a base di NP.
Protocollo
1. Messa a fuoco del laser Nanosecond e Fluence di misurazione
- Montare l'apparecchio di ablazione posizionando una barra magnetica di agitazione e una fase di ablazione porosa all'interno di un bicchiere di vetro da 50 ml.
NOTA: Lo stadio di ablazione è costituito da una piattaforma in acciaio inossidabile con diametro di 3,81 cm e 1,6 mm con dieci fori di diametro 0,65 cm e sei fori di diametro 0,50 cm forati nel disegno illustrato in figura 1 . Lo scopo di questi fori è quello di permettere al liquido di muoversi attraverso il bersaglio in modo che le particelle non si accumulino immediatamente al di sopra del bersaglio. La miscelazione insufficiente porta a interazioni dannose tra il laser e le particelle già formate. Inoltre, tre fori di tappatura # 29 (8-32) si trovano vicino al perimetro della piattaforma per accettare viti di regolazione che servono come gambe per sollevare la piattaforma e fornire spazio per una barra magnetica di agitazione ( figura 1A ).- Posizionare il bicchiere su un magneteMescolare la lastra e posizionare la lastra di mescolanza su una fase di traduzione xy per consentire il movimento del bersaglio durante l'ablazione ( Figura 1A ).
- Impostare il laser Nd: YAG per operare alla lunghezza d'onda fondamentale di 1.064 nm, con una durata di impulso di 5 ns e una frequenza di ripetizione di impulso di 10 Hz. Misurare l'energia per impulso con un misuratore di potenza laser e di energia. L'energia necessaria è 240-250 mJ.
- Mettete a fuoco la trave sotto il bersaglio sullo stadio di ablazione usando una lente convergente a focale di 250 mm (NA = 0,05).
NOTA: La trave in entrata ha un raggio di 4.025 mm ed un'obiettivo di 161 mm è necessaria per raggiungere la dimensione del punto desiderato. La dimensione spot ottimale è determinata empiricamente. Una dimensione più grande è utilizzata per ridurre l'effetto di schermatura da NP presenti in soluzione. Questo è equilibrato dal fatto che l'aumento della dimensione del punto richiede una maggiore energia per mantenere una corretta fluidità. - Determinare la dimensione dello spot posizionando un bersaglio metallico (vedere la sezioneN 2) sul palco e ablating con diversi impulsi laser. Visualizzare l'obiettivo ablato insieme a una diapositiva a micrometro su un microscopio leggero dotato di telecamera CCD (obiettivo 4X) per misurare le dimensioni del punto ( Figura 1A ).
NOTA: Per l'apparecchio qui, il sistema di ablazione produce una dimensione spot con un'area media di 5,51 mm2. La dimensione dello spot rimane in questa gamma per ogni ablazione. - Calcola la fluidità dividendo l'energia di impulso per l'area spot. Per l'apparecchio qui, la fluidità è di 4,80 J / cm 2 .
2. Sintesi delle nanoparticelle d'argento mediante ablazione laser a pulsazione in liquido
- Pesare un obiettivo di argento piatto utilizzando un microbalance per ottenere la massa di pre-ablazione.
- Aderire il bersaglio d'argento allo stadio poroso usando nastro adesivo a doppia faccia. Aggiungere 40 ml di liquido di ablazione al bicchiere ( Figura 1A ). L'altezza del liquido sopra l'obiettivo è di 11 mm.
NOTA: ablazione tipica liqLe uidi sono soluzioni acquose contenenti 60 mM SDS o 2 mM PVP per migliorare la monodispersione. - Sotto l'agitazione continua, spostare la fase xy motorizzata controllata dal computer in un modello ellittico (dimensioni: asse maggiore = 2,09 cm, asse minore = 0,956 cm, area = 1,57 cm 2 ) ad una velocità di 0,42 cm / s e ablate l'obiettivo Per 20-40 min.
NOTA: la concentrazione di NP aumenta con tempi di ablazione più lunghi. Assicurarsi che l'agitazione sia sufficientemente vigorosa per mantenere uniforme la concentrazione NP in tutta la soluzione per minimizzare gli effetti di schermatura 7 .
3. Caratterizzazione delle nanoparticelle del metallo
- Raccogliere la soluzione di nanoparticelle dal bicchiere mediante decantazione. Confermare la presenza di nanoparticelle misurando i loro spettri di luce visibile UV (200-1,100 nm).
NOTA: I NP hanno un assorbimento di picco alla lunghezza d'onda della risonanza plasmonica di superficie (SPR). Per l'argento, la SPR è centrata a 400 nm. NP altamente concentratoLe soluzioni richiedono la diluizione prima di misurare lo spettro UV-VIS per assicurare che le letture di assorbanza rimangano entro l'intervallo lineare dello spettrofotometro. - Misurare il diametro idrodinamico dei NPs mediante dispersione luminosa dinamica (DLS) utilizzando un metodo di analisi di distribuzione numerica 29 .
- Diluire la soluzione NP 1:40 nella soluzione di ablazione e pipettare 1 mL in una cuvetta di plastica da 1 cm. Utilizzando un angolo di misura di 180 ° , misurare la dispersione della luce ad una lunghezza d'onda di 633 nm per determinare il diametro NP secondo l'equazione Stokes-Einstein:
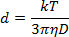
Dove d è il raggio idrodinamico, k è la costante di Boltzmann, T è la temperatura assoluta, η è la viscosità e il coefficiente di diffusione della traslazione D o la velocità del movimento Brownian.
- Diluire la soluzione NP 1:40 nella soluzione di ablazione e pipettare 1 mL in una cuvetta di plastica da 1 cm. Utilizzando un angolo di misura di 180 ° , misurare la dispersione della luce ad una lunghezza d'onda di 633 nm per determinare il diametro NP secondo l'equazione Stokes-Einstein:
- Confermare la dimensione e la forma NP utilizzando il micro elettronico di trasmissioneScopy (TEM) 30 .
NOTA: Il diametro idrodinamico misurato utilizzando DLS è maggiore della dimensione misurata utilizzando TEM a causa dello strato di solvente che circonda i NP.- Diluire la soluzione NP 1:40 in acqua doppia distillazione per rimuovere eventuali additivi in eccesso ( ad es. SDS o PVP) che possono interferire con l'imaging. Far cadere 2 μL della soluzione su una griglia TEM in rame pre-rivestita con film di lacey / sottile carbonio (disponibile in commercio, vedere l'elenco dei materiali) e asciugare per una notte a temperatura ambiente sotto vuoto in un essiccatore.
- Immagini i NP per valutare la dimensione e la forma come descritto nel riferimento 30 .
- Per calcolare la concentrazione di NP, dispiegare tutti i NP disciolti leggermente dal bersaglio metallico ablato (punto 2.3), posizionando l'obiettivo in un bagno d'acqua sonicante contenente acqua distillata per 1 minuto.
- Asciugare l'obiettivo sotto un flusso d'aria compressa per 1 minuto. Misurare la massa della taGiri su un microbalance. Quantificare la massa dei NP in soluzione come la differenza di peso prima e dopo l'ablazione, che si presume sia il risultato di espulsione di nanoparticelle metalliche nella soluzione.
4. Post-irradiazione
- Diluire i NP a una concentrazione massima di 100 μg / mL nella stessa soluzione di ablazione utilizzata in 2.2. Questo limite di concentrazione è fondamentale per garantire un'irraggiamento uniforme.
- Trasferire 15-17 ml di NPs diluiti in una cuvetta di quarzo contenente una barra di agitazione ( figura 1B ). Posizionare la cuvetta su una piastra magnetica allineata parallela al laser in arrivo.
- Utilizzare un sistema laser Nd: YAG per produrre impulsi laser da 25 ps 532 nm e una lente a focale di 75 mm per concentrare il laser sul centro della soluzione. Irradiare la soluzione per 30 minuti a più ore, a seconda della dimensione desiderata.
NOTA: L'energia totale erogata dipende dalla concentrazione della soluzione e dalla tIl nome dell'irraggiamento e può variare da 0,5 mJ a 3,5 mJ. Per l'apparecchio qui, 30 minuti di post-irradiazione di un campione trasparente e di bassa concentrazione (<50 μg / mL), si ottiene NP in argento con diametro di 10 nm.
5. Misurazione delle proprietà antibatteriche delle nanoparticelle
NOTA: La tossicità dei NP d'argento contro Gram-positivi ( Bacillus subtilis ) e Gram-negativi ( Escherichia coli ) è stata testata 31 . Il metodo è facilmente adattato a qualsiasi specie; Tuttavia la dose efficace delle nanoparticelle può variare notevolmente e deve essere determinata empiricamente. Qui, E. coli viene utilizzato come modello di sistema per la descrizione del metodo.
- Coltivare colture E. coli (ceppo MG1655) a 37 ° C in Luria broth (LB) contenente 10 g / L di tryptone Bacto, estratto di lievito da 5 g / L e 10 g / l di cloruro di sodio. Diluire le colture durante la notte ad una densità ottica (λ = 600Nm) di 0,01 in LB fresco.
- Se i NPs sono stati sintetizzati in supporti di ablazione contenenti additivi ( ad es. SDS o PVP), aggiungere la rispettiva sostanza chimica al LB in modo tale che la concentrazione rimanga costante dopo l'aggiunta dei NP.
NOTA: Ad esempio, in un esperimento tipico, un obiettivo d'argento viene ablato in una soluzione SDS da 60 mM per ottenere una soluzione di NP di 100 μg / mL. Se la concentrazione finale di NP nei campioni di coltura è di 10 μg / mL, preparare LB contenente 6 mM SDS ( cioè 1/10 la concentrazione di SDS nel liquido di ablazione). Non vi è alcun effetto negativo sulla crescita dei batteri quando si utilizza queste concentrazioni. Questo è mostrato nel controllo -AgNP in Figura 3 . - Aggiungere le NP alla coltura diluita a concentrazioni che vanno da 0 a 50 μg / mL e coltivare le colture con agitazione a 37 ° C per altri 2 h. Come controllo positivo per la tossicità, trattare E. coli con un antibiotico ( ad es. 30 μg / mL kanamycin).
- Dopo l'incubazione di 2 ore, diluire serialmente i campioni di coltura 1:10 in LB fresco e individuare 10 g di gocce di ciascuna diluizione su piastre LB agar. Tipicamente, 10 4 -10 8 volte le diluizioni sono sufficienti per vedere singole colonie.
- Una volta che le gocce sono state assorbite, incubare le piastre per una notte a 37 ° C e contare le unità di formazione della colonia (cfu) la mattina successiva.
Risultati
Utilizzando obiettivi d'argento, i parametri laser sopra descritti e 60 mM SDS nel liquido di ablazione, vengono generati NP NPN con l'assorbanza UV-VIS a SPR ( Figura 2A ). Le misure TEM e DLS mostrano un diametro NP medio di circa 25 nm prima della post-irraggiamento ( Figura 2B ). L'ablazione del bersaglio d'argento per 30 minuti produce in genere una concentrazione NP di 200 μg / mL. Nel valutare la tossicit...
Discussione
Gli effetti antimicrobici riproduttivi dei NP richiedono la produzione costante di NP con dimensioni e concentrazioni simili. Pertanto, è fondamentale standardizzare i parametri laser, inclusi fluenza, lunghezza d'onda e durata dell'impulso. Mentre la diffusione della luce dinamica è un metodo facile e rapido per la stima della dimensione NP, la quantificazione accurata della distribuzione di dimensioni richiede la misura diretta da parte di TEM. Poiché ogni fascio laser ha caratteristiche distinte in termini...
Divulgazioni
Gli autori non hanno niente da rivelare.
Riconoscimenti
Questo lavoro è stato sostenuto dalla National Science Foundation (NSF assegna CMMI-0922946 a DB, CMMI-1300920 a DB e S.O'M., CMMI-1531789 a S.O'M., DB e EAK) e un Busch Biomedical Research Grant a EAK e S.O'M.
Materiali
| Name | Company | Catalog Number | Comments |
| Nanosecond Nd:YAG laser | Ekspla | NL303 | |
| Motorized xy scanning stage | Standa | 8MTF | |
| UV-VIS spectrophotometer | Agilent | Cary 60 | |
| Dynamic light scattering unit | Malvern | Zetasizer ZS 90 | |
| Microbalance | Maktek | TM 400 | |
| Transmission electron microscope | Zeiss | EM 902 | |
| Silver foil target | Alfa Aesar | 12127 | |
| 250 mm focal length lens | Edmund Optics | 69-624 | |
| Copper TEM grids | Pacific Grid-Tech | Cu-400LD | Lacey/thin film coated grid |
| E. coli MG1655 | ATCC | 47076 | |
| Bacto-tryptone | BD Biosciences | 211705 | |
| Yeast extract | BD Biosciences | 212750 | |
| Sodium chloride | Fisher Scientific | BP3581 | |
| Bacto-agar | BD Biosciences | 214010 | |
| Sodium dodecyl sulfate | Fisher Scientific | BP166-100 | |
| Polyvinylpyrrolidone | Fisher Scientific | BP431-100 | |
| Stainless steel disc (for ablation stage) | Metal Remnants, Inc. | N/A | 1.5 inch diameter, 16 gauge |
| Beaker | Fisher Scientific | 02-540G | |
| Magnetic stir bar | Fisher Scientific | 14-513-57 | |
| Magnetic stir plate | Fisher Scientific | 11-100-49SH | |
| Laser energy and power meter | Coherent | 1098579 | |
| Carbon tape | Shinto Chemitron Co. Ltd. | STR Tape | |
| Sonicating water bath | Branson | 1510 | |
| Air compressor | GMC | Syclone 3010 | For drying ablation target |
| 75 mm focal length lens | Edmund Optics | 34-096 | Focusing lens for post-irradiation |
| Quartz cuvette | Precision Cells Inc | 21UV40 | 50 mm light path (for post-irradiation) |
| Kanamycin | Fisher Scientific | BP906-5 | |
| Light microscope | Nikon | 50i | This microscope is used to focus the laser on the ablation stage. This particular model is no longer available, but any light microscope with a 4X objective will work. |
| CCD camera | AmScope | MT5000-CCD | |
| Micrometer slide | Ted Pella | 2280-70 |
Riferimenti
- Amendola, V., Meneghetti, M. What controls the composition and the structure of nanomaterials generated by laser ablation in liquid solution?. Phys Chem Chem Phys. 15 (9), 3027-3046 (2013).
- Anastas, P., Eghbali, N. Green chemistry: principles and practice. Chem Soc Rev. 39 (1), 301-312 (2010).
- Mafune, F., Kohno, J. Y., Takeda, Y., Kondow, T., Sawabe, H. Formation of Gold Nanoparticles by Laser Ablation in Aqueous Solution of Surfactant. J Phys Chem B. 105 (22), 5114-5120 (2001).
- Rao, S. V., Podagatlapalli, G. K., Hamad, S. Ultrafast laser ablation in liquids for nanomaterials and applications. J Nanosci Nanotechnol. 14 (2), 1364-1388 (2014).
- Tsuji, T., et al. Preparation of silver nanoparticles by laser ablation in polyvinylpyrrolidone solutions. Appl Surf Sci. 254 (16), 5224-5230 (2008).
- Zeng, H., et al. Nanomaterials via laser ablation/irradiation in liquid: a review. Adv Funct Mater. 22 (7), 1333-1353 (2012).
- Naddeo, J. J., et al. Antibacterial Properties of Nanoparticles: A Comparative Review of Chemically Synthesized and Laser-Generated Particles. Adv. Sci. Eng. Med. 7 (12), 1044-1057 (2015).
- Elsayed, K. A., Imam, H., Ahmed, M. A., Ramadan, R. Effect of focusing conditions and laser parameters on the fabrication of gold nanoparticles via laser ablation in liquid. Opt. & Laser Tech. 45, 495-502 (2013).
- Kabashin, A. V., Meunier, M. Synthesis of colloidal nanoparticles during femtosecond laser ablation of gold in water. J Appl Phys. 94 (12), 7941-7943 (2003).
- Nichols, W. T., Sasaki, T., Koshizaki, N. Laser ablation of a platinum target in water I. Ablation mechanisms. J Appl Phys. 100 (11), 114911 (2006).
- Povarnitsyn, M. E., Itina, T. E., Levashov, P. R., Khishchenko, K. V. Mechanisms of nanoparticle formation by ultra-short laser ablation of metals in liquid environment. Phys Chem Chem Phys. 15 (9), 3108-3114 (2013).
- Mortazavi, S. Z., Parvin, P., Reyhani, A., Golikand, A. N., Mirershadi, S. Effect of Laser Wavelength at IR (1064 nm) and UV (193 nm) on the Structural Formation of Palladium Nanoparticles in Deionized Water. J Phys Chem C. 115 (12), 5049-5057 (2011).
- Kim, J., Reddy, D. A., Ma, R., Kim, T. K. The influence of laser wavelength and fluence on palladium nanoparticles produced by pulsed laser ablation in deionized water. Solid State Sci. 37, 96-102 (2014).
- Mortazavi, S. Z., Parvin, P., Reyhani, A., Mirershadi, S., Sadighi-Bonabi, R. Generation of various carbon nanostructures in water using IR/UV laser ablation. J Phys D: Appl Phys. 46 (16), 165303 (2013).
- Hunter, B. M., et al. Highly active mixed-metal nanosheet water oxidation catalysts made by pulsed-laser ablation in liquids. J Am Chem Soc. 136 (38), 13118-13121 (2014).
- Momma, C., et al. Short-pulse laser ablation of solid targets. Opt Commun. 129 (1), 134-142 (1996).
- Sonntag, S., Roth, J., Gaehler, F., Trebin, H. R. Femtosecond laser ablation of aluminium. Appl Surf Sci. 255 (24), 9742-9744 (2009).
- Yamashita, Y., Yokomine, T., Ebara, S., Shimizu, A. Heat transport analysis for femtosecond laser ablation with molecular dynamics-two temperature model method. Fusion Eng Des. 81 (8), 1695-1700 (2006).
- Zhigilei, L. V., Lin, Z., Ivanov, D. S. Atomistic modeling of short pulse laser ablation of metals: connections between melting, spallation, and phase explosion. J Phys Chem C. 113 (27), 11892-11906 (2009).
- Schmidt, M., et al. Lasers in Manufacturing 2011 - Proceedings of the Sixth International WLT Conference on Lasers in Manufacturing Metal Ablation with Short and Ultrashort Laser Pulses. Physics Procedia. 12, 230-238 (2011).
- Azam, A., Ahmed, A. S., Oves, M., Khan, M. S., Memic, A. Size-dependent antimicrobial properties of CuO nanoparticles against Gram-positive and-negative bacterial strains. Int. J. Nanomed. 7, 3527-3535 (2012).
- Ivask, A., et al. Size-dependent toxicity of silver nanoparticles to bacteria, yeast, algae, crustaceans and mammalian cells in vitro. PLoS One. 9 (7), e102108 (2014).
- Kim, T. H., et al. Size-dependent cellular toxicity of silver nanoparticles. J Biomed Mater Res A. 100 (4), 1033-1043 (2012).
- Raghupathi, K. R., Koodali, R. T., Manna, A. C. Size-dependent bacterial growth inhibition and mechanism of antibacterial activity of zinc oxide nanoparticles. Langmuir. 27 (7), 4020-4028 (2011).
- Plech, A., Kotaidis, V., Gresillon, S., Dahmen, C., von Plessen, G. Laser-induced heating and melting of gold nanoparticles studied by time-resolved x-ray scattering. Phys Rev B. 70 (19), 195423 (2004).
- Takami, A., Kurita, H., Koda, S. Laser-Induced Size Reduction of Noble Metal Particles. J Phys Chem B. 103 (8), 1226-1232 (1999).
- Kamat, P. V., Flumiani, M., Hartland, G. V. Picosecond Dynamics of Silver Nanoclusters. Photoejection of Electrons and Fragmentation. J Phys Chem B. 102 (17), 3123-3128 (1998).
- Yamada, K., Tokumoto, Y., Nagata, T., Mafune, F. Mechanism of laser-induced size-reduction of gold nanoparticles as studied by nanosecond transient absorption spectroscopy. J Phys Chem B. 110 (24), 11751-11756 (2006).
- Pecora, R. Dynamic Light Scattering Measurement of Nanometer Particles in Liquids. J. Nanoparticle Res. 2 (2), 123-131 (2000).
- Pyrz, W. D., Buttrey, D. J. Particle size determination using TEM: a discussion of image acquisition and analysis for the novice microscopist. Langmuir. 24 (20), 11350-11360 (2008).
- Ratti, M., et al. Irradiation with visible light enhances the antibacterial toxicity of silver nanoparticles produced by laser ablation. Appl Phys A. 122 (4), 1-7 (2016).
- Sajti, C. L., Sattari, R., Chichkov, B. N., Barcikowski, S. Gram Scale Synthesis of Pure Ceramic Nanoparticles by Laser Ablation in Liquid. J Phys Chem C. 114 (6), 2421-2427 (2010).
- Streubel, R., Barcikowski, S., Gokce, B. Continuous multigram nanoparticle synthesis by high-power, high-repetition-rate ultrafast laser ablation in liquids. Opt Lett. 41 (7), 1486-1489 (2016).
- Streubel, R., Bendt, G., Gokce, B. Pilot-scale synthesis of metal nanoparticles by high-speed pulsed laser ablation in liquids. Nanotechnology. 27 (20), 205602 (2016).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon