Un abonnement à JoVE est nécessaire pour voir ce contenu. Connectez-vous ou commencez votre essai gratuit.
Method Article
Production de nanoparticules métalliques par laser-ablation pulsée dans les liquides: un outil pour étudier les propriétés antibactériennes des nanoparticules
Dans cet article
Résumé
Les propriétés antimicrobiennes des métaux comme le cuivre et l'argent ont été reconnues depuis des siècles. Ce protocole décrit l'ablation laser pulsée dans les liquides, une méthode de synthèse de nanoparticules métalliques qui permet d'affiner les propriétés de ces nanoparticules afin d'optimiser leurs effets antimicrobiens.
Résumé
L'émergence de bactéries résistantes aux médicaments multiples est une préoccupation clinique mondiale qui conduit certains à spéculer sur notre retour à une ère de médecine pré-antibiotiques. En plus des efforts visant à identifier de nouveaux médicaments antimicrobiens à petite molécule, l'utilisation de nanoparticules métalliques a suscité un grand intérêt pour le revêtement des dispositifs médicaux, des pansements et des emballages de consommation, en raison de leurs propriétés antimicrobiennes. La grande variété de méthodes disponibles pour la synthèse des nanoparticules aboutit à un large éventail de propriétés chimiques et physiques qui peuvent affecter l'efficacité antibactérienne. Ce manuscrit décrit la méthode pulsée laser-ablation dans les liquides (PLAL) pour créer des nanoparticules. Cette approche permet le réglage précis de la taille, de la composition et de la stabilité des nanoparticules à l'aide de méthodes de post-irradiation ainsi que de l'addition de tensioactifs ou d'extenseurs de volume. En contrôlant la taille et la composition des particules, une large gamme de propriétés physiques et chimiques de nanopa métalliqueOn peut explorer les matières plastiques qui peuvent contribuer à leur efficacité antimicrobienne, ouvrant ainsi de nouvelles avenues pour le développement antibactérien.
Introduction
Les nanoparticules (NP) sont généralement définies comme des particules ayant au moins une dimension inférieure à 100 nm. Les procédés traditionnels de synthèse chimique NP nécessitent généralement des agents réducteurs dangereux, comme les borohydrures et les hydrazines. En revanche, l'ablation au laser de cibles métalliques solides immergées dans un milieu liquide (ablation par laser pulsée dans les liquides - PLAL) fournit une voie respectueuse de l'environnement pour la synthèse NP qui satisfait à tous les 12 des Principes de Green Chemistry 1 , 2 . Dans PLAL, une cible métallique immergée est irradiée par des impulsions laser répétées. Au fur et à mesure que le laser sépare la cible, un plomb dense de grappes atomiques et de vapeur est libéré dans le milieu liquide dans lequel les IP se coalescent rapidement. Les NP produites par PLAL sont finement dispersées dans un milieu aqueux et la taille, la polydispersité et la composition des NP peuvent être facilement contrôlées en faisant varier le liquide d'ablation aqueux ainsi que le laser parLes ampères 1 , 2 , 3 , 4 , 5 , 6 .
Les caractéristiques des nanoparticules peuvent être ajustées en ajustant un certain nombre de paramètres laser, y compris: fluence, longueur d'onde et durée d'impulsion (révisé dans la référence 7 ). La fluence laser est calculée comme l'énergie de l'impulsion divisée par la zone du point laser sur la surface cible. Les effets précis de la fluence sur la taille et la polydispersité des IP sont un peu controversés. En général, il a été démontré que pour les systèmes à laser pulsé «longs» et «ultra-courts», il existe des régimes de fluence faible et élevé qui produisent des tendances négatives et positives en taille, respectivement 8 , 9 , 10 , 11 . NP taille distributiOn peut mesurer empiriquement les mesures en utilisant des techniques telles que la diffusion dynamique de la lumière et la microscopie électronique de transmission (TEM), comme décrit ci-dessous.
Le choix de la longueur d'onde du laser peut affecter les mécanismes physiques par lesquels les NP sont formés. À des longueurs d'ondes plus courtes (ultraviolettes), les photons à haute énergie sont capables de briser les liaisons interatomiques 12 . Ce mécanisme de photo-ablation est un exemple d'une synthèse de NP de haut en bas, car il en résulte la libération de fragments de matériau ultra-petits qui ont tendance à produire des échantillons plus larges plus polydispersés lors de la trempe dans le liquide de submersion 12 , 13 , 14 . En revanche, l'ablation par infrarouge proche (λ = 1 064 nm) produit un mécanisme de synthèse ascendant dominé par l'ablation au plasma 12 . L'absorption du laser par la cible libère les électrons qui entrent en collision avec des électrons liés à l'élimination des électrons. Comme cLes augmentations augmentent, le matériau est ionisé, ce qui déclenche un plasma. Le liquide environnant limite le plasma, augmente sa stabilité et augmente encore l'absorption 12 . Comme le plasma en expansion est éteint par le liquide de confinement, les NP sont condensés avec différentes géométries 4 , 12 , 15 .
Le choix de la durée d'impulsion laser peut influer davantage sur le processus de formation de NP. Les lasers à impulsions longues couramment utilisés, avec des durées d'impulsion supérieures à quelques picosecondes, comprennent tous les lasers à impulsions milli, micro, nano et certains picosecondes. Dans ce régime de largeur d'impulsion, la durée de l'impulsion laser est plus longue que le temps d'équilibrage électron-phonon, qui est typiquement de l'ordre de quelques picosecondes 4 , 16 , 17 , 18 , 19. Il en résulte une fuite d'énergie dans le milieu d'ablation environnant et la formation de NP par des mécanismes thermiques tels que l'émission thermionique, la vaporisation, l'ébullition et la fusion 1 , 20 .
L'activité antibactérienne des NP est fortement influencée par la taille des particules 21 , 22 , 23 , 24 . Afin d'améliorer la réduction de la taille et la monodispersité, les NP peuvent être irradiés une deuxième fois en utilisant un laser d'une longueur d'onde proche de la résonance plasma plasmique (SPR) du NP. Le rayonnement laser incident est absorbé par le NP par excitation du SPR. La fragmentation du NP peut se produire soit par évaporation thermique 25 , 26 soit par explosion Coulomb 27 , 28 . La photoexcitation soulève tLa température du NP au-dessus du point de fusion, ce qui entraîne l'évacuation de la couche externe de la particule. Il a été démontré que l'ajout d'agents tels que la polyvinylpyrrolidone (PVP) ou le dodécylsulfate de sodium (SDS) à la solution peut améliorer considérablement les effets post-irradiation 5 . L'impact de l'ajout de différents solutés a été décrit dans plusieurs rapports 1 , 4 , 6 . La facilité de manipulation des caractéristiques NP par PLAL offre une nouvelle méthode pour développer de nouveaux antimicrobiens à base de NP.
Protocole
1. Concentrer le laser à la nanose et le fluide de mesure
- Assembler l'appareil d'ablation en plaçant une barre d'agitation magnétique et une étape d'ablation poreuse dans un bécher en verre de 50 ml.
REMARQUE: L'étape d'ablation comprend une plate-forme en acier inoxydable de 3,81 cm de diamètre et 1,6 mm d'épaisseur avec dix trous de 0,65 cm de diamètre et six trous de 0,50 cm de diamètre forés dans le schéma illustré à la figure 1 . Le but de ces trous est de permettre au liquide de se déplacer sur la cible afin que les particules ne s'accumulent pas immédiatement au-dessus de la cible. Un mélange insuffisant conduit à des interactions délétères entre le laser et les particules déjà formées. En outre, trois trous taraudés # 29 (8-32) sont situés près du périmètre de la plate-forme pour accepter des vis de réglage qui servent de jambes pour élever la plate-forme et fournir un espace pour une barre d'agitation magnétique ( Figure 1A ).- Placez le bécher sur un magnétiqueAgiter la plaque et mettre la plaque d'agitation sur un étage de translation xy pour permettre le mouvement de la cible pendant l'ablation ( figure 1A ).
- Réglez le laser Nd: YAG pour fonctionner à la longueur d'onde fondamentale de 1 064 nm, avec une durée d'impulsion de 5 ns, et un taux de répétition d'impulsion de 10 Hz. Mesurez l'énergie par impulsion avec un compteur d'énergie et d'énergie laser. L'énergie requise est de 240-250 mJ.
- Concentrer le faisceau sous la cible sur l'étape d'ablation en utilisant une lentille convergente de longueur focale de 250 mm (NA = 0,05).
REMARQUE: Le faisceau entrant a un rayon de 4,025 mm et une hauteur de lentille de 161 mm est nécessaire pour atteindre la taille de spot souhaitée. La taille optimale des points est déterminée empiriquement. Une taille de tache plus grande est utilisée pour réduire l'effet du blindage par les NP présents en solution. Ceci est équilibré avec le fait que l'augmentation de la taille des taches nécessite une énergie plus élevée pour maintenir une fluidité adéquate. - Déterminer la taille de la tache en plaçant une cible métallique (voir sectioN 2) sur la scène et l'ablation avec plusieurs impulsions laser. Voir la cible ablée avec une glace micrométrique sur un microscope optique équipé d'une caméra CCD (objectif 4X) pour mesurer la taille de la tache ( Figure 1A ).
REMARQUE: pour l'appareil ici, le système d'ablation donne une taille de tache avec une surface moyenne de 5,51 mm 2 . La taille de la tache reste dans cette gamme pour chaque ablation. - Calculez la fluidité en divisant l'énergie des impulsions par la zone de détection. Pour l'appareil ici, la fluence est de 4,80 J / cm 2 .
2. Synthèse des nanoparticules d'argent par laser-ablation pulsée en liquide
- Peser une cible argent plate en utilisant une microbalance pour obtenir la masse de pré-ablation.
- Adhérer la cible d'argent à la phase poreuse en utilisant du ruban carbone à double face. Ajouter 40 ml de liquide d'ablation au bécher ( Figure 1A ). La hauteur du liquide au-dessus de la cible est de 11 mm.
REMARQUE: Ablation typique liqLes uides sont des solutions aqueuses contenant 60 mM de SDS ou 2 mM de PVP pour améliorer la monodispersité. - En remuant continuellement, déplacez le xy-stage motorisé commandé par ordinateur selon un motif elliptique (dimensions: axe principal = 2,09 cm, axe mineur = 0,956 cm, surface = 1,57 cm 2 ) à une vitesse de 0,42 cm / s et ablatez la cible Pendant 20 à 40 min.
NOTE: La concentration des NP augmente avec des temps d'ablation plus longs. Assurez-vous que l'agitation est suffisamment vigoureuse pour maintenir la concentration de NP uniforme dans toute la solution pour minimiser les effets de protection 7 .
3. Caractériser les nanoparticules métalliques
- Recueillir la solution de nanoparticules du bécher par décantation. Confirmer la présence de nanoparticules en mesurant leurs spectres lumineux UV-visibles (200-1 100 nm).
NOTE: Les NP ont une absorption de crête à la longueur d'onde de résonance de plasmon de surface (SPR). Pour l'argent, le SPR est centré à 400 nm. PN très concentréLes solutions nécessitent une dilution avant de mesurer le spectre UV-VIS pour s'assurer que les lectures d'absorbance restent dans la gamme linéaire du spectrophotomètre. - Mesurer le diamètre hydrodynamique des NP par diffusion dynamique de la lumière (DLS) en utilisant une méthode d'analyse de distribution de nombres 29 .
- Diluer la solution NP 1:40 dans la solution d'ablation et pipeter 1 mL dans une cuvette en plastique de 1 cm. En utilisant un angle de mesure de 180 ° , mesure la diffusion de la lumière à une longueur d'onde de 633 nm pour déterminer le diamètre NP selon l'équation de Stokes-Einstein:
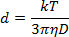
Où d est le rayon hydrodynamique, k est la constante de Boltzmann, T est la température absolue, η est la viscosité et le coefficient de diffusion translationnelle de D ou la vitesse du mouvement brownien.
- Diluer la solution NP 1:40 dans la solution d'ablation et pipeter 1 mL dans une cuvette en plastique de 1 cm. En utilisant un angle de mesure de 180 ° , mesure la diffusion de la lumière à une longueur d'onde de 633 nm pour déterminer le diamètre NP selon l'équation de Stokes-Einstein:
- Confirmer la taille et la forme NP en utilisant un micro-électronique à transmissionScopy (TEM) 30 .
NOTE: Le diamètre hydrodynamique mesuré à l'aide de DLS est supérieur à la taille mesurée à l'aide de TEM en raison de la couche de solvant entourant les NP.- Diluer la solution NP 1:40 dans de l'eau double-distillée pour enlever tous les additifs en excès ( p. Ex. SDS ou PVP) susceptibles d'interférer avec l'imagerie. Retirer 2 μL de la solution sur une grille TEM en cuivre pré-revêtue de film de dentelle / mince (disponible dans le commerce, voir la Liste des matériaux) et sécher pendant la nuit à température ambiante sous vide dans un dessiccateur.
- Image des NP pour évaluer la taille et la forme comme décrit dans la référence 30 .
- Pour calculer la concentration de NP, délimiter les NP NP lâches de la cible métallique ablatée (étape 2.3) en plaçant la cible dans un bain d'eau à ultrasons contenant de l'eau distillée pendant 1 min.
- Sécher la cible sous un courant d'air comprimé pendant 1 min. Mesurer la masse de la taRget sur une microbalance. Quantifier la masse de NP en solution comme différence de poids avant et après l'ablation, ce qui est supposé être le résultat de l'éjection de nanoparticules métalliques dans la solution.
4. Post-irradiation
- Diluer les NP à une concentration maximale de 100 μg / mL dans la même solution d'ablation utilisée en 2.2. Cette limite de concentration est essentielle pour assurer une irradiation uniforme.
- Transférer 15-17 ml des NP dilués dans une cuvette à quartz contenant une barre d'agitation ( Figure 1B ). Placez la cuvette sur une plaque d'agitation magnétique alignée parallèlement avec le laser entrant.
- Utilisez un système laser Nd: YAG pour produire des impulsions laser de 25 ps 532 nm et une lentille focale de 75 mm pour focaliser le laser sur le centre de la solution. Irradiate la solution pendant 30 minutes à plusieurs heures, selon la taille souhaitée.
NOTE: L'énergie totale fournie dépend de la concentration de la solution et de la TD'irradiation et peut aller de 0,5 mJ à 3,5 mJ. Pour l'appareil ici, 30 min de post-irradiation d'un échantillon transparent et à faible concentration (<50 μg / mL) donne des NP d'argent avec un diamètre de 10 nm.
5. Mesurer les propriétés antibactériennes des nanoparticules
NOTE: On a testé la toxicité des IP d'argent contre les Gram-positifs ( Bacillus subtilis ) et Gram-négatif ( Escherichia coli ) 31 . La méthode est facilement adaptée à toute espèce; Cependant, la dose efficace de nanoparticules peut varier considérablement et doit être déterminée de manière empirique. Ici, E. coli est utilisé comme système modèle pour la description de la méthode.
- Cultiver des cultures de E. coli (souche MG1655) pendant une nuit à 37 ° C dans Luria Broth (LB) contenant 10 g / L de Tryptone de Bacto, 5 g / L d'extrait de levure et 10 g / L de chlorure de sodium. Diluer les cultures de nuit jusqu'à une densité optique (λ = 600Nm) de 0,01 dans LB frais.
- Si les NP ont été synthétisés dans des milieux d'ablation contenant des additifs ( p. Ex. SDS ou PVP), ajoutez le produit chimique respectif à la LB de sorte que la concentration reste constante lors de l'addition des NP.
NOTE: Par exemple, dans une expérience typique, une cible d'argent est ablée dans une solution de SDS 60 mM pour donner une solution de NP de 100 μg / mL. Si la concentration finale de NP dans les milieux de culture est de 10 μg / mL, préparer LB contenant du SDS 6 mM ( c.-à-d. 1/10 de la concentration de SDS dans le liquide d'ablation). Il n'y a aucun effet négatif sur la croissance de la bactérie lors de l'utilisation de ces concentrations. Cela est indiqué dans le contrôle -AgNP de la figure 3 . - Ajouter les NP aux cultures diluées à des concentrations allant de 0 à 50 μg / mL et faire pousser les cultures avec agitation à 37 ° C pendant 2 h supplémentaires. En tant que témoin positif de la toxicité, traiter E. coli avec un antibiotique ( par ex. 30 μg / mL kanamYcin).
- Après 2 heures d'incubation, diluer en série les échantillons de culture 1:10 en LB fraîche et repérer 10 μL de gouttes de chaque dilution sur des plaques d'agar LB. Typiquement, 10 4 -10 8 dilutions sont suffisantes pour voir les colonies individuelles.
- Une fois que les gouttelettes ont été absorbées, incuber les plaques pendant une nuit à 37 ° C et compter les unités formant des colonies (cfu) le lendemain matin.
Résultats
En utilisant des cibles d'argent, les paramètres laser décrits ci-dessus et 60 mM de SDS dans le liquide d'ablation, les NP d'argent sont générés avec l'absorbance UV-VIS caractéristique au SPR ( Figure 2A ). Les mesures TEM et DLS révèlent un diamètre NP moyen d'environ 25 nm avant la post-irradiation ( Figure 2B ). L'ablation de la cible d'argent pendant 30 min donne typiquement une concent...
Discussion
Les effets antimicrobiens reproductibles des NP nécessitent une production constante de NP avec des tailles et des concentrations similaires. Par conséquent, il est essentiel de standardiser les paramètres laser, y compris la fluidité, la longueur d'onde et la durée d'impulsion. Alors que la diffusion dynamique de la lumière est une méthode simple et rapide pour estimer la taille NP, une quantification précise de la distribution de taille nécessite une mesure directe par TEM. Comme chaque faisceau laser...
Déclarations de divulgation
Les auteurs n'ont rien à dévoiler.
Remerciements
Ce travail a été soutenu par la National Science Foundation (NSF attribue CMMI-0922946 à DB, CMMI-1300920 à DB et S.O'M., Et CMMI-1531789 à S.O'M., DB et EAK) et un Busch Biomedical Research Grant à EAK et S.O'M.
matériels
| Name | Company | Catalog Number | Comments |
| Nanosecond Nd:YAG laser | Ekspla | NL303 | |
| Motorized xy scanning stage | Standa | 8MTF | |
| UV-VIS spectrophotometer | Agilent | Cary 60 | |
| Dynamic light scattering unit | Malvern | Zetasizer ZS 90 | |
| Microbalance | Maktek | TM 400 | |
| Transmission electron microscope | Zeiss | EM 902 | |
| Silver foil target | Alfa Aesar | 12127 | |
| 250 mm focal length lens | Edmund Optics | 69-624 | |
| Copper TEM grids | Pacific Grid-Tech | Cu-400LD | Lacey/thin film coated grid |
| E. coli MG1655 | ATCC | 47076 | |
| Bacto-tryptone | BD Biosciences | 211705 | |
| Yeast extract | BD Biosciences | 212750 | |
| Sodium chloride | Fisher Scientific | BP3581 | |
| Bacto-agar | BD Biosciences | 214010 | |
| Sodium dodecyl sulfate | Fisher Scientific | BP166-100 | |
| Polyvinylpyrrolidone | Fisher Scientific | BP431-100 | |
| Stainless steel disc (for ablation stage) | Metal Remnants, Inc. | N/A | 1.5 inch diameter, 16 gauge |
| Beaker | Fisher Scientific | 02-540G | |
| Magnetic stir bar | Fisher Scientific | 14-513-57 | |
| Magnetic stir plate | Fisher Scientific | 11-100-49SH | |
| Laser energy and power meter | Coherent | 1098579 | |
| Carbon tape | Shinto Chemitron Co. Ltd. | STR Tape | |
| Sonicating water bath | Branson | 1510 | |
| Air compressor | GMC | Syclone 3010 | For drying ablation target |
| 75 mm focal length lens | Edmund Optics | 34-096 | Focusing lens for post-irradiation |
| Quartz cuvette | Precision Cells Inc | 21UV40 | 50 mm light path (for post-irradiation) |
| Kanamycin | Fisher Scientific | BP906-5 | |
| Light microscope | Nikon | 50i | This microscope is used to focus the laser on the ablation stage. This particular model is no longer available, but any light microscope with a 4X objective will work. |
| CCD camera | AmScope | MT5000-CCD | |
| Micrometer slide | Ted Pella | 2280-70 |
Références
- Amendola, V., Meneghetti, M. What controls the composition and the structure of nanomaterials generated by laser ablation in liquid solution?. Phys Chem Chem Phys. 15 (9), 3027-3046 (2013).
- Anastas, P., Eghbali, N. Green chemistry: principles and practice. Chem Soc Rev. 39 (1), 301-312 (2010).
- Mafune, F., Kohno, J. Y., Takeda, Y., Kondow, T., Sawabe, H. Formation of Gold Nanoparticles by Laser Ablation in Aqueous Solution of Surfactant. J Phys Chem B. 105 (22), 5114-5120 (2001).
- Rao, S. V., Podagatlapalli, G. K., Hamad, S. Ultrafast laser ablation in liquids for nanomaterials and applications. J Nanosci Nanotechnol. 14 (2), 1364-1388 (2014).
- Tsuji, T., et al. Preparation of silver nanoparticles by laser ablation in polyvinylpyrrolidone solutions. Appl Surf Sci. 254 (16), 5224-5230 (2008).
- Zeng, H., et al. Nanomaterials via laser ablation/irradiation in liquid: a review. Adv Funct Mater. 22 (7), 1333-1353 (2012).
- Naddeo, J. J., et al. Antibacterial Properties of Nanoparticles: A Comparative Review of Chemically Synthesized and Laser-Generated Particles. Adv. Sci. Eng. Med. 7 (12), 1044-1057 (2015).
- Elsayed, K. A., Imam, H., Ahmed, M. A., Ramadan, R. Effect of focusing conditions and laser parameters on the fabrication of gold nanoparticles via laser ablation in liquid. Opt. & Laser Tech. 45, 495-502 (2013).
- Kabashin, A. V., Meunier, M. Synthesis of colloidal nanoparticles during femtosecond laser ablation of gold in water. J Appl Phys. 94 (12), 7941-7943 (2003).
- Nichols, W. T., Sasaki, T., Koshizaki, N. Laser ablation of a platinum target in water I. Ablation mechanisms. J Appl Phys. 100 (11), 114911 (2006).
- Povarnitsyn, M. E., Itina, T. E., Levashov, P. R., Khishchenko, K. V. Mechanisms of nanoparticle formation by ultra-short laser ablation of metals in liquid environment. Phys Chem Chem Phys. 15 (9), 3108-3114 (2013).
- Mortazavi, S. Z., Parvin, P., Reyhani, A., Golikand, A. N., Mirershadi, S. Effect of Laser Wavelength at IR (1064 nm) and UV (193 nm) on the Structural Formation of Palladium Nanoparticles in Deionized Water. J Phys Chem C. 115 (12), 5049-5057 (2011).
- Kim, J., Reddy, D. A., Ma, R., Kim, T. K. The influence of laser wavelength and fluence on palladium nanoparticles produced by pulsed laser ablation in deionized water. Solid State Sci. 37, 96-102 (2014).
- Mortazavi, S. Z., Parvin, P., Reyhani, A., Mirershadi, S., Sadighi-Bonabi, R. Generation of various carbon nanostructures in water using IR/UV laser ablation. J Phys D: Appl Phys. 46 (16), 165303 (2013).
- Hunter, B. M., et al. Highly active mixed-metal nanosheet water oxidation catalysts made by pulsed-laser ablation in liquids. J Am Chem Soc. 136 (38), 13118-13121 (2014).
- Momma, C., et al. Short-pulse laser ablation of solid targets. Opt Commun. 129 (1), 134-142 (1996).
- Sonntag, S., Roth, J., Gaehler, F., Trebin, H. R. Femtosecond laser ablation of aluminium. Appl Surf Sci. 255 (24), 9742-9744 (2009).
- Yamashita, Y., Yokomine, T., Ebara, S., Shimizu, A. Heat transport analysis for femtosecond laser ablation with molecular dynamics-two temperature model method. Fusion Eng Des. 81 (8), 1695-1700 (2006).
- Zhigilei, L. V., Lin, Z., Ivanov, D. S. Atomistic modeling of short pulse laser ablation of metals: connections between melting, spallation, and phase explosion. J Phys Chem C. 113 (27), 11892-11906 (2009).
- Schmidt, M., et al. Lasers in Manufacturing 2011 - Proceedings of the Sixth International WLT Conference on Lasers in Manufacturing Metal Ablation with Short and Ultrashort Laser Pulses. Physics Procedia. 12, 230-238 (2011).
- Azam, A., Ahmed, A. S., Oves, M., Khan, M. S., Memic, A. Size-dependent antimicrobial properties of CuO nanoparticles against Gram-positive and-negative bacterial strains. Int. J. Nanomed. 7, 3527-3535 (2012).
- Ivask, A., et al. Size-dependent toxicity of silver nanoparticles to bacteria, yeast, algae, crustaceans and mammalian cells in vitro. PLoS One. 9 (7), e102108 (2014).
- Kim, T. H., et al. Size-dependent cellular toxicity of silver nanoparticles. J Biomed Mater Res A. 100 (4), 1033-1043 (2012).
- Raghupathi, K. R., Koodali, R. T., Manna, A. C. Size-dependent bacterial growth inhibition and mechanism of antibacterial activity of zinc oxide nanoparticles. Langmuir. 27 (7), 4020-4028 (2011).
- Plech, A., Kotaidis, V., Gresillon, S., Dahmen, C., von Plessen, G. Laser-induced heating and melting of gold nanoparticles studied by time-resolved x-ray scattering. Phys Rev B. 70 (19), 195423 (2004).
- Takami, A., Kurita, H., Koda, S. Laser-Induced Size Reduction of Noble Metal Particles. J Phys Chem B. 103 (8), 1226-1232 (1999).
- Kamat, P. V., Flumiani, M., Hartland, G. V. Picosecond Dynamics of Silver Nanoclusters. Photoejection of Electrons and Fragmentation. J Phys Chem B. 102 (17), 3123-3128 (1998).
- Yamada, K., Tokumoto, Y., Nagata, T., Mafune, F. Mechanism of laser-induced size-reduction of gold nanoparticles as studied by nanosecond transient absorption spectroscopy. J Phys Chem B. 110 (24), 11751-11756 (2006).
- Pecora, R. Dynamic Light Scattering Measurement of Nanometer Particles in Liquids. J. Nanoparticle Res. 2 (2), 123-131 (2000).
- Pyrz, W. D., Buttrey, D. J. Particle size determination using TEM: a discussion of image acquisition and analysis for the novice microscopist. Langmuir. 24 (20), 11350-11360 (2008).
- Ratti, M., et al. Irradiation with visible light enhances the antibacterial toxicity of silver nanoparticles produced by laser ablation. Appl Phys A. 122 (4), 1-7 (2016).
- Sajti, C. L., Sattari, R., Chichkov, B. N., Barcikowski, S. Gram Scale Synthesis of Pure Ceramic Nanoparticles by Laser Ablation in Liquid. J Phys Chem C. 114 (6), 2421-2427 (2010).
- Streubel, R., Barcikowski, S., Gokce, B. Continuous multigram nanoparticle synthesis by high-power, high-repetition-rate ultrafast laser ablation in liquids. Opt Lett. 41 (7), 1486-1489 (2016).
- Streubel, R., Bendt, G., Gokce, B. Pilot-scale synthesis of metal nanoparticles by high-speed pulsed laser ablation in liquids. Nanotechnology. 27 (20), 205602 (2016).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon