このコンテンツを視聴するには、JoVE 購読が必要です。 サインイン又は無料トライアルを申し込む。
Method Article
液体中のパルスレーザアブレーションによる金属ナノ粒子の生成:ナノ粒子の抗菌特性を調べるためのツール
要約
銅および銀のような金属の抗菌特性は何世紀にもわたって認識されてきた。このプロトコルは、液体中でのパルスレーザーアブレーション、これらのナノ粒子の特性を微調整してその抗菌効果を最適化する能力を提供する金属ナノ粒子を合成する方法を記載している。
要約
多剤耐性菌の出現は、世界的な臨床的関心事であり、一部の者は、「抗生物質前」の医薬品の時代への復帰を推測している。新規な小分子抗菌薬を同定する努力に加えて、抗菌特性のために、医療器具、創傷被覆材、および消費者包装のためのコーティングとしての金属ナノ粒子の使用に大きな関心が寄せられている。ナノ粒子合成に利用可能な広範囲の方法は、抗菌効力に影響を及ぼすことができる広範囲の化学的および物理的特性をもたらす。この原稿では、ナノ粒子を作製するための液体中のパルスレーザアブレーション(PLAL)法について説明します。このアプローチは、照射後の方法ならびに界面活性剤または容量排除剤の添加を使用して、ナノ粒子のサイズ、組成および安定性の微調整を可能にする。粒径および組成を制御することにより、金属ナノ粒子の物理的および化学的特性の広い範囲それらの抗微生物効力に寄与することができ、それによって抗菌発達のための新しい道を開くことができる。
概要
ナノ粒子(NP)は、一般に、長さが100nm未満の少なくとも1つの寸法を有する粒子として定義される。従来の化学的NP合成法は、典型的には、水素化ホウ素およびヒドラジンのような有害な還元剤を必要とする。対照的に、液体媒体に浸漬された固体金属ターゲットのレーザーアブレーション(液体中のパルスレーザーアブレーション - PLAL)は、グリーン化学1,2の全12項目を満たすNP合成のための環境に優しいルートを提供する。 PLALでは、浸漬した金属ターゲットに繰り返しレーザーパルスを照射します。レーザーがターゲットをアブレーションすると、原子クラスターおよび蒸気の高密度プルームが液体媒体に放出され、そこでNPは急速に融合する。 PLALによって生成されたNPは、水性媒体中に微細に分散され、NPのサイズ、多分散性、および組成は、水性アブレーション液体ならびにレーザーパーツを変えることによって容易に制御することができる1、2、3、4、5、6。
ナノ粒子の特性は、フルエンス、波長、およびパルス持続時間を含む多くのレーザーパラメータを調整することによって調整することができる(参考文献7で概説)。レーザーフルエンスは、パルスエネルギーをターゲット表面上のレーザースポットの面積で割ったものとして計算されます。 NPのサイズおよび多分散性に対するフルエンスの正確な影響は、幾分議論の余地がある。一般的に、「ロング」および「超短パルス」レーザシステムでは、それぞれ8,9,10,11という負の傾向および正の傾向を生じる低フルエンスおよび高フルエンス領域が存在することが示されている。 NPサイズ配布以下に説明するように、動的光散乱および透過型電子顕微鏡(TEM)などの技法を用いて経験的に測定することができる。
レーザー波長の選択は、NPが形成される物理的メカニズムに影響を及ぼし得る。より短い(紫外線)波長では、高エネルギー光子は原子間結合を破壊することができる12 。この光アブレーションのメカニズムは、液浸液12,13,14 で急冷するとより大きな多分散サンプルを生成する傾向のある材料の超小型フラグメントの放出をもたらすので、トップダウンNP合成の一例である。対照的に、近赤外アブレーション(λ= 1064nm)は、プラズマアブレーション12を支配するボトムアップ合成メカニズムをもたらす。ターゲットによるレーザ吸収は、結合した電子と衝突し、その後自由な電子を解放する。 cとして物質がイオン化し、プラズマが点火する。周囲の液体はプラズマを閉じ込め、その安定性を高め、さらに吸収を増加させる12 。膨張するプラズマが閉じ込め液体によって急冷されると、NPは様々な形状4,12,15で凝縮される。
レーザパルス持続時間の選択は、NP形成プロセスにさらに影響を及ぼす可能性がある。数ピコ秒よりも長いパルス持続時間を有する一般的に使用される長パルスレーザは、ミリ、マイクロ、ナノおよびピコ秒パルスレーザのすべてを含む。このパルス幅領域では、レーザパルス持続時間は、典型的には数ピコ秒のオーダーである電子 - フォノン平衡時間よりも長い4,16,17,18,19。これは、周囲のアブレーション媒体へのエネルギーの漏れと、熱電子放出、気化、沸騰および融解などの熱機構によるNPの形成をもたらす。
NPの抗菌活性は、粒径21,22,23,24の影響を強く受ける。サイズ縮小および単分散性を高めるために、NPは、NPの表面プラズモン共鳴(SPR)に近い波長のレーザーを用いて2回目に照射することができる。入射レーザ放射は、SPRの励起によってNPによって吸収される。 NPの断片化は、熱蒸発25,26またはクーロン爆発27,28のいずれかによって起こり得る。光励起によってt融点より上のNPの温度であり、結果として粒子の外層が脱落する。ポリビニルピロリドン(PVP)またはドデシル硫酸ナトリウム(SDS)などの薬剤を溶液に添加すると、照射後効果が大幅に向上することが示されている5 。種々の溶質の添加の影響は、いくつかの報告書1,4,6に記載されている。 PLALによるNP特性の操作の容易さは、新規のNP系抗菌剤を開発するための新規な方法を提供する。
プロトコル
1.ナノ秒レーザーの集束とフルエンスの測定
- アブレーション装置を、50mLのガラスビーカー内に磁気攪拌棒および多孔質アブレーション段階を置くことによって組み立てる。
注:アブレーションステージは、直径0.65cmの穴10個と直径0.50cmの穴6個が図1に示すパターンでドリルされた直径3.81cm、厚さ1.6mmのステンレススチールのプラットフォームで構成されています。これらの穴の目的は、液体が標的を横切って移動し、粒子が標的のすぐ上に蓄積しないようにすることである。不十分な混合は、レーザとすでに形成された粒子との間の有害な相互作用をもたらす。さらに、#29(8-32)の3つのタップ穴は、プラットホームを持ち上げて磁気攪拌棒( 図1A )のためのスペースを提供するための脚として機能する止めねじを受け入れるために、プラットホームの周縁近くに配置されています。- ビーカーを磁気の上に置くプレートを撹拌し、切除プレート( 図1A )の移動を可能にするためにxy平行移動ステージ上に攪拌プレートをセットする。
- Nd:YAGレーザーを基本波長1064nm、パルス持続時間5ns、パルス繰返し率10Hzで動作するように設定する。レーザーパワーとエネルギーメーターで1パルスあたりのエネルギーを測定します。必要なエネルギーは240-250 mJです。
- 250 mmの焦点距離の集光レンズ(NA = 0.05)を使用して、アブレーションステージ上のターゲットの下にビームをフォーカスします。
注:入射ビームの半径は4.025 mmで、レンズの高さは161 mm必要です。最適スポットサイズは経験的に決定される。溶液中に存在するNPによる遮蔽効果を低減するために、より大きなスポットサイズが利用される。これは、スポットサイズを大きくすると、適切なフルエンスを維持するためにより高いエネルギーが必要になるという事実と釣り合っています。 - 金属ターゲットを置くことによってスポットサイズを決定する(section 2)をステージ上に置き、いくつかのレーザパルスでアブレーションする。スポットサイズ( 図1A )を測定するCCDカメラ付き光学顕微鏡(4倍対物レンズ)上のマイクロメータースライドと一緒にアブレーションされたターゲットを表示します。
注:ここでの装置では、アブレーションシステムは5.51mm 2の平均面積を有するスポットサイズを生じる。スポットサイズは、各アブレーションについてこの範囲にとどまる。 - パルスエネルギーをスポット面積で割ってフルエンスを計算します。ここの装置では、フルエンスは4.80J / cm 2である。
2.液体中のパルスレーザアブレーションによる銀ナノ粒子の合成
- プレアブレーション質量を得るためにマイクロバランスを用いて平らな銀ターゲットを秤量する。
- 銀ターゲットを両面カーボンテープを使用して多孔質ステージに付着させます。ビーカーに40mLの切除液を加えます( 図1A )。ターゲット上の液体の高さは11 mmです。
注:典型的なアブレーション液単分散性を高めるために、60mM SDSまたは2mM PVPのいずれかを含む水溶液である。 - 絶え間なく攪拌しながら、コンピュータ制御の電動式xyステージを0.42cm / sの速度で楕円形のパターン(寸法:長軸= 2.09cm、短軸= 0.956cm、面積= 1.57cm 2)で動かし、ターゲットをアブレーションする20〜40分間。
注:NPの濃度は、より長いアブレーション時間とともに増加する。遮蔽効果を最小限に抑えるために、溶液全体にわたってNP濃度を均一に保つために攪拌が十分に激しいことを確認する。
金属ナノ粒子のキャラクタリゼーション
- デカンテーションによってビーカーからナノ粒子溶液を収集する。 UV-可視光スペクトル(200-1,100nm)を測定することによって、ナノ粒子の存在を確認する。
注:NPは、表面プラズモン共鳴(SPR)波長においてピーク吸収を有する。銀については、SPRは400nmの中心にある。高濃度NP溶液は、吸光度の読みが分光光度計の線形範囲内に留まるようにUV-VISスペクトルを測定する前に希釈する必要があります。 - 数値分布解析法29を用いて動的光散乱法(DLS)によりNPの流体力学的直径を測定する。
- 切除溶液中のNP溶液1:40を希釈し、1cmのプラスチックキュベットに1mLピペットで入れる。 180°の測定角度を利用して、633nmの波長での光散乱を測定して、ストークス - アインシュタインの式に従ってNP直径を決定する:
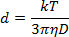
ここで、dは流体力学的半径、kはボルツマン定数、Tは絶対温度、ηは粘度、Dはブラウン運動の並進拡散係数または速度である。
- 切除溶液中のNP溶液1:40を希釈し、1cmのプラスチックキュベットに1mLピペットで入れる。 180°の測定角度を利用して、633nmの波長での光散乱を測定して、ストークス - アインシュタインの式に従ってNP直径を決定する:
- 透過電子顕微鏡を用いてNPサイズと形状を確認するスコピー(TEM) 30 。
注:DLSを使用して測定された流体力学的直径は、NPを囲む溶媒層に起因してTEMを使用して測定されたサイズよりも大きい。- 二重蒸留水で1:40のNP溶液を希釈して、イメージングを妨げる余分な添加物( 例えば、 SDSまたはPVP)を除去する。レース/薄いカーボンフィルム(市販品;材料リストを参照)でプレコートした銅TEMグリッド上に2μLの溶液を滴下し、デシケーター中、真空下、室温で一晩乾燥させる。
- NPを画像化して、参考文献30に記載されているようにサイズおよび形状を評価する。
- NP濃度を計算するには、ターゲットを蒸留水を入れた超音波水槽に1分間入れて、アブレートされた金属ターゲットから緩く付着したNPを除去する(ステップ2.3)。
- ターゲットを圧縮空気の流れの下で1分間乾燥する。タの質量を測定する微量天秤に取り付けてください。融解前後の重量の差として溶液中のNPの質量を定量する。これは金属ナノ粒子を溶液中に放出した結果と推定される。
4.照射後
- 2.2で使用したのと同じアブレーション溶液でNPを100μg/ mLの最大濃度に希釈する。この濃度限界は、均一な照射を確実にするために重要である。
- 15-17 mLの希釈したNPを攪拌棒を含む石英キュベットに移す( 図1B )。キュベットを、入ってくるレーザーと平行に配置された磁気撹拌プレート上に置く。
- Nd:YAGレーザーシステムを使用して25 ps 532 nmレーザーパルスを生成し、75 mm焦点距離レンズを使用して、レーザーを溶液の中心に集束させます。所望のサイズに応じて、溶液を30分〜数時間照射する。
注:送達される総エネルギーは、溶液の濃度およびt0.5mJ〜3.5mJの範囲であり得る。この装置では、透明で低濃度のサンプル(<50μg/ mL)の照射後30分で直径10nmの銀NPが得られます。
5.ナノ粒子の抗菌特性の測定
注:グラム陽性菌( Bacillus subtilis )およびグラム陰性菌( Escherichia coli )の両方に対する銀NPの毒性を試験した31 。この方法はどの種にも容易に適応できる。しかしながら、ナノ粒子の有効量はかなり変化し、経験的に決定されなければならない。ここでは、この方法の説明のためのモデル系として大腸菌を用いる。
- バクトトリプトン10g / L、酵母エキス5g / L、塩化ナトリウム10g / Lを含むLuria Broth(LB)中、37℃で一晩大腸菌培養物(株MG1655)を増殖させる。一晩培養物を光学密度(λ= 600nm)を新鮮LB中で0.01とする。
- NPが添加剤( 例えば、 SDSまたはPVP)を含むアブレーション媒体中で合成された場合、NPを添加すると濃度が一定になるように、それぞれの化学物質をLBに添加する。
注:例えば、典型的な実験では、銀ターゲットを60mM SDS溶液に溶かしてNPの100μg/ mL溶液を得る。培養培地中のNPの最終濃度が10μg/ mLである場合、6mM SDSを含むLB( すなわち 、アブレーション液中のSDS濃度の1/10)を調製する。これらの濃度を使用した場合、細菌の増殖に悪影響はありません。これは図3の -AgNPコントロールに示されています。 - 0〜50μg/ mLの範囲の濃度で希釈した培養液にNPを添加し、37℃で振とうしながら培養物をさらに2時間増殖させる。毒性の陽性対照として、抗生物質( 例えば、 30μg/ mLのカナマイシンイシン)。
- 2時間のインキュベーションの後、培養試料を1:10に順次希釈して新鮮なLBにし、各希釈液の10μL滴をLB寒天プレートにスポットする。典型的には、個々のコロニーを見るには10 4〜10 8倍希釈で十分である。
- 液滴が吸収されたら、37℃で一晩プレートをインキュベートし、翌朝、コロニー形成単位(cfu)をカウントする。
結果
銀ターゲット、上述のレーザパラメータ、およびアブレーション液体中の60mM SDSを使用して、銀NPがSPRで特徴的なUV-VIS吸光度で生成される( 図2A )。 TEMおよびDLS測定は、照射後( 図2B )の前に約25nmの平均NP直径を示す 。銀ターゲットを30分間アブレーションすると、典型的に200μg/ mLのNP濃度が得られ...
ディスカッション
NPの再現性のある抗菌効果は、同様の大きさおよび濃度のNPの一貫した生産を必要とする。したがって、フルエンス、波長、およびパルス持続時間を含むレーザパラメータを標準化することが重要です。動的光散乱は、NPサイズを推定するための簡単で迅速な方法であるが、サイズ分布の正確な定量は、TEMによる直接測定を必要とする。各レーザビームはモードプロファイルおよび発散の点で...
開示事項
著者は何も開示することはありません。
謝辞
この研究は、国立科学財団(NSF賞DBのCMMI-0922946、DBおよびS.O'M。のCMMI-1300920、S.O.M。、DBおよびEAKのCMMI-1531789)およびブッシュ・バイオメディカル・リサーチ・グラント(EAK and S.O'M)
資料
| Name | Company | Catalog Number | Comments |
| Nanosecond Nd:YAG laser | Ekspla | NL303 | |
| Motorized xy scanning stage | Standa | 8MTF | |
| UV-VIS spectrophotometer | Agilent | Cary 60 | |
| Dynamic light scattering unit | Malvern | Zetasizer ZS 90 | |
| Microbalance | Maktek | TM 400 | |
| Transmission electron microscope | Zeiss | EM 902 | |
| Silver foil target | Alfa Aesar | 12127 | |
| 250 mm focal length lens | Edmund Optics | 69-624 | |
| Copper TEM grids | Pacific Grid-Tech | Cu-400LD | Lacey/thin film coated grid |
| E. coli MG1655 | ATCC | 47076 | |
| Bacto-tryptone | BD Biosciences | 211705 | |
| Yeast extract | BD Biosciences | 212750 | |
| Sodium chloride | Fisher Scientific | BP3581 | |
| Bacto-agar | BD Biosciences | 214010 | |
| Sodium dodecyl sulfate | Fisher Scientific | BP166-100 | |
| Polyvinylpyrrolidone | Fisher Scientific | BP431-100 | |
| Stainless steel disc (for ablation stage) | Metal Remnants, Inc. | N/A | 1.5 inch diameter, 16 gauge |
| Beaker | Fisher Scientific | 02-540G | |
| Magnetic stir bar | Fisher Scientific | 14-513-57 | |
| Magnetic stir plate | Fisher Scientific | 11-100-49SH | |
| Laser energy and power meter | Coherent | 1098579 | |
| Carbon tape | Shinto Chemitron Co. Ltd. | STR Tape | |
| Sonicating water bath | Branson | 1510 | |
| Air compressor | GMC | Syclone 3010 | For drying ablation target |
| 75 mm focal length lens | Edmund Optics | 34-096 | Focusing lens for post-irradiation |
| Quartz cuvette | Precision Cells Inc | 21UV40 | 50 mm light path (for post-irradiation) |
| Kanamycin | Fisher Scientific | BP906-5 | |
| Light microscope | Nikon | 50i | This microscope is used to focus the laser on the ablation stage. This particular model is no longer available, but any light microscope with a 4X objective will work. |
| CCD camera | AmScope | MT5000-CCD | |
| Micrometer slide | Ted Pella | 2280-70 |
参考文献
- Amendola, V., Meneghetti, M. What controls the composition and the structure of nanomaterials generated by laser ablation in liquid solution?. Phys Chem Chem Phys. 15 (9), 3027-3046 (2013).
- Anastas, P., Eghbali, N. Green chemistry: principles and practice. Chem Soc Rev. 39 (1), 301-312 (2010).
- Mafune, F., Kohno, J. Y., Takeda, Y., Kondow, T., Sawabe, H. Formation of Gold Nanoparticles by Laser Ablation in Aqueous Solution of Surfactant. J Phys Chem B. 105 (22), 5114-5120 (2001).
- Rao, S. V., Podagatlapalli, G. K., Hamad, S. Ultrafast laser ablation in liquids for nanomaterials and applications. J Nanosci Nanotechnol. 14 (2), 1364-1388 (2014).
- Tsuji, T., et al. Preparation of silver nanoparticles by laser ablation in polyvinylpyrrolidone solutions. Appl Surf Sci. 254 (16), 5224-5230 (2008).
- Zeng, H., et al. Nanomaterials via laser ablation/irradiation in liquid: a review. Adv Funct Mater. 22 (7), 1333-1353 (2012).
- Naddeo, J. J., et al. Antibacterial Properties of Nanoparticles: A Comparative Review of Chemically Synthesized and Laser-Generated Particles. Adv. Sci. Eng. Med. 7 (12), 1044-1057 (2015).
- Elsayed, K. A., Imam, H., Ahmed, M. A., Ramadan, R. Effect of focusing conditions and laser parameters on the fabrication of gold nanoparticles via laser ablation in liquid. Opt. & Laser Tech. 45, 495-502 (2013).
- Kabashin, A. V., Meunier, M. Synthesis of colloidal nanoparticles during femtosecond laser ablation of gold in water. J Appl Phys. 94 (12), 7941-7943 (2003).
- Nichols, W. T., Sasaki, T., Koshizaki, N. Laser ablation of a platinum target in water I. Ablation mechanisms. J Appl Phys. 100 (11), 114911 (2006).
- Povarnitsyn, M. E., Itina, T. E., Levashov, P. R., Khishchenko, K. V. Mechanisms of nanoparticle formation by ultra-short laser ablation of metals in liquid environment. Phys Chem Chem Phys. 15 (9), 3108-3114 (2013).
- Mortazavi, S. Z., Parvin, P., Reyhani, A., Golikand, A. N., Mirershadi, S. Effect of Laser Wavelength at IR (1064 nm) and UV (193 nm) on the Structural Formation of Palladium Nanoparticles in Deionized Water. J Phys Chem C. 115 (12), 5049-5057 (2011).
- Kim, J., Reddy, D. A., Ma, R., Kim, T. K. The influence of laser wavelength and fluence on palladium nanoparticles produced by pulsed laser ablation in deionized water. Solid State Sci. 37, 96-102 (2014).
- Mortazavi, S. Z., Parvin, P., Reyhani, A., Mirershadi, S., Sadighi-Bonabi, R. Generation of various carbon nanostructures in water using IR/UV laser ablation. J Phys D: Appl Phys. 46 (16), 165303 (2013).
- Hunter, B. M., et al. Highly active mixed-metal nanosheet water oxidation catalysts made by pulsed-laser ablation in liquids. J Am Chem Soc. 136 (38), 13118-13121 (2014).
- Momma, C., et al. Short-pulse laser ablation of solid targets. Opt Commun. 129 (1), 134-142 (1996).
- Sonntag, S., Roth, J., Gaehler, F., Trebin, H. R. Femtosecond laser ablation of aluminium. Appl Surf Sci. 255 (24), 9742-9744 (2009).
- Yamashita, Y., Yokomine, T., Ebara, S., Shimizu, A. Heat transport analysis for femtosecond laser ablation with molecular dynamics-two temperature model method. Fusion Eng Des. 81 (8), 1695-1700 (2006).
- Zhigilei, L. V., Lin, Z., Ivanov, D. S. Atomistic modeling of short pulse laser ablation of metals: connections between melting, spallation, and phase explosion. J Phys Chem C. 113 (27), 11892-11906 (2009).
- Schmidt, M., et al. Lasers in Manufacturing 2011 - Proceedings of the Sixth International WLT Conference on Lasers in Manufacturing Metal Ablation with Short and Ultrashort Laser Pulses. Physics Procedia. 12, 230-238 (2011).
- Azam, A., Ahmed, A. S., Oves, M., Khan, M. S., Memic, A. Size-dependent antimicrobial properties of CuO nanoparticles against Gram-positive and-negative bacterial strains. Int. J. Nanomed. 7, 3527-3535 (2012).
- Ivask, A., et al. Size-dependent toxicity of silver nanoparticles to bacteria, yeast, algae, crustaceans and mammalian cells in vitro. PLoS One. 9 (7), e102108 (2014).
- Kim, T. H., et al. Size-dependent cellular toxicity of silver nanoparticles. J Biomed Mater Res A. 100 (4), 1033-1043 (2012).
- Raghupathi, K. R., Koodali, R. T., Manna, A. C. Size-dependent bacterial growth inhibition and mechanism of antibacterial activity of zinc oxide nanoparticles. Langmuir. 27 (7), 4020-4028 (2011).
- Plech, A., Kotaidis, V., Gresillon, S., Dahmen, C., von Plessen, G. Laser-induced heating and melting of gold nanoparticles studied by time-resolved x-ray scattering. Phys Rev B. 70 (19), 195423 (2004).
- Takami, A., Kurita, H., Koda, S. Laser-Induced Size Reduction of Noble Metal Particles. J Phys Chem B. 103 (8), 1226-1232 (1999).
- Kamat, P. V., Flumiani, M., Hartland, G. V. Picosecond Dynamics of Silver Nanoclusters. Photoejection of Electrons and Fragmentation. J Phys Chem B. 102 (17), 3123-3128 (1998).
- Yamada, K., Tokumoto, Y., Nagata, T., Mafune, F. Mechanism of laser-induced size-reduction of gold nanoparticles as studied by nanosecond transient absorption spectroscopy. J Phys Chem B. 110 (24), 11751-11756 (2006).
- Pecora, R. Dynamic Light Scattering Measurement of Nanometer Particles in Liquids. J. Nanoparticle Res. 2 (2), 123-131 (2000).
- Pyrz, W. D., Buttrey, D. J. Particle size determination using TEM: a discussion of image acquisition and analysis for the novice microscopist. Langmuir. 24 (20), 11350-11360 (2008).
- Ratti, M., et al. Irradiation with visible light enhances the antibacterial toxicity of silver nanoparticles produced by laser ablation. Appl Phys A. 122 (4), 1-7 (2016).
- Sajti, C. L., Sattari, R., Chichkov, B. N., Barcikowski, S. Gram Scale Synthesis of Pure Ceramic Nanoparticles by Laser Ablation in Liquid. J Phys Chem C. 114 (6), 2421-2427 (2010).
- Streubel, R., Barcikowski, S., Gokce, B. Continuous multigram nanoparticle synthesis by high-power, high-repetition-rate ultrafast laser ablation in liquids. Opt Lett. 41 (7), 1486-1489 (2016).
- Streubel, R., Bendt, G., Gokce, B. Pilot-scale synthesis of metal nanoparticles by high-speed pulsed laser ablation in liquids. Nanotechnology. 27 (20), 205602 (2016).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved