Se requiere una suscripción a JoVE para ver este contenido. Inicie sesión o comience su prueba gratuita.
Method Article
Producción de nanopartículas metálicas por ablación por láser pulsado en líquidos: una herramienta para estudiar las propiedades antibacterianas de las nanopartículas
En este artículo
Resumen
Las propiedades antimicrobianas de los metales como el cobre y la plata se han reconocido durante siglos. Este protocolo describe la ablación por láser pulsada en líquidos, un método de sintetizar nanopartículas de metal que proporciona la capacidad de afinar las propiedades de estas nanopartículas para optimizar sus efectos antimicrobianos.
Resumen
La aparición de bacterias resistentes a múltiples fármacos es una preocupación clínica global que lleva a algunos a especular sobre nuestro regreso a una era "pre-antibióticos" de la medicina. Además de los esfuerzos para identificar nuevos fármacos antimicrobianos de moléculas pequeñas, ha existido un gran interés en el uso de nanopartículas de metal como revestimientos para dispositivos médicos, vendajes de heridas y envases de consumo, debido a sus propiedades antimicrobianas. La gran variedad de métodos disponibles para la síntesis de nanopartículas da como resultado un amplio espectro de propiedades químicas y físicas que pueden afectar la eficacia antibacteriana. Este manuscrito describe el método pulsátil de ablación con láser en líquidos (PLAL) para crear nanopartículas. Este enfoque permite el ajuste fino del tamaño, la composición y la estabilidad de las nanopartículas utilizando métodos de post-irradiación, así como la adición de tensioactivos o excludentes de volumen. Mediante el control del tamaño de partícula y la composición, una amplia gama de propiedades físicas y químicas de nanopa de metalSe pueden explorar los ritos que pueden contribuir a su eficacia antimicrobiana abriendo así nuevas vías para el desarrollo antibacteriano.
Introducción
Las nanopartículas (NPs) se definen generalmente como partículas que tienen al menos una dimensión que es menor de 100 nm de longitud. Los métodos químicos tradicionales de síntesis de NP típicamente requieren agentes reductores peligrosos, tales como borohidruros e hidracinas. Por el contrario, la ablación con láser de dianas metálicas sólidas sumergidas en un medio líquido (ablación por láser pulsado en líquidos - PLAL) proporciona una ruta respetuosa con el medio ambiente para la síntesis de NP que satisface los 12 Principios de Química Verde 1 , 2 . En PLAL, un objetivo metálico sumergido es irradiado por pulsos láser repetidos. A medida que el láser ablaza el objetivo, se libera un denso plumaje de racimos atómicos y vapor en el medio líquido en el que las NP se unen rápidamente. Los NP producidos por PLAL se dispersan finamente en un medio acuoso y el tamaño, la polidispersidad y la composición de los NPs pueden ser fácilmente controlados variando el líquido de ablación acuoso así como el par de láserAmperios 1 , 2 , 3 , 4 , 5 , 6 .
Las características de las nanopartículas se pueden ajustar ajustando una serie de parámetros del láser, incluyendo: fluencia, longitud de onda y duración del pulso (revisado en la referencia 7 ). La fluencia del láser se calcula como la energía del pulso dividida por el área del punto del laser en la superficie del objetivo. Los efectos precisos de la fluencia sobre el tamaño y la polidispersidad de los PN son algo controvertidos. En general, se ha demostrado que para los sistemas de láser pulsado 'largo' y 'ultra-corto' existen regímenes de fluencia baja y alta que producen tendencias negativas y positivas de tamaño, respectivamente 8 , 9 , 10 , 11 . Tamaño NP distributiOns se pueden medir empíricamente utilizando técnicas tales como la dispersión dinámica de la luz y la microscopía electrónica de transmisión (TEM), como se describe a continuación.
La elección de la longitud de onda del láser puede afectar a los mecanismos físicos por los que se forman los NPs. A menor longitud de onda (ultravioleta), los fotones de alta energía son capaces de romper enlaces interatómicos [ 12] . Este mecanismo de foto-ablación es un ejemplo de una síntesis de NP de arriba hacia abajo porque da como resultado la liberación de fragmentos ultra pequeños de material que tienden a producir muestras más polidispersas mayores al apagarse en el líquido de inmersión 12 , 13 , 14 . En contraste, la ablación del infrarrojo cercano (λ = 1.064 nm) produce un mecanismo de síntesis de abajo hacia arriba dominado por la ablación plasmática 12 . La absorción del láser por el blanco libera electrones que chocan con, y posteriormente liberan, los electrones unidos. Como cOllisions aumentan, el material se ioniza, encendiendo así un plasma. El líquido circundante confina el plasma, aumenta su estabilidad, y aumenta aún más la absorción 12 . A medida que el plasma en expansión se enfría por el líquido de confinamiento, los NPs se condensan con diversas geometrías 4 , 12 , 15 .
La elección de la duración del impulso láser puede afectar aún más el proceso de formación NP. Los láseres de pulsos largos de uso frecuente, con duraciones de pulso superiores a unos cuantos picosecondos, incluyen todos los láseres pulsados de mili, micro, nano y algunos picosecondos. En este régimen de anchura de impulso, la duración del impulso del láser es más larga que el tiempo de equilibrio electrón-phonon, que es típicamente del orden de unos cuantos picosegundos 4 , 16 , 17 , 18 , 19. Esto da lugar a la fuga de energía en el medio de ablación circundante ya la formación de NPs por mecanismos térmicos tales como emisión termiónica, vaporización, ebullición y fusión 1 , 20 .
La actividad antibacteriana de NPs está fuertemente influenciada por el tamaño de partícula 21 , 22 , 23 , 24 . Con el fin de mejorar la reducción de tamaño y la monodispersidad, los NPs pueden ser irradiados una segunda vez usando un láser de una longitud de onda cerca de la resonancia de plasmón superficial (SPR) de la NP. La radiación láser incidente es absorbida por el NP a través de la excitación del SPR. La fragmentación del NP puede ocurrir por evaporación térmica 25 , 26 o explosión de Coulomb 27 , 28 . La fotoexcitación planteaLa temperatura del NP por encima del punto de fusión, dando como resultado el desprendimiento de la capa externa de la partícula. Se ha demostrado que la adición de agentes como la polivinilpirrolidona (PVP) o el dodecilsulfato de sodio (SDS) a la solución puede mejorar en gran medida los efectos post-irradiación [ 5] . El impacto de la adición de varios solutos se ha descrito en varios informes 1 , 4 , 6 . La facilidad de manipulación de las características NP por PLAL proporciona un nuevo método para desarrollar nuevos antimicrobianos basados en NP.
Protocolo
1. Enfocar el láser de nanosegundos y medir la fluencia
- Ensamble el aparato de ablación colocando una barra de agitación magnética y una etapa de ablación porosa dentro de un vaso de precipitados de vidrio de 50 ml.
NOTA: La etapa de ablación consiste en una plataforma de acero inoxidable de 3,81 cm de diámetro y 1,6 mm de espesor con diez orificios de 0,65 cm de diámetro y seis orificios de 0,50 cm de diámetro taladrados en el patrón ilustrado en la Figura 1 . El propósito de estos orificios es permitir que el líquido se mueva a través del objetivo de manera que las partículas no se acumulen inmediatamente por encima del objetivo. Una mezcla insuficiente lleva a interacciones deletéreas entre el láser y las partículas ya formadas. Además, tres orificios roscados # 29 (8-32) están situados cerca del perímetro de la plataforma para aceptar tornillos de ajuste que sirven como patas para elevar la plataforma y proporcionar espacio para una barra de agitación magnética ( Figura 1A ).- Coloque el vaso de precipitados en unAgitar la placa y poner la placa agitadora en una etapa de translación xy para permitir el movimiento del objetivo durante la ablación ( Figura 1A ).
- Ajuste el láser Nd: YAG para que funcione a la longitud de onda fundamental de 1.064 nm, con una duración de impulso de 5 ns y una frecuencia de repetición de impulsos de 10 Hz. Medir la energía por impulso con una potencia láser y medidor de energía. La energía requerida es 240-250 mJ.
- Enfoque el haz debajo del objetivo en la etapa de ablación usando una lente convergente de longitud focal de 250 mm (NA = 0.05).
NOTA: El haz entrante tiene un radio de 4,025 mm y se requiere una altura de lente de 161 mm para alcanzar el tamaño de punto deseado. El tamaño óptimo del punto se determina empíricamente. Se utiliza un tamaño de mancha mayor para reducir el efecto de blindaje por los NP presentes en solución. Esto se equilibra con el hecho de que el aumento del tamaño del punto requiere una mayor energía para mantener la fluencia adecuada. - Determine el tamaño del punto colocando un objetivo metálico (ver sectioN 2) en la platina y ablación con varios pulsos láser. Ver el objetivo ablated junto con una diapositiva de micrómetro en un microscopio de luz CCD equipado con cámara (objetivo 4X) para medir el tamaño del punto ( Figura 1A ).
NOTA: Para el aparato aquí, el sistema de ablación produce un tamaño de mancha con un área media de 5,51 mm2. El tamaño del punto permanece en este intervalo para cada ablación. - Calcule la fluencia dividiendo la energía del pulso por el área del punto. Para el aparato aquí, la fluencia es de 4,80 J / cm2.
2. Síntesis de nanopartículas de plata por ablación con láser pulsado en líquido
- Pesar un objetivo plano de plata utilizando una microbalanza para obtener la masa pre-ablación.
- Adherir el objetivo de plata a la fase porosa con cinta adhesiva de doble cara. Añadir 40 ml de líquido de ablación al vaso ( Figura 1A ). La altura del líquido por encima del objetivo es de 11 mm.
NOTA: Ablación típica liqUides son soluciones acuosas que contienen SDS 60 mM o PVP 2 mM para aumentar la monodispersidad. - Bajo agitación constante, mueva la etapa xy motorizada controlada por ordenador en un patrón elíptico (dimensiones: eje mayor = 2,09 cm, eje menor = 0,956 cm, área = 1,57 cm2) a una velocidad de 0,42 cm / s y ablación de la diana Durante 20 - 40 min.
NOTA: La concentración de NPs aumenta con tiempos de ablación más largos. Asegúrese de que la agitación es suficientemente vigorosa para mantener la concentración de NP uniforme en toda la solución para minimizar los efectos de blindaje 7 .
3. Caracterización de las nanopartículas metálicas
- Recoger la solución de nanopartículas del vaso de precipitados por decantación. Confirme la presencia de nanopartículas midiendo sus espectros de luz UV-visible (200-1,100 nm).
NOTA: Los NPs tienen una absorción de pico a la longitud de onda de resonancia de plasmón superficial (SPR). Para la plata, el SPR está centrado a 400 nm. NP altamente concentradoLas soluciones requieren dilución antes de medir el espectro UV-VIS para asegurar que las lecturas de absorbancia permanezcan dentro del rango lineal del espectrofotómetro. - Medir el diámetro hidrodinámico de los NPs por dispersión de luz dinámica (DLS) utilizando un método de análisis de distribución numérica [ 29] .
- Diluir la solución de NP 1:40 en la solución de ablación y pipetear 1 mL en una cubeta de plástico de 1 cm. Utilizando un ángulo de medición de 180 ° , mida la dispersión de la luz a una longitud de onda de 633 nm para determinar el diámetro NP según la ecuación de Stokes-Einstein:
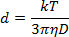
Donde d es el radio hidrodinámico, k es la constante de Boltzmann, T es la temperatura absoluta, η es la viscosidad, y D el coeficiente de difusión traslacional o la velocidad del movimiento browniano.
- Diluir la solución de NP 1:40 en la solución de ablación y pipetear 1 mL en una cubeta de plástico de 1 cm. Utilizando un ángulo de medición de 180 ° , mida la dispersión de la luz a una longitud de onda de 633 nm para determinar el diámetro NP según la ecuación de Stokes-Einstein:
- Confirmar el tamaño y la forma del NP usando el micro de transmisiónScopy (TEM) 30 .
NOTA: El diámetro hidrodinámico medido usando DLS es mayor que el tamaño medido usando TEM debido a la capa de disolvente que rodea a los NPs.- Diluir la solución de NP 1:40 en agua doblemente destilada para eliminar cualquier exceso de aditivos ( por ejemplo, SDS o PVP) que puedan interferir con la formación de imágenes. Dejar caer 2 μl de la solución sobre una rejilla metálica de cobre previamente recubierta con una película de carbono fino / fino (disponible comercialmente, véase la Lista de Materiales) y secar durante la noche a temperatura ambiente bajo vacío en un desecador.
- Imagen de los NP para evaluar el tamaño y la forma como se describe en la referencia 30 .
- Para calcular la concentración de NP, desalojar cualquier PN sueltamente unido de la meta de metal ablated (paso 2.3) colocando el objetivo en un baño de agua de sonicación que contiene agua destilada durante 1 minuto.
- Secar el blanco bajo una corriente de aire comprimido durante 1 minuto. Medir la masa de la taRget en una microbalanza. Cuantificar la masa de NPs en solución como la diferencia de peso antes y después de la ablación, que se supone que es el resultado de la eyección de nanopartículas de metal en la solución.
4. Post-irradiación
- Diluir los NP a una concentración máxima de 100 μg / mL en la misma solución de ablación que se utiliza en 2.2. Este límite de concentración es crítico para asegurar una irradiación uniforme.
- Transferir 15-17 mL de los NPs diluidos a una cubeta de cuarzo que contiene una barra de agitación ( Figura 1B ). Coloque la cubeta en una placa de agitación magnética alineada paralelamente con el láser entrante.
- Utilice un sistema de láser Nd: YAG para producir pulsos de láser de 25 ps 532 nm y una lente de distancia focal de 75 mm para enfocar el láser en el centro de la solución. Irradiar la solución durante 30 min a varias horas, dependiendo del tamaño deseado.
NOTA: La energía total suministrada depende de la concentración de la solución y tDe irradiación y puede oscilar entre 0,5 mJ y 3,5 mJ. Para el aparato aquí, 30 minutos después de la irradiación de una muestra transparente, de baja concentración (<50 μg / ml), se obtienen NP de plata con un diámetro de 10 nm.
5. Medición de las propiedades antibacterianas de las nanopartículas
NOTA: Se probó la toxicidad de los NPs de plata tanto en Gram- positivos ( Bacillus subtilis ) como en Gram- negativos ( Escherichia coli ) 31 . El método se adapta fácilmente a cualquier especie; Sin embargo, la dosis eficaz de nanopartículas puede variar considerablemente y debe determinarse empíricamente. Aquí, E. coli se utiliza como el sistema modelo para la descripción del método.
- Cultivar cultivos de E. coli (cepa MG1655) durante la noche a 37 ° C en Luria Broth (LB) que contiene 10 g / L de triptona Bacto, 5 g / l de extracto de levadura y 10 g / l de cloruro sódico. Diluir los cultivos durante la noche a una densidad óptica (λ = 600Nm) de 0,01 en LB fresco.
- Si se sintetizan los NPs en medios de ablación que contienen aditivos ( por ejemplo, SDS o PVP), a~nadir el producto quımico respectivo al LB de modo que la concentración permanezca constante al a~nadir los NPs.
NOTA: Por ejemplo, en un experimento típico se cierra un blanco de plata en una solución de SDS 60 mM para producir una solución de 100 mu g / ml de NPs. Si la concentración final de NP en el medio de cultivo es de 10 μg / mL, preparar LB que contenga SDS 6 mM ( es decir, 1/10 de la concentración de SDS en el líquido de ablación). No hay ningún efecto negativo sobre el crecimiento de las bacterias cuando se usan estas concentraciones. Esto se muestra en el control -AgNP en la Figura 3 . - Añadir los NPs a los cultivos diluidos en concentraciones que oscilan entre 0-50 μg / mL y cultivar los cultivos con agitación a 37 ° C durante 2 h adicionales. Como control positivo de toxicidad, tratar E. coli con un antibiótico ( por ejemplo, 30 μg / ml de kanamYcin).
- Después de la incubación de 2 h, diluir en serie las muestras de cultivo 1:10 en LB fresco y colocar 10 μL de gotas de cada dilución sobre placas de agar LB. Típicamente, las diluciones de 10 4 -10 8 veces son suficientes para ver colonias individuales.
- Una vez que las gotitas han sido absorbidas, incubar las placas durante la noche a 37 ° C y contar las unidades formadoras de colonias (cfu) a la mañana siguiente.
Resultados
Usando dianas de plata, se generan los parámetros láser descritos anteriormente y SDS 60 mM en el líquido de ablación, NPs de plata con la característica de absorbancia UV-VIS en el SPR ( Figura 2A ). Las mediciones TEM y DLS revelan un diámetro medio de NP de aproximadamente 25 nm antes de la irradiación posterior ( Figura 2B ). La ablación del blanco de plata durante 30 min produce típicamente una concentración de NP...
Discusión
Los efectos antimicrobianos reproducibles de los NPs requieren una producción consistente de NPs con tamaños y concentraciones similares. Por lo tanto, es crítico para estandarizar los parámetros del láser incluyendo fluencia, longitud de onda, y duración del pulso. Si bien la dispersión dinámica de la luz es un método fácil y rápido para estimar el tamaño NP, la cuantificación precisa de la distribución de tamaños requiere una medición directa por TEM. Como cada haz de láser tiene características dist...
Divulgaciones
Los autores no tienen nada que revelar.
Agradecimientos
Este trabajo fue apoyado por la Fundación Nacional de Ciencias (NSF adjudica CMMI-0922946 a DB, CMMI-1300920 a DB y S.O'M., Y CMMI-1531789 a S.O'M., DB y EAK) y un Busch Biomedical Research Grant para EAK y S.O'M.
Materiales
| Name | Company | Catalog Number | Comments |
| Nanosecond Nd:YAG laser | Ekspla | NL303 | |
| Motorized xy scanning stage | Standa | 8MTF | |
| UV-VIS spectrophotometer | Agilent | Cary 60 | |
| Dynamic light scattering unit | Malvern | Zetasizer ZS 90 | |
| Microbalance | Maktek | TM 400 | |
| Transmission electron microscope | Zeiss | EM 902 | |
| Silver foil target | Alfa Aesar | 12127 | |
| 250 mm focal length lens | Edmund Optics | 69-624 | |
| Copper TEM grids | Pacific Grid-Tech | Cu-400LD | Lacey/thin film coated grid |
| E. coli MG1655 | ATCC | 47076 | |
| Bacto-tryptone | BD Biosciences | 211705 | |
| Yeast extract | BD Biosciences | 212750 | |
| Sodium chloride | Fisher Scientific | BP3581 | |
| Bacto-agar | BD Biosciences | 214010 | |
| Sodium dodecyl sulfate | Fisher Scientific | BP166-100 | |
| Polyvinylpyrrolidone | Fisher Scientific | BP431-100 | |
| Stainless steel disc (for ablation stage) | Metal Remnants, Inc. | N/A | 1.5 inch diameter, 16 gauge |
| Beaker | Fisher Scientific | 02-540G | |
| Magnetic stir bar | Fisher Scientific | 14-513-57 | |
| Magnetic stir plate | Fisher Scientific | 11-100-49SH | |
| Laser energy and power meter | Coherent | 1098579 | |
| Carbon tape | Shinto Chemitron Co. Ltd. | STR Tape | |
| Sonicating water bath | Branson | 1510 | |
| Air compressor | GMC | Syclone 3010 | For drying ablation target |
| 75 mm focal length lens | Edmund Optics | 34-096 | Focusing lens for post-irradiation |
| Quartz cuvette | Precision Cells Inc | 21UV40 | 50 mm light path (for post-irradiation) |
| Kanamycin | Fisher Scientific | BP906-5 | |
| Light microscope | Nikon | 50i | This microscope is used to focus the laser on the ablation stage. This particular model is no longer available, but any light microscope with a 4X objective will work. |
| CCD camera | AmScope | MT5000-CCD | |
| Micrometer slide | Ted Pella | 2280-70 |
Referencias
- Amendola, V., Meneghetti, M. What controls the composition and the structure of nanomaterials generated by laser ablation in liquid solution?. Phys Chem Chem Phys. 15 (9), 3027-3046 (2013).
- Anastas, P., Eghbali, N. Green chemistry: principles and practice. Chem Soc Rev. 39 (1), 301-312 (2010).
- Mafune, F., Kohno, J. Y., Takeda, Y., Kondow, T., Sawabe, H. Formation of Gold Nanoparticles by Laser Ablation in Aqueous Solution of Surfactant. J Phys Chem B. 105 (22), 5114-5120 (2001).
- Rao, S. V., Podagatlapalli, G. K., Hamad, S. Ultrafast laser ablation in liquids for nanomaterials and applications. J Nanosci Nanotechnol. 14 (2), 1364-1388 (2014).
- Tsuji, T., et al. Preparation of silver nanoparticles by laser ablation in polyvinylpyrrolidone solutions. Appl Surf Sci. 254 (16), 5224-5230 (2008).
- Zeng, H., et al. Nanomaterials via laser ablation/irradiation in liquid: a review. Adv Funct Mater. 22 (7), 1333-1353 (2012).
- Naddeo, J. J., et al. Antibacterial Properties of Nanoparticles: A Comparative Review of Chemically Synthesized and Laser-Generated Particles. Adv. Sci. Eng. Med. 7 (12), 1044-1057 (2015).
- Elsayed, K. A., Imam, H., Ahmed, M. A., Ramadan, R. Effect of focusing conditions and laser parameters on the fabrication of gold nanoparticles via laser ablation in liquid. Opt. & Laser Tech. 45, 495-502 (2013).
- Kabashin, A. V., Meunier, M. Synthesis of colloidal nanoparticles during femtosecond laser ablation of gold in water. J Appl Phys. 94 (12), 7941-7943 (2003).
- Nichols, W. T., Sasaki, T., Koshizaki, N. Laser ablation of a platinum target in water I. Ablation mechanisms. J Appl Phys. 100 (11), 114911 (2006).
- Povarnitsyn, M. E., Itina, T. E., Levashov, P. R., Khishchenko, K. V. Mechanisms of nanoparticle formation by ultra-short laser ablation of metals in liquid environment. Phys Chem Chem Phys. 15 (9), 3108-3114 (2013).
- Mortazavi, S. Z., Parvin, P., Reyhani, A., Golikand, A. N., Mirershadi, S. Effect of Laser Wavelength at IR (1064 nm) and UV (193 nm) on the Structural Formation of Palladium Nanoparticles in Deionized Water. J Phys Chem C. 115 (12), 5049-5057 (2011).
- Kim, J., Reddy, D. A., Ma, R., Kim, T. K. The influence of laser wavelength and fluence on palladium nanoparticles produced by pulsed laser ablation in deionized water. Solid State Sci. 37, 96-102 (2014).
- Mortazavi, S. Z., Parvin, P., Reyhani, A., Mirershadi, S., Sadighi-Bonabi, R. Generation of various carbon nanostructures in water using IR/UV laser ablation. J Phys D: Appl Phys. 46 (16), 165303 (2013).
- Hunter, B. M., et al. Highly active mixed-metal nanosheet water oxidation catalysts made by pulsed-laser ablation in liquids. J Am Chem Soc. 136 (38), 13118-13121 (2014).
- Momma, C., et al. Short-pulse laser ablation of solid targets. Opt Commun. 129 (1), 134-142 (1996).
- Sonntag, S., Roth, J., Gaehler, F., Trebin, H. R. Femtosecond laser ablation of aluminium. Appl Surf Sci. 255 (24), 9742-9744 (2009).
- Yamashita, Y., Yokomine, T., Ebara, S., Shimizu, A. Heat transport analysis for femtosecond laser ablation with molecular dynamics-two temperature model method. Fusion Eng Des. 81 (8), 1695-1700 (2006).
- Zhigilei, L. V., Lin, Z., Ivanov, D. S. Atomistic modeling of short pulse laser ablation of metals: connections between melting, spallation, and phase explosion. J Phys Chem C. 113 (27), 11892-11906 (2009).
- Schmidt, M., et al. Lasers in Manufacturing 2011 - Proceedings of the Sixth International WLT Conference on Lasers in Manufacturing Metal Ablation with Short and Ultrashort Laser Pulses. Physics Procedia. 12, 230-238 (2011).
- Azam, A., Ahmed, A. S., Oves, M., Khan, M. S., Memic, A. Size-dependent antimicrobial properties of CuO nanoparticles against Gram-positive and-negative bacterial strains. Int. J. Nanomed. 7, 3527-3535 (2012).
- Ivask, A., et al. Size-dependent toxicity of silver nanoparticles to bacteria, yeast, algae, crustaceans and mammalian cells in vitro. PLoS One. 9 (7), e102108 (2014).
- Kim, T. H., et al. Size-dependent cellular toxicity of silver nanoparticles. J Biomed Mater Res A. 100 (4), 1033-1043 (2012).
- Raghupathi, K. R., Koodali, R. T., Manna, A. C. Size-dependent bacterial growth inhibition and mechanism of antibacterial activity of zinc oxide nanoparticles. Langmuir. 27 (7), 4020-4028 (2011).
- Plech, A., Kotaidis, V., Gresillon, S., Dahmen, C., von Plessen, G. Laser-induced heating and melting of gold nanoparticles studied by time-resolved x-ray scattering. Phys Rev B. 70 (19), 195423 (2004).
- Takami, A., Kurita, H., Koda, S. Laser-Induced Size Reduction of Noble Metal Particles. J Phys Chem B. 103 (8), 1226-1232 (1999).
- Kamat, P. V., Flumiani, M., Hartland, G. V. Picosecond Dynamics of Silver Nanoclusters. Photoejection of Electrons and Fragmentation. J Phys Chem B. 102 (17), 3123-3128 (1998).
- Yamada, K., Tokumoto, Y., Nagata, T., Mafune, F. Mechanism of laser-induced size-reduction of gold nanoparticles as studied by nanosecond transient absorption spectroscopy. J Phys Chem B. 110 (24), 11751-11756 (2006).
- Pecora, R. Dynamic Light Scattering Measurement of Nanometer Particles in Liquids. J. Nanoparticle Res. 2 (2), 123-131 (2000).
- Pyrz, W. D., Buttrey, D. J. Particle size determination using TEM: a discussion of image acquisition and analysis for the novice microscopist. Langmuir. 24 (20), 11350-11360 (2008).
- Ratti, M., et al. Irradiation with visible light enhances the antibacterial toxicity of silver nanoparticles produced by laser ablation. Appl Phys A. 122 (4), 1-7 (2016).
- Sajti, C. L., Sattari, R., Chichkov, B. N., Barcikowski, S. Gram Scale Synthesis of Pure Ceramic Nanoparticles by Laser Ablation in Liquid. J Phys Chem C. 114 (6), 2421-2427 (2010).
- Streubel, R., Barcikowski, S., Gokce, B. Continuous multigram nanoparticle synthesis by high-power, high-repetition-rate ultrafast laser ablation in liquids. Opt Lett. 41 (7), 1486-1489 (2016).
- Streubel, R., Bendt, G., Gokce, B. Pilot-scale synthesis of metal nanoparticles by high-speed pulsed laser ablation in liquids. Nanotechnology. 27 (20), 205602 (2016).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados