需要订阅 JoVE 才能查看此. 登录或开始免费试用。
Method Article
生物素化细胞表面蛋白的纯化
摘要
一种基于梯度改性密度离心方法被利用来上皮细胞从扇头蜱microplus肠组织隔离。生物素化表面结合蛋白,并通过链霉抗生物素蛋白磁珠纯化,用于下游应用。
摘要
Rhipicephalus microplus - 牛蜱 - 是对家畜作为几种病原体的载体的经济影响方面最重要的外寄生物。致力于牛蜱控制以减少其有害影响,重点是发现位于蜱肠上皮细胞表面的疫苗候选物质,例如BM86。目前的研究重点是利用cDNA和基因组文库筛选其他候选疫苗。蜱肠细胞的分离是调查蜱肠细胞膜上表面蛋白质组成的重要优势。本文构建了一种用于分离上皮细胞的新颖可行的方法,从半加入的微量元素的蜱肠内含量。该方案利用TCEP和EDTA从上皮支持组织和不连续密度离心分离器中释放上皮细胞以将上皮细胞与其他细胞类型分开。细胞表面蛋白质生物素化并从蜱肠上皮细胞中分离,使用链霉抗生物素蛋白连接的磁珠,允许在FACS或LC-MS / MS分析中的下游应用。
引言
扇头蜱microplus,牛蜱,是在对养牛业热带和亚热带地区,因为它矢量牛蜱传热(巴贝虫病),微粒孢子虫病和马焦虫病1,2,3,4经济影响方面最显著外寄生物。努力致力于牛蜱控制,减少有害影响,然而常规方法如使用化学杀螨剂具有隐含的缺点,例如在牛奶和肉中存在化学残留物,以及化学抗性蜱的流行率增加5,6,7。因此,研究了替代蜱控制方法的开发,例如使用天然抗性牛,生物防治(生物杀虫剂)和疫苗分级表4,5,6,7,8,9。
在追求能够被用作候选疫苗的蛋白质时,目前的研究集中在滴滴肠上。中肠壁由沉积在薄基底层上的单层上皮细胞构成,基底层的外侧形成肌肉网络。光和电子显微镜观察表明,中肠由三种类型的细胞组成:储备(未分化),分泌和消化。细胞类型的数量根据生理期有很大差异。分泌和消化细胞都从储备细胞18,19,20发起。
cDNA文库的构建检查蜱肠道的组合物导致了抗原性蛋白质,如Bm86进行的鉴定,作为可能的候选疫苗2,3,4。糖蛋白Bm86位于蜱肠细胞的表面,并在接种疫苗的牛中诱导针对牛蜱( R. microplus )的保护性免疫应答。被免疫的宿主产生的抗Bm86IgG被蜱摄入,在蜱肠细胞的表面上识别该抗原,随后扰乱了肠道组织的功能和完整性。基于Bm86抗原的疫苗通过减少雌性哺乳动物的数量,重量和繁殖能力,显示了R. microplus和Rhipicephalus annulatus的有效控制,从而导致后续蜱代4发生减少的幼虫侵袭。然而,基于Bm86的疫苗对于所有的蜱细胞阶段都没有效果表现出对R. microplus的一些地理株不能令人满意的功效,因此在肉牛和奶牛行业都很差采用这些疫苗2,4。
从蜱肠分离上皮细胞的能力是一个重要的创新,这将使研究的进展能够确定不同环境条件下的蛋白质膜组成,包括形态学和生理学。本文所述的方法利用螯合剂乙二胺四乙酸(EDTA)和还原剂三(2-羧乙基)膦(TCEP)从其上皮支持组织10释放上皮。通过振荡机械破坏组织,然后在Percoll中进行不连续梯度离心,回收上皮细胞。本文介绍了一种可行和新颖的用于分离蜱肠道外切的技术血细胞。随后在下游应用如FACS和/或LC-MS / MS分析中分析从这些上皮细胞表面分离的生物素化的细胞表面蛋白质。
Access restricted. Please log in or start a trial to view this content.
研究方案
1.从R. microplus肠上皮的解剖
- 在实验当天从牛收集半加成蜱。从主机取出后24小时内解剖。
- 在92 mm x 16 mm培养皿的底部附上一条胶带。在胶带上加一滴超级胶水。将蜱,腹侧放在超级胶上,让其干燥2分钟。
- 将100 mL磷酸盐缓冲盐水(PBS)倒入培养皿中,或直到蜱被完全浸没。
- 使用大小11的手术刀,从眼睛的顶部切割到底部的festoons,在刻度的两边。
- 使用无菌镊子,彻底清除盾板和alloscutum,并暴露出内部器官。
- 去除细白色线状器官(气管)和其他膜,以防止污染。
- 使用镊子去除肠道,通过捏住上部区域并从中拉出尸体。去除任何剩余的肠道组织,确保没有其他组织被解剖。
- 在没有氯化钙和硫酸镁和蛋白酶抑制剂混合物(PIC)的情况下将肠子储存在冰冷的汉克平衡盐溶液(HBSS)中。将干冰中的胆固醇冻结并储存在-20°C。
注意:为了帮助肠道解剖和蜱内脏的详情,请参阅D·索尼希恩,19"蜱的生物学"第3.1章。
上皮细胞分离
- 将解剖的肠倒入50mL管内的70μm细胞过滤器上。
- 用PIC用50 mL冰冷的HBSS冲洗肠道组织,直到溶液清澈透明,胆汁呈现白色/透明的外观。
- 用PIC重新悬挂30 mL冰冷HBSS中的胆固醇,轻轻混匀,并在4℃下以500 xg离心10分钟,以使肠内沉淀。取出上清液,重复洗涤3次。
- 通过250μm的细胞过滤器过滤悬浮液,涡流流过并通过70μm的细胞过滤器过滤,收集剩余的流通。
- 将悬浮液在4℃下以500xg离心20分钟以沉淀单个细胞。
3.使用密度离心梯度分离单个上皮细胞
- 通过AP15预滤纸过滤,制备密度离心梯度( 例如 Percoll)。在mqH 2 0(v / v)中制备40%和20%Percoll并在4℃下冷却1小时,然后分层梯度。
- 使用蠕动泵以最低速度设定,将3mL 40%密度离心梯度分离成16mL超速离心管,使其在冰上沉降15分钟。泵的速度应导致每分钟流量<1 mL。
- 将管倾斜成45°角,使用蠕动泵将40%层上的20%密度离心梯度层压。泵的速度应导致每分钟流量<1 mL。允许层在冰上沉降15分钟。
- 在20-40%密度离心梯度下,使用蠕动泵以<1 mL / min流速将3 mL含有蜱肠细胞的DMEM培养基。
- 对离心机进行编程,以实现最大加速和最小减速度以600 xg离心10分钟。收集DMEM之间的间期:20%密度离心梯度和20%:40%密度离心梯度以分离上皮细胞。在4°C储存收集的间期进行后续分析。
4.细胞分离评估
- 血球
- 用酒精清洁血球计数器滑块。
- 通过轻轻地上下移动细胞来重悬细胞。移取100μL细胞悬液,置于1.5 mL微量离心管中。
- 加入400μL0.4%台盼蓝。轻轻的轻轻混合管子。
- 移取100μL台盼蓝处理的细胞悬浮液,以缓慢填充血细胞计数器的两个腔室。
- 将血细胞计数器置于光学显微镜下,用10X物镜聚焦于血细胞计数器的网格线上。
- 使用手持计数器,计数一组16个正方形内的活体未染色细胞。在同一个广场内,计数蓝色死亡细胞。继续计数,直到计数了四组16个正方形。
- 使用以下公式计算每毫升的总细胞数:
47eq1.jpg"/> - 使用以下公式计算细胞存活率:
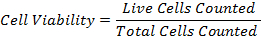
- 细胞分离可视化
- 在1.5 mL微量离心管中稀释9μLHBSS中的1μL分离细胞。轻轻地将微量离心管轻轻混匀。
- 将5μLHBSS中的分离细胞移至玻片的中间。用4',6-二脒基-2-苯基吲哚(DAPI)涂三滴安装介质。
- 在室温下孵育载玻片5分钟。小心地将盖子放在准备物上,避免气泡。
- 在荧光显微镜下观察360nm激发下用DAPI染色的细胞并在460nm发射。
细胞表面蛋白生物素化
- 生物素生物素使用生物素(A型)缀合物100μL单细胞上皮细胞试剂盒,按照制造商的说明书,以1:1的表面蛋白与缀合物的摩尔比
- 对于细胞裂解,向生物素化细胞中加入100μLPBS,1%Triton X-100,10%甘油,100μM氧化型谷胱甘肽和PIC。在冰上孵育1小时,每10分钟轻轻混匀。
- 将生物素化细胞在4℃下以20,000×g离心20分钟以沉淀不溶物质。收集含有细胞质和生物素化膜蛋白的上清液。
- 使用Bradford测定法确定蛋白质浓度。
6.生物素化表面蛋白的分离
- 将50μL的链霉亲和素磁珠加入1.5 mL微量离心管中。
- 将管放置在磁性支架中,将珠子收集在管的侧面。取出并弃去上清液。
- 向管中加入1000μLTBS,0.1%Tween-20。轻轻混合,用磁力柱收集珠子天。取出并弃去上清液。
- 将40μg生物素化的细胞表面蛋白结合,用洗涤的磁珠稀释至1×PBS中的300μL。在室温下搅拌孵育2小时。
- 用磁力支架收集珠子,取出并弃去上清液。
- 加入300μLTBS,0.1%Tween-20到管中,轻轻搅拌,重新悬浮珠。收集珠子,取出并弃去上清液。重复此洗涤步骤两次。
- 加入100μL0.1M甘氨酸pH2.0给磁珠,并在室温下孵育5分钟。收集珠子并除去含有洗脱的生物素化表面蛋白质的上清液。
- 在4-20%Tris-MOPS SDS-PAGE凝胶上观察分离的表面蛋白质。
7.生物素化表面蛋白的评估
- 点斑
- 切成7厘米×3厘米的硝酸纤维素膜条。
- 应用10μg总滴答t含量(从1.8以上)和10微克生物素化表面蛋白到膜。在室温下干燥15分钟。
- 转移到容器中并浸没在100mL的封闭缓冲液中。在室温下孵育一小时。丢弃阻塞缓冲区。
- 在100μLPBS,0.05%Tween-20中将硝酸纤维素膜洗涤5分钟,同时搅拌。丢弃洗涤缓冲液并重复洗涤三次。
- 在100μLPBS,0.05%Tween-20中的1/5000链霉亲和素 - 辣根过氧化物酶(HRP)中孵育2小时,并在室温下搅拌,并丢弃任何剩余的溶液。
- 在100μLPBS,0.05%Tween-20中搅拌洗涤硝酸纤维素膜5分钟。丢弃洗涤缓冲液并重复洗涤三次。
- 为了检测,将1片4-氯-1-萘酚溶于10mL冰冷的甲醇中。加入4 mL甲醇原液至20 mL TBS。加入10μL新鲜的30%过氧化氢和immedia适用于硝酸纤维素膜。
- 在室温下搅拌孵育直到底物产生不溶性蓝色终产物。这可能需要2-15分钟。
- 丢弃检测溶液,并在100μLmqH 2 O中洗涤三次。
- ELISA测定
- 用400μL100mM碳酸盐涂层缓冲液和ELISA板的第一排(A#)涂层2泳道(平底孔)稀释每个样品200ng,
- 将100μL100mM碳酸盐涂层缓冲液加入到行(BH)中的所有其它相应的孔中。
- 通过从A排中的每个孔中移取100μL,并将其转移到B列,准备每个样品的连续稀释液。通过移液轻轻混合,避免产生气泡。每行重复稀释,弃去最后100μL,从排H中的每个孔。
- 用石蜡膜覆盖板,并在4℃下孵育过夜。
- 洗平台e,200μLPBS,0.05%Tween-20 /孔三次。
- 向涂覆的孔中加入200μL封闭缓冲液,用Parafilm覆盖,并在4℃下孵育过夜。
- 在封闭缓冲液中稀释1 / 15,000链霉亲和素-HRP,并向板的每个孔中加入100μL。用石蜡膜覆盖,并在4℃下孵育过夜。
- 在200μLPBS,0.05%Tween-20 /孔中洗涤板5次。
- 要检测,每孔加入100μLTMB试剂。经过充分的显色,通常在10-15分钟之间,加入100μL的1M磷酸停止反应。
- 读取λ= 450nm处各孔的吸光度。
Access restricted. Please log in or start a trial to view this content.
结果
根据图1所示的原理图,从R. microplus的肠组织中分离上皮细胞。 使用该方案制备的蜱肠上皮细胞的代表性荧光显微镜图像显示在图2A中 和2B。 由于细胞分离是在半富集的R. microplus上进行的,细胞在整个样品中表现为单数,球形,光滑的表面...
Access restricted. Please log in or start a trial to view this content.
讨论
牛蜱侵染构成了养牛业在世界的热带和亚热带地区的一个主要问题,与控制时使用杀螨剂1,4依赖的最常用的方法。 Bm86进行先前蜱肠上皮表面作为对抗R. microplus侵染10保护性抗原,以有限的成功作为疫苗策略内识别由于Bm86进行地理序列变异和定期升压4的要求。
以前的出版物聚焦在上皮隔?...
Access restricted. Please log in or start a trial to view this content.
披露声明
作者没有什么可以披露的。
致谢
作者希望感谢澳大利亚昆士兰州农业和渔业部门提供用于本研究的Rhipicephalus microplus蜱,以及Lucas Karbanowicz协助视频拍摄。
Access restricted. Please log in or start a trial to view this content.
材料
| Name | Company | Catalog Number | Comments |
| 0.4% Trypan Blue | ThermoFisher Scientific | 15250061 | |
| 1.5 mL microcentrifuge tube | Eppendorf | 3322 | |
| 100mM Carbonate Buffer | 3.03 g Na2CO3, 6.0 g NaHCO3 1000 ml distilled water pH 9.6 | ||
| 16 mL centrifuge tubes with sealing cap | Thermo Scientific | 3138-0016 | Cool in ice prior to gradient |
| 250 µM cell strainer | Thermo Fisher | 87791 | |
| 3,3′,5,5′-Tetramethylbenzidine (TMB) Liquid Substrate System for ELISA | Sigma | T0440 | Stored at 4C |
| 30% Hydrogen Peroxide | Labscene | BSPA5.500 | |
| 4-20% Tris-MOPS Gel | Gen Script | M42015 | |
| 4-Chloro-1-naphthol tablet | Sigma-Aldrich | C6788 | |
| 50 mL Falcon Tube | Corning Blue | 30 x 115mm style. Polyproplyene conical tube. | |
| 70 µM cell strainer | BD Falcon | 352350 | |
| AP15 filter paper | Millipore | AO1504200 | |
| Biotin (Type A) Conjugation Kit | Abcam | Ab102865 | |
| Dissection microscope | Olympus | SZX7 | |
| DP Manager | Olympus | 2.2.1.195 | Cell imagery software |
| Duct Tape | Home Handyman | 48mm x 25mm Duct Tape | |
| Dulbecco’s Modified Eagle Medium | Gibco | 11995-065 | DMEM - ice cold for protocol |
| EDTA | Amresco | 0105-500G | |
| F96 Maxisorp Immuno Plate | Nunc | 439454 | |
| Fetal Bovine Serum | Sigma-Aldrich | 12003C | FCS |
| Fluorescence microscope | Olympus | BX51 | |
| Fluoroshield with DAPI | Sigma-Aldrich | F6057-20ML | DAPI |
| Forceps | Dumont | #9 Dumont - Switerzland | |
| Glycerol | Sigma-Aldrich | G5516 | Glycerol for molecular biology >99% |
| Glycine | Sigma-Aldrich | 410225 | |
| Hand-Held Counter | Officeworks | JA0376230 | |
| Hank’s Balanced Salt Solution | Sigma Life Sciences | H9394 | HBSS – ice cold for protocol |
| Hemacytometer | Optik Lakor | - | - |
| L-Glutathione oxidized | Sigma-Aldrich | G4376 | |
| Magnetic Separation Stand | Novagen | - | 4-Tube Magnetic Separation Rack |
| Methanol | Sigma-Aldrich | 179337 | |
| Milli-Q Water | Millipore | ZRXQ003WW | Integral Water Purification System for Ultrapure Water |
| Nitrocellulose Membrane | Life Sciences | 66485 | 30cm x 3M pure nitrocellulose membrane |
| PageRuler Prestained protein Ladder | Thermo-Fisher | SM0671 | |
| PBS | 1.16 g Na2HPO4, 0.1 g KCl, 0.1 g K3PO4, 4.0 g NaCl (500 ml distilled water) pH 7.4 | ||
| Percoll | Sigma-Aldrich | P1644-500ML | |
| Peristaltic Pump | Masterflex | 7518-10 | |
| Phosphoric Acid | Sigma-Aldrich | P6560 | |
| Pierce Protein-Free T20 PBS Blocking Buffer | Thermo-Scientific | 37573 | Stored at 4C. Blocking Buffer |
| Protease Inhibitor Cocktail | Sigma-Aldrich | P8215-5ML | PIC – stored at -20 °C |
| Quick Start Bradford Dye Reagent 1x | Biorad | 500-0205 | For Bradford Assay |
| Quick Start BSA Standards | Biorad | 500-0207 | BSA standards for Bradford Assay |
| Scalpel | Lab. Co | Size 11 Scalpel | |
| SilverQuest TM Staining Kit | Invitrogen | LC6070 | |
| Simply Blue TM Safe Stain | Invitrogen | LC6060 | |
| Sorvall C6+ Ultracentrifuge | Thermo Scientific | 46910 | |
| Streptavidin (HRP) | Abcam | AB7403 | |
| Streptavidin Magnetic Beads | New England Biolabs | S1420S | |
| Super Glue - Ultra Fast Mini | UHU | UHU Super Glue 1mg. Ultra Fast mini | |
| Table-top Centrifuge | Eppendorf | 22331 | |
| TCEP | Thermo Fisher | 20490 | |
| Triton X-100 | Biorad | 161-0407 | |
| Tween-20 | Sigma | P2287-500ML | |
| Vortex Mixer | Ratek | VM1 | |
| Water Bath | Grant | GD100 |
参考文献
- Rodriguez-Valle, M., et al. Efficacy of Rhipicephalus (Boophilus) microplus Bm86 against Hyalomma dromedarii and Amblyomma cajennense tick infestations in camels and cattle. Vaccine. 30, 3453-3458 (2012).
- De Rose, R., et al. Bm86 antigen induces a protective immune-response against Boophilus microplus following DNA and protein vaccination in sheep. Vet. Immunol. Immunopathol. 71, 151-160 (1999).
- García-García, J. C., et al. Sequence variations in the Boophilus microplus Bm86 locus and implications for immunoprotection in cattle vaccinated with this antigen. Exp. Appl. Acarol. 23, 883-895 (1999).
- Abbas, R. Z., Zaman, M. A., Colwell, D. D., Gilleard, J., Iqbal, Z. Acaricide resistance in cattle ticks and approaches to its management: The state of play. Vet. Parasitol. 203, 6-20 (2014).
- Kearney, S. Acaricide (chemical) resistance in cattle ticks. , AgNote No. K58. (2013).
- Foil, L. D., et al. Factors that influence the prevalence of acaricide resistance and tick-borne diseases. Vet. Parasitol. 125, 163-181 (2004).
- Rodriguez, M., et al. High level expression of the B. microplus Bm86 antigen in the yeast Pichia pastoris forming highly immunogenic particles for cattle. J Biotechnol. 33, 135-146 (1994).
- Rodriguez, M., et al. Effect of vaccination with a recombinant Bm86 antigen preparation on natural infestations of Boophilus microplus in grazing dairy and beef pure and cross-bred cattle in Brazil. Vaccine. 13 (18), 1804-1808 (1995).
- Lew-Tabor, A. E., Rodriguez Valle, M. A review of reverse vaccinology approaches for the development of vaccines against ticks and tick borne diseases. Ticks Tick Borne Dis. 7, 573-585 (2016).
- Capella, A. N., Terra, W. R., Ribeiro, A. F., Ferreira, C. Cytoskeleton removal and characterization of the microvillar membranes isolated from two midgut regions of Spodoptera frugiperda (Lepidoptera). Insect Biochem. Mol. Biol. 27, 793-801 (1997).
- Cioffi, M., Wolfersberger, M. G. Isolation of separate apical, lateral and basal plasma membrane from cells of an insect epithelium. A procedure based on tissue organization and ultrastructure. Tissue Cell. 15, 781-803 (1983).
- Koefoed, B. M. A simple mechanical method to isolate the basal lamina of insect midgut epithelial cells. Tissue Cell. 17, 763-768 (1985).
- Roche, J. K. Isolation of a purified epithelial cell population from human colon. Methods Mol. Med. 50, 15-20 (2001).
- Terra, W. R., Costa, R. H., Ferreira, C. Plasma membranes from insect midgut cells. An. Acad. Bras. Ciênc. 78, 255-269 (2006).
- Vargas, A. E., Markoski, M. M., Cañedo, A. D., Helena, F., Nardi, N. B. Identification, isolation and culture of intestinal epithelial stem cells from murine intestine. Stem Cells. 879, 479-490 (2012).
- Autengruber, A., Gereke, M., Hansen, G., Hennig, C., Bruder, D. Impact of enzymatic tissue disintegration on the level of surface molecule expression and immune cell function. Eur. J. Microbiol. Immunol. 2, 112-120 (2012).
- Karhemo, P. R., et al. An optimized isolation of biotinylated cell surface proteins reveals novel players in cancer metastasis. J. Proteomics. 77, 87-100 (2012).
- Obenchain, F. R., Galun, R. Physiology of Ticks. Current Themes in Tropical Science Volume 1. , Pergamon Press. 201-205 (1982).
- Sonenshine, D., Roe, R. Chapter 3.1. "Biology of Ticks". 1, Two, Oxford University Press. (2014).
- Raikhel, A. S., Balashov, Y. S. "An Atlas of Ixodid Tick Ultrastructure" (English Translation). , Entomology Society of America Entomological Society of America. (1983).
Access restricted. Please log in or start a trial to view this content.
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。