Un abonnement à JoVE est nécessaire pour voir ce contenu. Connectez-vous ou commencez votre essai gratuit.
Method Article
Purification des protéines de surface cellulaire biotinylées de
Dans cet article
Résumé
Une méthodologie à base de gradient de centrifugation modifiée a été utilisée pour isoler les cellules épithéliales du tissu intestinal de Rhipicephalus microplus . Les protéines liées à la surface ont été biotinylées et purifiées par des billes magnétiques de streptavidine pour une utilisation dans les applications en aval.
Résumé
Rhipicephalus microplus - la tache du bétail - est l'ectoparasite le plus important en termes d'impact économique sur le bétail en tant que vecteur de plusieurs agents pathogènes. Des efforts ont été dédiés au contrôle des tiques du bétail pour diminuer ses effets néfastes, en mettant l'accent sur la découverte de candidats vaccinés, tels que le BM86, situé à la surface des cellules épithéliales intestinales. La recherche actuelle se concentre sur l'utilisation de l'ADNc et les bibliothèques génomiques, afin d'examiner d'autres vaccins candidats. L'isolement des cellules intestinales de tiques constitue un avantage important dans l'étude de la composition des protéines de surface sur la membrane des cellules intestinales de la tique. Cet article constitue une méthode nouvelle et réalisable pour l'isolement des cellules épithéliales, à partir des tumeurs de la tumeur du R. microplus semi-engorgé . Ce protocole utilise le TCEP et l'EDTA pour libérer les cellules épithéliales des tissus de support sous-épithélial et une gradient de centrifugation de densité discontinueNt pour séparer les cellules épithéliales d'autres types de cellules. Les protéines de surface cellulaire ont été biotinylées et isolées à partir des cellules épithéliales intestinales, en utilisant des billes magnétiques liées à la streptavidine permettant des applications en aval dans FACS ou une analyse LC-MS / MS.
Introduction
Rhipicephalus microplus , la tache du bétail, est l'ectoparasite le plus important en termes d'impact économique sur l'industrie bovine des régions tropicales et sous-tropicales, car il vecteur de fièvre tectine bovine (babésiose), d'anaplasmose et de piroplasmose équine 1 , 2 , 3 , 4 . Les efforts ont été dédiés au contrôle des tiques du bétail, afin de diminuer l'effet néfaste, mais les méthodes conventionnelles telles que l'utilisation d'acaricides chimiques présentent des inconvénients implicites, comme la présence de résidus chimiques dans le lait et la viande, et l'augmentation de la prévalence des tiques résistant chimiquement 5 , 6 , 7 . Par conséquent, on a étudié le développement de méthodes alternatives de contrôle des tiques, telles que l'utilisation de bétail à résistance naturelle, le contrôle biologique (biopesticides) et le vaccinInes 4 , 5 , 6 , 7 , 8 , 9 .
Dans la recherche de protéines capables d'être utilisées comme vaccins candidats, la recherche actuelle est axée sur l'intestin de tique. La paroi du midgut est construite à partir d'une seule couche de cellules épithéliales reposant sur une fine lame basale, l'extérieur de la lame basale formant un réseau de muscles. Les observations de lumière et de microscope électronique indiquent que le intestin moyen se compose de trois types de cellules: réserve (indifférenciée), sécrétoire et digestive. Le nombre de types de cellules varie considérablement en fonction de la phase physiologique. Les cellules sécrétoires et digestives proviennent toutes deux des cellules de réserve 18 , 19 , 20 .
La construction de bibliothèques d'ADNcExaminer la composition de l'intestin de tache a conduit à l'identification de protéines antigéniques, telles que Bm86, en tant que vaccin potentiels candidats 2 , 3 , 4 . La glycoprotéine Bm86 est localisée à la surface des cellules intestinales de la tique et induit une réponse immunitaire protectrice contre la tumeur du bétail ( R. microplus ) chez les bovins vaccinés. Les IgG anti-Bm86 produites par l'hôte immunisé sont ingérées par la tique, reconnaissent cet antigène à la surface des cellules intestinales de tiques et perturbent ensuite la fonction et l'intégrité des tissus intestinaux. Les vaccins basés sur les antigènes Bm86 ont montré un contrôle efficace de R. microplus et de Rhipicephalus annulatus, en réduisant le nombre, le poids et la capacité de reproduction des femelles engorgantes, entraînant une infestation larvaire réduite dans les générations de tiques subséquentes 4 . Cependant, les vaccins basés sur Bm86 ne sont pas efficaces contre toutes les étapes de la tique et ontA démontré une efficacité insatisfaisante contre certaines souches géographiques de R. microplus , par conséquent, les industries du bœuf et des produits laitiers ont mal adopté ces vaccins 2 , 4 .
La capacité d'isoler les cellules épithéliales de l'intestin grêle est une innovation importante qui permettrait à la progression de la recherche de déterminer la composition de la membrane protéique, y compris la morphologie et la physiologie dans différentes conditions environnementales. La méthode décrite ici utilise l'agent de chélation de l'acide éthylènediaminetétracétique (EDTA) et l'agent réducteur tris (2-carboxyéthyl) phosphine (TCEP) pour libérer l'épithélium à partir de ses tissus de support sous-épithélial 10 . L'épithélium est récupéré suite à une rupture mécanique des tissus par tremblement, puis centrifugation en gradient discontinu à Percoll. Cet article décrit une technique réalisable et novatrice pour l'isolement de l'épiCellules cellulaires. Les protéines de surface cellulaire biotinylées, isolées de la surface de ces cellules épithéliales, peuvent ensuite être analysées dans des applications en aval telles que l'analyse FACS et / ou LC-MS / MS.
Access restricted. Please log in or start a trial to view this content.
Protocole
1. Dissection de l'épithélium intestinal de R. microplus
- Recueillir des tiques semi-engorgées de bovins le jour de l'expérience. Dissectez les tiques dans les 24 h après le retrait de l'hôte.
- Adhérer une bande de ruban adhésif au fond de la boîte à pétri 92 mm x 16 mm. Ajouter une goutte de super colle sur la bande. Placez la tique, côté ventral vers le bas sur la super-colle, laissez sécher pendant 2 min.
- Verser 100 ml de solution saline tamponnée au phosphate (PBS) dans la boîte de Petri, ou jusqu'à ce que la tique soit complètement submergée.
- Utilisant un scalpel de taille 11, couper du haut des yeux aux feston, des deux côtés de la tique.
- À l'aide de pinces stériles, enlever complètement le scutum et alloscutum , pour exposer les organes internes.
- Retirez les organes fin de fil blanc (trachée) et d'autres membranes pour éviter toute contamination.
- Retirer l'intestin à l'aide d'une pince, en pinçant la région supérieure et en tirant de lacarcasse. Enlevez tous les tissus intestinaux restants, en veillant à ce qu'aucun autre tissu n'a été disséqué.
- Entreposer l'intestin dans la solution de sel équilibrée Hank (HBSS) glacée sans chlorure de calcium et sulfate de magnésium avec un cocktail d'inhibiteur de protéinase (PIC). Glissez les grognements dans de la glace sèche et rangez-les à -20 ° C.
Remarque: Pour faciliter la dissection intestinale et les détails des organes internes de la tique, reportez-vous au chapitre 3.1 de D. Sonenshine, «Biologie des tiques» 19 .
2. Dissociation des cellules épithéliales
- Verser l'intestin disséqué sur une crépine cellulaire de 70 μm dans un tube de 50 ml.
- Rincez les tissus intestinaux avec 50 ml d'HBSS glacé avec PIC jusqu'à ce que la solution soit claire et que les tripes prennent un aspect blanc / clair.
- Re-suspendre les tripes dans 30 ml d'HBSS glacé avec PIC, mélanger doucement et centrifuger à 500 xg à 4 ° C pendant 10 minutes pour granuler l'intestin. Retirez le surnageant et répétez le processus de lavage trois fois.
- Pour déloger les cellules intestinales épithéliales, ré-suspendre l'intestin dans 10 ml de milieu de culture cellulaire Moyen d'aigle modifié de Dulbecco (DMEM), 2% de sérum de veau foetal (FCS), 0,5 mM d'acide éthylènediaminetétracétique (EDTA), 1 mM de Tris (2 -carboxyl) phosphine (TCEP), PIC et incuber pendant 60 min à 37 ° C sous rotation lente à l'aide d'un rouleau à 6 tr / min.
- Filtrer la suspension à travers une crépine de cellule de 250 μm, faire tourbillonner l'écoulement et filtrer à travers une crépine de cellule de 70 μm en recueillant le passage restant.
- Centrifuger la suspension à 500 xg à 4 ° C pendant 20 min pour granuler les cellules individuelles.
3. Isolation des cellules épithéliales simples en utilisant un gradient de centrifugation de densité
- Préparer un gradient de centrifugation de densité ( p . Ex. , Percoll) en filtrant à travers un papier pré-filtre AP15. Préparez 40% et un Percoll de 20% dans mqH 2 0 (v / v) et refroidissez à 4 ° C pendant 1 h avant de superposer le gradient.
- Utilisation d'un péristaltiquePompe réglée à la vitesse la plus basse, couche 3 mL de gradient de centrifugation de densité de 40% dans un tube à ultracentrifugation de 16 mL, ce qui lui permet de se déposer sur de la glace pendant 15 min. La vitesse de la pompe devrait conduire à un débit <1 mL par minute.
- En inclinant le tube à un angle de 45 °, utilisez la pompe péristaltique pour former un gradient de centrifugation de densité de 20% sur la couche de 40%. La vitesse de la pompe devrait conduire à un débit <1 mL par minute. Laisser reposer les couches sur de la glace pendant 15 min.
- Utiliser la pompe péristaltique à un débit de 1 mL par minute jusqu'à la couche 3 ml de milieu DMEM contenant des cellules intestinales de tiques sur le gradient de centrifugation de densité de 20 à 40%.
- Programmer la centrifugeuse pour une accélération maximale et une décélération minimale. Centrifuger à 600 xg pendant 10 min. Recueillir des interphases entre le DMEM: 20% de gradient de centrifugation de densité et les gradients de centrifugation à 20%: 40% pour isoler les cellules individuelles épithéliales. Conserver les interphases recueillies à 4 ° C pour des analyses ultérieures.
4. Évaluation de l'isolement cellulaire
- Hemacytometer
- Nettoyer l'hématomètre glisser avec de l'alcool.
- .Re-suspendre les cellules en faisant pipeter doucement les cellules vers le haut et vers le bas. Pipettez 100 μL de suspension cellulaire et placez-les dans un tube de microcentrifugeuse de 1,5 mL.
- Ajouter 400 μL de 0,4% de bleu trypan. Mélangez doucement en faisant glisser le tube.
- Pipeter 100 μL de la suspension cellulaire traitée par Trypan Blue pour remplir lentement les deux chambres de l'hémocytomètre.
- Placez l'hémocytomètre sous un microscope optique, en mettant l'accent sur les lignes de grille de l'hémocytomètre avec un objectif 10X.
- À l'aide d'un compteur de pointage manuel, comptez les cellules vivantes non colorées dans un ensemble de 16 carrés. Dans le même carré, comptez les cellules mortes bleues. Continuez à compter jusqu'à ce que quatre jeux de 16 carrés soient comptés.
- Calculez les cellules totales par ml en utilisant la formule:
47eq1.jpg "/> - Calculez le pourcentage de viabilité cellulaire en utilisant la formule:
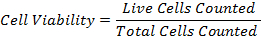
- Visualisation d'isolement cellulaire
- Diluer 1 μL des cellules isolées dans 9 μL de HBSS dans un tube de microcentrifugeuse de 1,5 mL. Enlevez délicatement le tube de microcentrifugeuse pour le mélanger.
- Pipeter 5 μL de cellules isolées dans HBSS au milieu d'une glissière en verre. Appliquer trois gouttes de milieu de montage avec 4 ', 6-diamidino-2-phénylindole (DAPI).
- Incuber le coulisseau à température ambiante pendant 5 min. Placez soigneusement un couvercle sur la préparation, évitez les bulles d'air.
- Visualiser les cellules colorées avec DAPI à l'excitation 360 nm et l'émission à 460 nm sous un microscope fluorescent.
5. Biotinylation de la protéine de surface cellulaire
- Biotinylate 100 μL de cellules épithéliales à une seule cellule en utilisant une conjugaison de biotine (type A)Kit, à un rapport molaire de la protéine de surface 1: 1 pour conjuguer, selon les instructions du fabricant
- Pour la lyse cellulaire, ajouter 100 μL de PBS, 1% de Triton X-100, 10% de glycérol, 100 uM de glutathion oxydé et PIC aux cellules biotinylées. Incuber sur de la glace pendant 1 h avec un mélange doux toutes les 10 min.
- Centrifuger les cellules biotinylées à 20 000 xg à 4 ° C pendant 20 minutes pour granuler la matière insoluble. Recueillir le surnageant contenant des protéines membranaires cytoplasmiques et biotinylées.
- Déterminer la concentration de protéines en utilisant le dosage de Bradford.
6. Isolation des protéines de surface biotinylées
- Ajouter 50 μL de Streptavidin Magnetic Beads dans un tube de microcentrifugeuse de 1,5 mL.
- Placez le tube dans un support magnétique, en recueillant les perles contre le côté du tube. Retirer et jeter le surnageant.
- Ajouter 1000 μL de TBS, 0,1% Tween-20 au tube. Mélanger doucement et collecter les perles avec le stan magnétiqueré. Retirer et jeter le surnageant.
- Combiner 40 μg de protéines de surface cellulaire biotinylées, dilué à 300 μL dans 1x PBS avec des billes magnétiques lavées. Incuber pendant 2 h à température ambiante avec agitation.
- Recueillir les perles avec un support magnétique, retirer et jeter le surnageant.
- Ajouter 300 μL de TBS, 0,1% Tween-20 au tube, mélanger doucement pour ré-suspendre les perles. Recueillir des perles, enlever et jeter le surnageant. Répétez cette étape de lavage deux fois.
- Ajouter 100 μL de la glycine 0,1 M pH 2,0 aux perles magnétiques et incuber à température ambiante pendant 5 min. Recueillir des perles et éliminer le surnageant contenant des protéines de surface biotinylées éluées.
- Visualiser les protéines de surface isolées sur un gel SDS-PAGE Tris-MOPS à 4-20%.
7. Évaluation de la protéine de surface biotinylée
- Dot Blot
- Couper une bande de nitrocellulose de 7 cm x 3 cm.
- Appliquer 10 μg totauxT contenu (de 1.8 ci-dessus), et 10 μg de protéine de surface biotinylée à la membrane. Laisser sécher pendant 15 minutes à température ambiante.
- Transférer dans un récipient et immerger dans 100 ml de tampon de blocage. Incuber à température ambiante avec agitation pendant une heure. Supprimer le tampon de blocage.
- Laver la membrane de nitrocellulose dans 100 μL de PBS, 0,05% de Tween-20 pendant 5 minutes sous agitation. Déposer le tampon de lavage et répéter les lavages trois fois.
- Incuber dans 1/5000 Streptavidine-peroxydase de raifort (HRP) dans 100 μL de PBS, 0,05% de Tween-20 pendant 2 h avec agitation à température ambiante et jeter toute solution restante.
- Lavez la membrane de nitrocellulose dans 100 μl de PBS, 0,05% de Tween-20 pendant 5 min avec agitation. Jeter le tampon de lavage et répéter le lavage trois fois.
- Pour la détection, dissoudre 1 comprimé de 4-chloro-1-napthol dans 10 ml de methanol glacé. Ajouter 4 mL de stock de méthanol à 20 mL de TBS. Ajouter 10 μL de peroxyde d'hydrogène 30% frais et immediaAppliquer à la membrane de nitrocellulose.
- Incuber avec agitation à température ambiante jusqu'à ce que le substrat produise un produit final bleu insoluble. Cela peut prendre entre 2-15 min.
- Déconner la solution de détection et laver la membrane trois fois dans 100 μL de mqH 2 O.
- Dosage ELISA
- Diluer 200 ng de chaque échantillon avec 400 μL de tampon de revêtement Carbonate 100 mM et 2 couches de la première rangée (A #) de la plaque ELISA (puits à fond plat)
- Ajouter 100 μL de tampon de revêtement de carbonate 100 mM à tous les autres puits correspondants en rangées (BH).
- Préparez les dilutions en série de chaque échantillon en pipetant 100 μL de chaque puits dans la rangée A et en transférant dans la rangée B. Mélanger doucement en pipetant et éviter de produire des bulles. Répétez les dilutions dans chaque rangée, rejetant les 100 μL finaux de chaque puits dans la rangée H.
- Couvrir la plaque avec du parafilm et incuber à 4 ° C pendant la nuit.
- Laver le platE avec 200 μl de PBS, 0,05% de Tween-20 par puits trois fois.
- Ajouter 200 μL de tampon de blocage sur les puits revêtus, couvrir avec Parafilm et incuber à 4 ° C pendant la nuit.
- Diluer 1/15 000 Streptavidine-HRP dans un tampon de blocage et ajouter 100 μL à chaque puits de la plaque. Couvrir avec du parafilm et incuber à 4 ° C pendant la nuit.
- Laver la plaque dans 200 μl de PBS, 0,05% de Tween-20 par puits cinq fois.
- Pour détecter, ajouter 100 μL de réactif TMB par puits. Après un développement de couleur suffisant, habituellement entre 10-15 min, ajoutez 100 μl d'acide phosphorique 1 M pour arrêter la réaction.
- Lisez l'absorbance de chaque puits à λ = 450nm.
Access restricted. Please log in or start a trial to view this content.
Résultats
Les cellules épithéliales ont été isolées des tissus intestinaux de R. microplus selon le schéma présenté dans la figure 1 . L'imagerie microscopique de fluorescence représentative des cellules épithéliales intestinales préparées à l'aide de ce protocole est illustrée à la Figure 2A Et 2B. Comme l'isolement cellulaire e...
Access restricted. Please log in or start a trial to view this content.
Discussion
Les infestations de tiques de bétail constituent un problème majeur pour l'industrie bovine dans les régions tropicales et subtropicales du monde, avec la méthode de contrôle la plus commune dépend de l'utilisation d'acaricides 1 , 4 . Bm86 a été précédemment identifié dans la surface épithéliale intestinale comme antigène protecteur contre l'infestation par R. microplus 10 , avec un succès limité ...
Access restricted. Please log in or start a trial to view this content.
Déclarations de divulgation
Les auteurs n'ont rien à dévoiler.
Remerciements
Les auteurs souhaitent remercier la Biosecurity Tick Colony (Queensland Department of Agriculture & Fisheries, Australie) pour la fourniture des tiques Rhipicephalus microplus utilisées pour cette étude, et Lucas Karbanowicz pour l'assistance au tournage vidéo.
Access restricted. Please log in or start a trial to view this content.
matériels
| Name | Company | Catalog Number | Comments |
| 0.4% Trypan Blue | ThermoFisher Scientific | 15250061 | |
| 1.5 mL microcentrifuge tube | Eppendorf | 3322 | |
| 100mM Carbonate Buffer | 3.03 g Na2CO3, 6.0 g NaHCO3 1000 ml distilled water pH 9.6 | ||
| 16 mL centrifuge tubes with sealing cap | Thermo Scientific | 3138-0016 | Cool in ice prior to gradient |
| 250 µM cell strainer | Thermo Fisher | 87791 | |
| 3,3′,5,5′-Tetramethylbenzidine (TMB) Liquid Substrate System for ELISA | Sigma | T0440 | Stored at 4C |
| 30% Hydrogen Peroxide | Labscene | BSPA5.500 | |
| 4-20% Tris-MOPS Gel | Gen Script | M42015 | |
| 4-Chloro-1-naphthol tablet | Sigma-Aldrich | C6788 | |
| 50 mL Falcon Tube | Corning Blue | 30 x 115mm style. Polyproplyene conical tube. | |
| 70 µM cell strainer | BD Falcon | 352350 | |
| AP15 filter paper | Millipore | AO1504200 | |
| Biotin (Type A) Conjugation Kit | Abcam | Ab102865 | |
| Dissection microscope | Olympus | SZX7 | |
| DP Manager | Olympus | 2.2.1.195 | Cell imagery software |
| Duct Tape | Home Handyman | 48mm x 25mm Duct Tape | |
| Dulbecco’s Modified Eagle Medium | Gibco | 11995-065 | DMEM - ice cold for protocol |
| EDTA | Amresco | 0105-500G | |
| F96 Maxisorp Immuno Plate | Nunc | 439454 | |
| Fetal Bovine Serum | Sigma-Aldrich | 12003C | FCS |
| Fluorescence microscope | Olympus | BX51 | |
| Fluoroshield with DAPI | Sigma-Aldrich | F6057-20ML | DAPI |
| Forceps | Dumont | #9 Dumont - Switerzland | |
| Glycerol | Sigma-Aldrich | G5516 | Glycerol for molecular biology >99% |
| Glycine | Sigma-Aldrich | 410225 | |
| Hand-Held Counter | Officeworks | JA0376230 | |
| Hank’s Balanced Salt Solution | Sigma Life Sciences | H9394 | HBSS – ice cold for protocol |
| Hemacytometer | Optik Lakor | - | - |
| L-Glutathione oxidized | Sigma-Aldrich | G4376 | |
| Magnetic Separation Stand | Novagen | - | 4-Tube Magnetic Separation Rack |
| Methanol | Sigma-Aldrich | 179337 | |
| Milli-Q Water | Millipore | ZRXQ003WW | Integral Water Purification System for Ultrapure Water |
| Nitrocellulose Membrane | Life Sciences | 66485 | 30cm x 3M pure nitrocellulose membrane |
| PageRuler Prestained protein Ladder | Thermo-Fisher | SM0671 | |
| PBS | 1.16 g Na2HPO4, 0.1 g KCl, 0.1 g K3PO4, 4.0 g NaCl (500 ml distilled water) pH 7.4 | ||
| Percoll | Sigma-Aldrich | P1644-500ML | |
| Peristaltic Pump | Masterflex | 7518-10 | |
| Phosphoric Acid | Sigma-Aldrich | P6560 | |
| Pierce Protein-Free T20 PBS Blocking Buffer | Thermo-Scientific | 37573 | Stored at 4C. Blocking Buffer |
| Protease Inhibitor Cocktail | Sigma-Aldrich | P8215-5ML | PIC – stored at -20 °C |
| Quick Start Bradford Dye Reagent 1x | Biorad | 500-0205 | For Bradford Assay |
| Quick Start BSA Standards | Biorad | 500-0207 | BSA standards for Bradford Assay |
| Scalpel | Lab. Co | Size 11 Scalpel | |
| SilverQuest TM Staining Kit | Invitrogen | LC6070 | |
| Simply Blue TM Safe Stain | Invitrogen | LC6060 | |
| Sorvall C6+ Ultracentrifuge | Thermo Scientific | 46910 | |
| Streptavidin (HRP) | Abcam | AB7403 | |
| Streptavidin Magnetic Beads | New England Biolabs | S1420S | |
| Super Glue - Ultra Fast Mini | UHU | UHU Super Glue 1mg. Ultra Fast mini | |
| Table-top Centrifuge | Eppendorf | 22331 | |
| TCEP | Thermo Fisher | 20490 | |
| Triton X-100 | Biorad | 161-0407 | |
| Tween-20 | Sigma | P2287-500ML | |
| Vortex Mixer | Ratek | VM1 | |
| Water Bath | Grant | GD100 |
Références
- Rodriguez-Valle, M., et al. Efficacy of Rhipicephalus (Boophilus) microplus Bm86 against Hyalomma dromedarii and Amblyomma cajennense tick infestations in camels and cattle. Vaccine. 30, 3453-3458 (2012).
- De Rose, R., et al. Bm86 antigen induces a protective immune-response against Boophilus microplus following DNA and protein vaccination in sheep. Vet. Immunol. Immunopathol. 71, 151-160 (1999).
- García-García, J. C., et al. Sequence variations in the Boophilus microplus Bm86 locus and implications for immunoprotection in cattle vaccinated with this antigen. Exp. Appl. Acarol. 23, 883-895 (1999).
- Abbas, R. Z., Zaman, M. A., Colwell, D. D., Gilleard, J., Iqbal, Z. Acaricide resistance in cattle ticks and approaches to its management: The state of play. Vet. Parasitol. 203, 6-20 (2014).
- Kearney, S. Acaricide (chemical) resistance in cattle ticks. , AgNote No. K58. (2013).
- Foil, L. D., et al. Factors that influence the prevalence of acaricide resistance and tick-borne diseases. Vet. Parasitol. 125, 163-181 (2004).
- Rodriguez, M., et al. High level expression of the B. microplus Bm86 antigen in the yeast Pichia pastoris forming highly immunogenic particles for cattle. J Biotechnol. 33, 135-146 (1994).
- Rodriguez, M., et al. Effect of vaccination with a recombinant Bm86 antigen preparation on natural infestations of Boophilus microplus in grazing dairy and beef pure and cross-bred cattle in Brazil. Vaccine. 13 (18), 1804-1808 (1995).
- Lew-Tabor, A. E., Rodriguez Valle, M. A review of reverse vaccinology approaches for the development of vaccines against ticks and tick borne diseases. Ticks Tick Borne Dis. 7, 573-585 (2016).
- Capella, A. N., Terra, W. R., Ribeiro, A. F., Ferreira, C. Cytoskeleton removal and characterization of the microvillar membranes isolated from two midgut regions of Spodoptera frugiperda (Lepidoptera). Insect Biochem. Mol. Biol. 27, 793-801 (1997).
- Cioffi, M., Wolfersberger, M. G. Isolation of separate apical, lateral and basal plasma membrane from cells of an insect epithelium. A procedure based on tissue organization and ultrastructure. Tissue Cell. 15, 781-803 (1983).
- Koefoed, B. M. A simple mechanical method to isolate the basal lamina of insect midgut epithelial cells. Tissue Cell. 17, 763-768 (1985).
- Roche, J. K. Isolation of a purified epithelial cell population from human colon. Methods Mol. Med. 50, 15-20 (2001).
- Terra, W. R., Costa, R. H., Ferreira, C. Plasma membranes from insect midgut cells. An. Acad. Bras. Ciênc. 78, 255-269 (2006).
- Vargas, A. E., Markoski, M. M., Cañedo, A. D., Helena, F., Nardi, N. B. Identification, isolation and culture of intestinal epithelial stem cells from murine intestine. Stem Cells. 879, 479-490 (2012).
- Autengruber, A., Gereke, M., Hansen, G., Hennig, C., Bruder, D. Impact of enzymatic tissue disintegration on the level of surface molecule expression and immune cell function. Eur. J. Microbiol. Immunol. 2, 112-120 (2012).
- Karhemo, P. R., et al. An optimized isolation of biotinylated cell surface proteins reveals novel players in cancer metastasis. J. Proteomics. 77, 87-100 (2012).
- Obenchain, F. R., Galun, R. Physiology of Ticks. Current Themes in Tropical Science Volume 1. , Pergamon Press. 201-205 (1982).
- Sonenshine, D., Roe, R. Chapter 3.1. "Biology of Ticks". 1, Two, Oxford University Press. (2014).
- Raikhel, A. S., Balashov, Y. S. "An Atlas of Ixodid Tick Ultrastructure" (English Translation). , Entomology Society of America Entomological Society of America. (1983).
Access restricted. Please log in or start a trial to view this content.
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon