É necessária uma assinatura da JoVE para visualizar este conteúdo. Faça login ou comece sua avaliação gratuita.
Method Article
Purificação de proteínas de superfície de células biotiniladas de
Neste Artigo
Resumo
Utilizou-se uma metodologia baseada em gradiente de centrifugação por densidade modificada para isolar células epiteliais do tecido intestinal de Rhipicephalus microplus . As proteínas ligadas à superfície foram biotiniladas e purificadas através de esferas magnéticas de estreptavidina para utilização em aplicações a jusante.
Resumo
Rhipicephalus microplus - o carrapato do gado - é o ectoparasito mais significativo em termos de impacto econômico sobre o gado como um vetor de vários agentes patogênicos. Os esforços foram dedicados ao controle do carrapato do gado para diminuir seus efeitos deletérios, com foco na descoberta de vacinas candidatas, como o BM86, localizado na superfície das células epiteliais do intestino do carrapato. Pesquisa atual enfoca a utilização de bibliotecas de cDNA e genômicas, para pesquisar outras vacinas candidatas. O isolamento das células intestinais do carrapato constitui uma vantagem importante na investigação da composição das proteínas superficiais sobre a membrana das células intestinais do carrapato. Este artigo constitui um método inovador e viável para o isolamento de células epiteliais, a partir dos índices de intestino de carvão de R. microplus semi-engrossado . Este protocolo utiliza TCEP e EDTA para libertar as células epiteliais dos tecidos de suporte subepitelial e um gradiente de centrifugação de densidade descontínuaNt para separar as células epiteliais de outros tipos de células. As proteínas da superfície celular foram biotiniladas e isoladas das células epiteliais intestinais do carrapato, utilizando grânulos magnéticos ligados à estreptavidina, permitindo aplicações a jusante em FACS ou LC-MS / MS-analysis.
Introdução
Rhipicephalus microplus , o carrapato do gado, é o ectoparasito mais significativo em termos de impacto econômico na indústria pecuária de regiões tropicais e subtropicais, na medida em que eleva a febre do carrapato bovino (babesiose), anaplasmose e piroplasmose equina 1 , 2 , 3 , 4 . Os esforços foram dedicados ao controle do carrapato do gado, para diminuir o efeito deletério, no entanto, os métodos convencionais, como o uso de acaricidas químicos, apresentam desvantagens implícitas, como a presença de resíduos químicos no leite e a carne e o aumento da prevalência de carrapatos quimicamente resistentes 5 , 6 , 7 . Conseqüentemente, o desenvolvimento de métodos alternativos de controle de tiquetaque foi estudado, como o uso de bovinos de resistência natural, controle biológico (biopesticidas) e vacinaInes 4 , 5 , 6 , 7 , 8 , 9 .
Na busca de proteínas capazes de serem utilizadas como vacinas candidatas, a pesquisa atual é focada no intestino do carrapato. A parede do intestino médio é construída a partir de uma única camada de células epiteliais descansando sobre uma lâmina basal fina, com a parte externa da lâmina basal formando uma rede de músculo. As observações de luz e microscópio eletrônico indicam que o intestino médio consiste de três tipos de células: reserva (indiferenciada), secreção e digestivo. O número de tipos de células varia consideravelmente dependendo da fase fisiológica. As células secretoras e digestivas originam-se das células de reserva 18 , 19 , 20 .
A construção de bibliotecas de cDNAPara examinar a composição do intestino do carrapato levou à identificação de proteínas antigênicas, como o Bm86, como potenciais candidatos à vacina 2 , 3 , 4 . A glicoproteína Bm86 está localizada na superfície das células intestinais do carrapato e induz uma resposta imune protetora contra o carrapato do gado ( R. microplus ) no gado vacinado. As IgG anti-Bm86 produzidas pelo hospedeiro imunizado são ingeridas pelo carrapato, reconhecem este antígeno na superfície das células intestinais do carrapato e, posteriormente, perturbam a função e integridade do tecido intestinal. As vacinas baseadas em antígenos Bm86 mostraram controle efetivo de R. microplus e Rhipicephalus annulatus, reduzindo o número, peso e capacidade reprodutiva das fêmeas envolventes, resultando em uma infestação larval reduzida nas gerações subseqüentes do carrapato 4 . No entanto, as vacinas baseadas em Bm86 não são eficazes contra todos os estádios de carrapatos e têmDemonstraram eficácia insatisfatória contra algumas cepas geográficas de R. microplus , conseqüentemente as indústrias de carne bovina e láctea adotam mal estas vacinas 2 , 4 .
A capacidade de isolar células epiteliais do intestino do carrapato é uma inovação significativa que permitiria a progressão da pesquisa para determinar a composição da membrana protéica, incluindo morfologia e fisiologia sob diferentes condições ambientais. O método aqui descrito utiliza o agente de quelação de ácido etilenodiaminotetracético (EDTA) e o agente redutor tris (2-carboxietil) fosfina (TCEP) para libertar o epitélio dos seus tecidos de suporte subepitelial 10 . O epitélio é recuperado após a ruptura mecânica dos tecidos por agitação, seguida de centrifugação descontínua gradiente em Percoll. Este artigo descreve uma técnica viável e inovadora para o isolamento do intestino intestinal epiCélulas celulares. As proteínas de superfície celular biotiniladas, isoladas a partir da superfície destas células epiteliais, podem subsequentemente analisar em aplicações a jusante tais como análise de FACS e / ou LC-MS / MS.
Access restricted. Please log in or start a trial to view this content.
Protocolo
1. Dissecção do Epitélio Gut de R. microplus
- Recolher carrapatos semi-engorrosados do gado no dia do experimento. Dissecte os tiques dentro de 24 h após a remoção do hospedeiro.
- Aderir uma tira de fita adesiva ao fundo da placa de Petri 92 mm x 16 mm. Adicione uma gota de super cola à fita adesiva. Coloque o tiquetaque, lado ventral para baixo sobre a super cola, deixe secar por 2 min.
- Despeje 100 mL de solução salina tamponada com fosfato (PBS) na placa Petri, ou até que o carrapato esteja completamente submerso.
- Utilizando um bisturi do tamanho 11, corte do topo dos olhos para as festinhas inferiores, em ambos os lados do tiquetaque.
- Usando fórceps estéril, remova completamente o scutum e alloscutum , para expor os órgãos internos.
- Remova os órgãos finos de fio branco (traquéia) e outras membranas para evitar a contaminação.
- Remova o intestino usando fórceps, apertando a região superior e puxando docarcaça. Remova os tecidos de intestino restantes, garantindo que nenhum outro tecido tenha sido dissecado.
- Armazene o intestino na Solução Salgada equilibrada de Sal Hank (HBSS) com cloreto de cálcio e sulfato de magnésio com coquetel inibidor de proteinase (PIC). Fique congelado nas tripas em gelo seco e armazene a -20 ° C.
Nota: Para auxiliar na dissecação intestinal e nos detalhes dos órgãos internos do carimbo, consulte o Capítulo 3.1 de D. Sonenshine, "Biologia dos Carrapatos" 19 .
2. Dissociação de células epiteliais
- Despeje o intestino dissecado sobre um filtro de células de 70 μm dentro de um tubo de 50 mL.
- Lave o tecido intestinal com 50 mL de HBSS gelado com PIC até que a solução fique clara e as tripas assumam uma aparência branca / clara.
- Re-suspende as tripas em 30 mL de HBSS gelado com PIC, misture suavemente e centrifugue a 500 xg a 4 ° C durante 10 minutos para sedimentar o intestino. Remova o sobrenadante e repita o processo de lavagem três vezes.
- Para desalojar as células intestinais epiteliais, re-suspender o intestino em 10 mL de meio de cultura celular Meio de águia modificada de Dulbecco (DMEM), 2% de soro de vitelo fetal (FCS), 0,5 mM de ácido etilenodiaminotetracético (EDTA), 1 mM de Tris (2 -carboxietil) fosfina (TCEP), PIC e incubar durante 60 minutos a 37 ° C sob rotação lenta utilizando um rolo a 6 rpm.
- Filtre a suspensão através de um filtro de célula de 250 μm, vorteie o fluxo e filtre através de um filtro de células de 70 μm coletando o fluxo restante.
- Centrifugar a suspensão a 500 xg a 4 ° C durante 20 minutos para sedimentar as células individuais.
3. Isolamento de células epiteliais simples usando um gradiente de centrifugação de densidade
- Prepare gradiente de centrifugação de densidade ( por exemplo , Percoll), filtrando-se através de um papel de pré-filtro AP15. Prepare 40% e um Percoll de 20% em mqH 2 0 (v / v) e arrefecer a 4 ° C durante 1 h antes da camada do gradiente.
- Usando um peristálticoBomba ajustada na velocidade mais baixa, coloque 3 mL de gradiente de centrifugação de densidade de 40% em um tubo de ultracentrífuga de 16 mL, permitindo que ele se assente no gelo durante 15 min. A velocidade da bomba deve levar a uma taxa de fluxo de <1 mL por minuto.
- Inclinando o tubo para um ângulo de 45 °, use a bomba peristáltica para aplicar o gradiente de centrifugação de densidade de 20% em cima da camada de 40%. A velocidade da bomba deve levar a uma taxa de fluxo de <1 mL por minuto. Permitir que as camadas se apliquem no gelo durante 15 min.
- Use a bomba peristáltica a uma taxa de fluxo de <1 mL por min para a camada 3 mL de meio DMEM contendo células intestinais do carrapato sobre o gradiente de centrifugação de densidade de 20-40%.
- Programe a centrífuga para aceleração máxima e desaceleração mínima. Centrífuga a 600 xg por 10 min. Colete interfases entre o DMEM: gradiente de centrifugação de densidade de 20% e os gradientes de centrifugação de densidade de 20%: 40% para isolar células individuais epiteliais. Armazene as interfases coletadas a 4 ° C para análises subsequentes.
4. Avaliação do isolamento celular
- Hemicitômetro
- Limpe o deslize com hematómetro com álcool.
- .Re-suspende as células pipetando suavemente as células para cima e para baixo. Pipetar 100 μL da suspensão celular e colocar em um tubo de microcentrífuga de 1,5 mL.
- Adicione 400 μL de 0,4% de Trypan Blue. Misture gentilmente acendendo o tubo.
- Pipetar 100 μL da suspensão de células tratadas com Trypan Blue para preencher lentamente ambas as câmaras do hemocitómetro.
- Coloque o hemocitómetro sob um microscópio de luz, com foco nas linhas de grade do hemocitômetro com um objetivo de 10X.
- Usando um contador de contos de mão, conte as células vivas sem coloração dentro de um conjunto de 16 quadrados. Dentro do mesmo quadrado, conte com as células mortas azuis. Continue contando até quatro conjuntos de 16 quadrados são contados.
- Calcule as células totais por mL usando a fórmula:
47eq1.jpg "/> - Calcule a porcentagem de viabilidade celular usando a fórmula:
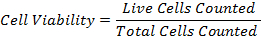
- Visualização de isolamento celular
- Diluir 1 μL das células isoladas em 9 μL de HBSS em um tubo de microcentrífuga de 1,5 mL. Mova suavemente o tubo de microcentrífuga para misturar.
- Pipetar 5 μL de células isoladas em HBSS no meio de uma lâmina de vidro. Aplique três gotas de meio de montagem com 4 ', 6-diamidino-2-fenilindole (DAPI).
- Incubar a corrediça à temperatura ambiente durante 5 min. Coloque cuidadosamente uma cobertura sobre a preparação, evitando bolhas de ar.
- Visualize células coradas com DAPI à excitação 360 nm e emissão a 460 nm sob um microscópio fluorescente.
5. Biotinilação de proteína de superfície celular
- Biotinilato 100 μL de células epiteliais de célula única usando conjugação de Biotina (Tipo A)Kit, com uma proporção molar de proteína de superfície 1: 1 para conjugar, de acordo com as instruções do fabricante
- Para a lise celular, adicione 100 μL de PBS, 1% de Triton X-100, 10% de glicerol, glutationa oxidada 100 μM e PIC nas células biotiniladas. Incubar no gelo durante 1 h com uma mistura suave a cada 10 min.
- Centrifugar as células biotiniladas a 20 000 xg a 4 ° C durante 20 min para sedimentar material insolúvel. Recolher o sobrenadante contendo proteínas de membrana citoplasmáticas e biotiniladas.
- Determine a concentração de proteína usando o ensaio de Bradford.
6. Isolamento de proteínas de superfície biotiniladas
- Adicione 50 μL de grânulos magnéticos de estreptavidina a um tubo de microcentrífuga de 1,5 mL.
- Coloque o tubo em um suporte magnético, recolhendo as contas contra o lado do tubo. Remova e descarte o sobrenadante.
- Adicione 1000 μL de TBS, 0,1% de Tween-20 ao tubo. Misture suavemente e colete as contas com o stan magnéticoD. Remova e descarte o sobrenadante.
- Combine 40 μg de proteínas de superfície celular biotiniladas, diluídas para 300 μL em 1x PBS com esferas magnéticas lavadas. Incubar durante 2 h à temperatura ambiente com agitação.
- Colete as contas com um suporte magnético, remova e descarte o sobrenadante.
- Adicione 300 μL de TBS, 0,1% de Tween-20 ao tubo, misturando suavemente para voltar a suspender as contas. Coletar pérolas, remover e descartar o sobrenadante. Repita este passo de lavagem duas vezes.
- Adicionar 100 μL da glicina 0,1 M pH 2,0 às esferas magnéticas e incubar à temperatura ambiente durante 5 min. Coletar esferas e remover o sobrenadante contendo proteínas de superfície biotiniladas eluidas.
- Visualize proteínas de superfície isoladas em um gel SDS-PAGE Tris-MOPS a 4-20%.
7. Avaliação da Proteína de Superfície Biotinilada
- Dot Blot
- Corte uma tira de 7 cm x 3 cm de membrana de nitrocelulose.
- Aplicar 10 μg total de carrapato guT (a partir de 1,8 acima) e 10 μg de proteína de superfície biotinilada para a membrana. Permitir a secagem durante 15 minutos à temperatura ambiente.
- Transfira para um recipiente e imergir em 100 mL de tampão de bloqueio. Incubar à temperatura ambiente com agitação durante uma hora. Descarte o buffer de bloqueio.
- Lavar a membrana de nitrocelulose em 100 μL de PBS, 0,05% de Tween-20 durante 5 min com agitação. Descarte o buffer de lavagem e repita as lavagens por três vezes.
- Incubar em 1/5000 Streptavidin-peroxidase de rábano (HRP) em 100 μL de PBS, 0,05% de Tween-20 durante 2 h com agitação à temperatura ambiente e descartar qualquer solução restante.
- Lavar a membrana de nitrocelulose em 100 μL de PBS, 0,05% de Tween-20 durante 5 min com agitação. Descarte o tampão de lavagem e repita a lavagem três vezes.
- Para a detecção, dissolver 1 comprimido de 4-cloro-1-naftol em 10 mL de metanol gelado. Adicione 4 mL de estoque de metanol a 20 mL de TBS. Adicione 10 μL de peróxido de hidrogênio 30% fresco e immediaAplicar-se à membrana de nitrocelulose.
- Incubar com agitação à temperatura ambiente até o substrato produzir um produto final azul insolúvel. Isso pode demorar entre 2-15 min.
- Descarte a solução de detecção e lave a membrana três vezes em 100 μL de mqH 2 O.
- Ensaio ELISA
- Diluir 200 ng de cada amostra com 400 μL de tampão de revestimento de Carbonato 100 mM e revestir 2 pistas da primeira fila (A #) da placa ELISA (poços de fundo plano)
- Adicione 100 μL de tampão de revestimento de carbonato 100 mM a todos os outros poços correspondentes em linhas (BH).
- Prepare diluições em série de cada amostra, pipeteando 100 μL de cada poço na linha A, e transfira para a linha B. Misture suavemente por pipetagem e evite produzir bolhas. Repita as diluições por cada linha, descartando os 100 μL finais de cada poço na linha H.
- Cubra a placa com parafilme e incube a 4 ° C durante a noite.
- Lave a plataformaE com 200 μL de PBS, 0,05% de Tween-20 por poço três vezes.
- Adicione 200 μL de tampão de bloqueio aos poços revestidos, cubra com Parafilm e incube a 4 ° C durante a noite.
- Diluir 1 / 15,000 Streptavidina-HRP em tampão de bloqueio e adicionar 100 μL a cada poço da placa. Cubra com parafilme e incube a 4 ° C durante a noite.
- Lave a placa em 200 μL de PBS, 0,05% de Tween-20 por poço cinco vezes.
- Para detectar, adicione 100 μL de reagente TMB por poço. Após um desenvolvimento de cor suficiente, geralmente entre 10-15 min, adicione 100 μL de ácido fosfórico 1 M para parar a reação.
- Leia a absorvância de cada poço em λ = 450nm.
Access restricted. Please log in or start a trial to view this content.
Resultados
As células epiteliais foram isoladas dos tecidos intestinais de R. microplus de acordo com o esquema apresentado na Figura 1 . A imagem de microscopia de fluorescência representativa das células epiteliais intestinais do carrapato, preparada usando este protocolo, é mostrada na Figura 2A E 2B. À medida que o isolamento das células é conduzi...
Access restricted. Please log in or start a trial to view this content.
Discussão
As infestações por carrapatos de gado constituem um grande problema para a indústria do gado em regiões tropicais e subtropicais do mundo, com o método de controle mais comum dependendo do uso de acaricidas 1 , 4 . O Bm86 foi previamente identificado dentro da superfície epitelial do intestino do carrapato como um antígeno protetor contra a infestação de R. microplus 10 , com sucesso limitado como estratégia de vacina d...
Access restricted. Please log in or start a trial to view this content.
Divulgações
Os autores não têm nada a revelar.
Agradecimentos
Os autores desejam agradecer a Biosecurity Tick Colony (Queensland Department of Agriculture & Fisheries, Austrália) para a prestação de carrapatos Rhipicephalus microplus utilizados para este estudo e Lucas Karbanowicz para assistência em video-filmagem.
Access restricted. Please log in or start a trial to view this content.
Materiais
| Name | Company | Catalog Number | Comments |
| 0.4% Trypan Blue | ThermoFisher Scientific | 15250061 | |
| 1.5 mL microcentrifuge tube | Eppendorf | 3322 | |
| 100mM Carbonate Buffer | 3.03 g Na2CO3, 6.0 g NaHCO3 1000 ml distilled water pH 9.6 | ||
| 16 mL centrifuge tubes with sealing cap | Thermo Scientific | 3138-0016 | Cool in ice prior to gradient |
| 250 µM cell strainer | Thermo Fisher | 87791 | |
| 3,3′,5,5′-Tetramethylbenzidine (TMB) Liquid Substrate System for ELISA | Sigma | T0440 | Stored at 4C |
| 30% Hydrogen Peroxide | Labscene | BSPA5.500 | |
| 4-20% Tris-MOPS Gel | Gen Script | M42015 | |
| 4-Chloro-1-naphthol tablet | Sigma-Aldrich | C6788 | |
| 50 mL Falcon Tube | Corning Blue | 30 x 115mm style. Polyproplyene conical tube. | |
| 70 µM cell strainer | BD Falcon | 352350 | |
| AP15 filter paper | Millipore | AO1504200 | |
| Biotin (Type A) Conjugation Kit | Abcam | Ab102865 | |
| Dissection microscope | Olympus | SZX7 | |
| DP Manager | Olympus | 2.2.1.195 | Cell imagery software |
| Duct Tape | Home Handyman | 48mm x 25mm Duct Tape | |
| Dulbecco’s Modified Eagle Medium | Gibco | 11995-065 | DMEM - ice cold for protocol |
| EDTA | Amresco | 0105-500G | |
| F96 Maxisorp Immuno Plate | Nunc | 439454 | |
| Fetal Bovine Serum | Sigma-Aldrich | 12003C | FCS |
| Fluorescence microscope | Olympus | BX51 | |
| Fluoroshield with DAPI | Sigma-Aldrich | F6057-20ML | DAPI |
| Forceps | Dumont | #9 Dumont - Switerzland | |
| Glycerol | Sigma-Aldrich | G5516 | Glycerol for molecular biology >99% |
| Glycine | Sigma-Aldrich | 410225 | |
| Hand-Held Counter | Officeworks | JA0376230 | |
| Hank’s Balanced Salt Solution | Sigma Life Sciences | H9394 | HBSS – ice cold for protocol |
| Hemacytometer | Optik Lakor | - | - |
| L-Glutathione oxidized | Sigma-Aldrich | G4376 | |
| Magnetic Separation Stand | Novagen | - | 4-Tube Magnetic Separation Rack |
| Methanol | Sigma-Aldrich | 179337 | |
| Milli-Q Water | Millipore | ZRXQ003WW | Integral Water Purification System for Ultrapure Water |
| Nitrocellulose Membrane | Life Sciences | 66485 | 30cm x 3M pure nitrocellulose membrane |
| PageRuler Prestained protein Ladder | Thermo-Fisher | SM0671 | |
| PBS | 1.16 g Na2HPO4, 0.1 g KCl, 0.1 g K3PO4, 4.0 g NaCl (500 ml distilled water) pH 7.4 | ||
| Percoll | Sigma-Aldrich | P1644-500ML | |
| Peristaltic Pump | Masterflex | 7518-10 | |
| Phosphoric Acid | Sigma-Aldrich | P6560 | |
| Pierce Protein-Free T20 PBS Blocking Buffer | Thermo-Scientific | 37573 | Stored at 4C. Blocking Buffer |
| Protease Inhibitor Cocktail | Sigma-Aldrich | P8215-5ML | PIC – stored at -20 °C |
| Quick Start Bradford Dye Reagent 1x | Biorad | 500-0205 | For Bradford Assay |
| Quick Start BSA Standards | Biorad | 500-0207 | BSA standards for Bradford Assay |
| Scalpel | Lab. Co | Size 11 Scalpel | |
| SilverQuest TM Staining Kit | Invitrogen | LC6070 | |
| Simply Blue TM Safe Stain | Invitrogen | LC6060 | |
| Sorvall C6+ Ultracentrifuge | Thermo Scientific | 46910 | |
| Streptavidin (HRP) | Abcam | AB7403 | |
| Streptavidin Magnetic Beads | New England Biolabs | S1420S | |
| Super Glue - Ultra Fast Mini | UHU | UHU Super Glue 1mg. Ultra Fast mini | |
| Table-top Centrifuge | Eppendorf | 22331 | |
| TCEP | Thermo Fisher | 20490 | |
| Triton X-100 | Biorad | 161-0407 | |
| Tween-20 | Sigma | P2287-500ML | |
| Vortex Mixer | Ratek | VM1 | |
| Water Bath | Grant | GD100 |
Referências
- Rodriguez-Valle, M., et al. Efficacy of Rhipicephalus (Boophilus) microplus Bm86 against Hyalomma dromedarii and Amblyomma cajennense tick infestations in camels and cattle. Vaccine. 30, 3453-3458 (2012).
- De Rose, R., et al. Bm86 antigen induces a protective immune-response against Boophilus microplus following DNA and protein vaccination in sheep. Vet. Immunol. Immunopathol. 71, 151-160 (1999).
- García-García, J. C., et al. Sequence variations in the Boophilus microplus Bm86 locus and implications for immunoprotection in cattle vaccinated with this antigen. Exp. Appl. Acarol. 23, 883-895 (1999).
- Abbas, R. Z., Zaman, M. A., Colwell, D. D., Gilleard, J., Iqbal, Z. Acaricide resistance in cattle ticks and approaches to its management: The state of play. Vet. Parasitol. 203, 6-20 (2014).
- Kearney, S. Acaricide (chemical) resistance in cattle ticks. , AgNote No. K58. (2013).
- Foil, L. D., et al. Factors that influence the prevalence of acaricide resistance and tick-borne diseases. Vet. Parasitol. 125, 163-181 (2004).
- Rodriguez, M., et al. High level expression of the B. microplus Bm86 antigen in the yeast Pichia pastoris forming highly immunogenic particles for cattle. J Biotechnol. 33, 135-146 (1994).
- Rodriguez, M., et al. Effect of vaccination with a recombinant Bm86 antigen preparation on natural infestations of Boophilus microplus in grazing dairy and beef pure and cross-bred cattle in Brazil. Vaccine. 13 (18), 1804-1808 (1995).
- Lew-Tabor, A. E., Rodriguez Valle, M. A review of reverse vaccinology approaches for the development of vaccines against ticks and tick borne diseases. Ticks Tick Borne Dis. 7, 573-585 (2016).
- Capella, A. N., Terra, W. R., Ribeiro, A. F., Ferreira, C. Cytoskeleton removal and characterization of the microvillar membranes isolated from two midgut regions of Spodoptera frugiperda (Lepidoptera). Insect Biochem. Mol. Biol. 27, 793-801 (1997).
- Cioffi, M., Wolfersberger, M. G. Isolation of separate apical, lateral and basal plasma membrane from cells of an insect epithelium. A procedure based on tissue organization and ultrastructure. Tissue Cell. 15, 781-803 (1983).
- Koefoed, B. M. A simple mechanical method to isolate the basal lamina of insect midgut epithelial cells. Tissue Cell. 17, 763-768 (1985).
- Roche, J. K. Isolation of a purified epithelial cell population from human colon. Methods Mol. Med. 50, 15-20 (2001).
- Terra, W. R., Costa, R. H., Ferreira, C. Plasma membranes from insect midgut cells. An. Acad. Bras. Ciênc. 78, 255-269 (2006).
- Vargas, A. E., Markoski, M. M., Cañedo, A. D., Helena, F., Nardi, N. B. Identification, isolation and culture of intestinal epithelial stem cells from murine intestine. Stem Cells. 879, 479-490 (2012).
- Autengruber, A., Gereke, M., Hansen, G., Hennig, C., Bruder, D. Impact of enzymatic tissue disintegration on the level of surface molecule expression and immune cell function. Eur. J. Microbiol. Immunol. 2, 112-120 (2012).
- Karhemo, P. R., et al. An optimized isolation of biotinylated cell surface proteins reveals novel players in cancer metastasis. J. Proteomics. 77, 87-100 (2012).
- Obenchain, F. R., Galun, R. Physiology of Ticks. Current Themes in Tropical Science Volume 1. , Pergamon Press. 201-205 (1982).
- Sonenshine, D., Roe, R. Chapter 3.1. "Biology of Ticks". 1, Two, Oxford University Press. (2014).
- Raikhel, A. S., Balashov, Y. S. "An Atlas of Ixodid Tick Ultrastructure" (English Translation). , Entomology Society of America Entomological Society of America. (1983).
Access restricted. Please log in or start a trial to view this content.
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados